INTRODUCCIÓN
La abundancia y diversidad de la comunidad del plancton juega un papel indispensable en la salud de los ecosistemas acuáticos, porque participa activamente en la transferencia de energía y carbono generado por los productores primarios dentro de un sistema acuático (Dodds y Whiles, 2010; Tulsankar et al., 2021). La comunidad zooplanctónica a su vez está regulada por los cambios en las condiciones ambientales, estos cambios influyen en las características poblacionales de las comunidades y en consecuencia en los servicios ecosistémicos que ofrecen estos cuerpos de agua (Hutchinson, 1961, Roldán y Ramírez, 2008, Li et al., 2019).
Para tener un mejor entendimiento de las variaciones temporales de las comunidades zooplanctónicas en los ecosistemas dulceacuícolas en Colombia se han abordado algunas temáticas, enfocadas a conocer la influencia que tiene el ciclo hidrológico en cortos periodos de tiempo sobre la comunidad, o en la asociación del zooplancton a la condición trófica del ecosistema o de los hábitats donde se desarrollan (Arango-Rojas et al., 2010; Aranguren y Monroy, 2014; Villabona et al., 2011). Sin embargo, los trabajos hasta el momento siguen siendo limitados (Roldan, 2020), pero se tiene conocimiento que esta comunidad se caracteriza principalmente por presentar una mayor proporción de rotíferos, respecto a los otros grupos (cladóceros, copépodos), este aspecto se resalta como una característica en común para la mayoría de sistemas cenagosos colombianos (Gallo et al., 2009). De esta manera, el presente trabajo es una contribución para acercarnos a un mejor entendimiento del funcionamiento de estos ecosistemas en Colombia.
Las ciénagas de origen fluvial según la convención de RAMSAR son cuerpos de agua poco profundos que tienen conexión directa y/o indirecta a un río, esta puede ser permanente o temporal (Roldán y Ramírez, 2008). La columna de agua de estos sistemas no supera los 10 m de profundidad, son sistemas que en el día presentan estratificación y mezcla e isotermia en la noche, además exhiben vegetación flotante y enraizada temporalmente y concentraciones altas de sustancias húmicas y suelos saturados (Lewis, 1983; Montoya y Aguirre, 2009). La dinámica de las ciénagas varía según la época del año, durante los períodos de inundación, estas adquieren máximas extensiones y profundidades, invaden tierras adyacentes e intercambian agua con el río y por estas variaciones en la dinámica acuática existen cambios anuales en la fisicoquímica del agua, en la productividad y por ende en la disponibilidad de hábitat y alimento para la biota acuática (Junk et al., 1989; Pulido y Pinilla, 2017; Ricaurte et al., 2019).
El presente trabajo tiene como objetivo estudiar la composición, estructura y diversidad del zooplancton dulceacuícola presente en la ciénaga de Paredes y su relación con las variables ambientales durante el periodo de 2013 a 2014, con lo que se contribuye a aumentar el conocimiento de las planicies de inundación tropical. Se plantea como hipótesis que la comunidad zooplanctónica cambia en su abundancia, composición y diversidad como respuesta a las fluctuaciones de las variables fisicoquímicas durante un pulso de inundación.
MATERIALES Y MÉTODOS
Área estudio
La Ciénaga de Paredes es un cuerpo de agua que hace parte del ecosistema de bosque húmedo Tropical (bh-T) en el valle Medio de la cuenca del río Magdalena (García y Dister, 1990). Se encuentra ubicada en el departamento de Santander, Colombia (73°46'W, 7°26'N) entre los municipios de Sabana de Torres y Puerto Wilches (Barón et al., 2006). El principal afluente es la quebrada La Gómez, con un flujo calculado de 1,82 m3-s-1 y tiene algunos afluentes secundarios como la quebrada El Champán, quebrada La Hoya y su efluente es el Caño Peruétano (Solís y Criales-Hernández, 2016) (Fig. 1). La profundidad de la ciénaga está determinada por el régimen de lluvias, que es de tipo bimodal, esta puede alcanzar hasta los 3000 mm anuales (García y Dister, 1990). Este comportamiento marca el pulso hidrológico en estos ambientes definido con valores máximos finalizando mayo y noviembre, asociado al período de aguas altas, y los mínimos en diciembre, enero y febrero, asociados al período de aguas bajas (Criales-Hernández y Jerez-Guerrero, 2016).
Fase de campo
Se recolectaron 30 muestras zooplanctónicas durante los meses de abril, junio, agosto, octubre de 2013 y febrero y mayo de 2014, en cinco puntos de muestreo, ubicados en la ciénaga de Paredes (Fig. 1), como parte del proyecto de la VIE código 5715. Para establecer los períodos del pulso de inundación, aguas en ascenso, aguas en descenso, aguas altas y aguas bajas, durante el pulso de inundación se utilizaron los datos del IDEAM y las medidas de profundidad de la ciénaga correspondientes a los meses de muestreo.
En cada punto se midió in situ se estimó la transparencia, con un disco Secchi yla profundidad, con ecosonda HONDEX ps-7. Se tomaron datos superficiales de conductividad (jjS/ cm ± 0,5), temperatura (°C ± 0,3), pH (± 0,1) y oxígeno (mg/L) con una sonda multiparamétrica HACH. Para la determinación de clorofila a, demanda biológica de oxígeno (DBO), dureza, nitratos y alcalinidad total, se tomó un litro de agua superficial, que se refrigeró y se transportó hasta un laboratorio certificado para su análisis, siguiendo la metodología descrita en Standard methods for the examination of water and wastewater (2005).
Para la recolecta de zooplancton se hicieron arrastres superficiales circulares, con una red estándar de 63 (Jim, equipada con un medidor de flujo digital General Oceanics. La velocidad promedio de arrastre fue de 3,5 km h-1, durante cinco minutos, se calcularon los volúmenes de agua filtrada teniendo en cuenta la velocidad neta y el flujo para cada una de las muestras.
Las muestras recolectadas se fijaron con formol buferizado al 4 %, posteriormente fueron transportadas en envases plásticos de 140 ml y depositadas en el Museo de Historia Natural de la UIS, dentro de la colección de Hidrobiología, con número de colección UIS-MHB-036 - UIS-MHB-040, UIS-MHB-069 - UIS-MHB-073, UIS-MHB-114 - UIS-MHB-118, UIS-MHB-149 - UIS-MHB-153, UIS-MHB-189 - UIS-MHB-193, UIS-MHB-202, UIS-MHB-219 - UIS-MHB-223.
ANÁLISIS DE LABORATORIO Y TRATAMIENTO DE DATOS
Para las variables fisicoquímicas se realizó un test de normalidad Shapiro-Wilk y posteriormente, se les realizó el test "MARDIA" de normalidad multivariado, el cual permitió evaluar si los datos eran paramétricos. Debido a que los datos fisicoquímicos de pH, temperatura, profundidad, transparencia, conductividad, oxígeno, amonio, dureza total, alcalinidad y clorofila a no fueron normales, se transformaron usando raíz cuadrada.
Con el fin de conocer cuáles eran las variables fisicoquímicas significativas dentro del presente estudio, se realizó un análisis de escalamiento multidimensional no métrico (NMDS). Posteriormente, se realizó la prueba no paramétrica Kruskal-Wallis para establecer si existían diferencias significativas entre los meses del pulso de inundación y una prueba post-hoc de Kruskall-Wallis, para conocer entre qué meses se encontraron las diferencias significativas. Todos los análisis estadísticos se haciendo uso del software R Studio (RStudio Team, 2020).
Los organismos zooplanctónicos fueron identificados hasta el nivel taxonómico más bajo posible, usando un microscopio óptico Zeiss y las diferentes claves taxonómicas disponibles en el laboratorio de hidrobiología. La cuantificación de los organismos se llevó a cabo usando una cámara Sedgwick-Rafter, bajo un microscopio invertido Primovert, Zeiss, donde se revisaron tres mililitros de cada muestra (Postel et al., 2000). Las abundancias se estandarizaron en función del volumen de agua filtrada en cada estación a individuos por 1000 m3 (ind/1000 m3).
Se elaboró una matriz con las abundancias estandarizadas para estimar los atributos de la comunidad, se calcularon los índices de diversidad verdadera o números efectivos de Hill (Jost, 2006) mediante la biblioteca INEXT en el programa R Studio. Se verificó si existían diferencias significativas entre los números efectivos de Hill, durante el pulso de inundación con un análisis de varianza paramétrico (ANOVA), para conocer donde se encontraron las diferencias significativas se realizó la prueba post-hoc Tukey. Para evaluar el comportamiento de la comunidad e identificar asociaciones taxonómicas, se realizó un análisis usando como criterio la similaridad, con el índice de Bray-Curtis y una prueba de rutina SIMPROF (999 simulaciones; p= 0,05), usando el software Primer V7.
Con el fin de conocer los nuevos registros para el departamento de Santander y Colombia se realizaron búsquedas de cada especie en el portal del Global Biodiversity Information Facility (GBIF), en el Sistema de Información sobre Biodiversidad de Colombia (SiB Colombia) y literatura publicada. Finalmente, con la búsqueda en bases de datos y artículos científicos se conoció la distribución de cada una de las especies en las diferentes zonas biogeográficas del planeta (Neotrópico, Neartico, Paleártico, Oriental, Australia, Pacífico, Afrotropical y Antártico).
RESULTADOS
A partir de los valores de precipitación (IDEAM) y la profundidad obtenida in situ durante el año 2013-2014, se estableció el pulso de inundación para las fechas de muestreo así: aguas en ascenso correspondió a los meses de abril, agosto y octubre de 2013, aguas en descenso al mes de junio 2013, aguas bajas a febrero 2014 y aguas altas a mayo 2014.
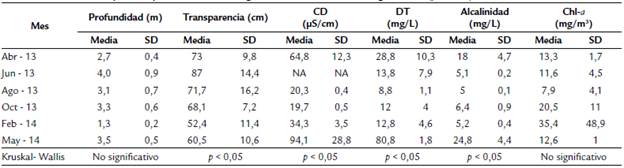
Durante el periodo de estudio la profundidad de la ciénaga estuvo entre 1,3 y 4 m, la transparencia entre 52,4 y 87,0 cm, la conductividad eléctrica entre 19,7 y 94,1 µS/cm, la dureza total entre 8,8 y 80,8 mg/L, la alcalinidad entre 5 y 24,8 mg/L, la clorofi la a entre 7,9 y 35,4 mg/m3 (Tabla 1). La temperatura estuvo entre 29,3 y 33, 3°C, los valores de nitratos se encontraron entre 0,55 y 0,013 mg/L.
En el análisis de Kruskal-Walis se observaron diferencias significativas (p<0.05) para las variables de transparencia, conductividad, dureza total y alcalinidad (Tabla 1). Por medio del test de comparación múltiple de Kruskal-Wallis se encontró que para las variables de transparencia hubo diferencias (p<0.05) entre el periodo jun-13 y feb-14, para la conductividad entre abr-13 y oct-13, agos-13 y oct-13 con respecto a may-14, para la dureza total hubo diferencias entre abr-13 y ago-13; y ago-13 y may-14 y para la alcalinidad hubo diferencias entre jun-13, ago-13 y feb-14 con respecto al mes de may-14.
Tabla 1 Variables fisicoquímicas presentes en la ciénaga Paredes 2013-2014. No significativo (p > 0,05).
El análisis de escalamiento multidimensional no métrico (NMDS) (Fig. 2) arrojó un valor de estrés bajo (0,073), las variables de transparencia (p= 0,001), profundidad (p=0,015), conductividad (p=0,001), dureza total (p=0,001), alcalinidad (p=0,001) y clorofila a (p=0,001), fueron las que presentaron un valor estadístico significativo.
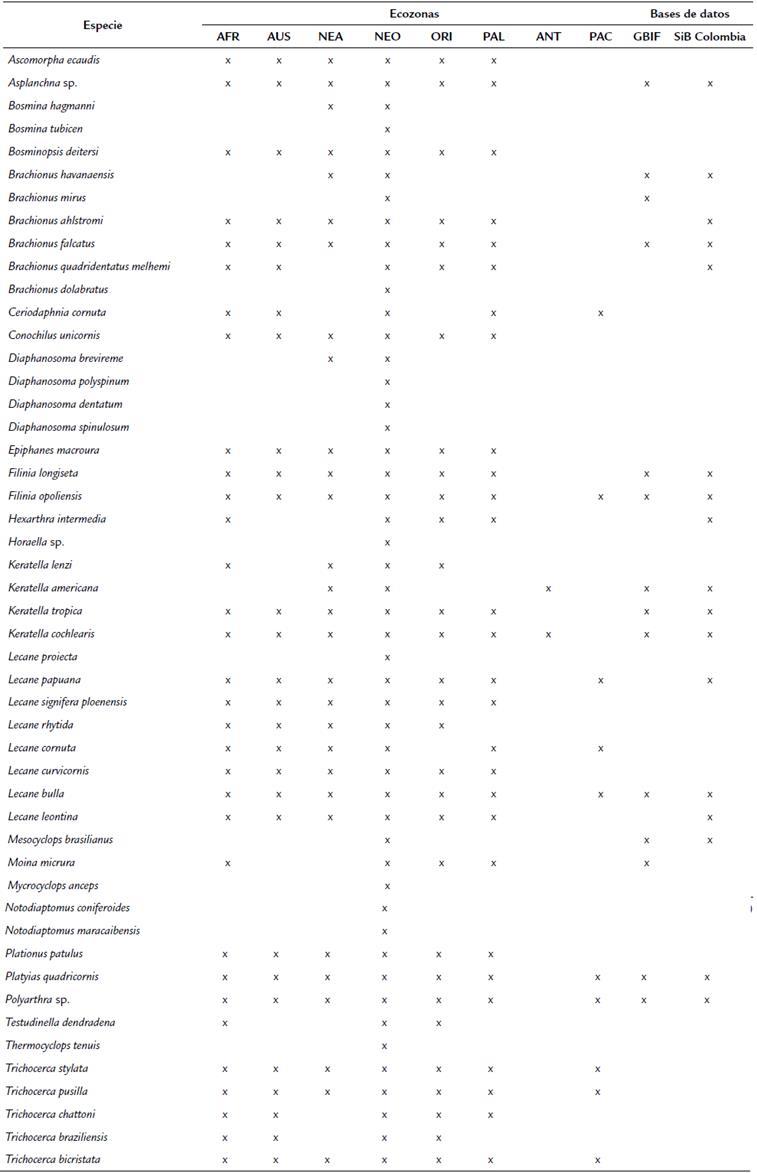
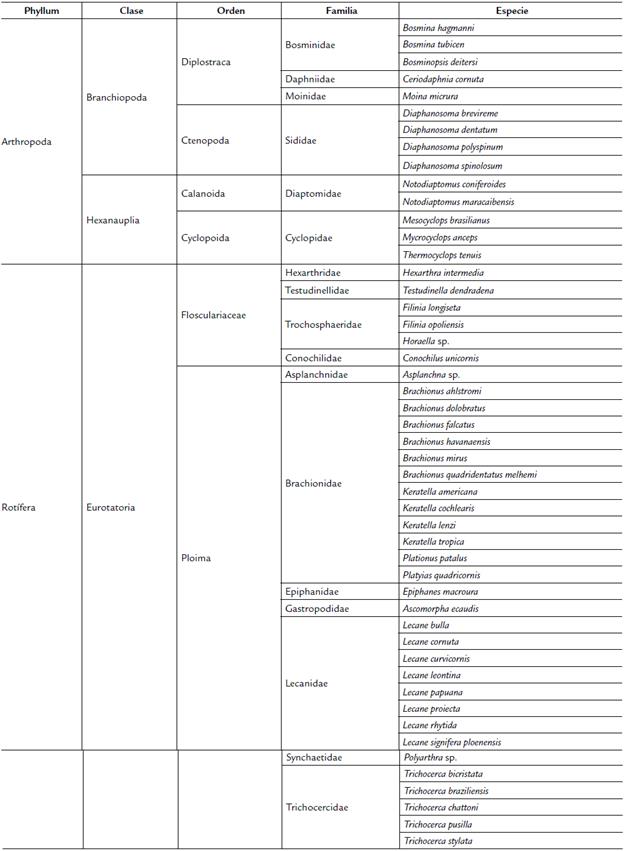
Se identificaron 49 especies zooplanctónicas, distribuidas en dos phylum, cinco clases, siete órdenes, 17 familias y 26 géneros (Tabla 2). Para el phylum Rotifera se identificaron 36 especies y para Arthropoda 14 especies. La clase que presentó el mayor número de especies fue Eurotatoria (35), seguida por Brachiopoda (9) y Hexanauplia (3). Los órdenes con mayor número de especies fueron Plomia (29) y Flosculariaceae (6). Las familias que presentaron más especies fueron Brachionidae (12), Lecanidae (8) y Trichocercidae (5). El género con más especies fue Lecane (8), seguido por Brachionus (6) y Trichocera (5) (Anexo 1). Dos especies fueron identificadas hasta nivel de subespecie: Brachionus quadridentatus melhemi Barrois & Daday, 1894 y Lecane signifera ploenensis Voigt, 1902. Se encontraron nauplios y copepoditos de Calanoida y Cyclopoida durante todo el periodo de estudio.
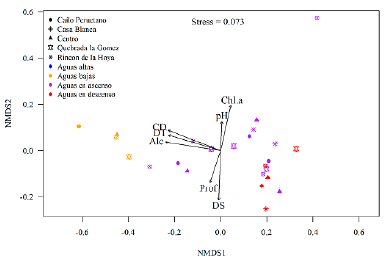
Figura 2 Análisis de escalamiento multidimensional no métrico (NMDS) de las variables fisicoquímicas.
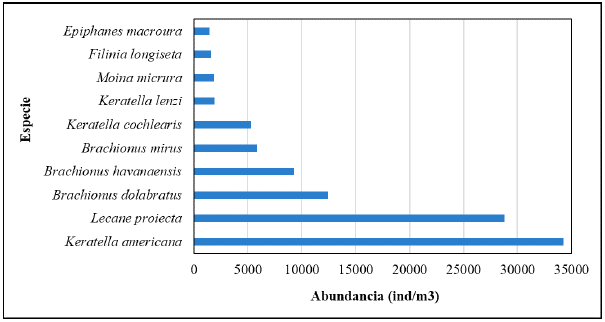
Keratella americana Carlin, 1943 fue la especie que presentó las mayores abundancias para todo el periodo de estudio (34263) ind/m3, seguido por Lecane proiecta Hauer, 1956 (28782) ind/m3 y Brachionus dolabratus Harring, 1914 (12420) ind/m3 (Fig. 3). Para el mes de abr-13, las especies con mayores abundancias fueron Keratella americana (4550 ind/m3), Brachionus havanaensis Rousselet, 1911 (2254 ind/ m3) y Brachionus dolabratus ^1238 ind/m3). El mes de jun-13 presentó las mayores abundancias para Brachionus dolabratus (6637 ind/m3), Keratella americana (3097 ind/m3) y Lecane proiecta (958 ind/m3). Ago-2013 tuvo las mayores abundancias Lecane proiecta (10267 ind/m3), Keratella americana (4389 ind/m3) y Moina micrura Kurz, 1875 (742 ind/m3). Oct-13 se encontraron las mayores abundancias para Lecane proiecta (5721 ind/m3), Keratella americana (5704 ind/m3) y Brachionus mirus Daday, 1905 (824 ind/m3). Para el mes de feb-14 las mayores abundancias se presentaron Lecane proiecta (2302 ind/m3), Keratella americana (1851 ind/m3) y Keratella cochlearis Gosse, 1851 (1027 ind/m3). En el mes de may-14 las mayores abundancias se presentaron para Brachionus havanaensis (1258 ind/m3), Lecane proiecta (781 ind/m3) y Keratella americana (748 ind/m3).
Tabla 2 Lista taxonómica de especies zooplanctónicas registradas en la ciénaga de Paredes (Santander - Colombia).
En cuanto a la diversidad verdadera, se encontró que el valor de riqueza (q=0) más alto se presentó en el mes de abr-13 (27 especies efectivas), seguido de ago-13 (24 especies efectivas), oct-13 (23 especies efectivas), jun-13 (21 especies efectivas), may-14 (20 especies efectivas) y feb-14 (19 especies efectivas). La diversidad de orden 1 (q=1) fue mayor para el mes de abr-13 (9,4), seguido por may-14 (9,0), feb-14 (7), oct-13 (6), agos-13 (4,6) y el de menor valor se presentó durante jun-13 (4,3), siendo el mes de abr- 13, 2,17 veces más diverso en especies de zooplancton que el de jun-13. Con respecto a la diversidad de orden 2 (q=2), el mayor valor lo presentó el mes de may-14 (6,5), seguido por abr-13 (6,4), feb-13 (5), oct-13 (3,9), ago-13 (2,9) y el menor valor en jun-13 (2,8). La equitatividad en el mes de may-14 fue 2,26 veces mayor que en el mes de ago-13. Los meses de may-14 y abr-13 presentaron diferencias significativas en los órdenes de diversidad q1 y q2 con respecto a los otros meses (p<0,05), mientras que entre los meses de may-14 y abr-13 no se presentaron diferencias significativas (p>0,05).
De acuerdo con el análisis de similitud de Bray Curtis, se observa la formación de seis grupos, el primero formado por jun-13, el segundo por feb-14, el tercero por ago-13, el cuarto por oct-13, el quinto por may-14 y el sexto por abr-13. Para el primer grupo se encontró una similaridad del 75,13 %, donde las especies que mayor aportaron a este fueron Brachionus dolabratus, Keratella americana y Lecane proiecta. El segundo grupo presentó un 74,17 % de similaridad y las especies que aportaron mayor porcentaje acumulado fueron Keratella americana, Lecane proiecta y Brachionus falcatus. El tercer grupo tuvo un porcentaje de similaridad de 75,90 %, las especies que aportaron mayor porcentaje fueron Lecane proiecta, Keratella americana y Diaphanosoma brevireme Sars, 1901 . El cuarto grupo tuvo un 73,93 % de similaridad y las especies que más aportaron a este fueron Keratella americana, Lecane proiecta y Brachionus dolabratus. El quinto grupo tuvo 78,30 % de similaridad, las especies que más contribuyeron fueron Brachionus havanaensis, Keratella americana y Lecane proiecta. El sexto grupo presentó un 80,97 % similaridad, las especies que aportan más a este porcentaje son Keratella americana, Brachionus havanaensis y Keratella lenzi Hauer, 1953.
De las 50 especies identificadas, todas están reportadas para el Neotrópico, y todas reportadas para Colombia en publicaciones. De estas, 15 son nuevos registros para el departamento de Santander, y 34 especies son nuevos registros en el GBIF y SIB Colombia (Anexo 1). El rotífero Testudinella dendradena Beauchamp, 1955 ha sido reportado para las llanuras de inundación amazónica, sin embargo, no existen ocurrencias de esta especie en el GBIF. Las especies encontradas se encuentran registradas en Colombia para ciénagas, lagos, embalses y ríos respectivamente.
DISCUSIÓN
La ciénaga de Paredes se caracterizó como un sistema polimíctico cálido continuo, según Donato (1998) corresponde a la provincia de tierras bajas, presentando cambios en las variables fisicoquímicas con respecto a la variación temporal (Montoya y Aguirre, 2009). El comportamiento de la columna de agua a lo largo del periodo de estudio fue similar al reportado para otros sistemas cenagosos del Magdalena Medio, presentando un régimen bimodal, evidenciando periodos de aguas en ascenso durante abr-13, oct-13, y ago-13, aguas en descenso durante jun-13, aguas bajas durante feb-14 y aguas altas durante may-14 (Barón et al., 2006; Criales-Hernández y Jerez-Guerrero, 2016; Mojica et al., 2014; Montoya y Aguirre, 2013; Solís y Criales-Hernández, 2016). Este comportamiento se ve influenciado por las precipitaciones locales y de alta montaña, y la dinámica de la cordillera Oriental de los Andes colombianos, mostrando un patrón en los niveles de agua bajos, altos e intermedios y por lo tanto, de sus condiciones físicas y químicas (Barón et al., 2006; Donato, 1998; Montoya y Aguirre, 2009).
El NMDS evidencia que la ciénaga presenta una orientación ordenada por la transparencia, conductividad eléctrica y profundidad, los valores medios de estas variables en donde se agrupan la mayoría de las estaciones y momentos del pulso de inundación. Este patrón de ordenación que se observa en la ciénaga de Paredes es similar a lo que se puede observar en otras ciénagas con mayor conectividad respecto al cuerpo de agua principal (Montoya-Aguirre, 2013). La conductividad eléctrica es una de las variables que mejor exhibe los cambios temporales en los ecosistemas naturales colombianos, como lo observado en Paredes, teniendo los mayores valores durante el periodo de aguas altas (Montoya-Aguirre 2013, Ramírez y Viña, 1998).
Las diferencias significativas encontradas para las variables fisicoquímicas de alcalinidad, dureza total, transparencia y conductividad eléctrica en los períodos de aguas altas y aguas en ascenso, guardan relación con un mayor contenido de materia orgánica, ácidos débiles durante estos periodos que tienen las mayores precipitaciones, lo que promueve un aumento en los valores de las variables, lo que sugiere que la temporalidad de este sistema dulceacuícola se ve afectada principalmente por los cambios en la química del agua (Junk, 1989; Roldan y Ramírez, 2008; Montoya y Aguirre, 2009).
La ciénaga de Paredes presenta una riqueza y composición similar a la descrita para otros lagos tropicales de Colombia (Aguirre, 2014; Dorado et al., 2008; Gallo et al., 2006; Gaviria y Aranguren, 2019; Palacio et al., 2008). La distribución de las especies es semejante a lo que se describe para otros sistemas cenagosos a lo largo del Magdalena Medio (Aguirre, 2014; Barón et al., 2006; Criales-Hernández et al., 2020; Gallo et al., 2009; Solís y Criales-Hernández, 2016). Esto sugiere que se puede estar presentando una conexión entre los sistemas que pertenecen a la planicie de inundación, este transporte o intercambio de especies podría ser posible por la comunicación que existe entre los caños o quebradas constituyendo un importante corredor biogeográfico o vía de dispersión en la planicie de inundación del Magdalena Medio (Andrade-Sossa et al., 2011; de Paggi et al., 2014; de Paggi y Paggi, 2008; Simões et al., 2012).
La composición del zooplancton que se identificó en la ciénaga de Paredes puede estar condicionada a la presencia y distribución de las plantas acuáticas, las cuales permiten una heterogeneidad de hábitat, una mayor superficie de refugio y contribuyen al incremento en la disponibilidad de recursos alimenticios para estos organismos (Lougheed et al., 2002; Penatti et al., 2015, Villabona et al., 2011). El 67 % de especies estaba constituido por rotíferos, similar a lo reportado para otros cuerpos de agua ubicados en llanuras de inundación en Suramérica (Ibáñez, 2000; Jaramillo y Aguirre, 2012). La alta riqueza y abundancia de rotíferos puede ser explicada por la alta oferta de materia orgánica que ofrecen estos sistemas cenagosos, además estos organismos se pueden ver favorecidos por la tolerancia que tienen a las fluctuaciones ambientales (Gallo et al., 2009; Gebrehiwot et al., 2017; Martins et al., 2020; Neves et al., 2003). Las mayores abundancias para todos los meses de estudio correspondieron a Keratella americana y Lecane proiecta, estas especies permiten dar una idea del estado trófico de la ciénaga de Paredes, debido a que estos organismos se presentan en sistemas eutrofizados, con alta carga de nutrientes y materia orgánica (Pinheiro et al., 2019; Umaña y Avilés, 2019; Villabona et al., 2014), estos organismos son oportunistas, de estrategia R, ciclo de vida corto y alta tolerancia a la variabilidad en los factores ambientales (Neves et al., 2003). La dominancia numérica de los rotíferos, a pesar de la red utilizada 63 (Jim pudo haber subestimado la cuantificación de otros pequeños organismos como protozoos de menor tamaño, sin embargo, para las estimaciones de índices de diversidad son menos influenciados por el tamaño de malla (Macedo et al., 2019, Riccardi, 2010).
En cuanto a los resultados que se obtuvieron con los números de Hill, los valores más altos de diversidad (q1 y q2) fueron para los meses abril de 2013 y mayo de 2014, los cuales corresponden a los meses de mayor precipitación durante el presente estudio. Este periodo otorga las condiciones fisicoquímicas que favorecen el aumento en la productividad primaria (Padovesi y Rezende, 2017), y en consecuencia una mayor disponibilidad de recursos que benefician algunas especies de la comunidad zooplanctónica, especialmente los rotíferos, como se mencionó anteriormente, podríamos sugerir que es una tendencia frecuente en sistemas de planicies de inundación tropical (Bonecker et al., 2005; Sampaio y López, 2000).
Los estudios basados en el cálculo de los números de Hill o diversidad verdadera son un buen indicador de diversidad al compararlo con otros estudios (Jost y González, 2012) sin embargo para el zooplancton de agua dulce en Colombia son muy escasos; por lo que el presente estudio contribuye al conocimiento de la diversidad de estos cuerpos de agua desde diferentes enfoques ecológicos. Gavilán (2000) desarrolló el índice de Shannon-Wiener en su trabajo para las ciénagas Chucurí, Llanito y Paredes, todas ubicadas en el Magdalena Medio Santandereano durante 1998-1999; y Barón et al. (2006) transformó este índice en el número de Hill q1 para cada una de estas ciénagas con aplicación exclusivamente al grupo taxonómico de cladóceros. En el presente trabajo se calcularon los números de Hill q1 de menor y mayor valor para el zooplancton total en cada una de las ciénagas estudiadas por Gavilán (2000), obteniéndose valores de q1 para Paredes: 3,07 - 17,3; Llanito: 8 - 15,3; Chucurí: 2,3 - 14,1; nuestros valores de q1 estuvieron entre 4,3 - 9,4 especies efectivas, ubicándolo en el rango medioinferior con respecto a las otras ciénagas estudiadas. Esto es un indicativo del cambio del ecosistema por pérdida de diversidad zooplanctónica de estos sistemas acuáticos en los últimos años, tendencia que se ha visto en aumento en varias regiones del mundo (Xiong et al., 2020).
Adicionalmente, la diversidad biótica es un factor fundamental para el mantenimiento de la estructura y funcionamiento de estos ecosistemas (Lasso et al., 2014), por lo que podemos asumir que la disminución en la diversidad puede estar relacionada con alteraciones del hábitat entre las que se encuentran deforestación, cambio en la cobertura vegetal, fragmentación del hábitat por construcción de diques, alteración de los caudales, transporte de sedimentos y sustancias tóxicas, entre otros (Lasso et al., 2014). Esta zona del departamento se caracteriza por presentar una gran actividad agrícola, lo que puede estar ejerciendo una fuerte presión a estos cuerpos de agua por el aumento de las actividades antropogénicas, otros autores señalan que las planicies de inundación se encuentran entre los más amenazados de la tierra (Alahuhta et al., 2019; Gélvez et al., 2020; Xiong et al., 2020).
Con este trabajo se reportan 15 nuevos registros de especies de zooplancton para el departamento de Santander, Colombia. En cuanto a las especies registradas en el GBIF, Testudinella dendradena no presenta registros de ocurrencia, sin embargo, la literatura la reporta para el neotrópico (Sharma y Khan, 2016). Se resalta que el trabajo registró 34 nuevos reportes de especies para GBIF y 32 nuevos reportes para SiB Colombia, esto nos da una idea del gran vacío de información que existe en las bases de datos en comparación con la cantidad de registros publicados en literatura (Roldán, 2020).
CONCLUSIONES
Los cambios en la estructura y diversidad de la comunidad zooplanctónica en la ciénaga de Paredes, Santander, Colombia, durante 2013 - 2014 están influenciados por los cambios en las variables de transparencia, conductividad, dureza total y alcalinidad. La alta riqueza y abundancia de rotíferos puede ser explicada por la oferta de materia orgánica que ofrece la ciénaga de Paredes, estos organismos se pudieron ver favorecidos por la tolerancia que presentan ante las fluctuaciones que se dan en la columna de agua. Las dos especies más abundantes y frecuentes fueron Keratella americana y Lecane proiecta, Estas dos especies cosmopolitas son características de sistemas eutrofizados, con alta carga de nutrientes y materia orgánica, como lo que se observa en la ciénaga de Paredes. La diversidad en la ciénaga de Paredes ha disminuido en este cuerpo de agua sugiriendo cambios en las características que podrían afectar el funcionamiento del ecosistema lo que hace necesario desarrollar estudios a largo plazo que contribuyan al entendimiento de la estructura y dinámica no solo de la ciénaga sino también de sus cuencas aledañas y sus posibles afectaciones antrópicas.