INTRODUCCIÓN
Las aflatoxinas (AF) son metabolitos secundarios termoestables (> 300°C) producidos por los hongos cosmopolitas y ubicuos del género Aspergillus. Son difuranocumarinas que pueden causar intoxicaciones agudas y crónicas en humanos y animales, con comprobado efecto hepatotóxico, teratogénico, carcinogénico e inmunotóxico (IARC, 2012; Arrua et al. 2013; Benkerroum, 2019; Kumar et al. 2021), siendo las principales AFB1, AFB2, AFG1 y AFG2 y la AFM1, que es biotransformada a partir de la AFB1 en el tracto gastrointestinal de los mamíferos y excretada por la leche (Kumar et al. 2017; Patriarca y Fernandez Pinto, 2017; Arrúa et al. 2021).
Aspergillus flavus es la principal especie productora de estas aflatoxinas, y posee la capacidad adaptativa de crecer y desarrollarse en diferentes sustratos y en amplio rango de pH, temperaturas (12° C - 48° C), siendo ideal 28° C - 37° C, en ambientes con humedad superior al 80 %. A pesar de esto, la producción de micotoxinas se da bajo condiciones específicas y es multifactorial, dependiendo de la capacidad toxigénica de la cepa, la micobiota asociada, la temperatura, humedad, actividad de agua y composición quimica del sustrato, disponibilidad de oxígeno y tiempo de almacenamiento (Arrua et al. 2013; Kumar et al., 2017).
El maíz es un producto altamente susceptible a la contaminación por Aspergillus tanto en campo como durante el almacenamiento, y esto, representa el principal factor de riesgo de contaminación por aflatoxinas (Patriarca y Fernandez Pinto, 2017; Taniwaki et al., 2019).
Un aspecto relevante de este estudio es que el maíz en Paraguay tiene relevancia social, económica y cultural, siendo ingrediente de platos tradicionales consumidos de manera regular por las familias, especialmente en el campo, como lo son el vori-vori, la sopa paraguaya, polenta, mbeju entre otros (Salhuana y Machado, 1999), por tanto el consumo de estos productos contaminados con Aspergillus y sus micotoxinas podría representar un riesgo para los consumidores, especialmente en países como Paraguay, donde los controles de micotoxinas son casi inexistentes o nulos. Es por estas razones que conocer las características del agente causal, en este caso, A. flavus, ayudará a diseñar estrategias de mitigación, reduciendo los niveles de contaminación fúngica y consecuentemente disminuyendo el riesgo de contaminación por sus micotoxinas (Perrone et al., 2014; Probst y Cotty, 2012). Los aislados de A. flavus se destacan por la amplia variabilidad intra-especie que presentan, siendo así necesario además de identificarlos de forma correcta, caracterizar su capacidad de producir aflatoxinas (Okoth et al., 2018; Probst et al., 2014).
Para la detección de micotoxinas en alimentos u otras matrices es necesario seleccionar técnicas que posean alto grado de exactitud, precisión y reproducibilidad. Actualmente existen varios métodos normalizados de análisis que cumplen con estas exigencias, recomendados por la Asociación de Químicos Analíticos Oficiales - AOAC (Association of Official Analytical Chemists) (Lattanzio et al., 2018; Santos et al., 2013; Turner et al., 2015).
Las aflatoxinas tienen la ventaja de presentar fluorescencia natural, y esta característica, puede ser utilizada para su detección bajo luz ultravioleta (UV), este hecho, fue determinante en la detección y clasificación de las aflatoxinas. La AFB y AFG se denominan así por presentar fluorescencia blue (azul) y G, por presentar fluorescencia Green (verde), respectivamente, en el método de cromatográfica en capa delgada - CCD (Shephard, 2009; Zhang et al., 2018).
Para evaluar la capacidad aflatoxigénica se pueden ensayar diferentes sustratos, como medios de cultivo y sus diferentes composiciones, granos directamente in vitro o in vivo o bien utilizar técnicas cromatográficas e inmunoensayos para detección y cuantificación de las aflatoxinas (Probst y Cotty, 2012).
Considerando estos aspectos, el objetivo de este trabajo fue evaluar la capacidad de producir aflatoxinas de aislados de Aspergillus en medios de cultivo sintéticos y en modelo in vitro con granos de maíz.
MATERIALES Y MÉTODOS
Aislados fúngicos
Los experimentos fueron realizados en el Laboratorio de Biotecnología del Centro Multidisciplinario de Investigaciones Tecnológicas de la Universidad Nacional de Asunción (CEMIT-UNA), Paraguay.
Aislados de Aspergillus provenientes de maíz avatí-morotí y que pertenecen a la Colección de Cultivos de Microorganismos de la Universidad Nacional de Asunción - CCM-UNA (FELACC, SI-70) fueron seleccionados para este estudio.
Se reactivaron dos aislados de A. flavus (CCM-AS02, CCM-AS29) y un aislado de Aspergillus luchuensis (CCM-AS04) que fueron cultivados en cajas de Petri con medio de cultivo Papa Dextrosa Agar (PDA) e incubados a 25 °C, por cinco días. Estos organismos, previamente identificados morfológicamente, mediante el uso de la clave de identificación de Klich, 2009 (Klich y Pitt, 2009) y molecularmente mediante la secuenciación parcial de ITS1,4 y calmodulina (CaM)(Samson et al., 2014) poseen secuencias depositadas en GenBank (Tabla 1).
Tabla 1 Producción de aflatoxinas en medio de cultivo Agar-Coco (AC) y YES y determinación del tipo de aflatoxina por Cromatografía en Capa Delgada - CCD.
I: Inconclusa. + presencia de fluorescencia, - ausencia de fluorescencia bajo luz UV (A = 360 nm). AFB1: Aflatoxina B1. ND: no determinado.
*número de acceso en Genbank
CARACTERIZACIÓN DEL POTENCIAL AFLATOXIGÉNICO DE LOS AISLADOS DE Aspergillus SPP. EN MEDIOS DE CULTIVO:
Screening de aflatoxinas
Para el screening de la producción de aflatoxinas fueron sembrados explantes de 0,5 cm de diámetro en cajas de Petri con agar coco (AC) y agar extracto de levadura y sacarosa (YES - por su nomenclatura en inglés Yeast Extract Sucrose) que se incubaron a 25±2 °C por un periodo de siete días en ausencia de luz. La fluorescencia presentada por los crecimientos fúngicos fue visualizada bajo luz UV (A= 360 nm) (Davis et al., 1987; Sepúlveda y Piontelli, 2005; Rodrigues et al., 2007; Faria et al., 2017).
Análisis cualitativo de la producción de aflatoxinas
Primeramente, fue sembrado 1 µL de suspensión fúngica semilíquida de los aislados de A. flavus (CCM-AS02, CCM-AS29) y A. luchuensis (CCM-AS04) preparada con agar 0,2 % en cajas de Petri (90 mm) con el medio de cultivo YES. Se incubaron por siete días a 25±2 °C en ausencia de luz (Filtenborg et al., 1983).
Fue utilizado para el ensayo el método rápido de Filtenborg et al., (1983), que se basa en la cromatografía en capa delgada (CCD) para determinar el tipo de aflatoxina producida y fue realizado de dos maneras:
a) Se aplicó directamente un explante de 5 mm de diámetro con micelio fúngico en la placa de CCD, previamente activada.
b) Se sembraron 10 µL de los extractos obtenidos de la mezcla de tres explantes con micelio fúngico y 1 mL de cloroformo P.A. en la placa de CCD.
Se utilizaron placas cromatográficas de sílica gel 60 G F254 (20 x 20 cm, 0.25 mm espesor, Merck5721, Alemania). La fase móvil utilizada fue cloroformo: acetona (90:10, v:v). Los estándares de aflatoxinas B1, B2, G1 y G2 fueron utilizados en la concentración de 1(µ/mL. Las placas fueron reveladas con luz UV (λ= 360 nm).
Por último, se calculó el factor de retención y se comparó, en cada corrida, con los estándares (Pildain et al., 2005; Ritter et al., 2011; Rodrigues et al., 2007). Los ensayos fueron realizados por triplicado.
Infección in vitro de maíz
Para evaluar el potencial aflatoxigénico de los aislados de Aspergillus en maíz in vitro, se preparó suspensión fúngica con agua destilada estéril de cada aislado (CCM-AS02, CCM-AS04 y CCM-AS29) equivalente a 1-5 x 107 esporas/mL, que fue cuantificada en cámara de Neubauer.
Los granos de maíz avatí-morotT, recién adquiridos del mercado fueron previamente esterilizados por autoclave a 121 °C, 1 atm, por 15 minutos. Para el ensayo fueron colocados en frascos de vidrio, 10 g de maíz por repetición, cubiertos con una película delgada de polietileno (para reducir la pérdida de humedad del grano) y fueron realizadas pequeñas perforaciones para facilitar el intercambio gaseoso (Bucio-villalobos et al., 2001; Moreno Martínez et al., 2000), con un total de seis repeticiones por tratamiento.
Se inocularon las unidades experimentales con 1 mL de las suspensiones fúngicas más 4 mL de agua destilada estéril, y posteriormente, los frascos fueron incubados a 27±3 °C por diez días. El tratamiento control fue realizado mediante adición de 5 mL de agua destilada estéril.
Cuantificación de aflatoxinas
El contenido de aflatoxinas totales (AFB1, AFB2, AFG1 y AFG2) se determinó utilizando la prueba de inmunoensayo rápido de flujo lateral Afla-V®-VICAM® para granos de maíz, cuyo rango de cuantificación es 2 - 100 ppb y límite de detección de 2 ppb. La extracción de aflatoxinas totales se realizó siguiendo las instrucciones del fabricante, como se describe a continuación (VICAM, 2017). Se pesaron 5 g de granos de maíz, a los cuales se les adicionó una solución de 25 mL de metanol al 70 % y se agitaron por dos minutos.
Posteriormente, se filtró el sobrenadante y se transfirió 100 µL del extracto de cada muestra a un microtubo de 2 mL. Se adicionó 100 µL del Afla-V diluyente y se agitó en el vórtex. Por último, se transfirió 100 µL de esta mezcla al Afla-V strip test, se incubó por cinco minutos a temperatura ambiente y se realizó la lectura en el equipo VertuTM Lateral Flow Reader. En el caso de valores por encima del rango de cuantificación de la técnica, se realizaron diluciones con metanol al 70 % y se repitieron los pasos anteriores desde la utilización del Afla-V diluyente. Finalmente, se multiplicaron los resultados obtenidos por el factor de dilución para determinar la concentración de aflatoxinas de las muestras en ppb.
Análisis estadístico:
Los resultados fueron sometidos a análisis de varianza (ANOVA) soportado por las múltiples comparaciones de Tukey y fue considerado significativo cuando el p< 0,05. Los análisis estadísticos fueron realizados con GraphPad Prism versión 8.0.0 para Windows, GraphPad® Software, San Diego, California USA, www.graphpad.com.
RESULTADOS
En la tabla 1 se visualizan los resultados obtenidos del screening de la producción de aflatoxinas en medio de cultivo AC y YES, sin embargo, con el medio de cultivo AC el resultado se consideró inconcluso ya que no fue posible distinguir la presencia/ausencia de fluorescencia bajo luz UV (λ= 360nm).
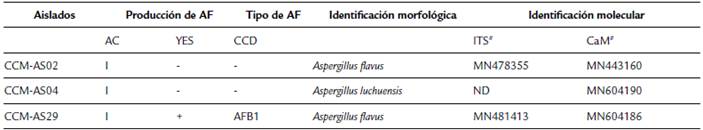
A. flavus CCM-AS29 produjo fluorescencia correspondiente con la producción de aflatoxinas, tabla 1. Con la técnica de CCD se pudo determinar que la aflatoxina producida corresponde con AFB1 por las dos técnicas ensayadas, tanto mediante el uso de explantes, como con el extracto (Fg. 1a y b). En los aislados A. flavus CCM-AS02 y A. luchuensis CCM-AS04 no se observó la producción de aflatoxinas en YES (Tabla 1), con ninguna de las técnicas de detección ensayadas en este estudio como se visualiza en las figuras 1c y d.
Figura 1 Cromatografía en capa delgada - CCD de los aislados de Aspergillus (explantes y extractos) para identificar las aflatoxinas producidas en medio de cultivo YES. Fase estacionaria sílica-gel 60 F254 y fase móvil cloroformo: acetona (90:10). a: Visualización de fluorescencia en la placa CCD (UV λ 360 nm), comparada con los estándares AFB1, AFB2, AFG1, AFG2 . b: Aflatoxina B1 - Aspergillus flavus CCM-AS29 (I, II- explantes; III y IV- extracto), c: Ausencia de bandas fluorescentes - Aspergillus flavus CCM-AS02, d: Ausencia de bandas fluorescentes - Aspergillus luchuensis CCM-AS04.
En cuanto a los resultados de la infección in vitro de maíz con los aislados de A. flavus (CCM-AS02, CCM-AS29) y A. luchuensis (CCM-AS04), se observa un incremento significativo de la producción de aflatoxinas (p< 0,05) en los grupos infectados con A. flavus CCM-AS02 (70.500±446,1 ppb) y CCM-AS29 (55.570±1143,6 ppb) cuando los mismos son comparados con el control que fue inoculado con agua destilada estéril (15,6±1,3 ppb) (Fig. 2). A su vez, el grupo inoculado con A. luchuensis CCM-04 (<LOD - 2 ppb), no se observó la producción de aflatoxinas.
Es importante resaltar que el aislado CCM-AS02 no produjo aflatoxinas en el medio de cultivo sintético (YES), sin embargo, cuando se inoculó en granos de maíz se observaron concentraciones superiores de aflatoxinas totales (70.500±446,1 ppb) en comparación con CCM-AS29 (55.570±1143,6 ppb), el cual es productor de estos metabolitos en medio de cultivo.
DISCUSIÓN
A. flavus presenta como característica intrínseca la variabilidad en el potencial de producir aflatoxinas (Camiletti et al., 2018; Okoth et al., 2018; Thathana et al., 2017), sin embargo, es conocido que en la población existen organismos no productores de la micotoxina, por lo que, determinar estas características, los factores y métodos ideales para que se den la producción de aflatoxinas, es crucial. En este estudio, como se pudo observar en los resultados obtenidos, en la tabla 1, con el medio de cultivo agar-coco, no fue conclusiva la presencia de fluorescencia bajo luz UV, contrario a lo descrito en la literatura (Davis et al., 1987; Faria et al., 2017); lo que se podría considerar como una limitación del estudio, y esto, podría atribuirse a las diferentes constituciones y formas de preparación del medio a base de coco que no se encuentra completamente unificado hasta la actualidad.
En la modificación utilizada por Monda et al. (2020), fue posible detectar fluorescencia por debajo de 1,75 ppb, que es el límite de detección del método de comparación utilizado RIDASCREEN®, sin embargo, Abbas et al. (2004) y Thathana et al. (2017) relataron en sus trabajos que la sensibilidad de técnicas que utilizan medios de cultivo para verificar la fluorescencia de aflatoxinas es muy baja, recomendando la asociación con métodos cromatográficos.
En cuanto al medio de cultivo a base de extracto de levadura (YES), se pudo determinar tanto la presencia como ausencia de fluorescencia bajo luz UV y la clasificación del tipo de aflatoxina producida por cromatografía en capa delgada (CCD) coincidiendo con Astoreca et al. (2012) y Gqaleni et al. (1997), que mencionan que este medio de cultivo favorece la producción de aflatoxinas, esto, se puede atribuir a su formulación enriquecida con carbohidratos y otros nutrientes (Liu et al., 2016).
La evidencia científica demuestra que los factores determinantes para estimar el riesgo potencial de contaminación por aflatoxinas en los alimentos son conocer la frecuencia fúngica y caracterizar el potencial de producción de aflatoxinas de los aislados en sus diferentes enfoques como molecular y fisiológico (Probst et al., 2014). La matriz donde crecen y se desarrollan estos organismos es uno de los factores de mayor relevancia para la producción de micotoxinas. En nuestro trabajo se pudo verificar que A. flavus CCM-AS02 no solo presentó producción de aflatoxina cuando se analizó en su matriz de origen (granos de maíz -in vitro), sino que, fue más elevado del que se observó en el aislado CCM-AS29, cuyo potencial ya fue demostrado por cromatografía en capa delgada (CCD) (Tabla 1 y Fg. 1).
Según Prost y Cotty (2012) la técnica para evaluar la producción de aflatoxinas de A. flavus con el ensayo in vitro con el maíz esterilizado por autoclave es altamente correlativa con el modelo de infección in vivo (Probst y Cotty, 2012) y ha sido sobradamente predictiva con la producción de aflatoxinas, lo que respalda la extrapolación de estos resultados a condiciones de almacenamientos utilizados en nuestro país.
A su vez, los mismos autores mencionan la variabilidad entre aislados y reportan algunos organismos con capacidad de producir hasta 200 000 ppb de AFB1 mientras que otros, presentan niveles mucho menores (10 ppb). En este estudio, la producción de aflatoxinas por parte de los aislados ensayados varió entre 50 000 y 70 000 ppb (Fig. 2). La capacidad de producción de aflatoxinas determinada es preocupante, lo cual es un indicativo de riesgo, considerando estas concentraciones tan elevadas.
Otro factor importante en el estudio de hongos productores de micotoxinas es la coinfección de A. flavus con otras especies y si éstas son importantes para inhibir o potenciar la producción de aflatoxinas, por lo que se evaluó como grupo externo al aislado A. luchuensis CCM-AS04, siendo este el primer reporte de esta especie en granos de maíz en Paraguay (Tabla 1). Es importante recalcar que este aislado no es reportado como productor de aflatoxinas (Hong et al., 2013) lo que fue corroborado bajo las condiciones de nuestro estudio.
La cantidad de aflatoxinas totales presentes varió de 13 a 16 ppb, en el grupo control (Fig. 2), demostrando la contaminación natural previa con dicha micotoxina en el maíz comercializado en Asunción, y corroborando este hallazgo con trabajos anteriores realizados por este grupo de investigación que también determinó la presencia de aflatoxinas en maíz adquirido en diferentes establecimientos comerciales (datos no publicados).
Considerando que el límite máximo tolerable (LMT) por Mercosur y FDA ( de las siglas en inglés, Food and Drug Administration, Estados Unidos), en granos de maíz es 20 ppb, los niveles determinados en el testigo con contaminación natural se encuentran dentro del rango permitido, sin embargo, esto representa un llamado de atención por el potencial riesgo, en especial para las personas vulnerables, como niños, embarazadas e inmunosuprimidos en general, sobre todo, considerando la toxicidad de las aflatoxinas (Arrúa et al., 2021; Benkerroum, 2020; IARC, 2012; MERCOSUR/GMC/RES. No 25/02, 2002). No obstante, si consideramos los LMT establecidos por la Unión Europea (Official Journal of the European Union, 2006) para aflatoxinas totales en maíz esde 10 ppb, las muestras testigos superan el límite tolerable.
La presencia de Aspergillus y aflatoxinas con alto potencial toxigénico contaminando maíz es una situación preocupante considerando el impacto económico directo e indirecto que puede representar. En cuanto a las pérdidas directas, se pueden resaltar la disminución del rendimiento de los granos, y la pérdida de mercados, como consecuencia de calidad industrial inferior y las restricciones a las exportaciones debido a los límites tolerables de aflatoxinas establecidos por los diferentes mercados internacionales. Las pérdidas indirectas, que muchas veces pasan desapercibidas, pero no por ello son de menor importancia, se relacionan principalmente a los efectos en la salud humana y animal ya que el grano no apto para comercialización para consumo humano, erróneamente se destina a alimentación animal, lo que lleva a un rechazo del alimento, baja del rendimiento, además de los efectos negativos en la salud animal y en casos extremos la muerte. Con relación a la salud humana se incrementan los gastos de la salud pública, debido al potencial carcinógeno de las aflatoxinas. y otras complicaciones graves que puede provocar. Los costos de disposición final de los granos contaminados, los retiros de los productos contaminados y las inversiones en investigación para el desarrollo de nuevas variedades, técnicas de diagnóstico y detección de micotoxinas entre otros aspectos, también son pérdidas importantes (IARC, 2012; P. Kumar et al., 2017; Mahato et al., 2019; Rushing y Selim, 2019).
Un aspecto fundamental a tener en cuenta es que la ingesta de alimentos contaminados con aflatoxinas afecta directamente la seguridad alimentaria, considerando que uno de los aspectos esenciales para cumplirla es la inocuidad del alimento consumido; esto, sumado a la problemática de la falta de programas de vigilancia, prevención y control de enfermedades trasmitidas por alimentos contaminados con micotoxinas en países en desarrollo como Paraguay y que tiene un impacto directo sobre todo en las poblaciones con mayor vulnerabilidad (Kumar et al., 2021; Mahato et al., 2019).
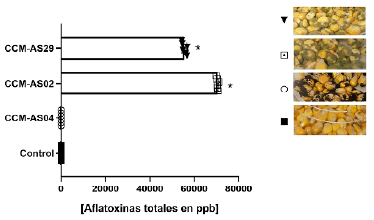
Figura 2 Determinación de la concentración de aflatoxinas en ppb en maíz avatí-morotí infectado por aislados de Aspergillus flavus CCM-AS02, CCM-AS29 y Aspergillus luchuensis CCM-AS04. Control: agua destilada estéril. LOD - 2 ppb. ANOVA post-test Tukey *p< 0,05.
A pesar de que la evaluación de riesgos es multifactorial, este estudio y sus resultados representan datos preliminares para determinar la capacidad de producción de aflatoxinas de aislados de Aspergillus en Paraguay bajo las condiciones específicas ensayadas.
CONCLUSIONES
Los aislados de A. flavus CCM-AS02 y CCM-AS29 provenientes de avatí-morotí (maíz de consumo humano) demostraron poseer una alta capacidad de producción de aflatoxinas bajos las condiciones ensayadas, en medio de cultivo YES y en granos de maíz a temperatura de 27±3 °C. Esto es una evidencia más de que es necesario alertar del riesgo que representa la contaminación de los granos de maíz con Aspergillus y aflatoxinas en Paraguay, marcando la importancia de establecer estrategias preventivas de control de este hongo en toda la cadena productiva del maíz.















