Halichoeres bivittatus (Bloch, 1791) (Pisces: Labridae) especie conocida localmente como Doncella rayada, se distribuye desde Carolina del Norte a Brasil, incluyendo el Golfo de México y el Mar Caribe, habitando comúnmente áreas rocosas y de arrecifes poco profundos, con hábitos alimenticios heterótrofos a base principalmente de gasterópodos (Cervigón, 1993). La Doncella rayada no tiene importancia pesquera artesanal; sin embargo, es muy abundante en arrecifes costeros y en escolleras en la línea costera (Clavijo y Donaldson, 1994; Hernández-Hernández et al., 2009), pero su importancia radica en su abundancia, como un componente importante en las interacciones tanto intraespecíficas como interespecíficas que se establecen en los ecosistemas. Por otro lado, los estudios sobre helmintos parásitos en lábridos son limitados, Muñoz et al. (2007) recopilaron las especies de helmintos parásitos para lábridos a nivel global; para H. bivittatus (Bloch) los registros corresponden a Neoapocreadium coili (Sogandares-Bernal, 1959) (Sogandares-Bernal y Sogandares, 1961), Proctoeces maculatus (Looss, 1901) (Shimazu y Nagasawa, 1985), P. subtenuis (Linton, 1907) (Linton, 1907), Schikhobalotrema adacutuum (Manter, 1938) (Manter, 1947), Lecithochirium latum (Vigueras, 1958) (Pérez-Vigueras, 1958), Coitocaecum sp. (Siddiqi y Cable, 1960), Helicometrina execta (Linton, 1910) (Overstreet, 1969), H. nimia (Linton, 1910) (Manter, 1933), Helicometra sp. (Dyer et al., 1998), Nicolla halichoeri (Overstreet, 1969) (Overstreet, 1969). En tanto, los estudios de comunidades de helmintos parásitos en lábridos también son limitados, se cuenta con los de Symphodus tinca (Linnaeus) y Labrus merula (Linnaeus) de Valencia, España (Campos y Carbonell, 1994), Halichoeres melanurus y otras especies de la familia Labridae de Australia (Muñoz et al., 2007) y para México el de H. radiatus de los arrecifes de Veracruz (Montoya-Mendoza et al., 2021), por lo que el presente el estudio analizó la riqueza y diversidad de la comunidad de especies de helmintos parásitos de H. bivittatus.
Se examinaron 94 especímenes de H. bivittatus, incluyendo 51 de Punta Gorda (sitio localizado en el extremo noroeste del Parque Nacional Sistema Arrecifal Veracruzano (PNSAV) 19°15'00'' N, 96°10'38'' W) y 43 de la escollera Mata de Uva (localizada al sur del PNSAV: 19°01'22'' N, 95°57'56'' W), ambos sitios fuera del polígono del parque (DOF, 2012), en el Estado de Veracruz, suroeste del Golfo de México. Los peces fueron capturados por pescadores de la localidad, mediante red tipo cuchara con diámetro de 50 cm y luz de malla de 0,4 cm, las colectas fueron mensuales de mayo a septiembre de 2001 hasta completar cada tamaño de muestra. La captura fue transportada en contenedores de plástico con hielo al Laboratorio de Investigación de Acuacultura Aplicada del Instituto Tecnológico de Boca del Río. En el laboratorio los peces fueron identificados mediante las claves de Humann y DeLoach (2013). De cada espécimen se registró longitud total en cm con un ictiómetro y el peso en g con una balanza analítica Entris® II con precisión de 0,1 g. Dentro de las 24 h posteriores a su captura se aplicó el examen helmintológico. El examen externo incluyó piel, aletas, boca y branquias, y el examen interno incluyó ojos, cerebro, mesenterios, esófago, estómago, intestino y músculos. Todos los helmintos fueron separados en cajas Petri con solución salina al 0,75 %, fijados en formalina caliente al 4 % y preservados en frascos viales con alcohol al 70 %. Para digéneos y céstodos se elaboraron preparaciones totales teñidos con Paracarmín de Mayer o Tricrómica de Gomori, aclarados con aceite de clavo y montados con Bálsamo de Canadá (índice de refracción n = 1,55). Los nemátodos fueron aclarados con glicerina y preservados en alcohol al 70 % de acuerdo con Vidal-Martínez et al. (2001). Se seleccionaron especímenes para depositar en la Colección Nacional de Helmintos (CNHE) del Instituto de Biología de la Universidad Nacional Autónoma de México, Ciudad de México, México. De acuerdo con Bush et al. (1997), se calculó la prevalencia (porcentaje de hospederos infectados para cada especie de helminto parásito) e intensidad promedio (número promedio de helmintos parásitos por hospedero infectado para cada especie de parásito). Para la muestra de cada sitio se analizó riqueza y diversidad de especies a nivel de comunidad componente (todas las especies de helmintos de todos los hospederos examinados) e infracomunidad (todas las especies de helmintos por hospedero examinado) (Holmes y Price, 1986; Bush et al., 1997).
Se analizó el tamaño de muestra para cada sitio mediante curvas de acumulación de especies, siguiendo el análisis de la comunidad de helmintos parásitos de Lutjanus campechanus (Poey) y Lutjanus synagris (Linnaeus) (Montoya-Mendoza et al., 2014, 2016). Las curvas fueron obtenidas con una aleatoriedad de 100, apoyados con el programa EstimateS, versión 8.0 (Moreno y Halffter, 2001; Colwell, 2011). La asíntota de la riqueza de especies se analizó con base en el modelo de Clench, ya que la ecuación del modelo permite estimar el número total de especies a nivel de comunidad componente como a/b (Clench, 1979; Soberón y Llorente, 1993; Jiménez-Valverde y Hortal, 2003). El modelo de Clench se describe por la ecuación: V2 = (a*V1)/ (1+(b*V1)), donde V2 es la riqueza observada, V1 es el número de hospederos examinados, a y b son parámetros de la curva calculada iterativamente: a es igual a la tasa de adición de nuevas especies, y b es un parámetro relacionado con la forma de la curva (ver Jiménez-Valverde y Hortal, 2003). Para determinar el número de especies raras que faltan a nivel de comunidad componente se aplicó el índice Bootstrap como un estimador no paramétrico de la riqueza de especies a partir de los datos observados siguiendo los criterios de Poulin (1998).
Table 1 Parámetros de infección y sitio de infección de los helmintos parásitos de Halichoeres bivittatus de Veracruz, México.
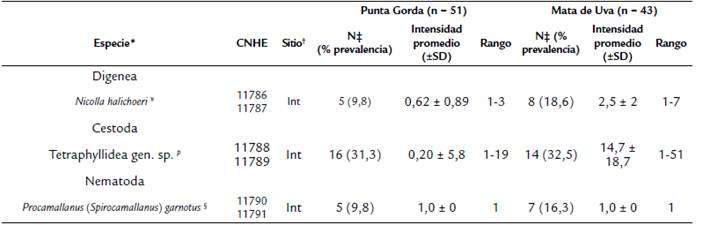
*Etapas de vida de las especies: p, plerocercoide.
†Sitio: Int, intestino.
‡N, número de huéspedes infectados.
§ Nuevo registro de hospedero.
¥ Nuevo registro de localidad.
CNHE: Colección Nacional de Helmintos, México; SD: desviación estándar.
Para la comunidad componente se calculó el índice de diversidad de Shannon-Wiener (H') (Magurran, 2004) y para la infracomunidad se calculó el promedio del número de especies de helmintos por pez, el promedio del número de especies de helmintos y el valor promedio del índice de diversidad de Brillouin (H) (Magurran, 2004), y se analizó la correlación entre el número total de especies (S) y el número total de helmintos (N) en función de la longitud y el peso del hospedero (Zar, 2010).
Se examinaron 51 especímenes H. bivittatus de Punta Gorda (PG), con una longitud total de 3,6 a 10,5 (promedio 6,7 ± 1,7) cm y peso de 1,0 a 15,0 (promedio 4,6 ± 3,5) g, y 43 especímenes de la misma especie de Mata de Uva (MU), con longitud total de 4,5 a 11,0 (promedio 7,3 ± 1,6) cm y peso de 2,0 a 15,0 (promedio 5,4 ± 3,2) g. En total, se recolectaron 326 helmintos (93 en PG y 233 en MU), se identificaron para ambos sitios tres especies: un digéneo Nicolla halichoeriOverstreet, 1969 (Digenea: Plagiorchiida: Opecoelidae), una larva de céstodo del Orden Tetraphyllidea y un nemátodo Procamallanus (Spirocamallanus) garnotus Bashirullah et Williams, 1980 (Nematoda: Rhabditida: Camallanidae).
El análisis de las curvas de especies acumuladas para la comunidad componente registró que el inventario de especies de helmintos está casi completo para ambos sitios y que la pendiente de la curva de especies acumuladas para la muestra fue de 0,005 en PG y 0,004 en MU, por lo que casi se alcanzó la asíntota y la riqueza estimada por el modelo de Clench: para PG fue 3,4 (a = 0,74, b = 0,21, a/b = 3,4) y para MU fue de 3,3 (a = 1,25, b = 0,38, a/b = 3,3). El valor Bootstrap, estimó que la riqueza de especies para PG fue de 3,1 y para MU 3,0, confirmando que la mayoría de las especies de helmintos en la comunidad componente se recuperaron casi en su totalidad para ambas muestras.
La mayor prevalencia registrada para ambos sitios fue para las larvas Tetraphyllidea (PG, 31,3 % y MU, 32,5 %); y la mayor intensidad promedio fue para las mismas larvas, pero en la muestra de MU (14,7 ± 18,7), adicionalmente N. halichoeri; es nuevo registro de localidad y el nemátodo P. (S.) garnotus nuevo registro de hospedero (Tabla 1).
En tanto, los parámetros de infracomunidad de H. bivittatus (Tabla 2) fueron menores a los de H. radiatus (promedio de riqueza 2,6 ± 0,81, promedio del número de helmintos 13,2 ± 23,0, y el promedio del índice de Brillouin 0,35 ± 0,26) (Montoya-Mendoza et al., 2021), de igual forma con los valores de las infracomunidades de carángidos, sciaénidos y lutjánidos del PNSAV y como de E. morio (2,62-4,5, 15,9140,6 y 0,13-0,87, respectivamente) del sureste del Golfo de México (Vidal-Martínez et al., 1998) y con otros hospederos de la Bahía de Chetumal, Mar Caribe (Aguirre-Macedo et al., 2007); de igual forma con los registros para lábridos de España (Campos y Carbonell, 1994) y de Australia (Muñoz et al., 2007).
Tabla 2 Parámetros de infracomunidad de helmintos parásitos de Halichoeres bivittatus de Veracruz, México.
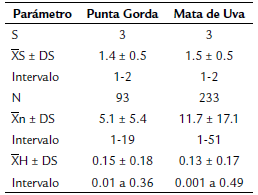
Los datos incluyen: S, riqueza de especies de helmintos; x̅S, promedio de especies de helmintos; x̅n, promedio del número de helmintos; x̅H, promedio del índice de Brillouin.
Estos registros bajos de riqueza y diversidad de especies pueden ser en respuesta a diferencias latitudinales y hábitos alimenticios de los hospederos, ya que particularmente H. bivittatus tiene una dieta limitada de posibles hospederos intermediarios infectados, a diferencia de otros hospederos, tanto del área de estudio como de otros sitios, los cuales suelen tener mayor vagilidad y una dieta que incluye una gran variedad de posibles hospederos intermediarios, que los exponen a infecciones al consumir estos posibles hospederos intermediarios infectados, como señalan Campos y Carbonell (1994), Muñoz et al. (2007) y Aguirre-Macedo et al. (2007). En este mismo aspecto, PG es señalado como un sitio sometido a una presión ambiental por su cercanía a la actividad portuaria, tanto del Viejo como del Nuevo Puerto de Veracruz (Jiménez-Badillo et al., 2014); además, este sitio lo señalaron con desarrollo de comunidades secundarias debido al alto deterioro ambiental por la pérdida de riqueza y diversidad de especies (Horta-Puga y Tello-Musi, 2009). En tanto, las escolleras artificiales de MU fueron puestas en la línea de playa de esta localidad con la finalidad de protegerla y evitar la pérdida de la misma por acción de las corrientes marinas. Estos sitios, con reciente construcción presentan limitada riqueza y diversidad de especies por efecto de la sucesión secundaria, como señalan Cházaro-Olvera et al. (2021) en comunidades de crustáceos marinos del litoral veracruzano. Por lo antes mencionado, resulta evidente la ausencia de invertebrados que son los hospederos intermediarios de los helmintos parásitos, y el escaso desarrollo de las comunidades de hospederos intermediarios tienen efecto en la riqueza de las comunidades de parásitos en los hospederos definitivos, por lo tanto, los ciclos de vida de estas especies no se cumplen en sitios con estas características (Aguirre-Macedo et al., 2011).
Cabe señalar que las infecciones de peces ocurren mediante la alimentación, ya que las tres especies de helmintos parásitos se localizaron en el intestino, confirmando la importancia de las infecciones mediante la cadena alimenticia, particularmente de Tetraphyllidea, puesto que la abundancia de estas larvas ubica a H. bivittatus como hospedero intermediario de estos parásitos que completan su ciclo de vida en elasmobranquios como Carcharhinus leucas (Müller et Henle) y otras especies de tiburones de la costa de Veracruz (Méndez y González, 2013, 2017).















