INTRODUCCIÓN
Los humedales constituyen uno de los ecosistemas más valiosos del planeta debido a que cumplen un rol importante en el mantenimiento y la regulación hídrica de las cuencas hidrográficas, estuarios y aguas costeras por medio de la regulación de la disponibilidad del agua, la mitigación del impacto por inundaciones, la absorción de contaminantes y la retención de sedimentos. Adicionalmente, presentan un gran potencial turístico por su valor paisajístico y son importantes en el ámbito de la educación y la investigación (Ministerio del Ambiente [MINAM], 2015), además de actuar como refugio de biodiversidad e influir en el control de la erosión (Moss, 2006). En la actualidad hay más de 2 400 humedales reconocidos como de importancia internacional o "Sitios Ramsar" en todo el mundo; 13 de estos se encuentran en Perú (Pulido, 2010), cinco de los cuales corresponden a humedales costeros, dentro de los que se destaca el Refugio de Vida Silvestre Los Pantanos de Villa por ser el único humedal urbano reconocido como un Área Natural Protegida (ANP) en el Perú.
La mayoría de las investigaciones realizadas en estos ecosistemas han sido sobre aves acuáticas; por ello se sabe de la estrecha y vital relación de estos ambientes con dichas comunidades. Sin embargo, se conoce poco sobre otras comunidades como la de los macroinvertebrados acuáticos y su relación con su entorno abiótico.
Entre los distintos taxones de macroinvertebrados acuáticos, los coleópteros constituyen un grupo notable debido a que presentan gran abundancia, alta diversidad ecológica, rangos de distribución restringidos y alto endemismo, constituyendo buenos indicadores de la biodiversidad de un territorio (Vergara et al., 2006).
A pesar de los estudios realizados sobre coleópteros acuáticos, se han establecido pocas correlaciones entre estos y las distintas variables fisicoquímicas. No obstante, se conoce la tolereancia de Enochrus a la salinidad (Kefford et al., 2003) y la correlación negativa entre la riqueza específica de coleópteros y la conductividad eléctrica (Epele and Archangelsky, 2012). Sin embargo, estos estudios fueron realizados en diferentes ambientes, desde sistemas lóticos en Australia (Kefford et al., 2003), hasta grandes lagos de USA (Arnott et al., 2006) y de Turquía (Özdamar and Kiyak, 2018). Muy pocos se han hecho en humedales propiamente dichos, como los realizados en Inglaterra (Juliano, 1991) y en Argentina (Epele y Archangelsky, 2012).
Armin et al. (2009) indicaron que la fisicoquímica del agua influye en la estructura comunitaria de los coleópteros acuáticos; además, investigar la relación de esta comunidad con el entorno abiótico puede dar información importante sobre eventos recientes ocurridos en su hábitat (Marques et al., 2003). En consecuencia, el objetivo de este estudio fue determinar la composición de la comunidad de coleópteros acuáticos presentes en el Refugio de Vida Silvestre Los Pantanos de Villa y evaluar la influencia de las variables fisicoquímicas del agua en la distribución espacial y temporal de esta comunidad.
MATERIALES Y MÉTODOS
Área de estudio
El presente estudio se realizó en el Refugio de Vida Silvestre Los Pantanos de Villa (RVSLPV), ubicado al sur de Lima Metropolitana, en el distrito de Chorrillos (Perú), el cual cuenta con una extensión de 263,27 hectáreas ubicadas entre las coordenadas 12°11'42''- 12°13'18'' S y 76°58'42''- 76°59'42'' W. Según el Mapa Nacional de Ecosistemas del Perú, se ubica en la Región Costa y pertenece al ecosistema Humedal Costero (MINAM, 2019). Esta área corresponde a una depresión plana entre los 0 y 5 m.s.n.m., rodeados de colinas entre los 100 y 300 m.s.n.m. y una línea de playa recta. La temperatura presenta un rango entre 15,6 °C y 25,8 °C y las precipitaciones totales mensuales son de 60 mm en promedio. El sitio corresponde a una llanura formada por depósitos aluviales moderadamente profundos, de textura franco-arenosa con problemas de excesiva salinidad (mayor a 16 mmhos/cm). Sus factores limitantes son el drenaje pobre y la alta salinidad, entre los más importantes (Instituto Nacional de Recursos Naturales [INRENA], 1998).
Los cuerpos de agua de esta ANP se alimentan de la filtración y escurrimiento de los acuíferos subterráneos provenientes de la cuenca del Río Rímac (Torres, 1999). Por otro lado, el flujo de agua es regulado por la entidad municipal a través de la extensa red de canales y drenes que recorren el RVSLPV (Pulido y Bermúdez, 2018).
Muestreo en campo y análisis en laboratorio
Las recolectas de macroinvertebrados acuáticos se realizaron en seis lagunas del RVSLPV: Delicias, Génesis, Marvilla, Mayor, Refugio y Sur, estableciéndose dos estaciones de muestreo (A y B) dentro de cada laguna (Fig. 1). Las estaciones de muestreo se seleccionaron según la representatividad y accesibilidad dentro del RVSLPV. Así, se incluyeron lagunas como Delicias por encontrarse en la zona de recuperación del ANP (SERNANP, 2016) y estar rodeada por viviendas en casi toda su extensión; además, se encuentra separada del resto del ANP por una de las principales avenidas del distrito; Génesis, por ser parte del circuito turístico y su facilidad de acceso; Marvilla, por ser la más próxima al mar, colindar con viviendas, tener la mayor presencia de aves comparada con las otras lagunas y también ser parte del recorrido turístico; la laguna Mayor se seleccionó por ser la más extensa y atractiva para turistas e investigadores; se tomaron muestras en Refugio por encontrarse fuera del circuito de turístico y lejos de zonas urbanas; y se incluyó a la laguna Sur por su extensión, ubicación y acceso. Se obtuvieron cinco réplicas en cada estación y se realizaron cuatro campañas de muestreo (12 de julio, 30 de setiembre y 15 de diciembre del 2017 y 10 de febrero del 2018). Se analizaron un total de 240 muestras.
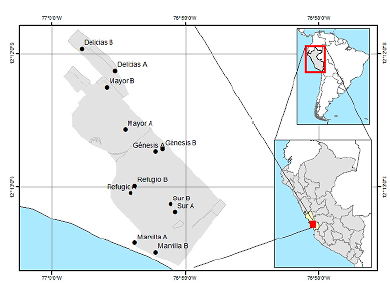
Figura 1 Ubicación de las estaciones de muestreo en el Refugio de Vida Silvestre Los Pantanos de Villa.
Se midieron in situ en cada estación y campaña de muestreo (entre las 9 y 14 horas del día, previo al muestreo de macroinvertebrados) la conductividad eléctrica (CE) y la turbidez (Turb) con un multímetro modelo KL 1385; el potencial de Hidrógeno (pH) y la temperatura (T) con un potenciómetro/termómetro modelo KL-009 (III) ATC y el oxígeno disuelto (OD) mediante un oxímetro portátil HANNA modelo HI9146-04, sumergiendo la sonda a aproximadamente 5 cm de profundidad.
Las muestras de coleópteros acuáticos se recolectaron en el borde del cuerpo de agua con una red Surber (250 µm, 30 cm x 30 cm) removiéndo vigorosamente el fondo y sobre la vegetación sumergida. El área muestreada por estación (considerando las cinco réplicas tomadas en cada una) fue de 0,45 m2. El material obtenido se fijó en alcohol al 96 % y posteriormente cada muestra se lavó con agua potable en un tamiz de 500 µm de abertura de malla para eliminar el exceso de detrito fino. Para la identificación taxonómica se utilizaron un estereomicroscopio marca Zeiz modelo Stemi DV4 con 80X de aumento y un microscopio compuesto marca Zeiz modelo Primo Star con 400X de aumento. Para la determinación de las especies se realizaron disecciones del edeago en machos adultos, previamente tratados en KOH al 10 % en baño térmico por 3-4 minutos para limpiar las estructuras de tejido e impurezas, y se conservaron en microviales con solución de alcohol al 96 %. Se utilizaron las claves taxonómicas de Perkins (1980), Trémouilles (1984), Ferreira-Jr (1995), Hansen (1995), Miller (2001), White and Roughley (2008), Archangelsky et al. (2009) y Balke et al. (2017). Los coleópteros acuáticos identificados se depositaron en la colección de macroinvertebrados bentónicos del Laboratorio de Invertebrados Acuáticos (Labinac), Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos (UNMSM).
Análisis de datos
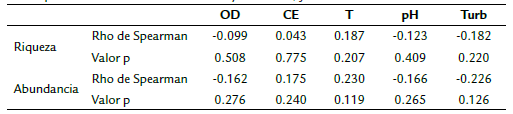
Luego de evaluar la normalidad de los datos, se utilizaron las pruebas no paramétricas de Kruskall-Wallis para estimar las diferencias significativas de la riqueza y abundancia entre estaciones de muestreo y entre lagunas. Se realizó un Análisis de Componentes Principales (ACP) para determinar las relaciones entre las estaciones de muestreo y las variables fisicoquímicas del agua, previamente se normalizaron los datos en el software PRIMER-E Ltd v6.1.6 (Clarke and Gorley, 2006). Se evaluó la similitud biótica entre las estaciones con el método de agrupamiento jerárquico (Cluster) (Rivera, 2011) y se realizó el análisis de escalamiento multidimensional no paramétrico (nMDS) agregando la variable "dummy" para agrupar las estaciones en las que no hubo conteo de organismos (Clarke et al., 2006). Ambos análisis se trabajaron en el software PRIMER-E Ltd v6.1.6 a partir de los datos transformados al aplicarles raíz cuadrada. Se graficó la curva de acumulación de especies con los estimadores no paramétricos Chao1 (basado en abundancia) y Jacknife1 (basado en incidencia) utilizando el programa PRIMER-E (Clarke and Gorley, 2006). Se evaluó el nivel de significancia entre las variables bióticas (riqueza y abundancia) y abióticas (variables fisicoquímicas) a nivel global y por campaña de muestreo, mediante la correlación de Spearman (por tratarse de datos con distribución no paramétrica) utilizando el programa Minitab 18.1. Se realizó el Análisis de Correspondencia Canónica (ACC) para determinar el grado de correlación entre las variables fisicoquímicas y la distribución de los coleópteros acuáticos entre las estaciones de muestreo; para este análisis los datos se transformaron previamente aplicándoles la raíz cuadrada; no se consideró a Meridiorhantus calidus, dado que solo se recolectó un individuo. La significancia estadística de los autovalores obtenidos en el ACC y las correlaciones entre especies y las variables fisicoquímicas se evaluaron con la prueba de Montecarlo basadas con 999 permutaciones. Este análisis se realizó en el programa estadístico Past 3.26 (Hammer et al., 2001).
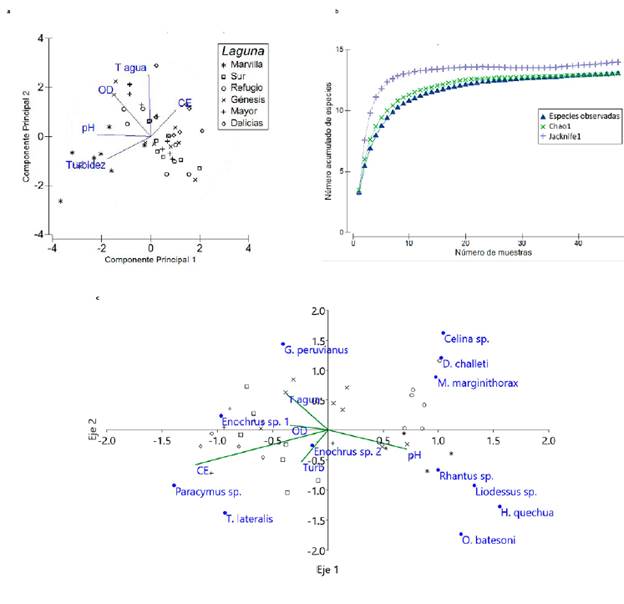
Figura 3 a. Análisis de componentes principales (ACP) de lagunas y variables fisicoquímicas, b. Curva de acumulación de especies de coleópteros acuáticos, y c. Análisis de Correspondencia Canónica (ACC) de los coleópteros acuáticos y las variables fisicoquímicas en el Refugio de Vida Silvestre Los Pantanos de Villa (Lima, Perú) de julio 2017 a febrero 2018.
Tabla 1 Ubicacion, parametros fisicos y unidades de vegetacion por estacion de muestreo en el Refugio de Vida Silvestre Los Pantanos de Villa (Lima, Peru). Julio 2017 - febrero 2018.
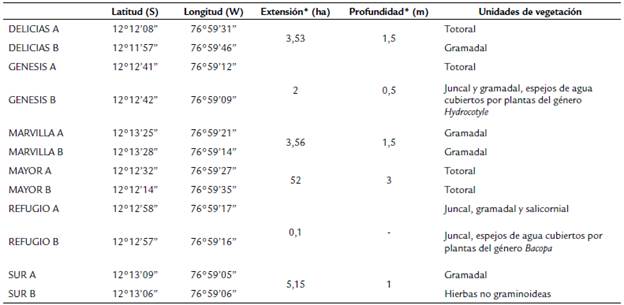
*Fuente: SERNANP (2016).
RESULTADOS
Caracterización fisicoquímica del agua
Los valores de oxígeno disuelto y conductividad eléctrica fueron altos en todas las estaciones y los valores de pH medidos mostraron tendencia a la alcalinidad, mientras que la temperatura del agua varió dentro de estrechos rangos en todas las lagunas estudiadas. En general, los valores de turbidez fueron menores a 100 NTU, con excepción de las estaciones de la laguna Marvilla (Tabla 2).
Tabla 2 Variables fisicoquímicas por estación de muestreo en el Refugio de Vida Silvestre Los Pantanos de Villa (Lima, Perú). Julio 2017 febrero 2018.
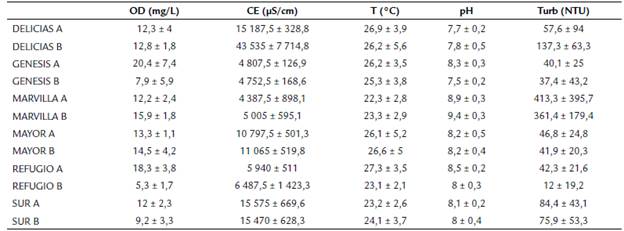
OD: Oxígeno disuelto, CE: conductividad eléctrica, T: temperatura del agua, pH: potencial de Hidrógeno, Turb: turbidez. Se muestra la media y desviación estándar para cada variable fisicoquímica.
La estación con los niveles más altos de CE fue Delicias B (presentó 43 535 µS/cm, casi cuatro veces el valor promedio de todas las lagunas), donde se evidenció el mayor impacto antropogénico en el área estudiada, por la gran cantidad de residuos sólidos varados en la orilla y la pérdida de cobertura vegetal en sus bordes (Fig. 2b). A su vez, resaltan las estaciones de la laguna Marvilla por presentar los valores más altos, tanto para pH como de turbidez (Tabla 2).
Composición y estructura de la comunidad de coleópteros acuáticos
Se identificaron 13 especies de coleópteros acuáticos, agrupadas en tres familias, siendo Dytiscidae la de mayor riqueza con seis especies, seguida por Hydrophilidae con cuatro especies e Hydraenidae con tres especies. La curva de acumulación de especies observada se mantuvo próxima a las curvas estimadas, indicando un muestreo representativo (Chao1: 100 %; Jacknife1: 92,99 %; Fig. 3c). En abundancia, se destacó la familia Hydrophilidae, mientras que Hydraenidae presentó la menor cantidad de individuos (Tabla 3). En cuanto a las especies reportadas, se destacan Desmopachria challeti K. B. Miller, 2001 (Dytiscidae) e Hydraena quechuaPerkins, 1980 (Hydraenidae), ya que constituyen nuevos registros para el Perú. Se encontraron dos morfoespecies dentro del género Enochrus; sin embargo, estas no pudieron ser identificadas a nivel de especie ante la falta de publicaciones actualizadas para este grupo de coleópteros en el neotrópico americano.
Se observó una distribución agregada de las especies de coleópteros entre las lagunas y estaciones. Las lagunas Génesis, Marvilla y Sur no se destacaron ni en riqueza, ni en abundancia para la comunidad estudiada. La mayor riqueza y abundancia de los Dytiscidae ocurrió en las estaciones de la laguna Refugio, donde sobresalieron Liodessus sp. y D. challeti por ser las más abundantes. Con respecto a los Hydrophilidae, tanto su riqueza como su abundancia fueron mayores en Delicias B y Mayor A. De las tres especies de Hydraenidae, H. quechua y O. batesoni se encontraron principalmente en Refugio B, mientras que G. peruvianus alcanzó una mayor distribución, con presencia en nueve de las 12 estaciones.
Las pruebas estadísticas de Kruskal-Wallis evidenciaron diferencias significativas para la riqueza (rq) y la abundancia (ab) entre estaciones de muestreo (prq=0,005 y pab=0,003) y entre lagunas (prq=0,010 y pab=0,021), pero no entre campañas de muestreo (prq=0,92 y pab=0,66).
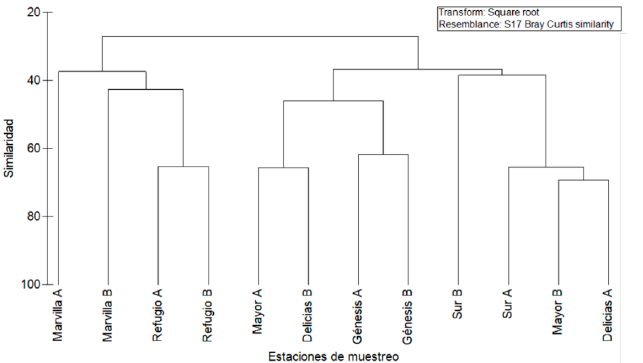
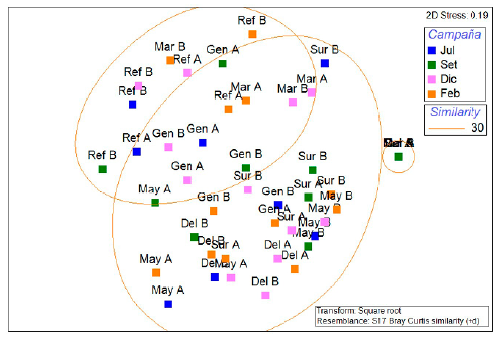
Los resultados del análisis Cluster mostraron que las lagunas evaluadas se asociaron en tres grupos (Anexo 5), de forma que el grupo de la izquierda (representado por las lagunas Marvilla y Refugio) alberga una alta riqueza de coleópteros, sobre todo ditiscidos. En el grupo de la derecha, con 40 % de similaridad, se asocian las estaciones de menor riqueza de coleópteros acuáticos (Sur A y B, Mayor B y Delicias A), con dominio de los hidrofi lidos. Por su parte, el grupo central muestra valores intermedios de riqueza y la presencia de las tres familias de coleópteros. Con respecto al nMDS, este presentó un stress de 19 %, lo que representa un ordenamiento moderadamente ajustado y muestra gráficamente que no habría diferencias significativas a nivel temporal (Anexo 6).
LA COMUNIDAD DE COLEÓPTEROS ACUÁTICOS Y LAS VARIABLES FISICOQUÍMICAS
El ACP explicó el 63,9 % de la variación de datos a través de sus dos primeros ejes. El componente principal 1 (37,6 %) presentó correlación negativa con el pH y la turbidez, mientras que la temperatura del agua y el OD tuvieron correlaciones positivas con el componente principal 2 (26,2 %). Al hacer la evaluación por lagunas, se observó que Marvilla mostró una clara correlación positiva con la turbidez y el pH; por su parte, la CE estuvo correlacionada con la laguna Delicias, mientras que, con un patrón menos claro, se observó una correlación negativa de la laguna Sur con el OD (Fig. 3a).
El análisis de correlación de Spearman no mostró resultados significativos (p<0,05) entre los factores bióticos (riqueza y abundancia) y los abióticos (variables fisicoquímicas) durante este estudio (Anexo 4), excepto al evaluar las relaciones por campaña de muestreo, en las que se encontró la única correlación significativa (p= 0,046) entre la abundancia de coleópteros y el pH (Rho= -0,585) en la campaña de diciembre del 2017.
Con respecto al ACC, los ejes 1 y 2 recogieron el 79,45 % de varianza acumulada, aportando cada uno el 61,08 % y el 18,37 %, respectivamente. En la Figura 3c, cuatro de las cinco variables medidas se relacionan con el lado izquierdo del Eje 1, de las que destaca la CE por su mayor influencia; además, asociadas a esta variable se encuentran tres especies de Hydrophilidae: Enochrus sp1, Paracymus y T. lateralis, así como las lagunas Delicias y Mayor. Por otra parte, en el lado derecho del gráfico, relacionado con valores alcalinos del pH y registros menores al promedio de temperatura, OD, CE y turbidez, se ubican las especies de Dytiscidae e Hydraenidae (excepto G. peruvianus), asociadas a la laguna Refugio (Fig. 3c).
A nivel de especies, se destaca Liodessus por su aparente tolerancia a altos nieles de pH (9,36) y turbidez (413,33 NTU), ya que fue la especie dominante en la laguna Marvilla al presentar hasta 52 individuos por estación, mientras que las demás especies alcanzaban abundancias de entre 1 y 5 individuos en esta misma laguna (Tabla 3).
DISCUSIÓN
Caracterización fisicoquímica del agua
De los factores fisicoquímicos medidos, algunos se destacaron por mostrar valores relativamente altos, comparados con otros ecosistemas dulceacuícolas. Entre estos se tiene el oxígeno disuelto. Los altos valores de OD encontrados en este estudio podrían deberse a los amplios espejos de agua de las lagunas evaluadas, tal como indica Rivera (2011); además, Metcalf and Eddy (1996) mencionan que hay una relación positiva entre el tamaño del espejo de agua y el aumento de la concentración de oxígeno ganado por procesos biológicos como la fotosíntesis y físicos como el intercambio gaseoso. Lo anterior se refuerza con lo reportado por Seki et al. (1979) al evaluar una floración algal en un lago en Japón; estos autores deducen que en lagos eutrofizados o hipereutrofizados, el oxígeno disuelto presenta variaciones importantes dependiendo de la hora, debido a la fotosíntesis y a la respiración vegetal, con la fotosíntesis como la responsable del aumento del OD por encima de los 60 cm de profundidad y con los valores más altos al mediodía. Wang et al. (2000) también registraron una fuerte correlación entre el OD y la abundancia de algas en aguas eutrofizadas, mientras que Zang et al. (2011) encontraron una correlación positiva entre el OD y la clorofila a. Así mismo, estos valores de OD concuerdan con lo reportado por Peralta (2012) en este mismo ambiente (el RVSLPV) y por Castillo y Huamantinco (2020) en el Humedal Santa Rosa.
A partir del ACP se pueden destacar dos relaciones entre las lagunas y las variables fisicoquímicas: (1) Delicias y su fuerte correlación positiva con la CE, lo que se explicaría por la permanente presión urbana a la que está sometida esta laguna al estar rodeada por viviendas en casi toda su extensión, pues estudios previos han demostrado que la CE se eleva en casos de contaminación antropogénica (Matienzo, 2014). Sin embargo, esta alta conductividad también podría relacionarse a otros factores no evaluados en este estudio. (2) Marvilla y su fuerte correlación con el pH y la turbidez, lo cual se debería a que esta es la laguna más próxima al mar y se extiende en paralelo a la orilla de playa, y esto generaría un aumento en la entrada de sales por escorrentía (Instituto Geológico, Minero y Metalúrgico [INGEMMET], 2019). Además, Contreras and Kerekes (1993) señalan que en los sistemas costeros los valores de pH están dados por el intercambio del CO2 atmosférico con los cuerpos de agua, ya que cuando este interactúa con el agua de mar, resulta en valores ligeramente alcalinos (Broecker, 1974). Otra característica importante de esta laguna es el intenso color verde del agua, lo que evidenciaría un proceso de eutrofización, probablemente relacionado con una floración o bloom de cianobacterias, ya que estas se adaptan fácilmente a ambientes de pH alcalino (Chorus et al., 2000), tal como lo registró Mendoza (2016) en la laguna Huacachina. Sería justamente esta floración de cianobacterias la que explicaría los elevados valores de turbidez, pues Vargas y Romero (2006) indican que el plancton (además de otros sólidos suspendidos y partículas coloidales) es uno de los responsables de la turbidez del agua.
Composición y distribución de la comunidad de coleópteros acuáticos
Estudios realizados por Pérez et al. (2014) y Guareschi et al. (2015) en humedales en España encontraron que las familias de coleópteros acuáticos con mayor riqueza específica en estos ambientes son Dytiscidae e Hydrophilidae. Las investigaciones de Von Ellenrieder and Fernández (2000) y Torres et al. (2008) en Argentina, así como de Peralta (2012) y Castillo y Huamantinco (2020) en Perú, obtuvieron resultados similares.
Los Dytiscidae, además de los Hydraenidae Ochthebius batesoni e Hydraena quechua, demostraron su preferencia por ambientes de poca profundidad y con vegetación que cubre gran parte del espejo de agua, como sucedió en la laguna Refugio. Estas condiciones son favorables no solo para el desarrollo de estos hidraénidos (Perkins, 1980), sino también para ditíscidos como Liodessus y Desmopachria (Larson et al., 2001).
Las pruebas estadísticas de Kruskal-Wallis para la riqueza, la abundancia y la estructura comunitaria no mostraron diferencias significativas a nivel temporal entre las estaciones ni entre las lagunas. De manera general, se esperaría que se verificara alguna variación en la comunidad de coleópteros acuáticos como consecuencia de cambios en el nivel de agua de las lagunas, pero dado que estas son extensas (excepto la laguna Refugio), las variaciones en el nivel de agua parecen no ser suficiente como para ejercer un cambio detectable en la composición y estructura de la comunidad de coleópteros acuáticos. Además, en Pantanos de Villa los niveles de agua son regulados por PROHVILLA (autoridad municipal) a través de canales y drenajes (Pulido y Bermúdez, 2018), por lo que no habría un cambio natural en la hidrología de estos cuerpos de agua. Por otro lado, recientemente se ha registrado la ausencia de diferencias significativas a nivel temporal para la comunidad de macroinvertebrados bentónicos en otros humedales costeros cercanos, como los Humedales de Ventanilla (Román, 2018 y Canales et al., 2022) y Santa Rosa (Castillo y Huamantinco, 2020).
INFLUENCIA DE LAS VARIABLES FISICOQUÍMICAS EN LA DISTRIBUCIÓN DE LOS COLEÓPTEROS ACUÁTICOS
Uno de los hallazgos de este estudio es la tolerancia de las especies de Hydrophilidae a los valores elevados de CE (43 535 µS/cm). La estación que mostró estos registros(Delicias B) fue la tercera en abundancia de coleópteros acuáticos, de los cuales el 89 % fueron hidrofílidos. Algunos estudios muestran que los valores altos de conductividad eléctrica afectan la abundancia y riqueza de insectos acuáticos (Braukmann and Böhme, 2011); sin embargo, las especies de Hydrophilidae de este estudio podrían no solo tolerar sino también prosperar en estas condiciones. Además, estudios realizados por Kefford et al. (2003) en Australia, encontraron que los Hydrophilidae presentan una gran tolerancia a los altos niveles de CE, atribuyéndole a Enochrus una tolerancia >15 000 µS/cm (LC50), lo que coincide con los resultados encontrados en este estudio.
Tabla 3 Composición, riqueza y abundancia de coleópteros acuáticos por estación de muestreo en el Refugio de Vida Silvestre Los Pantanos de Villa (Lima, Perú). Julio 2017 - febrero 2018.
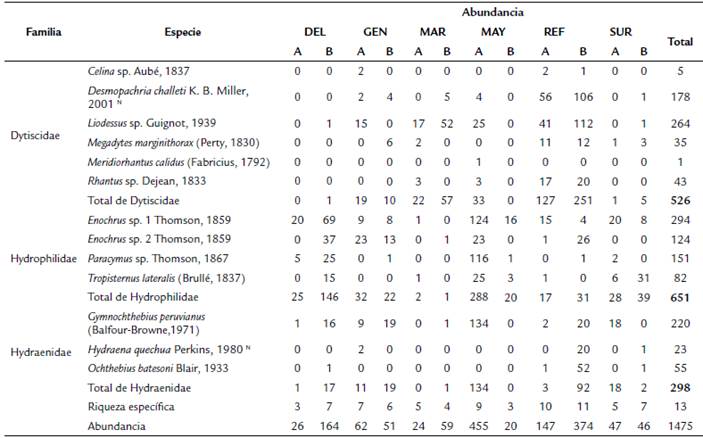
DEL: Delicias, GEN: Génesis, MAR: Marvilla, MAY: Mayor, REF: Refugio, SUR: Sur.
N Nuevo registro para el Perú.
Por su parte, autores como Juliano (1991) y Epele and Archangelsky (2012) han identificado el pH como un factor ambiental clave que afecta la distribución espacial de los coleópteros en algunos hábitats de humedales. Ya en 1986, Eyre et al. habían indicado que el pH y la conductividad eléctrica son los factores más importantes que afectan la distribución de la familia Dytiscidae, lo que coincide con los resultados aquí obtenidos; así, en el RVSLPV esta familia, junto con los Hydraenidae (excepto G. peruvianus), tendieron a prosperar en ambientes de baja CE y pH relativamente alcalino, comportándose como familias sensibles a la contaminación (Samir, 2017). No obstante, Kumar et al. (2018) señalan que los ditíscidos tienen un amplio rango de tolerancia a los valores de pH, pero este varía de acuerdo a la especie, siendo unas más sensibles que otras. Esto explicaría la correlación positiva encontrada entre el pH y la abundancia de los coleópteros en general, de los cuales la familia Dytiscidae fue la más abundante en la campaña de diciembre 2018, a pesar de los altos niveles de pH.
Es importante mencionar que las especies de Hydraenidae, a diferencia de lo que sucede en las otras familias, presentarían una respuesta diferenciada, ya que por un lado G. peruvianus parece ser capaz de colonizar más lagunas (incluso Delicias B que muestra una alta conductividad eléctrica), mientras que H. quechua y O. batesoni estarían restringidos a cuerpos de agua someros, con plantas acuáticas sumergidas y algas. Estos resultados concuerdan con las características abióticas de los ambientes reportados para algunas especies de Hydraena, como cuerpos de agua permanentes y poco profundos (Delgado et al., 1992) o aguas estancadas eutróficas y poco oxigenadas (Aguilera y Gerend, 1995).
En la presente investigación, la turbidez también fue un factor particularmente elevado en la laguna Marvilla. Al respecto, algunos estudios señalan que la floración de cianobacterias y la turbidez asociada afectan a la comunidad de macroinvertebrados, incluso algunas especies de cianobacterias producen sustancias toxicas (Robin et al., 2014). De los resultados mostrados en la Tabla 3 se podría suponer que la elevada turbidez afectaría a los coleópteros acuáticos, dado que la riqueza y abundancia en esta laguna mostraron valores comparativamente bajos en relación con los otros sitios de muestreo.
Con respecto al Cluster, se puede inferir, a partir de las observaciones en campo, que las lagunas en el agrupamiento derecho, en las que predominan los ditíscidos, se distinguen por la presencia notoria de organismos fotosintéticos, tanto en la superficie como en la columna de agua. Tal vez esta característica podría contribuir positivamente al desarrollo de esta familia de coleópteros. Por el contrario, las lagunas del sector derecho del dendrograma, que son las de menor riqueza en este estudio, no albergan ditíscidos pero sí hidrofilidos. Tanto la laguna Delicias A como Mayor B están sujetas a una fuerte presencia humana, representada por una carretera de alta circulación, así como por fábricas y viviendas. De lo anterior, se podría inferir que estas condiciones, que van en detrimento de los organismos, efectivamente afectan la riqueza, pero que algunas especies de hidrofi lidos pueden tolerarlas.
Algunos factores que no se midieron en este estudio, como las características morfológicas de las lagunas y la cobertura vegetal, se consideran en la literatura como de importancia para las comunidades de coleópteros acuáticos (Yee, 2014). Llama la atención, por los resultados obtenidos en esta investigación, que la laguna más pequeña y con mayor presencia de vegetación acuática fuera la que albergara la mayor diversidad y abundancia de ditiscidos e hidraenidos. Podríamos inferir que, en el área de estudio, las lagunas con un espejo de agua pequeño, de poca profundidad y con vegetación emergente o sumergida y matas de algas, ofrecerían un ambiente adecuado para que prosperen algunas familias de escarabajos acuáticos. Al respecto, diversos autores señalan que la vegetación acuática ofrece lugares de refugio, oviposición y alimentación; además, los hábitats poco profundos albergarían menos depredadores, como peces y larvas de odonatos (Valladares et al., 2002; Burghelea et al., 2008; Yee 2014).
Tal como indicó Batzer (2013), aún falta conocer los patrones predecibles en la relación de los invertebrados con los factores ambientales en los humedales, y agregaríamos que esta carencia de información es más patente en Sudamérica, donde no se tiene mucha información sobre los humedales costeros. Por ello, los estudios en ecología de coleópteros acuáticos y de otros invertebrados serían muy valiosos como insumo para implementar planes de manejo y conservación de estos ambientes.
CONCLUSIONES
Se identificaron 13 especies de coleópteros acuáticos, distribuidos en tres familias, siendo Dytiscidae la de mayor riqueza de especies e Hydrophilidae la más abundante. Se reportan por primera vez para el Perú las especies Desmopachria challeti K. B. Miller (Dytiscidae) e Hydraena quechua Perkins (Hydraenidae).
De las variables fisicoquímicas medidas, las que más influyeron en la distribución de los coleópteros acuáticos en el Refugio de Vida Silvestre Los Pantanos de Villa fueron la conductividad eléctrica, el potencial de hidrógeno (pH) y la turbidez.
Las especies de Hydrophilidae mostraron tolerancia a elevados valores de conductividad eléctrica, mientras que las especies de Dytiscidae (excepto Liodessus) e Hydraenidae prosperaron en condiciones de menores valores de CE y turbidez y con un pH ligeramente alcalino. Estas condiciones se verificaron en la laguna Refugio que, además, se distinguió por su pequeño tamaño y su vegetación hidrófila particular.