INTRODUCCIÓN
Los lagos andinos son ecosistemas geológicamente jóvenes que se formaron después de la última glaciación (Herrera-Martínez, 2016; Van Colen et al., 2017). En la zona tropical se ubican en un gradiente altitudinal, la mayoría de ellos entre 2000 y más de 4000 m.s.n.m. que, debido a su reciente formación, son sistemas generalmente oligotróficos y vulnerables a la intervención antrópica (Meneses-Ortegón y Herrera-Martínez, 2015; Herrera-Martínez, 2016). Sin embargo, a pesar de que los organismos bentónicos de las aguas continentales de todo el mundo han sido ampliamente estudiados, son escasos los trabajos sobre macroinvertebrados de lagos tropicales de alta montaña, como los de Tapia et al. (2018) y Alcocer et al. (2021). La mayor parte de los estudios realizados se han enfocado en grupos taxonómicos específicos, por ejemplo, ácaros acuáticos (Pešić et al., 2010; Goldschmidt et al., 2021) y planarias (Brusa et al., 2012).
Aun cuando los lagos de alta montaña han sido considerados ecosistemas con baja diversidad, es altamente probable que las variaciones en las condiciones ambientales en el gradiente horizontal y de profundidad (Herrera-Martínez, 2016) incrementen la riqueza taxonómica. La distribución de los macroinvertebrados dentro de los lagos responde a las variaciones ambientales en los diferentes hábitats, en respuesta al gradiente de profundidad (Engels et al., 2012; Chen et al., 2014; Pleskot et al., 2019). Especies que prefieren las condiciones que ofrecen las zonas someras, reducen su presencia en zonas más profundas (Eggermont et al., 2008). Los macrófitos de la zona litoral ofrecen una mayor diversidad de hábitats, tipos de alimento y refugio, lo que promueve una mayor diversidad de organismos (Thomaz y Cunha, 2010; Rico-Sánchez et al., 2014); en comparación con las zonas más profundas, dominadas por sedimentos finos con baja concentración de oxígeno (Prat y Rieradevall, 1998; Alcocer et al., 2022).
Una forma de entender los cambios en la riqueza taxonómica a lo largo de gradientes ambientales, como la profundidad en un lago, es estudiando sus diversos componentes en la escala geográfica. La riqueza de taxones en una región es la diversidad gamma (γ) que, a su vez, se puede separar en dos componentes, diversidad alfa (α) y beta (ß) (Whittaker, 1972). El cálculo de la diversidad ß, constituye un punto fundamental para entender la dinámica de los ecosistemas (Legendre et al., 2005; Calderón-Patrón et al., 2012). El concepto de diversidad beta fue introducido inicialmente por Whittaker (1960), quien lo definió como el grado de cambio o diferenciación de los ensamblajes en respuesta a gradientes o patrones ambientales. Desde aquel momento muchos autores han estudiado la diversidad beta (por ejemplo: Wilson y Shmida, 1984; Jost, 2007; Baselga, 2010) y los componentes de anidamiento (ßsin) y recambio (ßsim) (Baselga, 2010). Estos dos componentes pueden ser medidos a través de las transformaciones monótonas de la diversidad beta, los índices de disimilitud (Baselga y Leprieur, 2015). Son pocos los estudios que aportan información sobre los patrones de diversidad beta en gradientes de profundidad del agua, como el desarrollado por Wu et al. (2020). Por lo tanto, el objetivo de este estudio fue entender los factores que afectan los cambios espaciales de la diversidad de macroinvertebrados por zonas, gradiente vertical, y dentro de zonas, en lagos andinos tropicales de alta montaña, a partir del estudio de los componentes de diversidad y la partición de la diversidad ß. Nosotros hipotetizamos que la diversidad ß tiene una mayor contribución que la a a la diversidad total de un lago andino tropical, ya que los cambios en las condiciones ambientales de los lagos pueden determinar ensamblajes diferentes de macroinvertebrados, principalmente por el recambio de especies.
MATERIALES Y MÉTODOS
Área de estudio: Cristalina es un lago ubicado en la parte central de la Cordillera Oriental de Colombia (5°57' N, y 73°05' W), dentro del corredor de páramos Guantiva-La Rusia, a 27 km al norte de la Ciudad de Duitama. Las características del lago Cristalina y el clima del páramo fueron descritas por Herrera-Martínez et al. (2017). El lago se encuentra en el páramo de la Rusia a 3740 m de altitud con 10 °C de temperatura media en el agua y 9 m de profundidad máxima, con un régimen de precipitación anual de 1000 mm y dos periodos lluviosos, uno de abril a mayo y otro de octubre a noviembre. El paisaje de la zona es dominado por vegetación de bosque alto andino y páramo, con comunidades dominadas por los géneros Espeletia y Espeletiopsis, pajonales de Calamagrostis, pastizales mixtos y parches de Polylepis (Meneses-Ortegón y Herrera-Martínez, 2013; Rangel-Ch, 2018).
Variables Biológicas: La recolección de muestras fue realizada en noviembre de 2018, en la época de máxima precipitación. En el lago se ubicaron 20 sitios de muestreo, diez se seleccionaron al azar en la zona litoral y diez se situaron en la zona limnética sobre un transecto perpendicular a la orilla que atravesó el cuerpo de agua. Los sitios de muestreo se clasificaron por zonas, de acuerdo a la profundidad: Litoral (0 a 0,70 m), Sublitoral (0,71 a 5,30 m) y profunda (> 5,30 m) definidos con base en la pendiente, baja en litoral, media sublitoral y nuevamente baja en zona profunda. Las muestras de macroinvertebrados fueron recolectadas utilizando dos métodos, de acuerdo con la profundidad en cada sitio de estudio. En la zona litoral se removió el sedimento en un área aproximada de 0,16 m2 y los organismos se recolectaron con una red de inmersión de 250 (µm de malla realizando movimientos en zig-zag. En el transecto, se utilizó una draga Ekman de 0,023 m2 de área. Las muestras fueron lavadas en el sitio y preservadas con etanol al 96 %. En laboratorio, los organismos fueron separados en grupos taxonómicos utilizando un estereomicroscopio Nikon SMZ 745T y preservados en viales con alcohol al 70 %. Los macroinvertebrados se identificaron al nivel taxonómico más detallado posible utilizando las claves de Ruiz-Moreno et al. (2000), Merritt et al. (2008), Fernández y Domínguez (2009), Prat et al. (2014), Hauer y Resh (2017) y Silva y Ferrington (2018).
Variables ambientales: Se midieron in situ, en los sitios de muestreo, la profundidad, la temperatura, el pH (WTW 3210), la conductividad (YSI-30) y la concentración de oxígeno (YSI-55). Además, se realizaron perfiles de oxígeno y temperatura en profundidad en cuatro sitios del transecto.
Análisis de datos: Se analizó la normalidad de los datos utilizando dos pruebas Shapiro-Wilk y Anderson-Darling (Razali y Wah, 2011) y, para mayor solidez, se realizaron simulaciones de probabilidad múltiple por el método de Monte Carlo utilizando PAST 4.0. Los datos biológicos fueron transformados por Log10+1 para reducir el efecto de los taxones más abundantes sobre el resto de las poblaciones y tratar de ajustar los datos a normalidad. Se realizaron análisis de correlación, también en PAST, y, para reducir la probabilidad de cometer el error tipo 1, se realizó la corrección de Bonferroni. Se evaluaron los componentes de riqueza de macroinvertebrados del lago Cristalina tomando el modelo aditivo en donde la diversidad gamma (γ) resulta de la adición de las diversidades alfa (α) y beta (ß) (γ = α + ß). Este modelo permite una evaluación de la contribución relativa de cada componente a la diversidad total debido a que ambos componentes a y ß se encuentran en las mismas unidades (Lande, 1996). Se realizó un análisis de regresión para determinar si la riqueza a, variable y, está relacionada con la riqueza g, variable x. Se evaluó la contribución de dos escalas espaciales de muestreo a la diversidad total: 1- sitios de muestreo y 2- zonas del lago, a partir de las riquezas a (α 1-sitios y α 2-zonas) y ß (ß1-sitios y ß2-zonas). Las escalas espaciales se definieron en razón a diferencias en la pendiente del fondo y la profundidad. También se realizó un análisis de los patrones de disimilitud en la diversidad a partir de la partición de la diversidad ß en sus dos componentes, recambio y anidamiento (Baselga, 2010); basados en el modelo multiplicativo γ = α x ß que garantiza el supuesto de independencia entre α y ß (Wilson y Shmida, 1984; Jost, 2007). El componente de recambio de taxones de la diversidad ß se calculó a partir de la disimilaridad de Simpson (βsim) y el componente b de anidamiento (βsne) se calculó a partir de la diferencia entre el índice de Sorensen (βsor), que incorpora tanto anidamiento como diferencias de riqueza de especies, y βsim (βsne = βsor - βsim) (Baselga, 2010). Se realizaron los análisis multivariados Escalamiento Multidimensional no Métrico (nMDS) y Porcentaje de Similaridad (Simper) utilizando el programa PRIMER V7. El ordenamiento nMDS se utilizó como una medida de disimilitud promedio, diversidad b, alrededor de un grupo de unidades de observación individuales en un espacio multivariado (Anderson et al., 2006). El Simper permitió identificar los taxones típicos de cada grupo de muestras y aquellas que contribuyen a diferenciar los grupos identificados, a partir del porcentaje de similitud o disimilaridad y al análisis de las relaciones entre las similaridades o disimilaridades medias y la desviación estándar de las mismas (sim/DS; dis/DS) (Clarke y Gorley, 2015).
RESULTADOS
Variables ambientales
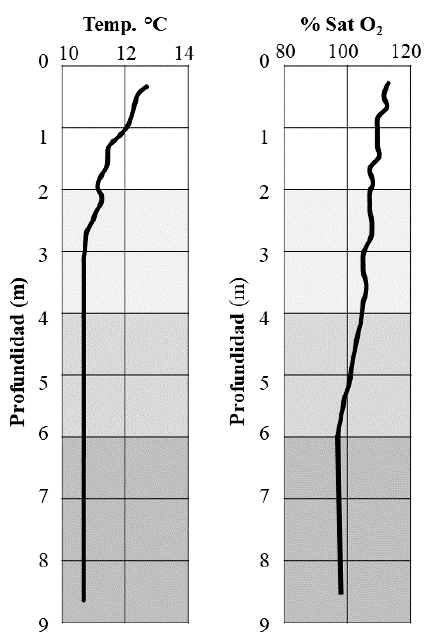
Las variables físico-químicas, en la zona litoral del lago, fueron similares en todos los sitios de muestreo, con aguas oxigenadas (8,9 mg/l-1), frías (12,28 °C), de baja conductividad eléctrica (9,8 µS-cm-1) y ácidas (5,21). La profundidad máxima del lago fue 9,0 m. Se observó una ligera estratificación térmica. La temperatura descendió progresivamente 1,0 °C hasta los 3 m de profundidad y, luego, permaneció constante hasta el fondo a 10,9 °C (Fig. 1). La saturación de oxígeno se encontró por encima del 90 % en toda la columna de agua. La profundidad estuvo correlacionada inversa y significativamente (p < 0,01), en más de 80 %, con temperatura y oxígeno. Las muestras de la zona litoral estaban integradas por vegetación macrofítica, materia orgánica y sedimentos. Las muestras de las zonas sublitoral y profundo estaban integradas por materia orgánica y sedimentos, excepto en las muestras 11 y 14 en las que también se observaron restos de vegetación.
Variables biológicas
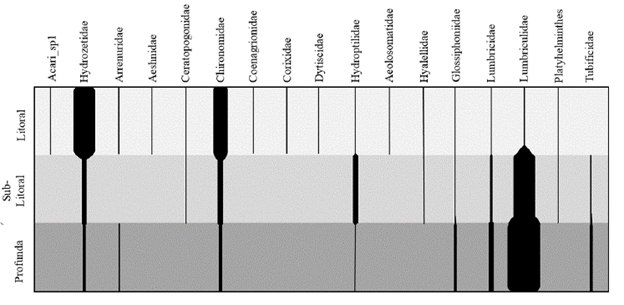
La densidad de macroinvertebrados varió entre las zonas del lago Cristalina con 2498, 1704 y 2967 ind.m-2 en litoral, sublitoral y profunda, respectivamente. Por familias, las más abundantes fueron Hydrozetidae (Hydrozetes spp), Lumbriculidae y Chironomidae con 39,6, 31,6 y 18,4 %, respectivamente, del total de organismos encontrados en el lago Cristalina. La abundancia de macroinvertebrados varió entre las tres zonas en el gradiente de profundidad (Fig. 2). Hydrozetes y Chironomidae se encuentra en proporciones diez a 15 y dos a cinco veces más abundantes en litoral que en sublitoral y profunda, respectivamente. Lumbriculidae, por el contrario, incremento su abundancia con el aumento de la profundidad. Hydrozetes1 se correlacionó inversamente (-0,775) con la profundidad y positivamente (0,838) con la abundancia de macrófitos, ambas significativamente (p < 0,01).
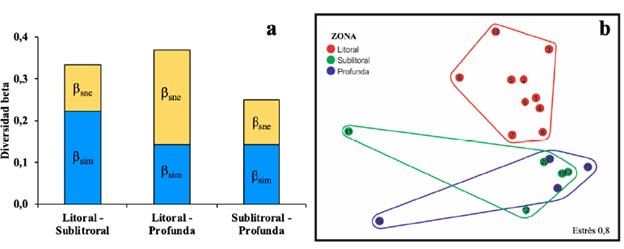
En las 20 muestras recolectadas en el lago Cristalina, se identificaron un total de 28 taxones de macroinvertebrados, riqueza γ. Taxonómicamente, los grupos con mayor riqueza fueron los quironómidos con nueve géneros, ácaros con seis taxones y oligoquetos con tres. La distribución y abundancia relativa de macroinvertebrados en cada una de las zonas del lago se muestran en la figura 2. Los macroinvertebrados con mayor amplitud de distribución en el lago son Psectrocladius, Hydrozetes1 y Oxyethira, que aparecen en más del 50 % de las muestras. La familia Lumbriculidae solo fue observada en cuatro de las 20 muestras recolectadas. Por zonas, diez morfotipos de macroinvertebrados fueron encontrados en todos los gradientes de profundidad. Por familias, seis se encuentran presentes en las tres profundidades, litoral, sublitoral y profunda. La riqueza a de macroinvertebrados de Cristalina aumentó con la riqueza g, indicando que, probablemente, este ensamblaje no se encuentra saturado (r = 0,58, p < 0,03, r 2 = 0,34). La riqueza g explica el 34 % de la variación de la riqueza α (Fig. 3a). La partición aditiva de la diversidad mostró que el aporte de la riqueza ß1 a la riqueza total de cada zona del lago es mayor que el aporte de la riqueza a1 (Fig. 3b). b1litoral aporta el 57 %, b1sublitoral 71 % y b1profunda 70 %. El componente de riqueza β2 lago fue 72 %.
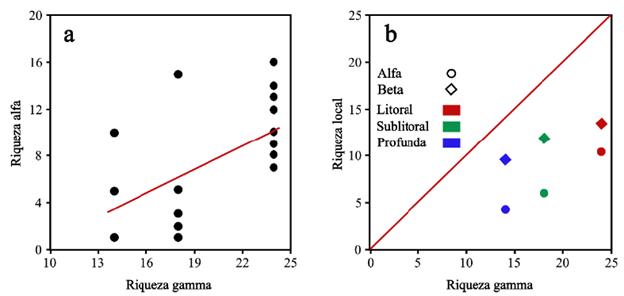
Figura 3 a- Relación entre la riqueza gamma y la riqueza alfa de los macroinvertebrados en el lago Cristalina. b- Contribución de los componentes alfa y beta a la riqueza gamma de los macroinvertebrados en las tres zonas del lago.
La disimilaridad total por pares (βsor) de la zona litoral del lago fue más alta con la zona profunda que con la zona sublitoral (Fig. 4a). La disimilaridad βsor más baja fue 0,25 para sublitoral-profunda. La partición de βsor mostró que el componente de recambio (ßsim) fue alto entre las zonas litoral-sublitoral y entre sublitoral-profunda, ßsim = 66,67 % y 57,14 %, respectivamente. En tanto que, entre litoral-profunda, el mayor aporte a la disimilaridad ßsor se debió al anidamiento, ßsne = 61,22 %.
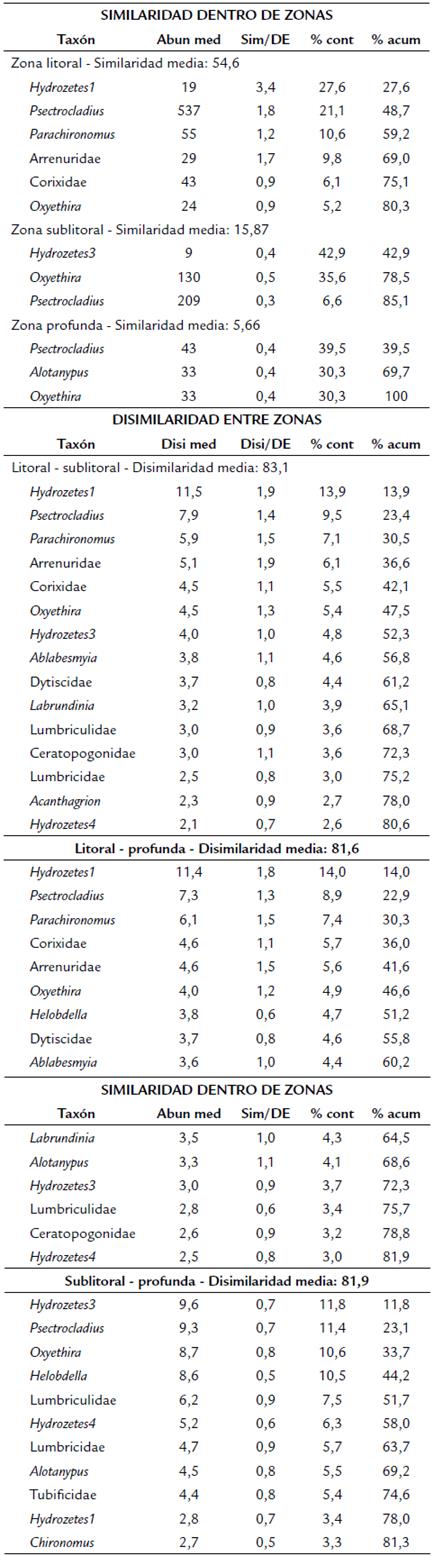
El análisis nMDS mostró diferencias en la composición de macroinvertebrados con relación a las zonas porprofundidad (Fig. 4b). La estructura de los ensamblajes de la zona litoral es diferente de las zonas sublitoral y profunda y, entre estas dos últimas, es relativamente similar. Dos sitios (11 y 14), uno de la zona sublitoral y otro de la zona profunda, se separaron espacialmente de sus agrupaciones debido a que fueron los de mayor riqueza dentro de cada zona, 15 y diez taxones, respectivamente. En estos sitios se observaron macrófitas y mayores abundancias de Lumbriculidae (> 60 %). El análisis Simper mostró los taxones característicos dentro de cada zona (Tabla 1) e identificó las especies que más contribuyen a diferenciar los ensamblajes de macroinvertebrados entre zonas. La similitud entre las muestras dentro de litoral es cercana al 55 %. La similaridad entre muestras dentro de las zonas sublitoral y profunda es < 20 %. Las especies típicas de la zona litoral, con relaciones Disi/DE > 1,20, fueron Hydrozetes1, Psectrocladius, Parachironomus y Arrenuridae. Tanto en sublitoral como en profunda se encontraron tres taxones que acumulan más del 80 % de la contribución al ensamblaje de cada zona; sin embargo, presentaron relaciones Sim/DE > 0,5. Las disimilaridad entre zonas fue > 80 %. Los morfotipos con relaciones Disi/DE > 1,10: Hydrozetes1, Psectrocladius, Parachironomus, Corixidae, Arrenuridae, Oxyethira y Ablabesmyia, contribuyeron en más del 45 % a la disimilaridad entre las zonas litoral-sublitoral y litoral-profunda. Las relaciones Disi/DE para la disimilaridad entre sublitoral y profunda fueron < 1,0.
DISCUSIÓN
La riqueza taxonómica de macroinvertebrados acuáticos del lago Cristalina (28 morfotipos) es mayor que la reportada para otros lagos tropicales de alta montaña, tanto de la zona andina (7 a 20 taxones por lago) (Posada-García et al., 2008; Alba-Hincapié et al., 2016; Gómez et al., 2016; Tapia et al., 2018) como de América Central (cuatro a ocho taxones por lago) (Alcocer et al., 2021). La riqueza de Cristalina también es mayor a la encontrada en lagos de alta montaña de algunas regiones de la zona templada europea (14 a 23 taxones por lago) (Hamerlík et al., 2014; Ungermanová et al., 2014). Parte de estas diferencias se pueden atribuir a que algunos taxones, como los quironómidos, no se identifican a nivel genérico y lo hacen solo a familia o subfamilia. Aun cuando Cristalina es un lago tropical andino pequeño (< 2 ha) (Herrera-Martínez et al., 2017), mostró variaciones de diversidad dentro de cada zona y entre ellas. La correlación entre las riquezas g y a indica un patrón no saturado de taxones, entre más especies hay en cada zona del lago, más especies se encontrarán en cada sitio. Patrones insaturados de especies indican baja interacción entre las especies de una comunidad local y la diversidad se atribuye más a procesos no interactivos regionales, a la reserva regional de especies, que a patrones interactivos como competencia (Cornell y Lawton, 1992). Si la comunidad local estuviera saturada la diversidad ß no se incrementaría con la riqueza regional (Srivastava, 1999) y la riqueza a sería relativamente más alta. Sin embargo, Loreau (2000) establece que la interpretación de una comunidad saturado o no saturada, a partir correlaciones entre diversidades local y regional, son dependientes de la escala geográfica que, a su vez, tiene efecto sobre el equilibrio entre las diversidades α y ß. En nuestro caso el tamaño muestreal de sitio es considerado pequeño y, por lo tanto, sugiere que es adecuado para nuestras conclusiones. A pesar de esto creemos que es necesario seguir trabajando para entender las relaciones entre las diversidades α y ß de los macroinvertebrados a diferentes escalas geográficas. La riqueza por sitio a es baja con relación a la riqueza regional γ; es la riqueza ß la responsable de la mayor parte de la riqueza regional, tanto a escala de zonas como total del lago. Esto demuestra la disimilitud entre sitios y entre zonas del lago Cristalina, a pesar de su pequeño tamaño.
La partición de la diversidad beta muestra que el mayor aporte a la disimilitud se debe al recambio de especies que al anidamiento. Sin embargo, este no es así entre todas las zonas, entre litoral y profunda la mayor parte de la disimilaridad se debe al anidamiento ßsne; lo que demuestra el efecto de gradiente ambiental sobre la estructura de la diversidad de macroinvertebrados en lagos andinos. La alta disimilaridad por anidamiento entre la zona litoral más somera y la profunda indica diferencias fisiológicas de los organismos para tolerar los cambios en el gradiente ambiental. Nuestro trabajo permitió establecer la importancia de los microhábitats en la diversidad biológica de los macroinvertebrados en lagos andinos. La riqueza por zonas disminuye en el gradiente de profundidad. La zona litoral presenta un ensamblaje característico dominado, principalmente, por Hydrozetes, Psectrocladius, Parachironomus y Arrenuridae con similaridades entre muestras > 50 %. Las zonas sublitoral y profunda presentaron una amplia variación en la diversidad entre muestras, similaridad baja, lo que no permite identificar un ensamblaje característico de cada una de ellas. Sin embargo, Psectrocladius y Oxyethira fueron frecuentes en estas dos zonas, acompañados de Hydrozetes3 en sublitoral y de Alotanypus en profunda.
La presencia de los taxones más representativos en la zona litoral del lago Cristalina es concordante con su biología y ecología. La dieta de Hydrozetes incluye bacterias, microalgas y detritos de plantas, entre otros (Weigmann y Deichsel, 2006), y su hábitat son las plantas acuáticas, o entre musgos en suelos inundados (Bayartogtokh y Ermilov, 2019). Psectrocladius, es un género que, al igual que sucede en Cristalina, puede habitar lagos de aguas frías, por encima de 2000 m.s.n.m. en Centro América (Wu et al., 2015) y se asocia a musgos de la zona litoral como Sphagnum (Tarkowska-Kukuryk y Mieczan, 2014). Contrario a lo reportado para la literatura, en donde Parachironomus, al parecer, tiende a habitar zonas con bajas contracciones de oxígeno (Cortelezzi et al., 2020); en Cristalina solo se encontró en la zona litoral más oxigenada. Se ha reportado que Parachironomus prefiere habitar macrófitas como Myriophyllum (Williams et al., 2020); macrófita que ha sido reportada en lagos cercanos a Cristalina en la parte somera (Ramos et al., 2013). Arrenuridae es el único taxón colectado en la zona litoral y profunda, aunque en bajas densidades; la mayoría de las especies de la familia Arrenuridae pertenece al género Arrenurus. En América del sur se han descrito 153 especies (Rosso de Ferradás y Fernández, 2005; Smit, 2020), buena parte de ellos son parásitos de otros organismos (Gerson et al., 2003). Muchas de la especies de esta familia pueden soportar largos periodos en condiciones difíciles, por ejemplo, con un mínimo de humedad en la zona litoral (Davids et al., 2006).
El oxígeno es un factor que determina la distribución de los organismos en el gradiente de profundidad. En el lago Cristalina la zona limnética presenta una saturación de oxígeno mayor al 70 %. Sin embargo, en algunos periodos del año, y particularmente en la noche, se pueden presentar periodos de disminución de oxígeno en estos lagos andinos de alta montaña tropical (Herrera-Martínez, 2016). Además, a pesar de que la columna de agua está oxigenada, no necesariamente los sedimentos también lo están; esto debido a que la zona más profunda suele estar integrada por sedimentos finos en donde se reduce el intercambio gaseoso y se acumula materia orgánica (Herrera-Martínez, 2016). En lagos de alta montaña se ha observado que, en períodos de estratificación, cuando se reduce la concentración de oxígeno en el fondo, se reduce la abundancia de macroinvertebrados; en tanto que, en períodos de mezcla vertical, el aporte de oxígeno al fondo permite el desarrollo de un ensamblaje más complejo y abundante, particularmente de quironómidos (Alcocer et al., 2022). Podemos suponer que, a futuro, cambios pequeños en condiciones como la temperatura pueden tener efecto sobre otras características ambientales como la concentración de oxígeno, con efectos sobre la estructura biótica. La zona litoral ofrece una mayor diversidad de hábitats para el establecimiento de macroinvertebrados de diferentes grupos taxonómicos lo que determinó la presencia de diez taxones exclusivos y mayor riqueza, con alta disimilaridad por recambio. Organismos como los coríxidos y anfípodos prosperan en esta zona, y en el caso de estos últimos (familia Hyalellidae) se encuentran asociados a la vegetación acuática y se alimentan de materia orgánica en descomposición (Liévano y Ospina 2007). En Cristalina las densidades de organismos en la zona profunda son muy bajas, excepto en Lumbriculidae, los cuales presentan la mayor densidad de organismos en la zona profunda, aunque limitada a unas pocas muestras. Esta abundancia se atribuye a mayores concentraciones de materia orgánica y a la tolerancia de estos organismos a bajas concentraciones de oxígeno en los sedimentos finos (Prat y Rieradevall, 1998). En lagos oligotróficos de alta montaña, la descomposición de material autóctono como las macrófitas, generan un gran aporte de materia orgánica, propiciando un hábitat idóneo para el establecimiento de algunos oligoquetos.
CONCLUSIONES
Nuestros resultados indican que la diversidad en los sitios y zonas del lago es baja con relación a la diversidad total g, y varía entre ellos, con altos valores de diversidad ß. Esto conduce a pensar que las diferencias de hábitat dentro de un lago tropical andino de alta montaña, a pesar de su pequeño tamaño, son necesarias para mantener una mayor diversidad de macroinvertebrados.
Los ensamblajes de macroinvertebrados de lagos andinos tropicales cambian espacialmente, vertical y horizontalmente, principalmente por el recambio de especies; aun cuando entre la zona litoral más somera y la más profunda, la disimilaridad por anidamiento es mucho mayor.
Las diferencias en las condiciones ambientales entre zonas del lago no son muy amplias, pero son suficientes para incrementar la diversidad ß; indicando que estos ecosistemas de lago son vulnerables a tensores naturales y antrópicos como el calentamiento global.