INTRODUCCIÓN
Los pacientes con diabetes mellitus (DM) sufren una alta tasa de complicaciones, entre ellas la aparición de lesiones en tejidos blandos (principalmente en miembros inferiores), lo cual ocasiona pobre control metabólico de la enfermedad, aumenta las tasas de hospitalizaciones recurrentes e incrementa el riesgo de aparición de desenlaces desfavorables 1-5. El pie diabético (PD) es una complicación frecuente que disminuye considerablemente la calidad de vida y capacidad funcional del individuo, así como su supervivencia; la incidencia registrada varía entre el 19 y el 34 % en diabéticos 6-9. Anualmente, entre 9.1 a 26.1 millones de personas con DM alrededor del mundo desarrollan PD, con un riesgo de muerte a 5 y 10 años, el doble que el de un paciente diabético sin lesiones dérmicas en sus pies 2,3. Así, el PD representa el 83 % de las amputaciones mayores y el 96 % de las amputaciones menores, lo cual resulta en un aumento de los costos asociados a una enfermedad considerada prevenible y de la cual se conoce hace muchas décadas 4.
Los agentes etiológicos de esta afección varían de acuerdo con las características de la lesión, tiempo de evolución, lugar de residencia del paciente, uso previo de antibióticos, entre otros factores 10-12. La mayoría de las infecciones del PD son polimicrobianas, involucrando bacterias grampositivas, tales como Enterococcus, Staphylococcus aureus y Streptococcus pyogenes, así como gramnegativas de tipo Pseudomonas aeruginosa, especies de Klebsiella y E. coli13,14. Muchos patógenos bacterianos tienen la capacidad de adaptarse a los antibióticos, por lo que la resistencia antimicrobiana se ha convertido en un problema creciente en el PD en países en desarrollo 13. Esta resistencia representa una carga significativa para los sistemas de salud, puesto que aumenta la morbilidad, mortalidad y costos del tratamiento 13-16.
En el PD infectado se recomienda la toma de muestra para cultivo y el inicio de tratamiento antibiótico empírico con el fin de evitar la progresión del daño de los tejidos, mientras se espera la identificación del agente causal 10,14. El cultivo con antibiograma permite conocer el microbiota del PD, subsidiando el desarrollo de guías locales para la antibioticoterapia empírica inicial, promoviendo el impacto directo en el éxito del tratamiento y reduciendo costos, con un uso escalonado y más lógico de antimicrobianos. El uso inadecuado de antibióticos durante el tratamiento del PD puede agravar la infección y conducir al desarrollo de resistencia inicial o adicional bacteriana 17-19.
Dada la importancia de esta enfermedad y sus consecuencias, tales como amputación, resistencia antibiótica y mortalidad 20-22, es necesario que, en países en vía de desarrollo con un perfil epidemiológico diferente, se realicen estudios que permitan conocer la situación clínica y microbiológica actual de los pacientes con PD, a fin de tomar conciencia y realizar actividades preventivas y manejos oportunos. Además, la vigilancia activa de los microorganismos etiológicos del PD y sus patrones de resistencia bacteriana son relevantes para establecer un adecuado manejo empírico inicial que esté de acuerdo con la epidemiología local y regional. En la región del Caribe colombiano es escasa la evidencia que apoye la toma de decisiones basada en datos propios y se desconoce el comportamiento microbiológico actual de este tipo de infección. En función de lo anterior, el objetivo de este estudio fue describir el perfil clínico y microbiológico, además de factores asociados con desenlaces desfavorables en infecciones de PD en una población del Caribe colombiano.
MATERIALES Y MÉTODOS
Diseño de estudio
Estudio de corte transversal, que incluyó pacientes con infección de pie diabético atendidos en un hospital de referencia de tercer nivel de la región del Caribe colombiano, entre septiembre de 2021 y mayo de 2022.
Participantes
Se incluyeron pacientes que cumplieran con los siguientes criterios: 1 edad igual o mayor a 18 años; 2 mínimo un día de estancia hospitalaria; 3 firma de consentimiento informado para participar en el estudio; 4 Historia clínica con datos sociodemográficos y clínicos completos; 5 diagnóstico de DM y PD; y 6 que se les hubiera realizado cultivo profundo de la lesión de PD (de acuerdo con los protocolos estandarizados del hospital). Se excluyeron mujeres gestantes.
Para la selección de los individuos, se utilizó muestreo por conveniencia de casos consecutivos hospitalizados que cumplieron con los criterios de selección. Según los registros estadísticos del hospital, en 2020 estuvieron hospitalizados 899 pacientes con diagnóstico de DM, con incidencia promedio de PD del 25 % (con base en literatura mundial), para un universo del estudio de 224 pacientes. Con base en esta cifra se estimó el tamaño de la muestra mediante OpenEpi Versión 3 Online 23, calculado con una frecuencia hipotética del 50%, límite de confianza del 5 % e intervalo de confianza del 95 %, obteniendo así un tamaño de muestra no probabilístico de 142 pacientes.
Extracción de datos y variables estudiadas
Se recolectó información de datos demográficos y características clínicas basales como sexo, edad, procedencia, seguridad social, estado civil, nivel educativo, ocupación, talla, peso, índice de masa corporal (IMC), estado nutricional, estancia hospitalaria, antecedentes de tabaquismo, hipertensión arterial, infarto de miocardio, enfermedad vascular cerebral o periférica, tipo de DM (1 o 2), tiempo de diagnóstico de la DM, tratamiento farmacológico y adherencia, diagnóstico de nefropatía al momento del ingreso y necesidad de terapia de reemplazo renal al ingreso. Así mismo, laboratorios al ingreso, como hemoglobina glicosilada, glucosa y creatinina. También información relacionada con la úlcera como el número de úlceras, localización, características de la ulcera, y tiempo de evolución, antecedente de amputación, claudicación por escala Fontaine 24, gravedad de acuerdo con la clasificación de Wagner (25) y presencia de infección según criterios Infectious Diseases Society of America (IDSA) / International Working Group on the Diabetic Foot (IWGDF) 26.
Otros datos relacionados con los cuidados intrahospitalarios (uso de ayudas diagnósticas de tipo radiografías simples, arteriografía, Doppler, resonancia magnética; el índice tobillo brazo con sonda de Doppler continuo vascular y monofilamento de 10 gr para neuropatías), con el tratamiento quirúrgico (necesidad de amputación, como cirugía primaria y secundaria, nivel de amputación inicial) y con la infección (perfil microbiológico de los cultivos iniciales y de la infección del muñón, uso de antibióticos antes y después de los cultivos, duración de antibioticoterapia, cultivos negativos y presencia de osteomielitis) fueron indagados. De forma similar, se recolectó información acerca de ingreso a Unidad de Cuidados Intensivos (UCI) y muerte intrahospitalaria.
Se tuvieron en cuenta las siguientes consideraciones en cuanto a definiciones: Disfunción renal: se definió si el filtrado glomerular (FG), estimado mediante MDRD-4 27, era <60mL/min; neuropatía sensitiv: si había ausencia de sensibilidad con el monofilamento (10 gr) o diapasón (64 - 128Hz); lesión isquémica a resultado con unas pruebas diagnósticas confirmatorias: índice tobillo-brazo <0,9. La severidad de la ulceración se consideró según el estadio de Wagner (1 - 5), y la graduación de infección según criterios IWGDF/IDSA (0 - 3). Además, para la descripción de la lesión, en caso de ser múltiples, se describió solo la más severa, y los principales desenlaces adversos tenidos en cuenta fueron la amputación no traumática, ingreso a UCI y mortalidad hospitalaria.
La obtención de datos se realizó mediante fuentes secundarias obtenidas a través de un formulario, que se aplicó a las historias clínicas de los pacientes que cumplían con los criterios de inclusión. Adicionalmente se utilizó como otra fuente secundaria los reportes de los cultivos que fueron previamente tomados en el hospital a los pacientes incluidos en el estudio.
Análisis estadístico
Toda la información se registró en una matriz de Excel. La normalidad de las variables cuantitativas fue evaluada usando el test de Kolmogorov-Smirnov. Las variables cuantitativas se expresaron en media y desviación estándar (DE) o mediana y rango intercuartílico (RIQ), según su distribución. Las variables cualitativas se expresaron en frecuencias absolutas y porcentajes. Para la comparación entre variables cuantitativas/continuas de distribución paramétrica, se utilizó test de ANOVA, y test de Mann Whitney para las no paramétricas. Las variables cualitativas se compararon con el test de Chi cuadrado. Se realizó una regresión logística no ajustada para identificar las variables sociodemográficas, clínicas y de laboratorio asociadas a desenlaces desfavorables (mortalidad, amputación, resistencia bacteriana y diagnóstico de osteomielitis por imagenología). Se hizo el cálculo de razón de prevalencia (RP) con su respectivo intervalo de confianza del 95 % (IC 95 %). Se determinó un valor de p <0,05 como estadísticamente significativo. Todo el análisis estadístico se realizó por medio del software SPSS v.29.
Consideraciones éticas
Este estudio fue aprobado por el Comité de Ética de la E.S.E. Hospital Universitario del Caribe, cumplió con la Declaración de Helsinki 28 y fue clasificado en la categoría de investigación sin riesgo, según el artículo 11 de la Resolución 8430 de 1993 del Ministerio de Salud de Colombia 29. Todos los pacientes o sus familiares firmaron el consentimiento informado. El manejo de los datos obtenidos de las historias clínicas se realizó de acuerdo con lo establecido en la Ley 23 de 1981 del Congreso de Colombia 30 y la Resolución 1995 de 1999 del Ministerio de Salud de Colombia 31.
RESULTADOS
Un total de 149 pacientes fueron incluidos en el estudio. El 61,8 % de la muestra era de sexo masculino, con una mediana de edad de 61 (55 - 67) años, proveniente en un 73,8 % de la zona urbana y pertenecían al régimen de salud subsidiado (84,6 %). El 35,6 % vivía en unión libre, seguido de los casados (30,2 %), y el 73,1 % (n=109) eran cartageneros. Los niveles educativos más comunes entre la población fueron básica primaria y secundaria, respectivamente (37,6 % y 23,5 %).
Al indagar acerca de los antecedentes médicos y las características clínicas, se identificó tabaquismo en el 41,6 % de los pacientes, hipertensión arterial en el 59,7 %, neuropatía en 77,2 % y enfermedad renal crónica con filtrado glomerular <60mL/min en el 45.6 % de los casos (figura 1). Sin embargo, solo el 10,8 % recibía sesiones de diálisis. La mediana de IMC fue de 25,7 (24,2 - 27,3) kg/m2 y la mediana de hemoglobina glicada 10,1 % (8,1 - 12; siendo más frecuente los valores > 10, 53,7 %). Un 94,6 % de los participantes tenía diabetes tipo II, con mayor frecuencia de uso de insulinas (29,6 %), seguido de metformina (22,1 %), insulina + orales (20,8 %); en quienes solo 39,6% reportó adherencia farmacológica.
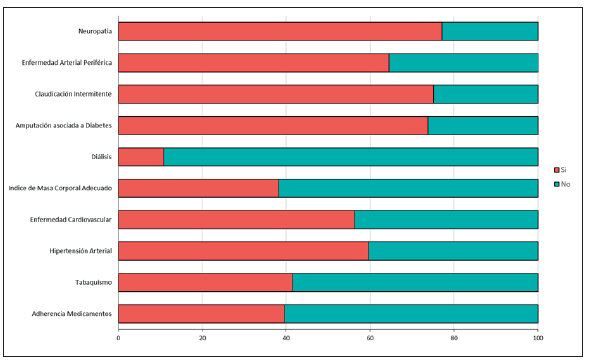
Fuente: autores.
Figura 1 Distribución del porcentaje de factores de riesgo cardiometabólicos y para pie diabético.
Así mismo, predominó infección moderada a severa (67,8 %), de evolución crónica (50,3 %), tener clasificación Fontaine IV (36,2 %), test de monofilamento positivo (72,5 %), tener enfermedad arterial periférica (64,4 %), clasificación de Wagner IV (30,2 %) y clasificación IDSA/IWGDF III (45,7 %). Un tercio de los pacientes fue amputado (32,2 %), se realizó diagnóstico imagenológico de osteomielitis en el 44,9 %, el 28,2 % ingresó a UCI y se registró mortalidad en el 12,8 % (tablas 1-2).
Tabla 1 Características clínicas generales de la población estudiada
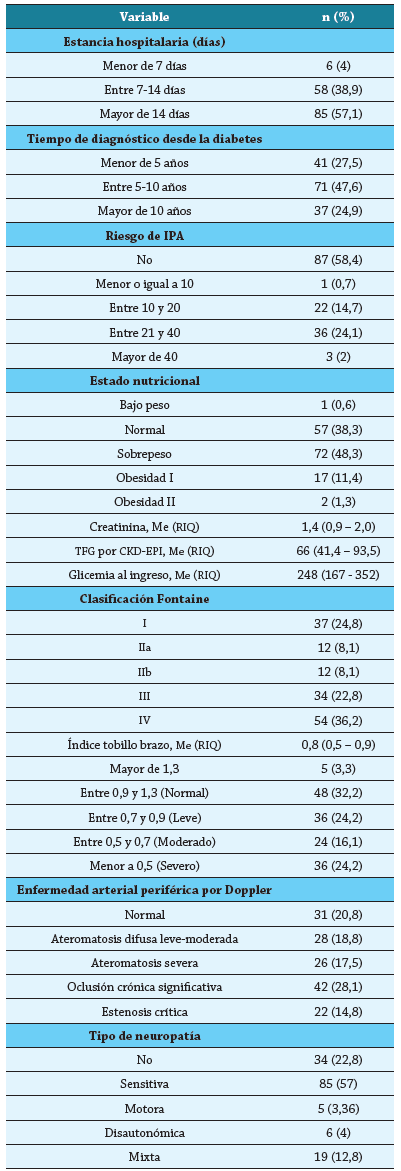
Fuente: autores.
CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; IPA: Índice de Paquete por Año; TFG: Tasa de Filtrado Glomerular
Tabla 2 Características clínicas de las infecciones de pie diabético

Fuente: autores.
IDSA/IWGDF: Infectious Diseases Society of America / International Working Group on the Diabetic Foot; RMN: Resonancia Magnética Nuclear; TAC: Tomografia Axial Computarizada
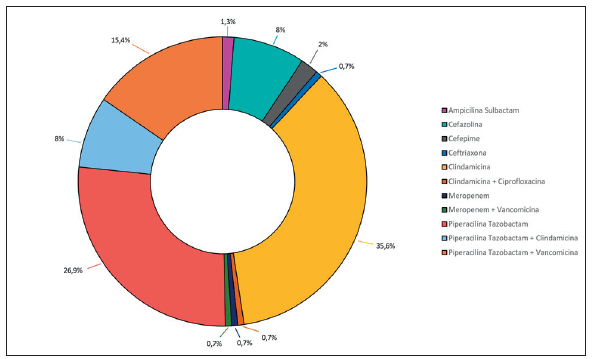
La tabla 3 registra las características de los microorganismos aislados y los tratamientos utilizados, y se encontró de mayor a menor frecuencia la presencia de Pseudomona aeruginosa (18,1%), Escherichia coli (13,5 %), Staphylococcus aureus (12,8%) y Klebsiella pneumoniae (11,4 %) (figura 2). El 75,2 % de los pacientes recibió terapia antimicrobiana dirigida, con mediana de días de antibiótico de 12 (9 - 21) días. Los tratamientos antibióticos de ingreso más utilizados fueron Clindamicina (35,6%), Piperacilina-Tazobactam (26,9 %) y Piperacilina-Tazobactam + Vancomicina (15,4 %) (figura 3); variando en frecuencia al final del tratamiento, con alto uso de Piperacilina-Tazobactam (20,8 %), seguido de Meropenem + Ciprofloxacino (12,7 %), Cefepime (9,4 %) y Clindamicina (8,7 %).
Tabla 3 Características de los microorganismos aislados en los cultivos de infección de pie diabético en la población estudiada.
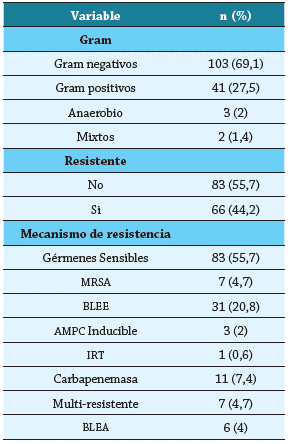
Fuente: autores.
AMPC: Cefalosporinasa; BLEA: Betalactamasa de espectro ampliado; BLEE: Betalactamasa de espectro extendido; MRSA: Staphylococcus aureus resistente a la meticilina; Inhibitor-resistant TEM.
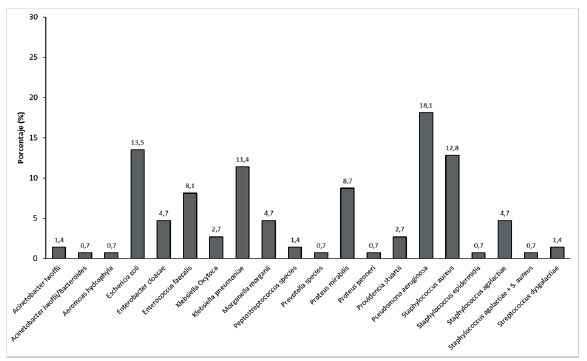
Fuente: autores.
Figura 2 Distribución de la frecuencia de agentes microbianos identificados en cultivo de infección de pie diabético, expresado en porcentajes.
Fuente: autores.
Figura 3 Distribución de antibioticoterapia utilizada al ingreso del manejo de la infección por pie diabético.
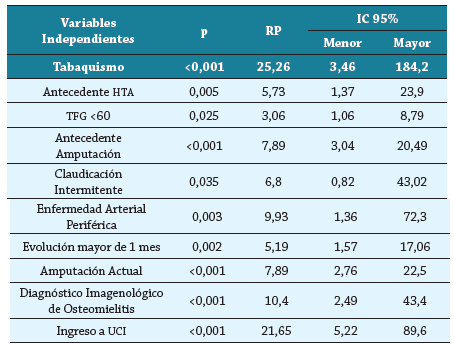
Al evaluar factores relacionados con mortalidad se identificó que el tabaquismo (RP 25,26; IC 95 % 3,46 - 184,2, p <0,001), sufrir de hipertensión arterial (RP 5,73; IC 95 % 1,37 - 23,9, p=0,005) y enfermedad renal crónica (RP 3,06; IC 95 % 1,06 - 8,79, p=0,025), haber sido amputado por diabetes (RP 7,89; IC 95 % 3,04 - 20,49, p <0,001), tener enfermedad arterial periférica (RP 9,93; IC 95 % 1,36 - 72,3, p=0,003), diagnóstico imagenológico de osteomielitis (RP 10,40; IC 95 % 2,49 - 43,4, p <0,001) e ingreso a UCI (RP 21,65; IC 95 % 5,22 - 89,6, p <0,001) se identificaron como factores asociados con mortalidad de manera significativa (tabla 4).
Tabla 4 Factores asociados a mortalidad en infección de pie diabético.
Fuente: autores..
HTA: Hipertensión Arterial; TFG: Tasa de Filtrado Glomerular; UCI: Unidad de Cuidados Intensivos.
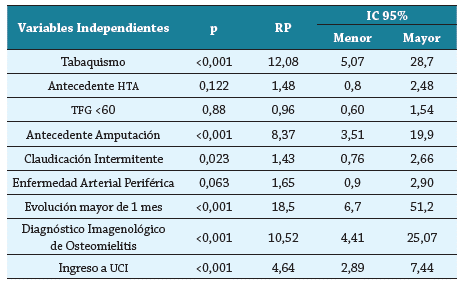
En la tabla 5 se puede observar que el tabaquismo (RP 12,08; IC 95 % 5,07 - 28,7, p <0,001), el antecedente de amputación asociado a diabetes (RP 5,14; IC 95 % 3,23 - 8,19, p <0,001), tener un tiempo de evolución de la ulcera mayor de 1 mes (RP 8,37; IC 95 % 3,51 - 19,94, p <0,001), tener diagnóstico imagenológico de osteomielitis (RP 10,52; IC 95 % 4,41 -25,07, p <0,001) e ingresar a UCI (RP 4,64; IC 95% 2,89 - 7,44, p <0,001) fueron factores asociados de manera significativa para amputación.
Tabla 5 Factores asociados a amputación en infección de pie diabético.
Fuente: autores.
HTA: Hipertensión Arterial; TFG: Tasa de Filtrado Glomerular; UCI: Unidad de Cuidados Intensivos.
Finalmente, al valorar los factores más importantes asociados con resistencia antibiótica, se encontró de manera significativa al hábito de tabaquismo (RP 2,49; IC 95 % 1,96 - 4,40, p <0,001), antecedente de amputación asociado a diabetes (RP 2,57; IC 95 % 1,86 - 3,54, p <0,001), tener úlcera crónica (RP 2,98; IC 95 % 1,87 - 4,73, p <0,001) y diagnóstico imagenológico de osteomielitis (RP 4,45; IC 95 % 2,71 - 7,31, p <0,001). Igualmente, se mantuvo el tabaquismo (RP 3,07; IC 95 % 2,06 - 4,58, p <0,001), la cronicidad de la ulcera (RP 4,46; IC 95 % 2,61 - 7,61, p <0,001), el antecedente de amputación (RP 2,57; IC 95 % 1,89 - 3,51, p <0,001) y el ingreso a UCI (RP 3,54; IC 9 5% 2,55 - 4,93, p <0,001) como factores asociados de manera significativa al diagnóstico de osteomielitis por imagenología.
DISCUSIÓN
El PD es una complicación derivada de un mal control metabólico de la DM a lo largo del tiempo, la cual evoluciona frente a la omisión en la búsqueda de atención oportuna de signos clínicos, tanto por parte del paciente como por los equipos de salud encargados de tamizaje y seguimiento 1. Esto es congruente con la mediana de edad evidenciada en este estudio (61 años), dado que en esta población el proceso de envejecimiento y aparición de múltiples factores de riesgo cardiometabólicos inciden negativamente sobre la capacidad de controlar la salud metabólica del individuo, siendo una población de riesgo para aparición de complicaciones de tipo vascular, como el PD, por la progresión en los cambios ateroscleróticos y alteraciones fisiopatológicas propias de la DM 2,4. Relacionado con la distribución del sexo, procedencia, régimen de salud y nivel educación, en la región del Caribe colombiano aún persiste el patrón sociolaboral de predominancia masculina, siendo el hombre el responsable de la esfera económica de la familia 32,33, y si además este pertenece a niveles socioeconómicos muy bajos sin educación superior, tendrá dificultad en acceder a trabajo formal en la zona urbana, pudiendo encontrarse entonces expuesto a trabajos de alto riesgo, malas condiciones higiénicas y ambientales, de estrés físico, extensas jornadas laborales, estilo de vida inadecuado, entre otros 32-34; que entorpecen el alcance de metas de salud cardiometabólica y que además facilitan la progresión de una lesión menor en pie por colonización microbiana e incapacidad de respuesta inmune oportuna. Esto es congruente con el perfil sociodemográfica de la población de estudio. Calles et al. 35, Orduz et al. 36 y Rodríguez et al. 37 ejecutaron estudios con objetivo similar al presente en Venezuela 35, República Dominicana y Colombia 36 y Cuba 37, y encontraron un patrón sociodemográfico semejante, a excepción del último, donde fue predominante el sexo femenino. Sin embargo, es notable que la distribución en Latinoamérica de estas características es compartida, pudiendo explicarse por costumbres socioculturales tradicionales y el modelo laboral de los países en vía de desarrollo 34.
La prevalencia de factores de riesgo cardiometabólicos son determinantes en el control metabólico basal de la DM y la evolución y desenlaces de las complicaciones de esta entidad, como lo es el PD 4,6,8. Se evidenció que el tabaquismo, la hipertensión arterial, la enfermedad renal crónica, neuropatía periférica y enfermedad cardiovascular fueron factores prevalentes en la población estudiada. Además, la mediana de la hemoglobina glicada fue de 10.1 %, con un rango superior hasta de 12 %, doblando entonces aproximadamente el valor estipulado de meta 3. Se ha descrito previamente que la región del Caribe colombiano se encuentra mezclada con distintas razas, predominando la afrodescendiente, seguido de la indígena y mulata 38. Aunque es bien conocido que la carga genética que posee la raza afro respecto a las enfermedades cardiovasculares es mayor en comparación con otras razas 39, es necesario recordar que los estilos de vida insaludables (entendiéndose principalmente como poca actividad física) y tendencia al consumo frecuente de alimentos hipercalóricos y procesados precipitan la aparición de sobrepeso y obesidad, que se asocian fuertemente con la presentación de disfunción metabólica y vascular, lo cual desencadena la aparición de hipertensión arterial y DM 3. Otros factores pueden ser los socioculturales, los cuales incluyen el tabaquismo y elevado consumo de alcohol (propio de culturas ancestrales) 34,38, que aportan de manera negativa a la ecología epigenética de la población y explican la prevalencia observada. Rodríguez et al. 37 y Calles et al. 35 reportaron un comportamiento similar en cuanto al hábito de fumar, prevalencia de hipertensión arterial y sobrepeso y obesidad en Venezuela y Cuba, respectivamente. No obstante, resaltó de manera significativa el mal control metabólico (64 %) y la neuropatía moderada (60,5 %), lo cual permite correlacionar el comportamiento en poblaciones con características y resultados similares.
Los datos expuestos previamente se correlacionan con la prevalencia de DM tipo II (94.6 %). Ahora bien, el grado de control metabólico explica por qué aproximadamente un tercio de la población es insulinodependiente (29,6%), siendo representativo también el grupo de requerimiento de insulina adicional a fármacos orales (20,8 %). Solo el 39,6 % reportó adherencia farmacológica, y la progresión fisiopatológica y el mal control metabólico, precipitan la aparición de PD, y específicamente en fase moderada-avanzada (con mayor frecuencia en estadio Fontaine IV [36,2 %], Wagner IV [30,2 %], IDSA/IWGDF III [45,7 %] y elevada prevalencia de enfermedad arterial periférica [64,4 %]. La falta de educación en salud y la resistencia social frente a las terapias médicas podrían responder a las causas de que solo 4 de cada 10 pacientes con DM sean adherentes al tratamiento. Mismos hallazgos y argumentos han sido discutidos en poblaciones similares sobre la adherencia al tratamiento 35. Pero al comparar la fase de estadio del PD se observó una frecuencia mayor en nuestros resultados, a pesar de que el índice tobillo-brazo en el 32,2 % de nuestra población se encontraba normal, diferente a lo encontrado en estudios realizados en poblaciones aledañas 35,37.
El perfil microbiológico encontrado en este estudio destacó la presencia de Pseudomona aerugi-nosa, Escherichia coli, Staphylococcus aureus y Klebsiella pneumoniae, con mediana de días de antibiótico de 12 (9 - 21) días, durante los cuales los pacientes fueron tratados predominantemente con Piperacilina-Tazobactam, Meropenem + Ciprofloxacino, Cefepime, Clindamicina, entre otros. Flores-Moreno et al. 40 estudiaron 52 pacientes con úlceras por PD en un centro de alto nivel en Honduras, y observaron que el 78,8 % tuvo cultivo positivo y que Proteus mirabilis fue el agente más frecuente (24,4 %), seguido de la K. pneumoniae (12,2 %); mientras que P. aeruginosa se identificó sólo en el 4.8 % y el S. aureus en el 2.4 %; siendo tratados luego del aislamiento principalmente con Ciprofloxacino (13,5 %) y Amoxicilina/Ácido Clavulánico (11,5 %). Aunque llama la atención que el 63,5 % de los pacientes no recibió antibiótico al egreso. Por su parte, Pincay-Parrales et al. 41 evaluaron una población con necesidades similares en Ecuador, donde K. pneumoniae se identificó en el 21 % y P. aeruginosa en el 14 %, seguido de Candida albicans y Candida tropicales, agentes no identificados en nuestra población. En Cuba 42, en 210 pacientes estudiados por PD se identificó infección monomicrobiana en el 64,8 %, siendo el S. aureus el microorganismo más frecuentemente aislado (30,9 %), seguido de Enterobacter spp (19,3 %) y E. coli (14,3 %). Entonces es evidente la variación de distribución microbiológica entre las regiones del Caribe, probablemente explicado por la microbiota de cada localización, grupo poblacional y factores de exposición, obligando a personalizar la terapia antimicrobiana según cada región.
Calles et al. 35 buscaban factores asociados a la presencia de pie diabético, y encontraron que la neuropatía (OR 3,67; IC 95 % 1,11 - 12,01), alteración en el índice tobillo-brazo (OR 4,84; IC 95 % 1,52 - 15,4) y el antecedente de PD (OR 9,71; IC 95 % 2,94 - 32) se asociaban significativamente con la aparición de esta condición. Autores de otra región 43 llevaron a cabo un metaanálisis con el objetivo de evaluar los niveles de hemoglobina glicada y el riesgo de amputación de la extremidad baja en pacientes con DM, y evidenciaron que por cada aumento de 1% en el valor de este parámetro, la probabilidad de amputación aumenta 1.22 veces (IC 95 % 1,16 - 1,29). Esto se correlaciona de manera directa con los hallazgos de nuestro estudio, en los que los niveles de hemoglobina glicada oscilaron en el 10 %. Pero se encontró que en nuestra población numerosos factores se asocian con desenlaces desfavorables (mortalidad, amputación, diagnóstico de osteomielitis por imagen y resistencia microbiana), siendo común entre todos, el tabaquismo (p <0,001), antecedente de amputación (p <0,001), la cronicidad de la ulcera (p <0,001) y el ingreso a UCI (p <0,001). En consecuencia, estos hallazgos deben ser considerados en futuras guías locales o regionales que busquen controlar la carga de enfermedad generada por el PD en la región del Caribe colombiano, y que además busquen redirigir de manera eficaz, eficiente y segura la terapia antimicrobiana del PD.
Entre las limitaciones de este estudio se encuentra la naturaleza del diseño de la investigación, la cual no permite establecer propiamente causalidad entre las variables analizadas y los desenlaces planteados. No obstante, sirve como base para estudios en el futuro cercano con diseños más complejos. Así mismo, al haber obtenido información de historias clínicas, pudo existir errores de digitación que se controlaban con verificación de la información a partir de identificación de la variable desde diferentes temas por indagar, así como fueron controlados los sesgos relacionados con la toma del cultivo al realizar una estandarización del procedimiento y del procesamiento de la muestra en el laboratorio. Pero es imperativo mencionar que la institución hospitalaria donde se ejecutó el estudio es un centro de tercer nivel de referencia regional que recibe pacientes de toda la región del Caribe colombiano, lo cual enriquece la disponibilidad de datos a la literatura regional. De esta forma, sería posible mejorar estrategias y planes de salud, administrativos y económicos en el manejo de PD.
CONCLUSIÓN
Este estudio demostró que en la región del Caribe colombiano, la infección por pie diabético es predominante en hombres de mediana edad, con presentación moderada a severa, causada principalmente por bacterias gramnegativas y enterobacterias, y con una frecuencia importante de amputación y de necesidad de manejo por cuidado intensivo, la cual ocasiona mortalidad en 1 de cada 10 pacientes. El tabaquismo y el ingreso a cuidado intensivo son los principales factores asociados de manera significativa a desenlaces desfavorables en esta población.















