Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colomb. Cardiol. vol.12 no.6 Bogota Apr. 2006
Premio Trabajos de Concurso "Mejor trabajo presentado por un Miembro de Número" en el XXI Congreso Colombiano de Cardiología
(1) Departamento de Cardiología Preventiva, Clínica Medellín, Medellín, Colombia.
(2) Barts Hospital y Universidad de Londres, Londres, Reino Unido.
(3) Corporación para Investigaciones Biológicas de Antioquia y Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
Correspondencia: Dagnóvar Aristizábal, MD. Departamento de Cardiología Preventiva, Clínica Medellín, Calle 54 No. 46-27 (1405), Teléfono: (4) 5117378 Ext. 101-111, Medellín, Colombia.
Recibido: 15/03/06. Aceptado: 17/03/06.
Las enfermedades cardiovasculares se han consolidado como las principales causas de enfermedad y muerte no violenta en Colombia. La hipertensión arterial es el desorden cardiovascular más frecuente en nuestra nación, con una prevalencia que oscila entre 13% y 23% (1, 2). Por la alta frecuencia en la población adulta, la hipertensión arterial es un factor de riesgo mayor para el desarrollo de enfermedad coronaria así como de enfermedad cerebrovascular y renal.
Por más de cincuenta años se han investigado las causas de la hipertensión arterial y se ha descubierto que existen factores ambientales y genéticos que afectan la respuesta de órganos como el riñón o el cerebro y del sistema cardiovascular, que además provocan alteraciones en el control de la presión arterial y la hipertensión crónica. Algunos factores ambientales como exceso de calorías y sal en la dieta, sobrepeso, estrés sicosocial y consumo significativo de alcohol elevan la presión arterial (3), lo cual se ha corroborado en nuestra población (4). Sin embargo, poco se sabe acerca de qué factores genéticos participan en el desarrollo de la hipertensión. En la actualidad, se considera que el componente genético, aun no clarificado, determina un 30% a 50% de los niveles de presión arterial en las poblaciones (5).
Para iniciar el estudio genético se tomó una población colombiana de tamaño mediano. De un total de 5.720 personas entre 18 y 65 años, se evaluaron 3.000, de donde se excluyeron individuos con primer grado de consanguinidad (1.998 sujetos). Se obtuvo la curva de distribución de la presión arterial con 1.002 individuos sin parentesco en quienes se estudiaron varios genes candidatos para hipertensión (6-22).
Se ha encontrado que genes candidatos como el gen del angiotensinógeno (AGT) regulan la función renal y provocan retención de sal y vasoconstricción sistémica (23, 24). Otros genes están implicados en el trasporte molecular de sodio en el riñón, como el WNK1 y el GNB3 (25-28), o poseen acción en la vasculatura, como el gen del receptor beta 2 adrenérgico (29).
Inicialmente, se diseñó un estudio de casos y controles para comparar los percentiles 10 y 90 de la curva de distribución de presión arterial. Se analizaron los haplotipos de las variantes M235T en el exón 2 y dos variantes moleculares de la región promotora del gen AGT (A-6G; A-20C). Se genotipificaron 191 personas con la técnica de reacción en cadena de la polimerasa (ARMS-PCR). Al comparar los diferentes genotipos para A-20C se demostró asociación genética entre la presencia de hipertensión con la variante –20AA del gen AGT (X2 = 4,26; p < 0,05).
Posteriormente, se encontró asociación del gen GNB3, que controla el transporte de sodio por los túbulos renales, el cual mostró un efecto genético independiente en presencia de hipertensión en individuos obesos portadores del alelo 825T del gen GNB3. En estos individuos la hipertensión se desarrollaría a través de la expansión del volumen vascular por cambios en la excreción renal de sal.
Finalmente, el gen del receptor beta 2 adrenérgico no demostró asociación genética con hipertensión pero tuvo una alta frecuencia en nuestra población, por lo cual se evaluó su efecto hemodinámico. La presencia de homocigocidad en los nucleótidos que determinan el aminoácido en la posición 16 del gen, modifica el estado hemodinámico a través cambios significativos del gasto cardiaco en reposo, bajo estímulo postural en la mesa basculante o bajo el efecto de un agonista del receptor beta 2.
Después de nueve años de exploración de las bases genéticas de la hipertensión esencial en Colombia, se demuestra la presencia de subgrupos de individuos con diferencias fenotípicas a partir de ciertos genotipos. Estos resultados marcan nuevas direcciones para entender la fisiopatología de esta condición en nuestra población y son el punto de partida para una mejor caracterización de la hipertensión con fines preventivos y terapéuticos.
Palabras clave: hipertensión, genes candidatos, polimorfismos, fisiopatología, genómica, farmacogenética, mecanismos moleculares.
Cardiovascular diseases are the main causes of disease and non-violent death in Colombia. Arterial hypertension is the most common cardiovascular disorder in our country, with a prevalence oscillating between 13% and 23% (1, 2). Given its high frequency in the adult population, arterial hypertension is a mayor risk for the development of coronary disease, as well as for cerebro-vascular and renal diseases.
The causes of arterial hypertension have been investigated for more than fifty years and it has been stated that there are environmental and genetic factors that affect the response of organs such as the kidney, the brain and the cardiovascular system, which in turn provoke alterations in the arterial pressure control and chronic hypertension. Some environmental factors like excessive caloric and salt intake, overweight, psycho-social stress and significant alcohol intake raise the arterial pressure (3), which has been corroborated in our population (4). Nevertheless, little is known regarding the genetic factors implicated in the development of hypertension. Currently, the not yet clarified genetic component determines 30% to 50% of the blood pressure levels in the population (5).
In order to initiate the genetic study, a medium size population was chosen. From a total of 5.720 people with ages between 18 and 65 years, 3.000 were evaluated, excluding relatives with first degree of consanguinity (1.998 subjects). A distribution curve of the arterial pressure was obtained with 1.002 non-related individuals in whom many candidate genes for hypertension were studied (6-22).
It has been found that candidate genes like the angiotensinogen gene (AGT) regulates kidney function, provokes salt retention and systemic vasoconstriction (23, 24). Other genes are implicated in the molecular sodium transport in the kidney, like the WNK1 and the GNB3 (25, 28), or act in the vasculature as the beta 2 adrenergic receptor gene (29).
Initially, a case control study was designed in order to compare the 10 and 90 percentiles from the arterial pressure distribution curve. The haplotypes of the M235T in the exon and two molecular variants of the promoter region of the AGT gene (A-6G; A-20C) were analyzed. 191 people were genotyped by means of the polymerase chain reaction technique (ARMS-PCR). When comparing the different genotypes for A-20C, a genetic association between the presence of hypertension with the -20AA variant of the AGT gene was found (X² = 4,26; p < 0,05).
Later, an association of the GNB3 gene that controls the sodium transport by the renal tubules was found. It showed an independent genetic effect in the presence of hypertension in obese individuals, carriers of the 825T allele of the GNB3 gene. In these individuals hypertension would develop through vascular volume expansion due to changes in the renal salt excretion.
Finally, the gene of the beta 2 adrenergic receptor did not show genetic association with hypertension, but had a high frequency in our population; for this reason, its hemodynamic effect was evaluated. The presence of homozygocity in the nucleotides that determine the amino acid in the 16 gene position modifies the hemodynamic state through significant changes in the cardiac output at rest, under postural stimulation in the tilt table or under the effect of an agonist of the beta 2 receptor.
After nine years exploring the genetic basis of essential hypertension in Colombia, the presence of subgroups of individuals with phenotypic differences through certain genotypes is demonstrated. Theses results open new ways in order to understand the pathophysiology of this condition in our population and are the start point for a better characterization of hypertension with preventive and therapeutic aims.
Key words: hypertension, candidate genes, polymorphism, genomic, pathophysiology, pharmacogenetics, molecular mechanisms.
Introducción
Aspectos generales de la hipertensión esencial
La hipertensión arterial esencial es un factor de riesgo independiente para enfermedad cardiovascular. Este desorden tiene alta prevalencia en países desarrollados y es la principal causa de mortalidad en nuestro medio. Se considera que el 25% de la población en el mundo, tiene cifras de presión arterial superiores a 140/90 mm Hg, lo cual se considera el límite entre normotensión e hipertensión (2, 30). La hipertensión arterial esencial cuya etiología no se conoce, es el tipo más frecuente de presión arterial elevada en humanos. En la actualidad se acepta que en la génesis de la hipertensión arterial esencial existe un 50% de base ambiental y hasta un 50% de factores genéticos (5, 6, 31).
Evidencia genética de la hipertensión arterial esencial
La evidencia del componente genético de la hipertensión arterial esencial proviene de la observación de este desorden en familiares de primer grado de consanguinidad. Los hijos de padres hipertensos suelen presentar cifras de presión arterial superiores cuando se comparan con las cifras de presión arterial de hijos de padres normotensos (5, 32).
El estudio de las bases genéticas de la hipertensión arterial esencial, comenzó formalmente en 1992 cuando un grupo de investigadores franceses y estadounidenses encontraron el gen del angiotensinógeno asociado con la hipertensión esencial en parejas de hermanos con este trastorno (24). Desde entonces han sido varias las poblaciones estudiadas con el fin de reproducir esta asociación. Se han reportado resultados positivos y negativos en la literatura, lo que al presente genera gran controversia acerca del papel de estas variantes genéticas en genes que controlan la presión arterial en humanos (14, 33).
Comienzos del estudio genético de la hipertensión arterial esencial en Colombia
Para iniciar el estudio de las bases genéticas de la hipertensión esencial en nuestro país, entre 1995 y 1996 se adelantaron contactos con varios científicos británicos que encabezaban el estudio de las bases genéticas de la hipertensión en el Reino Unido (British Hypertension Study), entre ellos Anna Dominicksac y John Connel, en Glasgow y Mark Caulfield en Londres. Después de varias visitas a Inglaterra para definir el nivel de cooperación y luego de analizar el recurso humano y técnico disponible en nuestro grupo, se estableció una colaboración para iniciar un estudio de epidemiología genética desarrollando la metodología y técnicas con nuestros propios recursos pero con la asesoría y cooperación del grupo inglés. A partir de 1996 se comenzó la labor de selección de una comunidad apta para este proyecto.
Población de estudio
Fue necesario acudir a un núcleo poblacional para conformar una gran fuente de individuos para realizar estudios genéticos poblacionales, con varios marcadores. Se seleccionó una población que reflejara genuinamente las poblaciones semi-rurales de nuestro país y la región latinoamericana. Se trató de evitar la heterogeneidad y la mezcla racial, lo cual daría origen a grandes variaciones en las frecuencias genotípicas y distorsionaría los resultados de los estudios de asociación genética. Esta situación suele ocurrir en zonas urbanas con población flotante y de gran diversidad de origen. Desde el punto de vista metodológico, para no estar restringidos por ningún punto de corte arbitrario en la definición de hipertensión, se realizó una curva de distribución poblacional para la presión arterial y a partir de allí se tomaron los percentiles más bajos y más altos de la distribución para comparar individuos con cifras extremas de presión arterial.
De acuerdo con los criterios para la selección de la población previamente mencionados, se escogió el municipio de Venecia (Antioquia), donde se establecieron contactos con las autoridades políticas, eclesiásticas y de salud de la localidad. Este municipio está ubicado en el suroeste antioqueño, en la región cafetera. Su temperatura promedio es de 19 ºC y se encuentra a 1.450 metros de altura sobre el nivel del mar. Al momento del rastreo poblacional, Venecia contaba con una población total de 12.705 habitantes, de los cuales 6.256 estaban entre los 20 y 65 años de edad, con 2.235 que habitaban la cabecera municipal, según las proyecciones de los últimos censos.
Para acceder al mayor número de personas que fuera posible, se programaron jornadas de toma masiva de la presión arterial, las cuales recibieron amplia difusión en la comunidad mediante volantes, a través de la emisora local, durante las celebraciones eucarísticas y en forma directa por el equipo de salud del municipio. Además, la información fue transmitida en las áreas rurales utilizando las promotoras de salud y por información directa en los puestos de salud. Entre octubre de 1996 y marzo de 1997 se evaluaron 3.000 individuos en la cabecera municipal y en tres de los cuatro corregimientos.
Técnicas y procedimientos en el estudio de campo
Consideraciones éticas
Durante la realización de esta investigación se tuvieron presentes los principios de respeto, beneficencia y justicia proclamados en el informe de Belmont. Además, el estudio se ajustó a lo exigido por la resolución 008430 de 1993 del Ministerio de Salud, donde se establecen las normas éticas para la investigación en seres humanos (34).
Luego de obtener el consentimiento informado (35), las personas evaluadas cooperaron con la siguiente secuencia:
A. Tres tomas de presión arterial en el brazo derecho en posición sentada con cinco minutos previos de descanso y dos minutos de diferencia entre cada toma, siguiendo los requerimientos indicados por la Asociación Americana del Corazón (36) y utilizando un tensiómetro digital validado para la toma de presión arterial (OMRON HEM-705 CP; Rugby, England) (37).
B. Evaluación por medio de una encuesta, de factores de riesgo para hipertensión arterial y antecedentes familiares y personales de enfermedades cardiovasculares.
C. Obtención del peso y la talla para la determinación del índice de masa corporal.
D. Toma de muestra de sangre para el análisis genético.
La figura 1 resume los procedimientos realizados en la fase clínica y de laboratorio.

E. A todos los pacientes se les entregó un carné con su nombre, fecha, promedio de presión arterial, peso, talla e índice de masa corporal.
F. A las personas con hipertensión (PAD > 95 mm Hg y/o PAS > 160 mm Hg), se les realizó un examen físico completo (incluyendo examen fundoscópico) y se les tomó una muestra para determinar la presencia de glucosuria, hematuria y proteinuria, mediante la técnica de cintilla de orina Combur Test (Boeringher Manheim). Estos pacientes se remitieron al hospital San Rafael de Venecia.
Además de evaluar la presión arterial de los pacientes con criterios de exclusión, se evalúo el índice de masa corporal y se brindó información pertinente de acuerdo con los hallazgos obtenidos. Los resultados de la evaluación se entregaron por escrito.
Los hallazgos de la encuesta se consignaron en una hoja electrónica (Excel, Microsoft), la cual se procesó para identificar individuos con primer grado de consanguinidad. Una vez se obtuvo la muestra poblacional, se estableció la curva de distribución de la presión arterial diastólica y sistólica, de donde se tomaron los deciles inferior y superior (percentiles 0-10 y 90-100) (Figura 2).

Extracción del ADN
Las muestras de sangre se transportaron el mismo día al laboratorio de investigación central en la ciudad y se procesaron para extraer los leucocitos. Mediante centrifugación a 2.500 g por diez minutos se separó la sangre, se removió el plasma y se almacenó para uso posterior. Los leucocitos se extrajeron por aspiración con pipetas Pasteur y se almacenaron en tubos Ependorff de 1,5 mL con una solución tampón de glicerol y fosfatos, según lo recomendado. Se obtuvo ADN de los leucocitos mediante precipitación con sales (38). Posteriormente, se realizaron las diferentes técnicas de genética molecular de acuerdo con los genes analizados como se describirá más adelante.
Métodos estadísticos
Características clínicas y datos genotípicos
Las características clínicas para cada individuo incluido en el estudio y los genotipos para cada SNP (se denominan SNP por Single Nucleotide Polimorphism, acrónimo en inglés), también se ingresaron en una base de datos en Microsoft Excel. La media y desviación estándar se utilizó para resumir la información de variables continuas y las variables dicotomas se presentan como porcentajes y/o frecuencias. Bajo la presunción de muestras al azar, un conjunto de datos biológicos debe seguir una distribución normal. Se evaluaron las desviaciones de la normalidad utilizando los test de Levene y Smirnov Kolgomorov (SPSS 11). Cuando las variables seguían una distribución normal, se utilizaron pruebas estadísticas paramétricas como la prueba de t para diferencias entre dos grupos o ANOVA (análisis de varianza) para evaluar diferencias entre más de dos grupos. De lo contrario, se emplearon por defecto pruebas no paramétricas.
Análisis multivariado
Los análisis multivariados se realizaron en SPSS11 para windows (SPSS Inc.). En este análisis la variable dependiente fue la presión arterial diastólica (se asignó un valor de 0 para presión baja y 1 para presión alta) y se incluyeron las siguientes variables independientes: edad, índice de masa corporal, género, estado de fumador, historia familiar de hipertensión y consumo de alcohol. En este modelo se pueden incluir parámetros genéticos como marcadores dialélicos o haplotipos y el efecto de dosis genética se mide como no portador, portador de una copia del alelo y portador de dos copias del alelo.
Análisis de datos genéticos
Las frecuencias alélicas se estimaron por el método de cuentas genéticas y el test de chi-cuadrado se utilizó para identificar desviaciones del equilibrio de Hardy-Weinberg y para medir asociación genética entre grupos. Se estimó el desequilibrio de ligamiento entre marcadores (D') usando el programa Arlequín v2.000 (39) y los haplotipos computacionales se obtuvieron utilizando un algoritmo bayesiano implementado en el programa PHASE (40). Con tablas de dos por cuatro, como lo proponen Botto y Khoury (41), se evaluaron las interacciones gen-ambiente en hipertensos. El riesgo relativo de interacciones gen-ambiente (RRi) y la fracción atribuible a la población de interacción gen-ambiente (PAFi), se estimaron de acuerdo con el trabajo de Yang y colaboradores (42).
El riesgo relativo de la influencia de un marcador genético en la presión arterial se presenta con la relación de disparidad (OR) con intervalos de confianza del 95%. En el cálculo de la relación de disparidad para un marcador genético los datos se presentan en tablas de 2x2. Un OR mayor de 1 indica que el alelo está asociado con el grupo afectado por el riesgo y por lo tanto confiere susceptibilidad. Alternativamente, un OR bajo 1 puede indicar un papel protector del marcador genético.
Cálculos de poder
Diseño del estudio de casos y controles
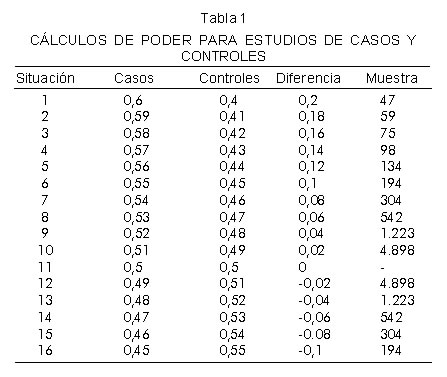
Bajo la suposición de no asociación de un marcador genético con el rasgo, se espera que las frecuencias alélicas sean iguales en los grupos afectados y no afectados con el rasgo. El poder en diseños de casos y controles depende del número de individuos en cada grupo y de las frecuencias alélicas observadas para el marcador genético en la población. Éste se calculó considerando las siguientes condiciones: nivel de significancia alfa del 0,05 y posibilidad de detectar una diferencia real del 80% bajo la proporción encontrada de los SNP genotipificados (p1-p2) (ver ecuación 1).

Ecuación 1. Cálculo de poder estadístico.
Za valor de z de dos colas para a= de 0,05 es ± 1,96
Zb el valor más bajo de Z de una cola para B de 0,20 es -0,84
p1 Proporción para el alelo en grupo 1; p2 Proporción para el alelo en grupo 2.
Se realizaron simulaciones de posibles escenarios a ocurrir durante el desarrollo de los experimentos. De la tabla 1 se concluye que entre mayor la diferencia en la frecuencia alélica entre los grupos, menor el número de sujetos requeridos en cada grupo.
Cálculos de poder para diferencias entre las medias de presión arterial como un rasgo cuantitativo
Se utilizó la ecuación 2 para calcular el tamaño de la muestra y establecer diferencias entre las medias en los dos grupos.

Ecuación 2. Tamaño de muestra para estudios con medias
en los dos grupos, es el estimativo de la desviación estándar en cada grupo, es el valor de dos colas de Z en relación a , y es el valor más bajo de una cola de en relación a b.
Se consideraron las siguientes condiciones:
- Nivel de significancia (nivel a, valor de P) para rechazar la hipótesis nula de 0,05.
- Poder deseado 0,80.
- La mayor diferencia con importancia clínica entre la media de los dos grupos, se asumió en 2 mm Hg de presión diastólica.
- Se asumió una desviación estándar igual entre los dos grupos.
Cálculos de poder para el test de desequilibrio en transmisión de alelos
Como lo describió Spielman (43, 44), el test de desequilibrio en la transmisión de alelos (TDT), se basa en el test de McNemar utilizado en estudios donde el resultado es una variable binaria (Si/No). Este test no sólo incluye las propiedades de una prueba de t apareada, sino que también es apropiado para datos nominales. Por lo tanto, se puede emplear el test de McNemar para comparar proporciones apareadas, que es el caso que aquí se describe.

Ecuación 3. Test de McNemar. La diferencia absoluta entre las celdas b y c en una tabla de 2x2 rechaza la hipótesis nula si la diferencia es > 3,84 (el valor crítico que confiere el valor de 0,05 en la distribución de chi cuadrado).
La hipótesis nula a probar en el TDT es que la transmisión de alelos a los descendientes afectados es la misma. La hipótesis alternativa es que las proporciones apareadas (alelos transmitidos) no son iguales. El valor obtenido en el test se compara contra la tabla de distribución Z para los valores de alfa y beta. Esta es la metodología general aplicada para cada capítulo de este estudio. En los capítulos respectivos se comentarán otros métodos estadísticos que se requirieron.
Nota: Este trabajo se desarrolló por etapas así que se ha preservado el orden en el cual históricamente se han estudiado los distintos genes que se han evaluado y se presentará a manera de capítulos.
Capítulo 1
Gen del angiotensinógeno
Por ser el gen que había demostrado un ligamiento claro con la hipertensión en humanos en varias poblaciones, se consideró necesario evaluar inicialmente su importancia en nuestra población.
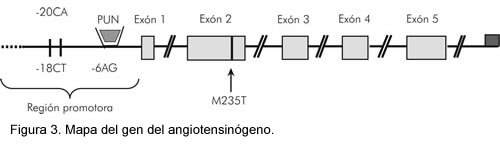
Se han reportado cerca de 51 polimorfismos de mononucleótidos (SNP) en las bases de datos públicas en la región cromosómica donde se encuentra el gen del angiotensinógeno. No es claro por qué esta región cromosómica de aproximadamente 18.000 bases presenta tanta variación genética, pero esto hace técnicamente difícil y costosa la evaluación de esta región del genoma en estudios de genética poblacional. La figura 3 muestra una representación esquemática del gen en las regiones estudiadas.
Fueron varios los hallazgos que resaltaron la importancia de este gen en hipertensión esencial. Jeunemaitre y colaboradores en grupos poblacionales de Francia y Norteamérica, identificaron 15 variantes moleculares en el gen del AGT, dos de las cuales se asociaron significativamente con la presencia de hipertensión esencial (24). Estas dos variantes están localizadas en el exón 2 del gen del AGT y corresponden al cambio de metionina por treonina en la posición 174 (T174M) y de treonina por metionina en la posición 235 (M235T). Esta última variante genética mostró una fuerte asociación positiva de la presión arterial con los niveles plasmáticos elevados de AGT. Diferentes estudios realizados en poblaciones japonesas, europeas y norteamericanas también indicaban una asociación entre estas dos variantes y la presencia de hipertensión.
En contraposición con estos hallazgos, otros estudios realizados en diferentes naciones mostraron resultados negativos (45-47). En el estudio efectuado por el Profesor Mark Caulfied y colaboradores en el Hospital de San Bartolomé de la Universidad de Londres en 63 familias británicas (48), no se identificó asociación entre estas dos variantes moleculares dialélicas y la hipertensión arterial esencial, pero sí se halló enlace y asociación genética entre el gen del AGT y la hipertensión esencial al utilizar marcadores altamente polimórficos (microsatélites) del gen. Este hallazgo indicaba que la variante molecular del AGT en el aminoácido en la posición 235, aparentemente no influenciaría de manera directa las concentraciones séricas de AGT sino que sería un marcador en desequilibrio con otro locus activo (linkage disequilibrium) (49).
Los resultados del trabajo de Inoue y colaboradores (49) indicaban que un cambio de una guanina por adenina en la posición –6 de la región promotora del gen AGT, afectaba el promedio de transcripción basal del gen AGT y estaba asociado en forma significativa con la presencia de hipertensión. Igualmente, Yanai y colaboradores (50) describieron cómo la presencia de diferencias en la secuencia en la región central del promotor, alteraba la afinidad del promotor por factores de transcripción. Específicamente, las variantes genéticas en la posición –20 y –18 podían afectar la actividad transcripcional hasta 2,5 veces (50). Además, un estudio en humanos hipertensos daba soporte a la importancia de esta variante como factor de riesgo genético en hipertensión arterial esencial (51).
Para estudiar la importancia de variantes del gen del AGT en nuestra muestra poblacional, se efectuó un estudio de casos y controles para determinar las frecuencias alélicas de las variantes funcionales M235T, –6, –18 y –20, en los extremos de la curva de distribución poblacional de la presión arterial diastólica que se había obtenido (Figura 2). Los resultados demostraron la presencia de asociación genética con un SNP localizado en la región promotora del gen del angiotensinógeno.
Materiales y métodos
Criterios de inclusión
Para este análisis se utilizaron los siguientes criterios de exclusión:
1. Ingestión de medicamentos que alteraran las cifras de presión arterial:
- Medicamentos antihipertensivos (excepto cuando la presión arterial diastólica fue mayor a 100 mm Hg).
- Uso de anovulatorios orales o subdérmicos.
- Litio y sedantes.
- Hormonas tiroideas de reemplazo.
- Medicamentos vasoconstrictores.
2. Personas menores de 18 o mayores de 65 años.
3. Embarazo actual.
4. Historia de preeclampsia o eclampsia.
5. Hipertensión arterial secundaria.
6. Primer grado de consanguinidad.
Análisis de la variante genotípica M235T en el gen del AGT
A partir de la secuencia publicada del exón 2 del gen del AGT en el banco de genes Genebank (hptt/www.ncbi.nlm.nih.gov/Genbank/) (Figura 4) y tomando como referencia la región del gen propuesta por Caufield y colaboradores (48), se diseñó en nuestro laboratorio el iniciador ATG 5'CAG GGT GCT GTC CAC ACT GGC TCC CA3' el cual hace una hibridización perfecta en el codón 235 del exón 2 en el gen AGT si éste codifica para una metionina, y el iniciador ACG 5 ‘ CAG GGT GCT GTC CAC ACT GGC TCC CG 3' que hace una hibridización perfecta sólo cuando el codón 235 del exón 2 del gen del AGT codifica para una treonina.

Ambos iniciadores son antiparalelos y se utilizan en dos reacciones separadas para amplificar el ADN mediante la reacción en cadena de polimerasa (PCR). Se agrega el iniciador paralelo A1 5' GCG CAC AAG GTC CTG TCT GCC CTG C 3'. La PCR se realizó en un equipo GeneAmp 9600 (Perkin-Elmer Corp, Norwalk, CN) bajo las siguientes condiciones: denaturación inicial a 95º C por 2 minutos, seguido de 30 ciclos de diez segundos por temperatura: 95º C (denaturación) y 77ºC (acoplamiento-extensión), finalizando con una extensión de 2 minutos. El producto de amplificación fue analizado en gel de agarosa teñido con bromuro de etidio 1 ng/10 mL a 160 voltios por 18 minutos y visualizado en el transiluminador. El fragmento de ADN amplificado (amplicón) es de 300 pares de bases.
La técnica de PCR utilizada se denomina ARMS (Amplification Refractory Mutation System) (52). El principio de esta técnica se basa en la incapacidad de la enzima Taq ADN polimerasa para extender un «primer» con un mal apareamiento en el extremo 3' del mismo. Si un individuo es homocigótico para metionina no amplifica con el codón de la treonina y lo opuesto sucede si es homocigótico para treonina. Sólo si es heterocigótico, en ambas reacciones ocurrirá la amplificación.
Para cada individuo, la reacción de ARMS-PCR fue efectuada por duplicado, sin que el investigador conociera a qué grupo pertenecían los sujetos analizados. Finalmente, la precisión de la técnica para detectar el polimorfismo fue corroborada mediante la determinación de la secuencia de ácidos nucleicos (53).

Resultados
Se analizó la muestra poblacional de 1.002 individuos sin parentesco para evaluar varios polimorfismos del gen del AGT. El grupo presenta edades comprendidas entre 18 y 65 años, con predominio del género femenino (58%) y una edad promedio cerca a los 40 años. Promedio de índice de masa corporal de 25,17 Kg/m2, consumo de licor por debajo de los 30 g/sem y actividad física en el 46% de la población (promedio 1,37 horas/semana). La tabla 3 muestra otras características de la población de donde se extrajeron los grupos para estudio.

La curva de distribución de la presión arterial diastólica para la muestra, tiene una distribución normal (Figura 2). Se tomaron los deciles extremos de la distribución (0-10 –controles- y 90-100 –casos-) y se compararon.
Como puede observarse en la tabla 4, los individuos en el decil superior están caracterizados por niveles promedios de presión arterial diastólica y sistólica que exceden la definición aceptada de hipertensión. Esta observación es de gran importancia si se tiene en cuenta que en este estudio no existen valores de corte para establecer la presencia de hipertensión.

Características genotípicas de la muestra
El gen del AGT se evaluó en 191 sujetos, 94 pertenecientes al percentil 10 y 97 del percentil 90. La distribución de los genotipos M235T estuvo en concordancia con el equilibrio de Hardy–Weinberg, en el percentil 90 (X2= 0,31; p > 0,5) y en el percentil 10 (X2= 0,06; p > 0,5) (Tabla 5).
Para el polimorfismo M235T, la frecuencia del alelo T235 fue del 58% en los casos y del 60% en los controles (diferencia no significativa). Por otra parte, la frecuencia de homocigóticos para el alelo T fue 42% en los casos y 40% en los controles (Tabla 5).
Igualmente, la distribución genotípica de las variantes –6AG y –20AC mostró proporciones en concordancia con el equilibrio de Hardy–Weinberg, en el percentil 90 (X2= 5,68 y 1,58 respectivamente p > 0,5) y en el percentil 10 (X2= 5,43 y 2,47 p > 0,5).
Para el alelo –6A las frecuencias fueron de 36% en los casos y de 30% en los controles, mientras el número de homocigóticos –6AA fue 19% en los casos y 14% en los controles.
En contraste con estos resultados, al evaluar el polimorfismo en la posición –20A del promotor del gen AGT, se encontró que la frecuencia de este alelo fue significativamente mayor en el grupo con presión arterial elevada. Además, la homocigocidad –20AA mostró asociación estadísticamente significativa con la presencia de presión arterial elevada (X2= 4,26; p < 0,05) (Tabla 5).
Resumen de los principales hallazgos para el gen del angiotensinógeno
En la evaluación de este gen candidato se demostró que uno de los polimorfismos del gen AGT localizado en la región promotora, puede constituir una variante de predisposición genética a la hipertensión en nuestra población. Sólo existe un estudio previo que demuestra la importancia de la variante A-20C como factor de riesgo genético para hipertensión esencial. Sato y colaboradores (51) identificaron en población japonesa la presencia de desequilibrio de enlace genético entre M235T y A-20C, y además entre M235T y C-18T. Sus hallazgos indican que estos dos polimorfismos son un factor de riesgo genético más importante y que se asocia más directamente con hipertensión esencial que M235T.
En contraste con estudios realizados en otras naciones, en nuestra población no se encontró asociación entre el polimorfismo M235T del gen AGT y la presencia de presión arterial elevada. Para este polimorfismo, nuestros resultados difieren de los reportados en poblaciones caucásicas y orientales (24, 54, 55), pero están en concordancia con otros reportes realizados en poblaciones negras del Caribe y Norteamérica (45-48, 56, 57). Estos hallazgos resaltan la importancia del gen del angiotensinógeno y su contraparte fisiológica, el sistema renina-angiotensina-aldosterona, como factores ligados a la presencia de hipertensión en esta población colombiana.
Capítulo 2
GEN WNK1
En 2001, Lifton y Jeunemaitre encontraron un par de genes causantes de hipertensión en humanos. Estos investigadores estudiaron una forma muy rara de hipertensión arterial conocida como pseudohipoaldosteronismo tipo II (PHA-II) (22). Estos pacientes se caracterizan por cifras de presión arterial elevada a temprana edad y niveles de potasio en el plasma de 6,2 mM. El trastorno electrolítico observado en estos pacientes, apuntaba a que la causa se encontraba en el riñón; sin embargo, el mecanismo molecular era incierto.
Mediante la estrategia de enlace genético (linkage) se asoció una región telomérica en el brazo corto del cromosoma 12 con PHA-II; el análisis detallado de esta región encontró una delección de 41.000 bases (41 Kb) en el intrón 1 del gen WNK1. El análisis de la expresión de este gen en leucocitos de pacientes con PHA-II, sugiere que este gen se expresa seis veces más en estos pacientes en comparación con personas normales (22). Posteriormente, se descubrió el gen WNK4 con 3 mutaciones en el exón 7. Estas mutaciones cambian la secuencia de aminoácidos en la proteína. Estudios de inmunohistoquímica indican que ambos genes se expresan en las células del túbulo distal glomerular, exactamente en la región de la nefrona sugerida por los fisiólogos como posible portadora del trastorno molecular (22).
Es así como WNK1 y WNK4 se convierten en nuevos genes candidatos para estudiar la hipertensión arterial esencial. Para su evaluación en esta fase del estudio en nuestra población, se emplearon tríos familiares con individuos hipertensos.
El gen WNK1
Este gen se localiza en la región telomérica del brazo corto del cromosoma 12. Está conformado por 28 exones y 27 intrones que ocupan alrededor de 156 Kb en el cromosoma (Figura 5).

Materiales y métodos
La estrategia de genotipificación de variantes puntuales en el gen WNK1 es DASH, acrónimo en inglés de «Dynamic Allele Specific Hybrydization» (58, 59). Al presente se han analizado seis variantes en el gen WNK1 en 37 familias colombianas. Las variantes son: exón 1 G/T, exón 6 T/C, exón 8 T/C, intrón 10 T/C, exón 13 C/A e intrón 26 T/C.
Principio de la técnica DASH (58, 59)
Por PCR se amplifica una región de 50 a 60 bases que contiene el polimorfismo con éste en la mitad. Este amplicon se biotinila en uno de sus extremos utilizando un iniciador marcado con biotina en su extremo 5'. Este amplicon se inmobiliza en un plato de 96 pozos cubierto con estreptavidina. La cadena no biotinilada se remueve con un agente denaturante (hidróxido de sodio). Obtenido el ADN de una sola cadena, se adiciona una sonda de 17 bases con el nucleótido que reconoce el polimorfismo ubicado en la mitad; el plato se coloca a 80oC por 10 segundos y luego la temperatura se reduce gradualmente 0,1oC por segundo hasta llegar a 30 oC. Se remueve el exceso de sonda y se agrega una solución con SYBR GREEN I, la cual produce fluorescencia en presencia de ADN de doble cadena. El plato se coloca en la máquina DASH, la cual incrementa la temperatura de 35oC a 80oC al mismo tiempo que registra la fluorescencia de cada pozo y la envía al computador en tiempo real. Cuando la sonda hibridiza perfectamente, el punto de fusión de la sonda es 5oC más elevado en contraste con la sonda que no hibridiza por completo. Esta lectura original es modificada por el software en la primera derivada negativa, permitiendo la genotipificación por el usuario (Figuras 6 y 7).
Control de calidad
Dos personas independientes evalúan los genotipos y en caso de discrepancias entre el primero y el segundo evaluador, la muestra se procesa de nuevo antes de realizar el análisis estadístico. Los genotipos se almacenan en una base de datos en Excel (Microsoft), donde se establecen las frecuencias alélicas por variante genética contando los genotipos.
Estimación de haplotipos
El programa PHASE del grupo de matemática y estadística de la Universidad de Oxford, se utiliza para establecer automáticamente los haplotipos (40). Básicamente, un haplotipo es como un código de barras; en este caso cada línea del código de barras sería un SNP y el conjunto de SNP forma el haplotipo. Es de anotar que en este caso se conoce la fase genética de cada individuo afectado; es decir, si se cuenta con el genotipo de los padres es posible identificar la procedencia de cada alelo.
Una vez que se obtiene la frecuencia de haplotipos con el programa PHASE, el siguiente paso es establecer el desequilibrio genético entre las variantes (linkage disequilibrium), o la forma cómo se relacionan los polimorfismos entre sí. Para este fin se utiliza el programa ARLEQUÍN que emplea la ecuación de Nei (39).
Resultados
Al presente se han analizado 38 familias colombianas en 6 polimorfismos, exón 1 G/T, exón 6 T/C, exón 8 T/C, intrón 10 T/C, exón 13 C/A e intrón 26 T/C. Sin embargo, el polimorfismo del exón 1 se encontró monomórfico en toda la población para la variante G. La tabla 3.1 muestra los genotipos encontrados en las 38 familias genotipificadas. La tabla 6 muestras las frecuencias alélicas para los SNP genotipificados.

El análisis de haplotipo realizado por PHASE, generó 7 haplotipos en 228 cromosomas evaluados. La figura 8 muestra las frecuencias alélicas encontradas en el gen WNK1. El haplotipo 3, con una frecuencia observada de 49%, fue el haplotipo predominante. En general, 4 alelos representan el 91% de la población genotipificada, hallazgo muy similar al de otros genes analizados por haplotipos en otras poblaciones cuyo número oscila entre 4 a 6 representando la mayor parte de la población.

Análisis de TDT por SNP individuales
No se encontró asociación en los 6 SNP genotipificados en el gen WNK1 e hipertensión arterial esencial (p > 0,05). Se debe tener presente que para el análisis de TDT aquellos tríos donde ambos progenitores son homocigóticos, no se incluyen en el análisis de TDT. Por SNP individuales, el SNP localizado en el intrón 10 T/C y aquel ubicado en el intrón 26T/C, fueron los más apropiados para el análisis de TDT; el 73% y el 57% respectivamente de las familias, se utilizaron en el análisis de TDT. En el exón 6 T/C sólo el 10% de las familias genotipificadas se incluyeron en el análisis de TDT (Tabla 7).

Este valor es inferior a 3,84 que es el valor de p < 0,05 en la tabla de Chi cuadrado con un grado de libertad. Por lo tanto, no hay evidencia de asociación de esta variante genética con la hipertensión arterial esencial.
Análisis de TDT con múltiples alelos
En el análisis de TDT con múltiples alelos, no se encontró evidencia de asociación del gen WNK1 con la hipertensión arterial esencial (p > 0,05). Se resalta que de 38 familias sólo tres no se incluyeron en el análisis de TDT porque ambos progenitores fueron hallados homocigotos para este gen (Tabla 8).

Por su gran poder para establecer una transmisión genética intrafamiliar de alelos importantes en la génesis de un rasgo, el TDT se convierte en una pieza importante para dilucidar causas genéticas en el estudio de la hipertensión esencial. Con el gen WNK1 se aplicó la técnica a esta población colombiana sin demostrar la participación de este gen en las familias estudiadas. A medida que se conforman los haplotipos y que el recurso de familias con tríos se incremente, la posibilidad de identificar alelos de este y otros genes participantes en hipertensión arterial, será mayor.
Capítulo 3
Gen GNB3
Las proteínas G son una familia heterotrimérica de proteínas localizadas en la porción intracitoplasmática de la membrana celular; ellas son el interruptor entre la superficie de los receptores extracelulares y la maquinaria interna celular que genera la respuesta. La sub-unidad beta de varias proteínas G se denomina proteína de unión al nucleótido de guanina (GNB) 3 (60).
Este gen ha sido asociado con hipertensión arterial esencial debido a que se ha observado un aumento en la actividad del intercambio de Na+/H+ en el transporte de la membrana celular de la mitad de los pacientes con hipertensión arterial esencial (61).
La explicación a estos hallazgos puede estar mediada por el polimorfismo que se encuentra en el nucleótido 825 del exón 10 de la proteína GNB3, el cual varía entre citosina y timina. Aunque este polimorfismo no afecta la secuencia de aminoácidos, permite que por un cambio a T se realice un empalme alternativo del mRNA, produciendo una delección del exón 9 en los nucleótidos 498-620. Este cambio produce una pérdida de 41 aminoácidos en la subunidad beta. Estudios realizados en células de insectos transformadas con esta variante, demuestran una mayor actividad que la que se encuentra en células de tipo salvaje (62).
La asociación del alelo GNB3 825T con hipertensión ha variado dependiendo de los diseños de los estudios y también puede depender de la penetrancia del alelo en las diferentes poblaciones estudiadas y del tipo de estudio realizado (29).
Estructura del gen GNB3
El gen GNB3 reside en el cromosoma 12. Tiene 11 exones y 10 intrones (Figura 9); la proteína que codifica tiene 340 aminoácidos y se encuentra en todos los tejidos del organismo, formando un complejo con las subunidades alfa y gamma. La función de esta sub-unidad beta es servir de anclaje a la proteína G (60).

Haplotipos del GNB3
El gen GNB3 presenta muchos SNP, de tal forma que en una población pequeña, un SNP individual podría no estar relacionado con un fenotipo específico, en cuya situación el estudio de los haplotipos es la estrategia indicada para estudiar estos genes y su asociación con la hipertensión. La haplotipificación molecular es una técnica costosa y difícil, por eso se han diseñado varios programas de computador para inferir el número de haplotipos en una población; estos métodos se conocen como haplotipificación molecular. Se han empleado el método de parsimonia de Clark (63), que se encuentra en la versión 2 del programa Arlequín (64) y el método bayesiano de Mathews (65) con el programa PHASE, para inferir la frecuencia de los haplotipos y para asignar las posibles combinaciones arbitrarias que se presentarían en cada individuo en la población.
Resultados
Características clínicas de individuos en los quintiles extremos de distribución de la presión arterial
Se seleccionaron 132 casos y 159 controles de la curva de distribución de la presión arterial. La tabla 9 muestra las características de cada grupo. Los grupos de estudio no fueron emparejados. El porcentaje de mujeres fue 70% en el grupo control y 47% en los casos y también se observó una diferencia significativa en edad e índice de masa corporal entre los grupos.
Predictores de presión arterial elevada
Los resultados del análisis multivariado se observan en la tabla 10. Los predictores multivariados de hipertensión fueron: índice de masa corporal, edad y presencia de hipertensión en familiar en primer grado (hombre). Estas variables explican el 43% de la varianza de la presión arterial.

Frecuencias alélicas de SNP
Se genotipificaron cinco SNP marcadores localizados en el gen GNB3 en el cromosoma 12p13, empleando pirosecuencia. La frecuencia de los alelos fue muy similar entre los grupos (Tabla 11); igualmente, en la tabla 12 se muestra la distribución de haplotipos. Los cinco marcadores estaban en equilibrio de Hardy-Weiberg.


Análisis de interacción gen ambiente
Se exploró una interacción potencial entre el alelo 825T del gen GNB3 y la obesidad, utilizando una tabla de 2x4 como lo proponen Botto y Khoury (41). El análisis se observa en la tabla 4.5. La prevalencia de obesidad (índice de masa corporal ³ 30 kg/m2) fue del 14% en nuestra población y la prevalencia de portadores del alelo 825T, fue del 75%. No se encontró una asociación independiente de factores ambientales con el alelo 825T. Sin embargo, en presencia de obesidad existió una asociación independiente y significativa con hipertensión (OR 2,47 IC= 1,25-4,87). El riesgo de hipertensión se duplicó en presencia de ambos factores de riesgo. La relación de disparidad para la variante genética y ambiental de riesgo presentes (Orge) es 2,5 (IC= 1,02-6,19). El riesgo relativo calculado para interacción gen ambiente (RRi) fue 8,96 y la fracción atribuible a la población para interacción gen ambiente (PAFi) fue 27% (Tabla 13). Estos hallazgos sugieren una fuerte interacción entre el alelo 825T y la obesidad.

Análisis de los resultados
Este capítulo reporta la estructura del gen GNB3 por primera vez en una población colombiana. Estudios previos han reportado una frecuencia del alelo 825T del 0,15 en poblaciones de Sur América. Nuestro estudio, que incluyó un número mayor de individuos, muestra que la frecuencia del alelo 825T en Sur América es mayor a la esperada. La frecuencia observada en Colombia fue 0,49. De acuerdo con las postulados del equilibrio de Hardy-Weinberg, donde el número de sujetos homocigóticos es derivado de p2 ó q2, y p, q son las dos frecuencias de alelos del SNP, el número de homocigóticos esperado para el alelo 825T en esta población sería 24%. De hecho, lo que se observó es que 75% de esta población colombiana era portador de al menos una copia de este alelo. Por esta razón se consideró la posibilidad que este alelo estuviera participando en la hipertensión en población con sobrepeso u obesidad.
Los mecanismos moleculares subyacentes en la hipertensión en sujetos obesos no están muy bien definidos pero aparecen implicadas una amplia gama de anormalidades metabólicas y hemodinámicas. Entre éstas los trastornos en la sensibilidad a la insulina y los cambios en el control del volumen vascular parecen importantes (66). En este capítulo del estudio de la hipertensión en nuestro país, se encontró una prevalencia de obesidad del 14%. Debido a la asociación previa del alelo 825T con obesidad e hipertensión y a la observación frecuente de obesidad en población hipertensa, se exploró una interacción entre éstos.
Nuestros resultados sugieren que la interacción es fuerte (RRi= 8,96). La PAFi para el alelo 825T y la obesidad fueron del 27%. Estos resultados pueden interpretarse como el porcentaje de individuos con hipertensión potencialmente prevenibles si el factor genético o el ambiental se remueve (42). Suprimir el alelo de susceptibilidad de la comunidad no es posible, pero remover el componente ambiental de aquellos que son portadores el alelo de susceptibilidad, es una situación realista con beneficio clínico potencial. Podría ser posible que el alelo 825T del gen GNB3 en forma independiente no sea suficiente para influir en los niveles de presión arterial en población colombiana, pero puede ser el disparador de algún mecanismo biológico por establecer en presencia de obesidad, lo cual puede llevar al desarrollo de hipertensión. Se requieren estudios complementarios para probar si así sucede y si el mecanismo fisiopatológico es a nivel renal como lo sugiere el efecto genético.
Los individuos obesos portadores de este alelo deben ser evaluados en forma prospectiva. Así, el alelo 825T se puede convertir en un alelo de predisposición a la hipertensión en estos individuos, que dobla el riesgo de aparición de hipertensión cuando se compara con sujetos obesos no portadores. Adicionalmente, estos resultados necesitan evaluación en otras poblaciones y también análisis prospectivos en grupos apareados de «hipertensos» y «normotensos» en combinación con estudios que evalúen intervenciones para reducir el peso en portadores del alelo 825T del gen GNB3.
Capítulo 4
Gen del receptor beta 2 adrenérgico en Colombia
El receptor acoplado a proteína G (GPCR) hace parte de una familia de proteínas las cuales están involucradas en varios eventos fisiológicos en humanos. En la membrana de las células GPCR se unen a un gran número de ligandos y como resultado se modulan varios procesos homeostáticos. Estos receptores moleculares llevan el primer mensajero (ligando) del exterior al interior de las células hacia otras proteínas que son activadas cuando el ligando se une al receptor que inicia la cascada intracelular. En la actualidad son el blanco de múltiples agentes farmacológicos utilizados para tratar varios trastornos en humanos, incluyendo la hipertensión esencial (67). El receptor b2 adrenérgico (receptor ADRB2) es un miembro de esta familia de proteínas que comparten varias características clínicas y funcionales.
Receptor beta 2 adrenérgico
El gen del ADBR2 no tiene intrones, está localizado en el cromosoma 5 y consta de 1.239 bases de nucleótidos. Este gen codifica una proteína de 413 aminoácidos cuya estructura terciaria está organizada en siete dominios transmembrana, que es la típica disposición de la familia de proteínas GPCR (68, 69), como se ve en la figura 10.

Desensibilización del ADRB2
El receptor beta 2 adrenérgico exhibe desensibilización, la cual es la tendencia de la respuesta biológica a declinar con el tiempo a pesar de la presencia continua de un estímulo de intensidad constante (70, 71). Esta propiedad del receptor puede proteger al organismo de la sobre-estimulación, pero también limita la utilidad clínica de agentes farmacológicos agonistas o antagonistas. En el receptor beta 2 esta propiedad funcional está regulada por polimorfismos de nucleótidos únicos en el gen del receptor, que causan cambios en la estructura de aminoácidos. Por ejemplo, el nucleótido 46 del gen ADBR2 puede ser una adenina o una guanosina, lo cual a nivel de la proteína cambia el amioácido 16 a una arginina o a una glicina (Arg16Gly) en el sitio N-terminal del receptor (72). También existe un cambio de glutamina por ácido glutámico en la posición 27 que también modula la desensibilización (72). El receptor beta 2 con glicina en la posición 16 exhibe más regulación descendente inducida por agonista que el receptor con el aminoácido arginina 16 (73). El receptor beta 2 se expresa en el corazón, donde modula efectos cronotrópicos e inotrópicos, y en los vasos de resistencia vascular periférica, donde modula la vasodilatación al ser estimulado por catecolaminas.
El alelo Gly16. Un marcador para hipertensión esencial
Se ha sugerido que los individuos con el alelo glicina 16 son susceptibles al desarrollo de presión arterial elevada, por la rápida desensibilización del receptor de la proteína que llevaría a que los vasos estuvieran más expuestos a los estímulos alfa constrictores de las catecolaminas, con una resistencia vascular periférica mayor y elevación de la presión arterial (74, 75). El ADBR2 también se expresa en las células presinápticas donde media la liberación de norepinefrina que induce vasocontricción. Los SNP descritos permiten aplicar las estrategias de desequilibrio de ligamiento para análisis de este receptor en sujetos con hipertensión (72, 76).
Gen ADRB2 en Venecia
La estructura genética del gen ADBR2 en la población de Venecia se estudió caracterizando 9 SNP mediante la técnica de Dynamic Allele Specific Hybridization (DASH) como se describió en el capítulo dos (58, 59). Los SNP seleccionados corresponden a resultados de desequilibrio de ligamiento (D') previos, reportados en otras poblaciones.
La figura 11 muestra la secuencias del gen ADRB2; la región codificante del gen empieza en la tripleta iniciadora ATG y termina en el codón de parada TAA. Los SNP se muestran en códigos internacionales (IUB). Las sondas iniciadoras para PCR y para hibridización se diseñaron cercanas al área del SNP seleccionado (Tabla 14).


Análisis computacional
Una vez los arreglos genotípicos se llenan, se marca el punto de inicio para el manejo computacional y el análisis estadístico. El primer procedimiento es contar el número de muestras homocigóticas y heterocigóticas por SNP, lo cual permitirá la estimación de las frecuencias alélicas para cada SNP y los cálculos del equilibrio de Hardy-Weinberg. Luego se estiman los haplotipos, para lo que se utilizan varios algoritmos empezando con el de Clark y otros más recientes tales como los incluidos en el software Arlequín (39) y los algoritmos de Bayes existentes en el software PHASE (40).
Resultados
Se genotipificaron 9 SNP marcadores en el gen ADBR2 en 292 individuos seleccionados de los quintiles inferior y superior de distribución de la presión arterial diastólica. Las frecuencias de alelos observadas para los dos grupos se muestran en la tabla 15.
Dos SNP predicen los haplotipos principales en el locus ADBR2 en la población de Venecia. Éstos son A-1023G y A49G. Todos los SNP estuvieron en equilibrio de Hardy-Weinberg. Ninguno de los SNP se asoció con presión arterial elevada. Se obtuvo información genética y de fenotipo completa en 822 individuos.
Frecuencia del alelo glicina en la posición 16
El alelo de glicina 16 se ha considerado como un alelo de susceptibilidad para hipertensión y su frecuencia se ha reportado en diversas poblaciones. Este es el primer reporte de las frecuencias alélicas de este marcador en Colombia. En 1.764 cromosomas estudiados, la frecuencia de este alelo fue de 0,56. Esta frecuencia es ligeramente mayor que la reportada por Drysdale y colaboradores en 15 sujetos latinos (76). En una muestra más grande, de 1.576 brasileños, se encontró una frecuencia de glicina 16 del 55% (77). En otro grupo de latinoamericanos, los «Quechuas», un grupo nativo que vive a 5.000 metros sobre el nivel del mar, el alelo glicina 16 tuvo una frecuencia de 0,63 (78). De estos reportes se deduce que el alelo glicina 16 es de presentación común en la población latinoamericana. En la población colombiana el receptor más común es el 16Arg:27Gln con una frecuencia de 0,43, seguido por 16Gly:27Gln con 0,36 y 16Gly:27Glu con 0,19.
Influencias de los haplotipos del ADRB2 sobre la presión arterial
Los nueve SNP genotipificados permitieron caracterizar completamente la estructura de este locus en esta población colombiana. Lo atractivo del análisis de haplotipos es que el patrón de desequilibrio de ligamiento y la historia genética evolutiva, se incluyen en el análisis. Así, los estudios de asociación de haplotipos son una nueva generación de estudios de asociación genética (79, 80). Los mismos cuatro haplotipos comunes observados en Colombia, se encuentran en afro-americanos, asiáticos y europeos (76), pero no se halló asociación de ninguno de estos haplotipos o su combinación con la presión. Sin embargo, la existencia de los haplotipos del gen en nuestra población y los efectos funcionales de la vasculatura, ameritan evaluación complementaria para clarificar el papel de este gen sobre el control hemodinámico de la circulación a través del sistema nervioso autónomo.
Importancia del genotipo funcional sobre los factores hemodinámicos y la respuesta a los agonistas del receptor
Para evaluar estos efectos funcionales se llevó a cabo una segunda etapa de estudio, cuyo objetivo fue medir la respuesta hemodinámica y de la presión arterial en individuos hipertensos no tratados de acuerdo con el genotipo Arg16Gly del receptor b2 adrenérgico.
Metodología
El estudio fue doble ciego con dos grupos de pacientes definidos de acuerdo con el genotipo, así: homocigóticos arginina 16 versus homocigóticos glicina 16. Se evaluaron 15 individuos arginia 16 y 10 pacientes glicina 16.
Los pacientes se evaluaron en el laboratorio de sistema nervioso autónomo donde se realizó un protocolo de dos horas que incluyó la realización de evaluación postural en mesa basculante y la realización de ecocardiografía Doppler para evaluación estructural y funcional cardiaca. Durante todo el procedimiento se monitoreó en forma continua la presión arterial por tonometría y se obtuvieron, en las fases estables de protocolo, mediciones simultáneas de presión arterial, frecuencia cardiaca, gasto cardiaco, volumen latido y resistencia periférica total. En la última parte del protocolo se infundió terbutalina por vía venosa como agonista beta 2 selectivo en dosis de 100, 200, 300 mg/Kg/min, ocho minutos en cada dosis.
Resultados
La tabla 16 muestra el ANOVA de los diferentes parámetros hemodinámicos en respuesta a la inclinación de 60 grados en la mesa basculante y para las tres dosis de beta-agonista. Se analizaron las siguientes variables: frecuencia cardiaca (FC), presión arterial media (PAM), presión arterial sistólica (PAS), presión arterial diastólica (PAD), gasto cardiaco (GC), índice cardiaco (IGC), volumen latido (VL), índice de volumen latido (IVL) y resistencia periférica total (RPT). Los valores de p se presentan en la tabla 16.

Las diferencias en los dos grupos definidos por los genotipos del locus ADBR2 16, fueron significativas para el índice cardiaco tanto durante la prueba de mesa basculante como en las infuciones de terbutalina. El índice latido mostró diferencia significativa sólo en la prueba. Durante ésta la respuesta hemodinámica es mediada por el sistema nervioso autónomo y estos hallazgos apoyan que SNP diferentes del ADBR2 influyen en esta respuesta. Adicionalmente, durante la intervención farmacológica con beta 2 agonista, se confirma que este SNP modula la respuesta hemodinámica inducida por el agonista con diferencias significativas en la respuesta dosis dependiente del índice cardiaco entre los genotipos (Figura 12). Estos resultados indican que el polimorfismo 16 Gly/Arg del gen ADBR2, es un determinante del índice cardiaco durante la prueba de mesa basculante y en respuesta a la terbutalina como agonista del receptor.
Capítulo 5
Conclusiones
Impacto institucional y para el país de los resultados obtenidos
La hipertensión es un problema de salud pública para Colombia, puesto que por su alta prevalencia genera problemas cardiovasculares de alta morbimortalidad, tales como enfermedad cerebrovascular e infarto del miocardio. Aunque mucho se conoce acerca de su fisiopatología, poco se sabe de su etiología genética. El hallazgo de factores genéticos que predisponen a la hipertensión, permitirá seleccionar grupos específicos de pacientes para realizar prevención primordial basada en el riesgo genético. Adicionalmente, se iniciarán estudios de la respuesta a medicamentos basados en el genotipo, área conocida como farmacogenética.
En la actualidad, en países desarrollados, varios grupos estudian las bases genéticas de la hipertensión en sus poblaciones; aunque sus hallazgos pueden ser de gran utilidad localmente para su población y para la comunidad médica en general, se cuestiona su aplicación a otras poblaciones por poseer un ancestro étnico diferente. Debido a ello es necesario realizar nuestros propios estudios con el fin de que generen información propia sobre el conjunto de genes de predisposición a la hipertensión en Colombia y que puedan ser compartidos y discutidos con la comunidad científica internacional.
Esta investigación ha permitido un número importante de desarrollos que se resumen a continuación:
1. Establecer las técnicas de «mapeo» genético en enfermedades cardiovasculares en nuestra institución. Además permitió la formación de recurso humano de alto nivel en investigación cardiovascular con PhD graduado y un estudiante de maestría que completó su programa. Con esto hemos dado inicio al grupo de investigación básica y clínica para el estudio de enfermedades del corazón, con aval universitario.
2. Apreciar lo que significa la hipertensión como enfermedad compleja desde el punto de vista genético. Es por esto que los resultados de estos estudios son discretos si se tiene en cuenta la cantidad de trabajo y recursos invertidos.
3. Después de nueve años de trabajo, nos hemos acercado a entender la hipertensión esencial y hemos progresado en el desarrollo de esta área en nuestro país. Quizás lo más importante es que no nos hemos quedado rezagados en la investigación de un área de enorme trascendencia epidemiológica para Colombia.
Desde el punto de vista científico las conclusiones más importantes de estos nueve años de búsqueda de factores genéticos en la hipertensión esencial, son las siguientes:
1. Se logró identificar un alelo de predisposición a la hipertensión esencial, el 825T del gen GNB3.
2. Se obtuvo un marcador asociado a la hipertensión localizado en el gen del angiotensinógeno.
3. Se exploró con resultado positivo un genotipo funcional en el receptor beta 2 adrenérgico que determina la respuesta genéticamente mediada sobre el índice cardiaco.
4. Se afirmó que la hipertensión indudablemente es una condición heterogénea desde el punto de vista clínico y genético. Existen subgrupos de hipertensos con factores subyacentes diversos tanto genéticos como ambientales pero es aparente que se puede hacer una diferenciación que conduzca a establecer fenotipos intermedios, los cuales gradualmente empiezan a emerger. Para el caso de nuestra población se insinúan como fenotipos intermedios la hipertensión dependiente de volumen muy probablemente en el grupo de los hipertensos con sobrepeso y obesidad y los hipertensos con cambios hemodinámicos en el índice cardiaco y que muy probablemente reflejan una respuesta simpática elevada mediada por efectos beta-adrenérgicos.
Se podría decir que estamos en el fin del principio, preparados para establecer mediante correlaciones genotipo - fenotipo las características de la hipertensión esencial.
Agradecimientos
Este estudio recibió cofinanciación de Colciencias, por medio de los proyectos Nº 2213-04-10164 y 1115-04-11955. Adicionalmente fue cofinanciado por fondos de la Clínica Medellín, la Universidad Pontificia Bolivariana (UPB), Susalud EPS, la Corporación para Investigaciones Biológicas (CIB) y la Universidad de Antioquia. Edwin García recibió apoyo de Inglaterra a través de una beca ORS.
Agradecemos de manera muy especial al Dr. Mark Caulfield por su apoyo académico y financiero; a la población de Venecia, Antioquia, y a todos los pacientes que colaboraron con el estudio.
Bibliografía
1. Bautista LE, Vera-Cala LM, Villamil L, Silva SM, Pena IM, Luna LV. Risk factors associated with the prevalence of arterial hypertension in adults in Bucaramanga, Colombia. Salud Pública Mex 2002; 44 (5): 399-405. [ Links ]
2. Diago JL. Enfermedades crónicas no transmisibles: una propuesta para desarrollar a nivel municipal. Bogotá: Ministerio de Salud, Colombia; 1994. [ Links ]
3. Yusuf S, Hawken S, Ounpuu S, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004; 364 (9438): 937-52. [ Links ]
4. Fernandez R, Gallego L, Gallo E, et al. Sensibilidad a la insulina y su relación con la presión arterial y otros factores de riesgo cardiovascular. Acta Med Col 1997; 22 (1): 8-17. [ Links ]
5. Ward R. Familial aggregation and genetic epidemiology of blood pressure. In: Laragh J, Brenner B, eds. Hypertension: Pathophysiology, Diagnosis, and Management. 1st. ed. New York: Reaven Press; 1990. p. 81-100. [ Links ]
6. Agarwal A, Williams GH, Fisher ND. Genetics of human hypertension. Trends Endocrinol Metab 2005; 16 (3): 127-33. [ Links ]
7. Aristizábal D. Determinación de las variantes moleculares del gen del angiotensinógeno como posible causa de hipertensión arterial esencial en una población Colombiana. UPB Escuela de Ciencias Biológicas; 1997. [ Links ]
8. Benjafield AV, Jeyasingam CL, Nyholt DR, Griffiths LR, Morris BJ. G-protein beta3 subunit gene (GNB3) variant in causation of essential hypertension. Hypertension 1998; 32 (6): 1094-7. [ Links ]
9. Bianchi G, Manunta P. Adducin, renal intermediate phenotypes, and hypertension. Hypertension 2004; 44 (4): 394-5. [ Links ]
10. Cockcroft JR, Gazis AG, Cross DJ, et al. Beta(2)-adrenoceptor polymorphism determines vascular reactivity in humans. Hypertension 2000; 36 (3): 371-5. [ Links ]
11. Dishy V, Sofowora GG, Xie HG, et al. The effect of common polymorphisms of the beta2-adrenergic receptor on agonist-mediated vascular desensitization. N Engl J Med 2001; 345 (14): 1030-5. [ Links ]
12. Eisenach JH, Barnes SA, Pike TL, et al. The Arg16/Gly {beta}2-adrenergic receptor polymorphism alters the cardiac output response to isometric exercise. J Appl Physiol 2005; 99 (5): 1776-81. [ Links ]
13. Fardella CE, Claverie X, Vignolo P, Montero J, Villarroel L. T235 variant of the angiotensinogen gene and blood pressure in the chilean population. J Hypertension 1998; 16 (6): 829-33. [ Links ]
14. Jeunemaitre X, Inoue I, Williams C, et al. Haplotypes of angiotensinogen in esential hypertension. Am J Hum Genet 1997; 60: 1448-60. [ Links ]
15. Luft FC. Molecular genetics of salt-sensitivity and hypertension. Drug Metab Dispos 2001; 29 (4 Pt 2): 500-4. [ Links ]
16. Melander O, Bengtsson K, Orho-Melander M, et al. Role of the Gly460Trp polymorphism of the alpha-adducin gene in primary hypertension in Scandinavians. J Hum Hypertens 2000; 14 (1): 43-6. [ Links ]
17. Mendelsohn ME. In hypertension, the kidney is not always the heart of the matter. J Clin Investigation 2005; 115 (4): 840-4. [ Links ]
18. Nishiuma S, Kario K, Kayaba K, et al. Effect of the angiotensinogen gene Met235—>Thr variant on blood pressure and other cardiovascular risk factors in two Japanese populations. J Hypertens 1995; 13 (7): 717-22. [ Links ]
19. Rankinen T, Rice T, Leon AS, et al. G protein beta 3 polymorphism and hemodynamic and body composition phenotypes in the HERITAGE Family Study. Physiol Genomics 2002; 8 (2): 151-7. [ Links ]
20. Schmidt S, Sharma A, Zilch O, et al. Association of M235T variant of the angiotensinogen gene with familial hypertension of early onset. Nephrol Dial Transplant 1995; 10 (7): 1145-8. [ Links ]
21. Su YR, Menon AG. Epithelial sodium channels and hypertension. Drug Metab Dispos 2001; 29 (4 Pt 2): 553-6. [ Links ]
22. Wilson FH, Disse-Nicodeme S, Choate KA, et al. Human hypertension caused by mutations in WNK kinases. Science 2001; 293 (5532): 1107-12. [ Links ]
23. Caulfield M, Lavender P, Newell-Price J, Kamdar S, Farrall M, Clark A. Angiotensinogen in human essential hypertension. Hypertension 1996; 28 (6): 1123-5. [ Links ]
24. Jeunemaitre X, Soubrier F, Kotelevtsev YV, et al. Molecular basis of human hypertension: role of angiotensinogen. Cell 1992; 71 (1): 169-80. [ Links ]
25. Chatziantoniou C, Ruan X, Arendshorst WJ. Defective G protein activation of the cAMP pathway in rat kidney during genetic hypertension. Proc Natl Acad Sci U S A 1995; 92 (7): 2924-8. [ Links ]
26. Choate KA, Kahle KT, Wilson FH, Nelson-Williams C, Lifton RP. WNK1, a kinase mutated in inherited hypertension with hyperkalemia, localizes to diverse Cl- -transporting epithelia. Proc Natl Acad Sci U S A 2003; 100 (2): 663-8. [ Links ]
27. Dai SP, Shi JP, Ding Q, et al. Polymorphism analysis of 825C/T of the G-protein beta 3 subunit in high risk population of hypertension in the northeast China. Yi Chuan Xue Bao 2002; 29 (4): 294-8. [ Links ]
28. Pietruck F, Moritz A, Montemurro M, et al. Selectively enhanced cellular signaling by Gi proteins in essential hypertension. G alpha i2, G alpha i3, G beta 1, and G beta 2 are not mutated. Circ Res 1996; 79 (5): 974-83. [ Links ]
29. Garcia EA, Newhouse S, Caulfield MJ, Munroe PB. Genes and hypertension. Curr Pharm Des 2003; 9 (21): 1679-89. [ Links ]
30. Chobanian AV, Bakris GL, Black HR, et al. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA 2003; 289 (19): 2560-72. [ Links ]
31. Dominiczak AF, Brain N, Charchar F, McBride M, Hanlon N, Lee WK. Genetics of hypertension: lessons learnt from mendelian and polygenic syndromes. Clinical And Experimental Hypertension 2004; 26 (7-8): 611-20. [ Links ]
32. Watt G, Harrap S, Foy C, et al. Abnormalities of glucocorticoid metabolism and the renin-angiotensin system: a four-corners approach to the identification of genetic determinants of blood pressure. J Hypertens 1992; 10 (5): 473-82. [ Links ]
33. Corvol P, Persu A, Gimenez_Roqueplo AP, Jeunemaitre X. Seven lessons from two candidate genes in human essential hypertension: angiotensinogen and epithelial sodium channel. Hypertension 1999; 33 (6): 1324-31. [ Links ]
34. Ministerio de Salud, República de Colombia. Resolución 008430 de 1993. Boletín epidemiológico de Antioquia; 1994. p. 235-49. [ Links ]
35. Clayton E, Steinberg K, Khoury M, et al. Informed consent for genetic research on stored tissue samples. JAMA 1995; 274 (22): 1786-92. [ Links ]
36. Pickering TG, Hall JE, Appel LJ, et al. Recommendations for blood pressure measurement in humans and experimental animals: Part 1: blood pressure measurement in humans: a statement for professionals from the Subcommittee of Professional and Public Education of the American Heart Association Council on High Blood Pressure Research. Hypertension 2005; 45 (1): 142-61. [ Links ]
37. O'Brien E, Mee F, Atkins M, Thomas M. Evaluation of three devices for self measurement of blood pressure according to the revised British hypertension society protocol: The Omron HEM-705 CP, Philips HP 5332, and Nissel DS 175. J Hypertens 1994; 12 (1): 54-61. [ Links ]
38. Maniatis T, Fritsch E, Sambrook J. Molecular cloning: a laboratory manual. 1989. [ Links ]
39. Schneider S, Roessli D, Excoffier L. Arlequin ver. 2.000: A software for population genetics data analysis. Genetics and Biometry, University of Geneve, Switzerland; 2000. [ Links ]
40. Liu JS, Sabatti C, Teng J, Keats BJ, Risch N. Bayesian analysis of haplotypes for linkage disequilibrium mapping. Genome Res 2001; 11 (10): 1716-24. [ Links ]
41. Botto LD, Khoury MJ. Commentary: facing the challenge of gene-environment interaction: the two-by-four table and beyond. Am J Epidemiol 2001; 153 (10): 1016-20. [ Links ]
42. Yang Q, Khoury MJ, Friedman JM, Flanders WD. On the use of population attributable fraction to determine sample size for case-control studies of gene-environment interaction. Epidemiology 2003; 14 (2): 161-7. [ Links ]
43. Spielman RS, Ewens WJ. The TDT and other family-based tests for linkage disequilibrium and association. Am J Hum Genet 1996; 59 (5): 983-9. [ Links ]
44. Spielman RS, Ewens WJ. A sibship test for linkage in the presence of association: the sib transmission/disequilibrium test. Am J Hum Genet 1998; 62 (2): 450-8. [ Links ]
45. Barley J, Blackwood A, Sagnella G, Markandu N, MacGregor G, Carter N. Angiotensinogen Met235—>Thr polymorphism in a London normotensive and hypertensive black and white population. J Hum Hypertens 1994; 8 (8): 639-40. [ Links ]
46. Fornage M, Turner S, Sing C, Boerwinkle E. Variation at the M235T locus of the angiotensinogen gene and essential hypertension: a population-based case-control study from Rochester, Minnesota. Hum Genet 1995; 96 (3): 295-300. [ Links ]
47. Rotimi C, Morrison L, Cooper R, et al. Angiotensinogen gene in human hypertension. Lack of an association of the 235T allele among African Americans. Hypertension 1994; 24 (5): 591-4. [ Links ]
48. Caulfield M, Lavender P, Farrall M, et al. Linkage of the angiotensinogen gene to essential hypertension [see comments]. N Engl J Med 1994; 330 (23): 1629-33. [ Links ]
49. Inoue I, Nakajima T, Williams CS, et al. A nucleotide substitution in the promoter of human angiotensinogen is associated with essential hypertension and affects basal transcription in vitro. J Clin Invest 1997; 99 (7): 1786-97. [ Links ]
50. Yanai K, Saito T, Hirota K, Kobayashi H, Murakami K, Fukamizu A. Molecular variation of the human angiotensinogen core promoter element located between the TATA box and transcription initiation site affects its transcriptional activity. J Biol Chem 1997; 272 (48): 30558-62. [ Links ]
51. Sato N, Katsuya T, Rakugi H, et al. Association of variants in critical core promoter element of angiotensinogen gene with increased risk of essential hypertension in Japanese. Hypertension 1997; 30 [part 1] (3): 321-5. [ Links ]
52. Hudson T. Amplification-Refractory Mutation System (ARMS) Analysis of Point Mutations. Washington: John Wiley & Sons, Inc; 1997. [ Links ]
53. Sanger F, Nicklen S, Coulson AR. DNA sequencing with chain-terminating inhibitors. Proc Natl Acad Sci USA 1977; 74: 5463-7. [ Links ]
54. Bennett C, Schrader A, Morris B. Cross-sectional analysis of Met235—>Thr variant of angiotensinogen gene in severe, familial hypertension. Biochem Biophys Res Commun 1993;197(2):833-9. [ Links ]
55. Hata A, Namikawa C, Sasaki M, et al. Angiotensinogen as a risk factor for essential hypertension in Japan. J Clin Invest 1994; 93 (3): 1285-7. [ Links ]
56. Caulfield M, Lavender P, Newell-Price J, et al. Linkage of the angiotensinogen gene locus to human essential hypertension in African Caribbeans. J Clin Invest 1995; 96 (2): 687-92. [ Links ]
57. Hingorani A, Sharma P, Jia H, Hopper R, Brown M. Blood pressure and the M235T polymorphism of the angiotensinogen gene. Hypertension 1996; 28 (5): 907-11. [ Links ]
58. Howell WM, Jobs M, Gyllensten U, Brookes AJ. Dynamic allele-specific hybridization. A new method for scoring single nucleotide polymorphisms. Nat Biotechnol 1999; 17 (1): 87-8. [ Links ]
59. Prince JA, Feuk L, Howell WM, et al. Robust and accurate single nucleotide polymorphism genotyping by dynamic allele-specific hybridization (DASH): design criteria and assay validation. Genome Res 2001; 11 (1): 152-62. [ Links ]
60. Rosskopf D, Busch S, Manthey I, Siffert W. G protein beta 3 gene: structure, promoter, and additional polymorphisms. Hypertension 2000; 36 (1): 33-41. [ Links ]
61. Canessa M, Morgan K, Goldszer R, Moore TJ, Spalvins A. Kinetic abnormalities of the red blood cell sodium-proton exchange in hypertensive patients. Hypertension 1991; 17 (3): 340-8. [ Links ]
62. Siffert W, Rosskopf D, Siffert G, et al. Association of a human G-protein beta3 subunit variant with hypertension. Nat Genet 1998; 18 (1): 45-8. [ Links ]
63. Clark AG. Inference of haplotypes from PCR-amplified samples of diploid populations. Mol Biol Evol 1990; 7 (2): 111-22. [ Links ]
64. Scheineider S, Roessli D, Excoffieer L. A software for population genetics data analysis. In. 2.000 ed. Geneve: Genetics and Biometry Laboratory. University of Geneve; 2000. [ Links ]
65. Stephens M, Smith NJ, Donnelly P. A new statistical method for haplotype reconstruction from population data. Am J Hum Genet 2001; 68 (4): 978-89. [ Links ]
66. Sowers JR, Frohlich ED. Insulin and insulin resistance: impact on blood pressure and cardiovascular disease. Med Clin North Am 2004; 88 (1): 63-82. [ Links ]
67. Hall RA, Premont RT, Lefkowitz RJ. Heptahelical receptor signaling: beyond the G protein paradigm. J Cell Biol 1999; 145 (5): 927-32. [ Links ]
68. Emorine LJ, Marullo S, Delavier-Klutchko C, Kaveri SV, Durieu-Trautmann O, Strosberg AD. Structure of the gene for human beta 2-adrenergic receptor: expression and promoter characterization. Proc Natl Acad Sci U S A 1987; 84 (20): 6995-9. [ Links ]
69. Rohrer DK, Chruscinski A, Schauble EH, Bernstein D, Kobilka BK. Cardiovascular and metabolic alterations in mice lacking both beta1- and beta2-adrenergic receptors. J Biol Chem 1999; 274 (24): 16701-8. [ Links ]
70. Vincent J, Blaschke TF, Hoffman BB. Desensitization of beta-adrenoceptor- and prostaglandin E1 receptor-mediated human vascular smooth muscle relaxation. J Cardiovasc Pharmacol 1992; 19 (3): 447-52. [ Links ]
71. Leineweber K, Heinroth-Hoffmann I, Ponicke K, Abraham G, Osten B, Brodde OE. Cardiac beta-adrenoceptor desensitization due to increased beta-adrenoceptor kinase activity in chronic uremia. J Am Soc Nephrol 2002; 13 (1): 117-24. [ Links ]
72. Green SA, Turki J, Innis M, Liggett SB. Amino-terminal polymorphisms of the human beta 2-adrenergic receptor impart distinct agonist-promoted regulatory properties. Biochemistry 1994; 33 (32): 9414-9. [ Links ]
73. Scott MG, Swan C, Wheatley AP, Hall IP. Identification of novel polymorphisms within the promoter region of the human beta2 adrenergic receptor gene. Br J Pharmacol 1999; 126 (4): 841-4. [ Links ]
74. Lang CC, Stein CM, Brown RM, et al. Attenuation of isoproterenol-mediated vasodilatation in blacks. N Engl J Med 1995; 333 (3): 155-60. [ Links ]
75. Hoit BD, Suresh DP, Craft L, Walsh RA, Liggett SB. beta2-adrenergic receptor polymorphisms at amino acid 16 differentially influence agonist-stimulated blood pressure and peripheral blood flow in normal individuals. Am Heart J 2000; 139 (3): 537-42. [ Links ]
76. Drysdale CM, McGraw DW, Stack CB, et al. Complex promoter and coding region beta 2-adrenergic receptor haplotypes alter receptor expression and predict in vivo responsiveness. Proc Natl Acad Sci U S A 2000; 97 (19): 10483-8. [ Links ]
77. Pereira AC, Floriano MS, Mota GF, et al. Beta2 adrenoceptor functional gene variants, obesity, and blood pressure level interactions in the general population. Hypertension 2003; 42 (4): 685-92. [ Links ]
78. Rupert JL, Monsalve MV, Devine DV, Hochachka PW. Beta2-adrenergic receptor allele frequencies in the Quechua, a high altitude native population. Ann Hum Genet 2000; 64 (Pt 2): 135-43. [ Links ]
79. Johnson GC, Esposito L, Barratt BJ, et al. Haplotype tagging for the identification of common disease genes. Nat Genet 2001; 29 (2): 233-7. [ Links ]
80. Stephens JC, Schneider JA, Tanguay DA, et al. Haplotype variation and linkage disequilibrium in 313 human genes. Science 2001; 293 (5529): 489-93. [ Links ]














