Introducción
La microbiota de la cavidad oral de un individuo sano está conformada por microorganismos que colonizan constantemente los diferentes microambientes que allí se presentan. Dichos microorganismos, al mantener un equilibrio con el entorno, tienen unas funciones específicas y esenciales para el bienestar de la salud oral, pero que, al momento de presentarse un desequilibrio, por cambios de hábitos, por ejemplo, generarán una disbiosis que puede conllevar al desarrollo de enfermedades orales. Por diferentes causas, que van desde técnicas de higiene bucal como el cepillado o el uso de seda dental, hasta procedimientos odontológicos como endodoncias, extracción de piezas dentarias o cirugías periodontales, las bacterias presentes en la cavidad oral pueden acceder al torrente sanguíneo produciendo bacteriemia1.
La bacteriemia se define como la presencia de bacterias en el torrente sanguíneo. Puede ser transitoria y no causar secuelas, o tener consecuencias metastásicas y sistémicas. Este fenómeno puede producirse espontáneamente por la infección de determinados tejidos, por el uso de sondas gastrointestinales o catéteres venosos, a través de la curación de una herida, durante el cepillado dental y después de procedimientos odontológicos invasivos. La bacteriemia transitoria suele ser asintomática, aunque pueden presentarse cuadros febriles. Diferentes estudios demuestran que este fenómeno ocurre con alta frecuencia después de procedimientos odontológicos, como el raspaje y alisado radicular en personas con periodontitis crónica, en los cuales cerca del 77% de los individuos sometidos a estos procedimientos han presentado niveles significativos de bacterias orales en sangre, viéndose aumentado el riesgo cuando el individuo tiene afecciones en el componente oral2.
La bacteriemia también puede ser un factor de riesgo importante para el desarrollo de complicaciones cardiovasculares, como endocarditis infecciosa, la cual es producida por la colonización y proliferación de agentes infecciosos en la superficie endotelial del corazón. Además, se pueden afectar válvulas cardíacas o vasos sanguíneos, produciendo daños a los músculos cardíacos, limitando así la capacidad de este para bombear sangre de manera eficiente o causando fugas graves de sangre a través de las válvulas dañadas. La endocarditis infecciosa también puede desarrollarse en dispositivos implantados en el corazón, como válvulas cardíacas artificiales, marcapasos o desfibriladores implantables3.
Eusse et al.4 realizaron un estudio entre los años 2003 y 2010 en el departamento de cirugía cardiovascular de la Clínica Medellín, Antioquia, en el que se incluyeron todos los pacientes con diagnóstico de endocarditis infecciosa tratados mediante cirugía en dicho hospital. Los resultados de este análisis en 54 pacientes arrojaron que el 77.7% de ellos presentaban al menos un factor de riesgo identificado para desarrollar endocarditis infecciosa donde la insuficiencia aórtica, la insuficiencia mitral y las prótesis valvulares fueron los principales factores detectados para el desarrollo de la enfermedad. En reportes de casos se ha asociado con procedimientos odontológicos invasivos de tipo quirúrgico y extracción dental5,6. No obstante, los factores asociados a procedimientos orales no están claramente estudiados, por lo que el objetivo de este estudio fue determinar la prevalencia de endocarditis infecciosa a partir de procedimientos odontológicos.
Materiales y métodos
Se realizó un estudio descriptivo de tipo retrospectivo cuantitativo teniendo como fuente de información secundaria las historias clínicas de los pacientes atendidos en el Hospital San Vicente Fundación entre 2014 y 2019 (Medellín, Colombia). El protocolo de estudio fue revisado y aprobado (39-2019) por el comité de ética para investigaciones en seres humanos de la facultad de Odontología de la Universidad de Antioquia de acuerdo con las normas éticas de la declaración de Helsinki de 1975 (revisada en 2013) y la Resolución 8430 de 1993 para estudios en humanos.
La población de estudio fue definida como todas las historias médicas registradas entre 2014 y 2019. Se realizó un muestreo no probabilístico para identificar las historias clínicas que cumplieran los siguientes criterios de selección: sujeto ≥ 18 años y que reportara en la historia médica diagnóstico de endocarditis infecciosa código CIE 10 (Clasificación Internacional de Enfermedades) que corresponden a esta condición (I330 endocarditis aguda o subaguda; I339 endocarditis aguda infecciosa ―bacteriana― no-especificada). Se excluyeron pacientes menores de edad, cuya historia médica no reportara claramente diagnóstico de endocarditis infecciosa o que presentaran otras complicaciones cardiovasculares y no especificadas.
Una vez identificados los pacientes que tuvieron endocarditis infecciosa, se procedió a recopilar las siguientes variables a partir de la información de la historia clínica: identificación general, sexo, edad, estrato socioeconómico, reporte de procedimiento odontológico (Sí/No), tipo de procedimiento odontológico (exodoncia/cirugía bucal/endodoncia), endocarditis infecciosa no-especificada (sí/no), reporte de procedimiento médico-quirúrgico (sí/no). Adicionalmente se recopiló información sobre el tipo de procedimiento no-odontológico o condición médica que fuera reportado en la historia clínica.
Los datos fueron compilados en hoja de cálculo para su procesamiento en software estadístico (SPSS ver. 25). Las variables continuas (edad) se presentan como el promedio e intervalo de confianza (IC 95%). Las variables categóricas se presentan como frecuencias absolutas y relativas.
Resultados
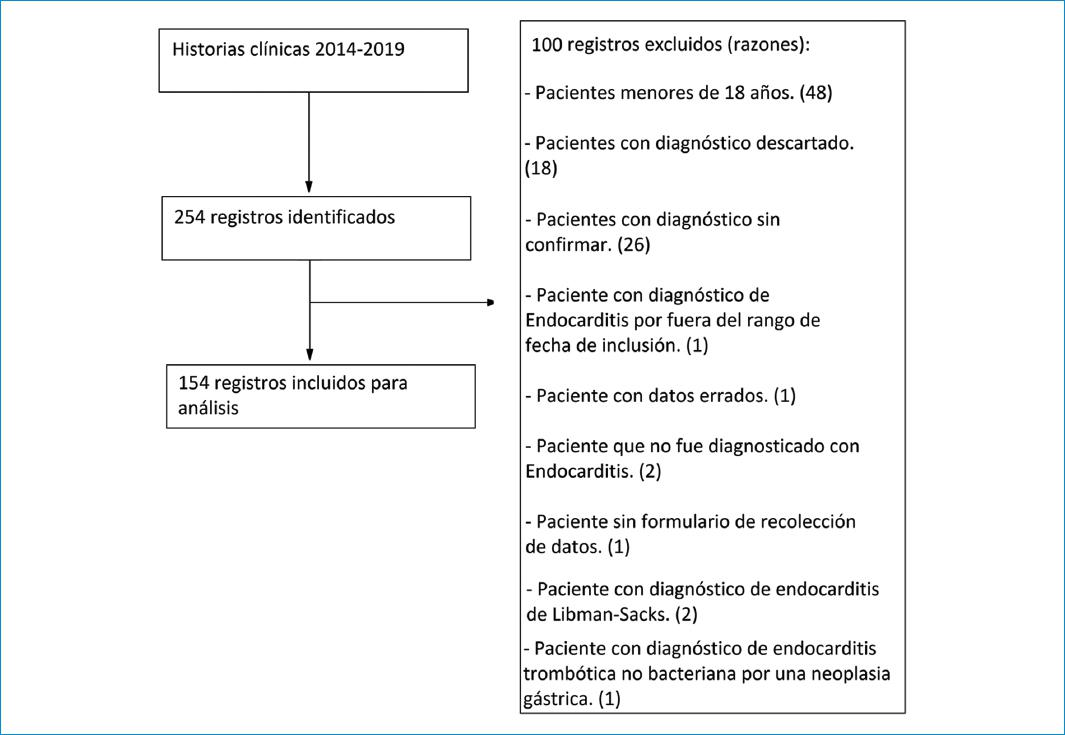
La figura 1 muestra el flujograma de inclusión y exclusión de registros médicos. En total se identificaron 254 registros de casos de endocarditis infecciosa, de los cuales fueron excluidos 100 por no cumplir con los criterios de inclusión. Por lo tanto, se analizaron 154 registros médicos.
La muestra de estudio estuvo conformada por 94 hombres (61 %) y 60 mujeres (39 %) con un promedio de edad de 58.8 años (Fig. 2).
Las variables médicas y causas reportadas relacionadas con endocarditis infecciosa se describen en las tablas 1 y 2. Casi una tercera parte de los casos presentó diabetes y cerca del 50% presentó procedimiento de diálisis reportado. Un muy bajo porcentaje (7.2%) de los pacientes tuvieron marcapasos y en ningún caso hubo profilaxis antibiótica previa a la hospitalización (Tabla 1). La causa relacionada con endocarditis infecciosa más comúnmente reportada fue el procedimiento de cateterismo para hemodiálisis (37%) seguido de bacteriemia no especificada (22%) y condición cardiovascular asociada a válvulas cardíacas y marcapasos (18.8%). En el 15.6% de los casos se reportó como endocarditis infecciosa no-especificada (CIE10 I339). De los 154 casos de endocarditis infecciosa registrados, solo en 1 caso (0.7%) se reportó un procedimiento odontológico del tipo endodoncia previo a la hospitalización.
Tabla 1 Variables médicas reportadas en casos de endocarditis infecciosa
| Variable | n | % |
|---|---|---|
| Diabetes | ||
| Si | 41 | 26.7 |
| No | 113 | 73.3 |
| Diálisis | ||
| Si | 73 | 47.5 |
| No | 81 | 52.5 |
| Marcapasos | ||
| Si | 11 | 7.2 |
| No | 143 | 92.8 |
| Profilaxis antibiótica previa al procedimiento médico/odontológico | ||
| Si | 0 | 0 |
| No | 154 | 100 |
Tabla 2 Causas médicas relacionadas con endocarditis infecciosa
| Causas | n | % |
|---|---|---|
| Catéter (hemodiálisis) | 57 | 37 |
| Bacteriemia no especificada | 34 | 22 |
| Cardiovascular (válvula/marcapasos) | 29 | 18.8 |
| Endocarditis infecciosa no-especificada (CIE10 I339 ) | 24 | 15.6 |
| Absceso (cerebral/hígado) | 4 | 2.6 |
| Problema pulmonar (neumonía) | 3 | 2 |
| Posparto | 2 | 1.3 |
| Absceso dental (endodoncia) | 1 | 0.7 |
| Total | 154 | 100 |
En algunos casos se pudo evidenciar reporte microbiológico de hemocultivo en la historia médica (Tabla 3). El microorganismo detectado más frecuentemente en los casos de endocarditis infecciosa fue el Staphylococcus aureus (43.3%), seguido del Staphylococcus epidermidis (10%), el Streptococcus mitis (5%), el Enterococcus faecalis (5%) y la Escherichia coli (5%).
Tabla 3 Microorganismos reportados a partir de cultivo microbiológico en casos de endocarditis infecciosa
| Microorganismo | Frecuencias (n = 60) | |
|---|---|---|
| n | % | |
| Staphylococcus aureus MR | 26 | 43.33 |
| Staphylococcus epidermidis | 6 | 10.00 |
| Staphylococcus lugdunensis MR | 2 | 3.33 |
| Staphylococcus caprae MR | 2 | 3.33 |
| Staphylococcus haemolyticus | 1 | 1.67 |
| Staphylococcus hominis | 1 | 1.67 |
| Streptococcus mitis | 3 | 5.00 |
| Streptococcus dysgalactiae | 2 | 3.33 |
| Streptococcus pluranimalium | 1 | 1.67 |
| Streptococcus gallolyticus | 1 | 1.67 |
| Streptococcus viridans | 1 | 1.67 |
| Streptococcus mutans | 1 | 1.67 |
| Streptococcus gordonii | 1 | 1.67 |
| Streptococcus pneumoniae | 1 | 1.67 |
| Klebsiella oxytoca | 1 | 1.67 |
| Arcanobacterium haemolyticum | 1 | 1.67 |
| Enterococcus faecalis | 3 | 5.00 |
| Escherichia coli | 3 | 5.00 |
| Haemophilus parainfluenzae | 2 | 3.33 |
| Cocos gram+ | 1 | 1.67 |
MR: multirresistente.
Discusión
Este estudio presenta datos objetivos sobre la frecuencia de endocarditis infecciosa relacionada con procedimientos odontológicos previos. Con una frecuencia de 0.7% durante el periodo de estudio de 5 años, tiene una prevalencia muy baja en comparación con procedimientos médicos-quirúrgicos de riesgo para endocarditis (> 60%). Vale la pena resaltar que el caso de endocarditis infecciosa relacionado con procedimiento odontológico se dio en un paciente masculino de 57 años que presentó un absceso dental y al cual le realizaron tratamiento endodóncico sin profilaxis antibiótica. A partir de la información registrada en la historia clínica no fue posible determinar si el paciente presentaba factores de riesgo que indicaran la necesidad de profilaxis antibiótica. Si bien los estudios muestran que no todas las infecciones orales requieren de antibioticoterapia, depende de las características clínicas específicas de la infección y de los factores de riesgo asociados, que aumente la posibilidad de contraer endocarditis infecciosa7,8. La Asociación Americana del Corazón recomienda la profilaxis antibiótica sólo en casos clasificados como alto riesgo9. No obstante, un estudio reportó que las inconsistencias en la prescripción de profilaxis antibiótica son frecuentes en procedimientos odontológicos en pacientes de alto riesgo10. Por lo tanto, una adecuada historia clínica y el análisis de factores de riesgo son el fundamento para determinar, de manera objetiva, el uso de antibióticos como profilaxis o terapia en procedimientos odontológicos.
Por su parte, procedimientos médico-quirúrgicos, como el cateterismo, fueron la causa más común de endocarditis infecciosa. Estudios clínicos concuerdan con estos resultados, demostrando que dispositivos médicos implantables ya sea permanentes (marcapasos) o transitorios (catéter, ventiladores), están relacionados con bacteriemia persistente y riesgo de endocarditis infecciosa11. Seguido en importancia estuvo la bacteriemia no específica y el antecedente de válvulas cardíacas y marcapasos. Puede ocurrir bacteriemia en cualquier caso donde haya pérdida de la continuidad de las mucosas (orofaríngea, genitourinaria, gastrointestinal, respiratoria) y piel, e incluso, de forma espontánea durante la masticación en pacientes con periodontitis12. Por lo tanto, las bacterias que ingresan al torrente sanguíneo de forma inadvertida pueden llegar a colonizar válvulas cardíacas y dispositivos médicos implantables, siendo esta una causa común de endocarditis infecciosa13.
En este estudio se excluyeron dos casos de endocarditis de Libman-Sacks ya que no representan casos de endocarditis infecciosa. La endocarditis de Libman-Sacks es una complicación del lupus eritematoso sistémico que se caracteriza por vegetaciones estériles en las válvulas cardíacas. El tratamiento es inmunosupresor y no está relacionado con bacteriemia14,15. Este registro fue importante porque puede semejar casos de endocarditis infecciosa.
Se pudo evidenciar la presencia de tres géneros importantes de bacterias asociadas a endocarditis infecciosa en los pacientes de nuestro estudio. En general, estas bacterias forman parte de la microbiota normal de la piel, las mucosas y el tracto respiratorio superior en los seres humanos, que logran tener acceso al torrente sanguíneo por enfermedad o más comúnmente por algún procedimiento médico invasivo, como el cateterismo. Uno de estos corresponde al género Haemophilus del grupo HACEK (Haemophilus, Aggregatibacter, Cardiobacterium, Eikenella, Kingella), causantes del 1 al 3% de todas las endocarditis infecciosas. Estas bacterias afectan principalmente a pacientes con cardiopatía subyacente o válvulas protésicas16. El segundo grupo estuvo conformado por estafilococos, específicamente el S. aureus, que es en la actualidad el principal agente infeccioso causante de endocarditis infecciosa en el mundo y que tuvo una prevalencia alta en nuestro estudio. Dicho crecimiento se ha dado por la característica multirresistente a tratamientos antibióticos que presenta y debido al incremento de procedimientos intravasculares, dispositivos intracardiacos y susceptibilidad subyacente del hospedero17. El tercer grupo corresponde a estreptococos, siendo los más prevalentes S. gallolyticus (antes S. bovis), S mitis/oralis, S. sanguinis, S. gordonii y S. mutans18. En Latinoamérica, el 39% de los casos de endocarditis infecciosa es ocasionado por estreptococos, mientras que el 17% se da por la presencia de S. aureus19. Sin embargo, como se expresó previamente, vale la pena resaltar que estos microorganismos hacen parte de la microbiota normal de la boca, el tracto respiratorio y la piel, pero cuando tienen acceso al torrente sanguíneo, se convierten en patógenos importantes para el desarrollo de endocarditis infecciosa. Por lo tanto, en todos los procedimientos médico-quirúrgicos y dentales invasivos, se deben tomar todas las medidas de control de infección local (asepsia del área) y en casos identificados como susceptibles, aplicar profilaxis antibiótica.
Por último, aunque la frecuencia de endocarditis infecciosa por procedimientos odontológicos fue muy baja, esto no le resta importancia a la conexión que hay entre procedimientos odontológicos invasivos con bacteriemia y una eventual endocarditis infecciosa. Por lo tanto, es de gran relevancia la anamnesis minuciosa en el paciente odontológico y la identificación de factores de riesgo para endocarditis infecciosa y así poder tomar las precauciones adecuadas con criterio clínico, ya que, según una revisión sistemática reciente20, todavía no es claro si la profilaxis antibiótica es efectiva para disminuir su incidencia. Así mismo, será de gran importancia a futuro el seguimiento y registro minucioso de los casos identificados para poder tener estadísticas más robustas que permitan determinar los factores de riesgo asociados a procedimientos odontológicos y, de esta forma, crear guías de atención clínica basadas en la evidencia.