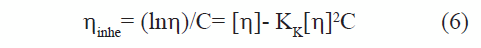Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Ingeniería Universidad de Antioquia
Print version ISSN 0120-6230On-line version ISSN 2422-2844
Rev.fac.ing.univ. Antioquia no.53 Medellín July/Sept. 2010
Medidas de la rigidez del quitosano en solución a través de la viscosidad intrínseca
Stiffness of chitosan in solution through intrinsic viscosity measurements
Carmiña Gartner , Betty Lucy López
Grupo de Ciencia de los Materiales, Universidad de Antioquia. Sede de Investigación Universitaria, SIU. Calle 62 N°. 52-59, Torre 1 Laboratorio 310
Resumen
El quitosano es el derivado parcialmente deacetilado de la quitina. El conocimiento del comportamiento del quitosano como polielectrolito en solución es muy importante, puesto que la mayoría de sus aplicaciones se basan en sus soluciones acuosas. En este trabajo se estudian parámetros hidrodinámicos para muestras de quitosano con diferente grado de acetilación (DA) y peso molecular que permiten entender el comportamiento de las soluciones a diferentes concentraciones y fuerzas iónicas (I). Con este fin un quitosano con peso molecular de 226 kD y 30% DA se depolimerizó y deacetiló para obtener diferentes DA y pesos moleculares. Por reometría rotacional se determinaron viscosidades relativas para calcular las concentraciones de superposición de cadenas (C*) y de enmarañamiento (Ce), y establecer así el rango de concentraciones entre los regímenes diluido y concentrado. A cada muestra se le determinó la viscosidad intrínseca ([η]) en solución de ácido acético 0,3 M, con varios niveles de fuerza iónica. Estos valores se usaron para calcular el factor de tolerancia a la sal (S) y el parámetro de rigidez (B). A partir de las medidas de [η] se calculó también el factor a de la ecuación de Mark-Howink-Kuhn-Sakurada, y parámetros estadísticos como la longitud de persistencia, longitud de Kuhn, y radio de giro, que permiten aproximarse a la conformación de la cadena y su rigidez. Se encontró que variaciones en DA no generan transiciones conformacionales notorias, mientras que el cambio en el peso molecular altera drásticamente la flexibilidad de la cadena. Los parámetros encontrados ayudarán a optimizar la preparación de membranas biocompatibles.
Palabras clave: Quitosano, rigidez, conformación de la cadena, viscosidad intrínseca, reología
Abstract
Chitosan is the partially deacetylated derivative from chitin. It is very significant to understand the behavior of chitosan as a polyelectrolyte, since most of chitosan final applications are related with its aqueous solutions. In this research, hydrodynamic parameters are studied for samples of chitosan with different degree of acetylation (DA) and molecular weight, to gain insight into the behavior of this polymer at different concentrations and ionic strengths (I). To achieve this, chitosan with an initial molecular weight of 226 kD and 30% DA, was depolymerized and deacetylated to obtain different molecular weights and DA. Relative viscosities were measured by rotational rheometry to caculate the overlap concentration (C*) and the entanglement concentration (Ce). These two concentrations allowed us to establish the dilute and concentrated solution regimes. Intrinsic viscosity ([η]) was measured for each sample in acetic acid 0,3 M solution using four levels of I. These measurements were used to calculate the salt tolerance factor (S) and the stiffness parameter (B). [η] measurements were also used to estimate Mark-Howink-Kuhn-Sakurada a factor, and statistical parameters such as the persistence length, the Kuhn length and the radius of gyration. These results provide an approximation to the conformation and stiffness of chitosan chains. It was found that variations in DA do not cause conformational changes, but modifications of molecular weight can dramatically transform the stiffness of the chain. These results will be used for optimizing the preparation of biocompatible membranes.
Keywords:Chitosan, stiffness, chain conformation, intrinsic viscosity, rheology
Introducción
El polisacárido quitosano es un copolímero compuesto de unidades repetitivas de N-acetyl - D-glucosamina y D-glucosamina obtenido por deacetilación parcial del biopolímero quitina. El quitosano posee propiedades como bioactividad, biocompatibilidad y biodegradabilidad, que posibilitan sus múltiples aplicaciones principalmente en el área biomédica y en la industria alimenticia. El grado de acetilación (DA), definido como el porcentaje de grupos acetilo en el copolímero y el peso molecular del quitosano son los principales parámetros que describen sus características físicas y químicas y definen en gran parte sus aplicaciones. Es importante además entender el comportamiento del quitosano en solución y su reología puesto que películas, membranas, fibras e hidrogeles se preparan a partir de las soluciones de este polisacárido [1-3].
Las soluciones de quitosano en medio acuoso ácido presentan el comportamiento de polielectrolitos catiónicos, debido a la protonación de los grupos amino [4]. Los polisacáridos en solución presentan una dinámica sensitiva a los tamaños de las cadenas, sus formas y número de cargas, las cuales dependen de la concentración del polímero. La hidrodinámica se refiere a las propiedades de soluciones diluidas mientras que la reología está asociada con soluciones altamente concentradas [5]. La transición entre un comportamiento diluido y uno semi-diluido está representado por un parámetro de concentración denominado C*, o concentración de traslape, porque a esta concentración los dominios moleculares se consideran ínterpenetrados. La transición entre un régimen semi-diluido a un régimen concentrado se denomina Ce, o concentración de enmarañamiento que representa la concentración por encima de la cual las cadenas del polímero están enmarañadas y las dimensiones de las cadenas son independientes de la concentración del polímero [6,7].
La fuerza iónica puede influenciar drásticamente los parámetros hidrodinámicos de los polisacáridos, por ejemplo la viscosidad intrínseca ([η]), y a su vez posibilita encontrar información sobre la flexibilidad de la cadena. En general el aumento de la fuerza iónica aumenta la flexibilidad y reduce la viscosidad [8]. La fuerza iónica tiene dos efectos importantes en las propiedades de las soluciones de polisacáridos. La primera es suprimir la no idealidad del sistema polielectrolítico por apantallamiento de las cargas. La segunda es causar un cambio conformational en el polisacárido [9, 10].
Existen varias aproximaciones para calcular las concentraciones que determinan la transición entre los regimenes diluido y concentrado. Se considera que para una solución semi-diluida libre de sal, la viscosidad es proporcional a la raíz cuadrada de la concentración del polímero, o ley de Fouss, (η~C½). Para predecir las concentraciones de traslape y de enmarañamiento, el criterio utilizado por Dobrynin está relacionado con la viscosidad relativa, h, en la siguiente forma: C* se alcanza cuando η =2 ηs y Ce cuando η=50ηs donde ηs es la viscosidad del solvente [7]. Por su parte para Desbrieres, C* es la concentración donde la pendiente de la curva de viscosidad específica contra concentración se desvía de uno en la expresión de Huggins y Ce es la concentración en la cual inicia el dominio terminal lineal en esta misma expresión [11]. Para Carreau, C* es el inverso de la viscosidad intrínseca [10, 12].
La viscosidad intrínseca es una medida del volumen hidrodinámico que ocupan las macromoléculas en solución y por tanto un reflejo de su tamaño; [η] es altamente dependiente de la concentración del polímero en solución, (C) (ecuación 1) [11, 13]. Experimentalmente [η] se obtiene a partir de mediciones de viscosidad relativa de soluciones con diferentes concentraciones de polímero. Las medidas se realizan en un viscosímetro capilar que puede ser del tipo Ubbelohde, Ostwald o Cannon-Fenske, a una temperatura determinada, basándose en la ley de Poiseuille y asumiendo un comportamiento newtoniano para bajas concentraciones y bajas fuerzas de cizalla. El valor de [η] se obtiene al extrapolar η a concentración cero mediante diferentes aproximaciones: Huggins, Kraemer, Martin, Schulz - Blaschke y Solomon - Ciuta [14].
El peso molecular se puede obtener a partir de medidas de [η] por medio de la relación de Mark- Houwink-Kuhn-Sakurada (MHKS), ecuación 2:
Donde Mv es el peso viscosidad promedio. Los valores de a y K en MHKS, son parámetros empíricos válidos sólo para un conjunto establecido de solvente-polímero y a una temperatura específica. El exponente a permite estimar la flexibilidad de una macromolécula y su conformación en solución haciendo uso del triángulo de Haug [14, 15]. Este triángulo describe los tres niveles de conformaciones macromoleculares: esfera compacta, tubo rígido y enrollamiento al azar, representados en cada uno de los vértices, los cuales dependen del valor de a, (figura 1).
El valor de a es análogo a los exponentes de las expresiones usadas para el cálculo del radio de giro o del coeficiente de difusión, medidos por dispersión de luz dinámica, DLS o ultracentrifugación [16]. En general, entre más cargas tiene el polisacárido su conformación es más cercana a un tubo rígido. Mientras que polisacáridos no cargados se comportan más como enrollamientos al azar [17].
Otra aproximación importante en el estudio de la conformación de un polímero es el parámetro empírico B, propuesto por Smidsrod y Haug, como una medida práctica de la rigidez relativa de polielectrolitos en solución, a partir de medidas de [η] a diferentes fuerzas iónicas [17]. Su ventaja es el no requerir medidas de pesos moleculares por otras técnicas. Bajos valores de B indican rigidez, mientras que altos valores indican flexibilidad.
Figura 1Triángulo de Haug [14,17]
La conformación en solución de muchos polisacáridos también se puede describir en términos de varios parámetros estadísticos, tales como la longitud de persistencia (lp), el radio de giro <Rg> y la longitud estadística de Kuhn (b). La longitud de persistencia indica la distancia en la cual la cadena puede ser considerada como rígida, y se considera igual a b/2 para polímeros semiflexibles, siendo b la longitud de Kuhn [12]. El radio de giro está definido como el cuadrado medio de la distancia final- final de una cadena y su cálculo puede derivarse de medidas de [η] y pesos moleculares, como se define en la ecuación 3 [10, 14].
Siendo Φ una constante universal igual a 2,1 x10-3 mol-1 (función de la forma de distribución espacial de las unidades moleculares) y Mn el peso molecular número promedio. El valor de <Rg> se usa para el cálculo de la longitud de Kuhn.
La aproximación para el cálculo de b considera la cadena dividida en n segmentos de Kuhn, de manera que cada segmento puede considerarse como si fuera libremente unido con el próximo; así entre mayor la longitud de un segmento, mayor es la rigidez del polímero. La ecuación 4 permite determinar el valor de b, siendo DP el grado de polimerización y l la longitud por unidad de monómero.
En este estudio se determinó la variación de la viscosidad intrínseca en soluciones de quitosano variando la fuerza iónica y la concentración del polímero, evaluando el efecto del cambio en DA y en peso molecular. Adicionalmente se definió el rango de concentraciones entre el régimen diluido y el concentrado. Estas medidas se realizaron con el fin de calcular la rigidez y la conformación del polímero en solución por medio de parámetros hidrodinámicos tanto empíricos como estadísticos. Si bien se investiga mucho sobre el tema, no existen resultados definitivos y el estudio molecular de los polisacáridos sigue siendo impredecible. Los parámetros calculados permitirán optimizar la preparación de membranas biocompatibles.
Experimentación
Reactivos
Se utilizó un quitosano comercial Sigma-Aldrich que fue caracterizado por medidas de peso molecular y grado de acetilación, obteniéndose valores de 226 kD y 30 % DA respectivamente. Todos los reactivos necesarios fueron de grado analítico.
Preparación de las muestras
Las muestras con diferente DA se obtuvieron por tratamiento del quitosano con NaOH 10 M a 110°C por diferentes tiempos. El DA fue cuantificado por titulación potenciométrica según método de Jiang [18], y por resonancia magnética nuclear de carbono usando polarización cruzada (13CNMR CPMAS), por medio de la relación entre la intensidad del grupo metilo y la suma de las intensidades de los carbonos del anillo.
Las muestras con diferentes pesos moleculares se obtuvieron por depolimerización del quitosano con diferentes cantidades de NaNO2, siguiendo el método establecido por Allan y Peyron [19, 20]. La reacción se detuvo con NaOH/metanol y el producto obtenido fue lavado y purificado. Los pesos moleculares se determinaron por cromatografía de exclusión de tamaño, (SEC).
Caracterización
Medidas por SEC
Se utilizó un cromatógrafo Waters con detector de índice de refracción. La columna y guarda columna utilizadas fueron TSK Gel G6000PW de Tosoh Biosciences. La curva de calibración se realizó con estándares de pullulán. Las condiciones utilizadas fueron: flujo 0,4 mL/min, temperatura del detector 30°C, y un buffer de ácido acético/ acetato de sodio de pH 4,5 y fuerza iónica 0,1M, como fase móvil [21].
Medidas de [η]
Las medidas de viscosidad se realizaron en un viscosímetro capilar tipo Ostwald de 4,34 mm de diámetro, a una temperatura de 25±0,1°C, usando como solvente ácido acético 0,3 M. Se usaron acetato de sodio y cloruro de sodio para controlar la fuerza iónica. El rango de concentraciones para obtener la mejor linealidad, estimado experimentalmente, varió entre 0,1 y 0,95 g/100 mL. El grado de protonación se calculó de la estequiometría según modelo de Rinaudo, con el fin de asegurar completa solubilidad del quitosano a la concentración de ácido utilizada [4].
Medidas por reometría rotacional
Se utilizó un reómetro Bohlin Gemini HR nano Malvern Rotonetic drive 2, con control de temperatura Peltier a 25°C. Se utilizó una geometria: Plato-Plato 40. Los rangos de concentración de quitosano variaron desde 0,5 a 3,75 g/100mL y se usó como solvente ácido acético 0,3M y diferentes fuerzas iónicas.
Determinación del parámetro de rigidez B
Se determinó el factor de rigidez para las muestras de diferente grado de acetilación y para las muestras con distinto peso molecular, siguiendo los lineamientos de Smidsred y Haug [17].
Resultados y Discusión
Medidas en el régimen concentrado
Para establecer el rango entre los regímenes diluido y concentrado y para el cálculo de Ce y C*, se realizaron curvas de viscosidad contra velocidad de cizalla (γ) a diferentes concentraciones de quitosano, variando entre 0,5 y 3,75 g/100mL. Se observó un comportamiento pseudoplástico para todas las soluciones y un rango newtoniano a bajas γ. La curva obtenida de viscosidad relativa contra concentración, η vs C, medida a una velocidad de cizalla de 173 s-1, se ajustó a un comportamiento exponencial según la siguiente ecuación: η = 0,0019e3,7819C.
De las múltiples aproximaciones existentes para el cálculo de Ce, se utilizaron las de Carreau y Dobrynin, y para el cálculo de C* la de Dobrynin. Usando la aproximación de Dobrynin se obtuvieron los valores de C*= 0,21 g/100mL y Ce = 1,06 g/100mL y a partir de la aproximación de Carreau se obtuvo un valor de C* = 0,12 g/100mL. La diferencia entre los valores obtenidos para C* puede explicarse como debida a los diferentes métodos de obtención de las viscosidades relativas. En el cálculo de η a partir de medidas por viscosimetría capilar, la velocidad de cizalla es muy baja y variable aunque bien puede asumirse un comportamiento newtoniano. Para el caso de η a partir de reometría rotacional se tomó un valor de rata de cizalla constante, mucho mayor que el que se predice para un viscosímetro capilar.
Médidas de viscosidad intrínseca
La viscosidad se midió para cada una de las muestras en el régimen diluido, con el fin de observar el comportamiento a diferentes fuerzas iónicas. Las curvas de viscosidad en función de la concentración de polímero, presentaron el comportamiento lineal esperado al graficar la viscosidad reducida (ηred) y la viscosidad inherente (ηinhe) contra la concentración, según las ecuaciones 5 y 6.
Ecuación de Huggins:
Ecuación de Kraemer:
Donde η es la viscosidad relativa y KH y KK son las constantes de Huggins y Kraemer respectivamente. La viscosidad intrínseca se calculó a partir de la extrapolación a concentración cero en las dos expresiones. La diferencia entre las dos constantes no fue mayor de 0,5, lo cual está de acuerdo con lo predicho por el modelo. La figura 2 ejemplifica las curvas obtenidas para tres niveles de fuerza iónica (I) de una de las muestras depolimerizadas. Todas las muestras estudiadas mostraron un comportamiento similar.
Figura 2 Viscosidad contra concentración a varias fuerzas iónicas para la muestra con peso molecular de 172 kD
Se observó la disminución de la viscosidad con el aumento de I, debido al efecto de apantallamiento de las cargas de los grupos amino, lo que confiere mayor flexibilidad a las cadenas del polímero. Cuando la solución está libre de sal, la viscosidad intrínseca es mucho mayor debido a las repulsiones entre las cadenas cargadas, lo cual incrementa su rigidez. La tabla 1 presenta los resultados obtenidos de las medidas de viscosidad para las muestras analizadas.
Tabla 1 Viscosidad intrínseca promedio ([η]) obtenida para diferentes (I)
Determinación del parámetro de rigidez B
Las viscosidades intrínsecas se graficaron contra el inverso de la raíz cuadrada de la fuerza iónica (I). Se obtuvieron dos líneas rectas: una para las muestras con diferente DA y otra para las muestras con diferente peso molecular. La pendiente S se denomina factor de tolerancia a la sal, expresada por la ecuación 7. La tabla 2 resume los resultados obtenidos.
Tabla 2 Viscosidades intrínsecas extrapoladas a fuerza iónica 0,1 M y el factor de tolerancia a la sal
El cambio en el DA muestra un menor efecto en la tolerancia a la sal pues aunque se observa una disminución de este factor, no es tan drástica como la observada con el cambio en el peso molecular. En la figura 3 se presentan las gráficas de log S en función del log [η]0,1 ([η] extrapolada a un valor de fuerza iónica 0,1 M) para los dos conjuntos de muestras analizadas: diferente DA y un mismo peso molecular, y diferente peso molecular y el mismo DA. Se obtienen rectas de la siguiente forma (ecuación 8):
El valor de B ó parámetro de rigidez fue determinado al extrapolar en la ecuación 8, el logaritmo [η]0,1 a 1 M. Se obtuvo un valor de B de 0,06 para las muestras con DA variable y 0,12 para las muestras con peso molecular variable.
El valor de 0,06 coincide con lo reportado por Smidsred y Haug, [17], para polímeros tipo hialunorato o carboximetil celulosa, que presentan estructuras químicas similares al quitosano, e indican que el polímero es rígido en el rango de acetilación estudiado (entre 30 y 0%), por lo cual se deduce que ni el número de cargas, ni el incremento de la fuerza iónica generan cambios apreciables en la conformación de barra extendida.
Figura 3 Log S en función de log [η] extrapolada a fuerza iónica 0,1 M, para diferentes grados de acetilación y para diferentes pesos moleculares
Existen dos efectos que determinan la conformación del quitosano con relación al DA a un mismo peso molecular; el primero es debido a los voluminosos grupos acetilo que pueden causar impedimento estérico o enlaces de hidrógeno intramoleculares. Esto explica porque el quitosano con el mayor DA (30%) presenta la mayor viscosidad y por ende la conformación más expandida y la mayor rigidez. Sin embargo a bajos grados de acetilación, predomina el segundo efecto causado por repulsión de cargas del polielectrolito, pues se observa que la viscosidad intrínseca es muy alta para el quitosano 0% acetilado. En este caso el efecto repulsivo de las cargas determina que éste exhiba la conformación expandida y por lo tanto muestre alta rigidez. Estos dos efectos combinados determinan que no se presente un cambio apreciable en el factor de tolerancia a la sal, ni en la rigidez del quitosano con la variación del contenido de grupos acetilo, dentro del rango de DA estudiado.
Al cambiar el peso molecular dejando el grado de acetilación constante, se observa que disminuye el grado de rigidez del quitosano, como se concluye del mayor valor obtenido para B (0,12). Se puede concluir que se presenta un cambio conformacional con el cambio en el peso molecular, como es discutido por Signini et al. [13]. La disminución en el peso molecular, manteniendo el grado de acetilación constante, implica que cadenas más pequeñas pueden ser más flexibles. Se observa también que entre más flexible la cadena, más alta la respuesta al factor de tolerancia y por consiguiente el valor de B se incrementa.
Cálculo del exponente a de la ecuación MHKS
Otra forma de aproximarse a la conformación del quitosano en solución es a través del cálculo del exponente a, el cual sólo puede determinarse para muestras de diferentes pesos moleculares. Al graficar el peso molecular en función de [η] en un gráfico bilogarítmico, se ajustó a una línea recta expresada en la ecuación 9:
Se obtuvo un valor para el exponente a igual a 0,84. Según el triángulo de Haug se ubica en un valor intermedio entre enrollamiento aleatorio y tubo rígido. Un mayor valor de a corresponde a una extensión mayor de la cadena. Otros autores han encontrado mayores valores como Cölfen: 1,0 y Rinaudo: 0,90, lo cual puede ser debido a que se analiza un rango más amplio de pesos moleculares. [4,6]. En este caso el efecto electrostático se ve contrarrestado por un menor tamaño de la cadena, lo cual disminuye su rigidez y coincide con el mayor valor encontrado para el parámetro B, que indica la disminución en la rigidez con la disminución del peso molecular.
Cálculo del radio de giro, longitud de Kuhn y longitud de persistencia
Estos parámetros hidrodinámicos definen la rigidez de una macromolécula y pueden ser calculados también a partir de medidas de [η] haciendo uso de las ecuaciones enunciadas anteriormente. En la tabla 3 se resumen los valores calculados. Estos valores están de acuerdo con los encontrados por Mazeau et al., [12], pero son menores que los reportados por Anthonsen et al- [8].
Tabla 3 Valores de radio de giro, longitud de Kuhn y longitud de persistencia
La reducción de la longitud de persistencia en términos de fuerza iónica indica que el quitosano se hace más flexible cuando el potencial repulsivo disminuye y con la disminución del peso molecular, lo que se adujo como un cambio conformacional del polímero, pasando del estado de barra rígida al límite con el enrollamiento aleatorio. Aunque la disminución de la flexibilidad es drástica con una leve adición de sal, la adición posterior de sal y su subsiguiente aumento en la fuerza iónica, no induce cambios notorios, lo que se observa al obtener un valor prácticamente constante de lp.
La conclusión es que el quitosano analizado es semirrígido con una longitud de persistencia de 48 Å, la cual tiende a decrecer con la disminución del tamaño de la cadena y con el aumento de la fuerza iónica. En el primer caso se asume un cambio conformational que tiene como consecuencia la disminución de la rigidez y en el segundo caso la disminución del potencial repulsivo induce a aglomeración de las cadenas. El grado de acetilación no tiene un efecto apreciable en la rigidez del polímero.
Conclusiones
Los resultados de este estudio contribuyen al entendimiento de la rigidez y la conformación del quitosano en solución teniendo en cuenta dos características muy importantes: el contenido de grupos acetilo y el peso molecular. Se observa que el quitosano presenta una mayor rigidez para mayor peso molecular y menor fuerza iónica, y se concluye que tiene mayor influencia en la rigidez de las cadenas la disminución del peso molecular que el cambio en el DA.
El parámetro B permite entender el comportamiento de polisacáridos en solución, prescindiendo de las complejas medidas de pesos moleculares por SEC. B no es muy sensitivo a las diferencias en cargas estequiométricas, pero sí a los cambios en peso molecular. Los dos efectos combinados de impedimento estérico de los grupos acetilo y de repulsión de cargas de los grupos amino protonados, contribuyen a mantener una alta rigidez en la cadena, para altos y bajos grados de acetilación.
El valor del exponente a en MHKS, permitió describir la conformación del quitosano como intermedia entre tubo rígido - enrollamiento aleatorio. Se observó que la cadena se hace más flexible con aumento en la fuerza iónica hasta cierto nivel, por encima del cual no se observan cambios apreciables en la flexibilidad. Esto se deduce de los valores casi constantes de tolerancia a la sal y de longitud de persistencia, cuando se incrementa la fuerza iónica.
Las medidas de viscosidad intrínseca permiten calcular las propiedades hidrodinámicas cuyos valores confluyen al mismo significado, a partir de distintas aproximaciones estudiadas. Se encontró experimentalmente que a pesos moleculares bajos y muy altas fuerzas iónicas se pierde la linealidad en la determinación de la viscosidad intrínseca y la medida se hace menos sensible.
No puede hacerse una comparación precisa con la información de la literatura debido a la diversidad de la distribución de grupos acetilo y pesos moleculares, ni pueden definirse valores exactos de los parámetros hidrodinámicos como lp y b, puesto que la evolución de estos modelos está inmersa en teorías estadísticas que consideran muchas aproximaciones y no son calculados exclusivamente a partir de datos experimentales. La caracterización macromolecular de los polisacáridos todavía permanece como un desafío y se hace aún más impredecible dado que polímeros provenientes de diferentes fuentes presentan diferentes características.
Agradecimientos
Los autores agradecen a Colciencias y a la Universidad de Antioquia por la financiación de este trabajo.
Referencias
1. G. Berth, H. Dautzenberg. "The degree of acetylation of chitosans and its effect on the chain conformation in aqueous solution". Carbohydrate Polymers. Vol. 47. 2002. pp. 39-51. [ Links ]
2. G. Berth, H. Dautzenberg, M. G. Peter. "Physicochemical characterization of chitosans varying in degree of acetylation". Carbohydrate Polymers. Vol. 36. 1998. pp. 205-216. [ Links ]
3. J. Brugnerotto, J. Desbriéres, L. Heux, K. Mazeau, M. Rinaudo. "Overview on structural characterization of chitosan molecules in relation with their behavior in solution". Macromolecular Symposia. Vol. 168. 2001. pp. 1-20. [ Links ]
4. M. Rinaudo, G. Pavlov, J. Desbriéres. "Influence of acetic acid concentration on the solubilization of chitosan". Polymer. Vol. 40. 1999. pp. 7029-7032. [ Links ]
5. S. Harding. "On the hydrodynamic analysis of macromolecular conformation". Biophysical Chemistry. Vol. 55. 1995. pp. 69-93. [ Links ]
6. H. Colfen, G. Berth, H. Dautzenberg. "Hydrodynamic studies on chitosans in aqueous solution". Carbohydrate Polymers. Vol. 45. 2001. pp. 373-383. [ Links ]
7. A. V. Dobrynin, R. H. Colby, M. Rubinstein. "Scaling Theory ofPolyelectrolyte Solutions". Macromolecules. Vol. 28. 1995. pp. 1859-1871. [ Links ]
8. M. W. Anthonsen, K. M. Vârum, O. Smidsrad. "Solution properties of chitosans: conformation and chain stiffness of chitosans with different degrees of N-acetylation". Carbohydrate Polymers. Vol. 22. 1993. pp. 193-201. [ Links ]
9. T. Odijk. "On the ionic-strength dependence of the intrinsic viscosity of DNA". Biopolymers. Vol. 18. 1979. pp. 3111-3113. [ Links ]
10. J. Cho, M. C. Heuzey, A. Begin, P. J. Carreau. "Viscoelastic properties of chitosan solutions: Effect of concentration and ionic strength". Journal of Food Engineering.Vol. 74. 2006. pp. 500-515. [ Links ]
11. J. Desbriéres. "Viscosity of semiflexible chitosan solution: Influence of concentration, temperature, and role of intermolecular interactions". Biomacromolecules. Vol. 3. 2002. pp. 342-349. [ Links ]
12. K. Mazeau, S. Pérez, M. Rinaudo. "Predicted influence of N-acetyl group content on the conformational extension of chitin and chitosan chains". Journal of Carbohydrate Chemistry. Vol. 19. 2000. pp. 1269-1284. [ Links ]
13. R. Signini, J. Desbriéres, S.P. Campana Filho. "On the stiffness of chitosan hydrochloride in acid-freeaqueous solutions". Carbohydrate Polymers. Vol. 43. 2000. pp. 351-357. [ Links ]
14. S. E. Harding. "The intrinsic viscosity of biological macromolecules. Progress in measurement, interpretation and application to structure in dilute solution". Progress in Biophysics and Molecular Biology. Vol. 68. 1997. pp. 207-262. [ Links ]
15. J. Brugnerotto, J. Desbrieres, G. Roberts, M. Rinaudo. "Characterization of chitosan by steric exclusion chromatography". Polymer. Vol. 42. 2001. pp. 9921-9927. [ Links ]
16. S. Hokputsa, K. Jumel, C. Alexander, S. E. Harding. "Hydrodynamic characterisation of chemically degraded hyaluronic acid". Carbohydrate Polymers. Vol. 52. 2003. pp. 111-117. [ Links ]
17. O. Smidsrad, A. Haug. "Estimation of the Relative Stiffness of the Molecular Chain in Polyelectrolytes from Measurements of Viscosity at Different Ionic Strengths". Biopolymers. Vol. 10. 1971. pp. 1213-1227. [ Links ]
18. X. Jiang, L. Chen, W. Zhong. "A new linear potentiometric titration method for the determination of deacetylation degree of chitosan". Carbohydrate Polymers. Vol. 54. 2003. pp. 457-463. [ Links ]
19. G. G. Allan, M. Peyron. "Molecular weight manipulation of chitosan I: kinetics ofdepolymerization by nitrous acid". Carbohydrate Research. Vol. 277. 1995. pp. 257-272 [ Links ]
20. G. G. Allan, M. Peyron. "Molecular weight manipulation of chitosan II: prediction and control of extent of depolymerization by nitrous acid". Carbohydrate Research. Vol. 277. 1995. pp. 273-282. [ Links ]
21. S. Nguyen, F. M. Winnik, M.D. Bushmann. "Improved reproducibility in the determination of the molecular weight of chitosan by analytical size exclusion chromatography". Carbohydrate Polymers. Vol. 75. 2009. pp. 528-533. [ Links ]
(Recibido el 26 de octubre de 2009. Aceptado el 15 de marzo de 2010)
*Autor de correspondencia: teléfono: + 57 +4 + 219 65 49, fax + 57 +4 + 219 65 50, correo electrónico: cgartner@udea.edu.co (C. Gartner)