Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Ingeniería Universidad de Antioquia
Print version ISSN 0120-6230
Rev.fac.ing.univ. Antioquia no.70 Medellín Jan./Mar. 2014
ARTÍCULO ORIGINAL
Propiedades volumétricas y viscosimétricas de las mezclas binarias de N,N- Dimetilformamida + 1-pentanol a varias temperaturas
Volumetric and viscometer properties binary mixtures of N,N- dimethylformamide + 1-pentanol at various temperatures
Manuel S. Páez*, Francisco J. Páez, Edineldo Lans
Departamento de Química, Facultad de Ciencias Básicas, Universidad de Córdoba. Carrera 6 No. 76-103, Km 3, vía Cereté. Montería, Colombia.
*Autor de correspondencia: teléfono: + 57 + 4 + 7860151 ext: 261, fax: + 57 + 4 + 786 0113 , correo electrónico: mspaezm@gmail.com (M. Páez)
(Recibido el 28 de junio de 2013. Aprobado de 23 de enero de 2014)
Resumen
Se determinaron las densidades y viscosidades de las mezclas binarias de N,N-Dimetilformamida (DMF) + 1-pentanol sobre todo el intervalo de concentraciones a las temperaturas de (283,15, 288,15, 293,15, 298,15 y 313,15) K utilizando un densímetro de tubo vibratorio Anton Paar DMA 5000 y un viscosímetro Anton Paar AMVn respectivamente. Se calcularon los volúmenes molares de exceso, las desviaciones de viscosidad, los coeficientes B de viscosidad y los parámetros de activación del flujo viscoso. Se discutieron los efectos de la concentración del 1-pentanol y de la temperatura sobre los parámetros previamente mencionados. Los resultados fueron interpretados en términos de interacciones soluto-solvente en medios orgánicos. Los volúmenes molares de exceso resultaron ser negativos, y fueron atribuidos a la presencia de varios factores: fuerzas atractivas tipo puentes de hidrógeno soluto-solvente, fuerzas físicas más débiles como la fuerza bipolar o cualquier otra fuerza de este tipo; así como, al acomodamiento de las moléculas del alcohol en los espacios de las moléculas de la DMF. Las desviaciones de viscosidad son altas y negativas en todo el intervalo de concentraciones y se incrementan al aumentar la temperatura, lo cual podría indicar la presencia de interacciones específicas entre las moléculas de 1-pentanol y la DMF, mientras que los altos valores negativos se pueden interpretar considerando la fuerza de los enlaces de hidrógeno, la forma y el tamaño de las moléculas estudiadas.
Palabras clave: Propiedades viscosimétricas, interacciones soluto-solvente, N,N-Dimetilformamida, 1-pentanol
Abstract
Densities and viscosities of the binary mixtures of N,N-Dimethylformamide (DMF) + 1-pentanol were determined in the entire concentration interval at the following temperatures: (283,15, 288,15, 293,15, 298,15 y 313,15) K using an vibrating tube densimeter Anton Paar DMA 5000 and an viscosimeter Anton Paar AMVn respectively. The excess molar volumes, viscosity deviations , B viscosity coefficients and parameters of viscous flow activation were calculated. The effects of 1-pentanol concentration and temperature on parameters mentioned above were discussed. The results were interpreted in terms of the solute-solvent interactions in organic medias. The excess molar volumes were negative, which can mainly be explained by factors such as the solute-solvent intermolecular attractive forces as hydrogen bonding interactions, other weaker physical interactions as dipole forces, and any other similar forces; as well as the rearrange of the alcohol molecules into the spaces of the DMF ones. The viscosity deviations were high and negatives and increased with temperature in the entire concentration interval, what could indicate the presence of specific interactions between 1-pentanol and DMF molecules, the high negative values can specifically be interpreted considering the hydrogen bonding interactions in addition to the form and size of the studied molecules.
Keywords: Viscosimetric properties, solute-solvent interactions, N,N-Dimethylformamide, 1-pentanol
Introducción
Los estudios de propiedades termodinámicas y de transporte de los líquidos puros y sus mezclas son importantes para el entendimiento de las interacciones soluto-soluto y soluto-solvente y pueden ser utilizadas para el desarrollo de modelos moleculares que permitan describir el comportamiento molecular de las soluciones, además, son fundamentales en cálculos de fisicoquímica e ingeniería involucrados en procesos de diseño en la industria del petróleo y en otros problemas prácticos sobre el flujo de fluidos, transporte de masa y transporte de calor [1, 2]. La dependencia de la viscosidad con concentración y temperatura es esencial para la caracterización de sustancias como adhesivos, lubricantes, pinturas, etc. Además, el estudio de mezclas binarias que contienen alcoholes como uno de los componentes es de gran interés debido a la libre asociación del alcohol a través de los enlaces de hidrógeno y al efecto que puedan sufrir estos debido a las interacciones con otro tipo de sustancias [1, 3, 4].
La DMF es un disolvente aprótico de gran importancia industrial que no presenta enlaces de hidrógeno, incoloro e inodoro, altamente volátil y altamente polar que presenta un olor característico. Además, puede servir como compuesto modelo de péptidos lo cual permite obtener información acerca de los sistemas proteicos [5]. Mientras que los alcoholes, en especial los de cadena corta como el 1-pentanol son compuestos orgánicos con una gran capacidad para donar protones y formar puentes de hidrogeno [6]. Lo cual lo hace sumamente interesante para el estudio de interacciones moleculares con la DMF, además, el 1-pentanol es una sustancia ampliamente utilizada en la industria química [1].
Hasta el momento, son muy pocos los trabajos reportados acerca de las propiedades volumétricas y viscosimétricas de la DMF con 1-alcanoles [5] entre los cuales se destacan estudios realizados con metanol, etanol y 1-propanol [7-9]. Sin embargo, no existe en la literatura estudios en los cuales se presenten las propiedades volumétricas y viscosimétricas de mezclas binarias de N,N- Dimetilformamida con 1-pentanol a diferentes temperaturas. En este trabajo, se analizaron las interacciones presentes entre la DMF y el 1-pentanol a partir del estudio de las propiedades volumétricas y viscosimétricas de estas mezclas, vía la aplicación de modelos apropiados.
Experimentación
Los reactivos 1-Pentanol y DMF con grado de pureza GC 98,5 % y de 99,8 % respectivamente fueron adquiridos de la casa comercial MERCK. Los reactivos fueron desgasificados antes de su uso.
El agua empleada para la calibración de los equipos fue doblemente destilada, con una conductividad menor que 2 μS-cm-1. Las soluciones fueron preparadas en la escala de fracción molar por el método gravimétrico, en frascos de vidrios con tapa y tomando todas las precauciones necesarias para evitar la pérdida de componentes por evaporación. Todas las medidas de masa fueron realizadas en una balanza analítica Ohaus Explorer con una precisión de 0,1 mg.
La medidas de densidad de los componentes puros y de sus soluciones fueron realizados en un densímetro digital de tubo vibratorio Anton Paar DMA 5000 [10] con una reproducibilidad de 1x 10-5 g/cm3 y con un control de temperatura de 0,001 K en el intervalo de temperatura estudiado.
Las medidas de viscosidad cinemática fueron llevadas a cabo en un viscosímetro digital Anton Paar AMVn [11] con un control de temperatura de 0,01 K. Los valores de viscosidad se determinaron con una incertidumbre de 0,004 mPa s.
Resultados y discusión
Los valores de las densidades y viscosidades de los líquidos puros obtenidos en este trabajo son reportados en la tabla 1, junto con los valores de literatura, observándose bastante grado de coincidencia entre ambos.
Las densidades de las soluciones de DMF + 1-pentanol son mostrados en las tablas 2-5, evidenciándose una disminución de la densidad de las mezclas con el aumento tanto de la concentración del alcohol en la solución como de la temperatura. A partir de las densidades se determinaron los volúmenes molares de mezcla para las soluciones utilizando la ecuación (1).

donde, M1, M2, son las masas moleculares de las sustancias puras DMF y el 1-pentanol respectivamente, x1 y x2 son las fracciones molares para ambos componentes y ρ es la densidad de la solución. Los valores de volúmenes molares de mezcla Vm son reportados en las tablas 2-5.
A partir de los datos anteriores se determinaron los volúmenes molares de exceso de mezcla, usando la ecuación (2).

donde, ρ°1 y ρ°2 son las densidades de las sustancias puras DMF y 1-pentanol respectivamente. Los valores calculados para los volúmenes molares de exceso fueron reportados en la tabla 2-5. Los valores de VEm muestran una desviación negativa con respecto al comportamiento ideal para todos los valores de composición y temperatura presentando un mínimo alrededor de 0,6 y 0,7 en concentración del 1-pentanol; así mismo, de estos datos se puede inferir que los valores de VEm para las mezclas de DMF + 1- pentanol son poco sensibles a los cambios de temperatura. El signo de los volúmenes molares de exceso depende de la magnitud relativa de la expansión y contracción de los líquidos debido a la mezcla; el signo negativo indica una contracción [7]. Para nuestro caso, este comportamiento puede ser atribuido a varios factores entre los que se destacan: intensificación de fuerzas atractivas con formación de puentes de hidrógeno 1-pentanol-DMF. La DMF posee dos sitios aptos para la formación de los puentes de hidrógeno, el átomo de oxígeno que sobresale en la molécula y el cual posee un par de electrones no compartidos y el átomo de nitrógeno que posee un par electrónico libre los cuales pueden ser fácilmente donados más aun debido a la presencia de los dos grupos CH3 que se ubican al lado del nitrógeno [5]. En virtud a esta característica, al momento de mezclar la DMF con el 1-pentanol, al ser este un líquido con asociaciones tipo puentes de hidrógeno, estos se redistribuyen debido a la interacción con la DMF, al mismo tiempo que se modifican las interacciones dipolares predominantes en la DMF pura. De igual manera, el acomodamiento de las moléculas del alcohol en los espacios intersticiales de las moléculas de la DMF, dada la diferencia en tamaño y forma con el 1-pentanol también puede contribuir a los valores negativos encontrados en esta mezcla [7].
Por otra parte, el volumen molar parcial de un componente  i en una solución puede ser evaluado a partir de la derivada parcial del volumen total V con respecto a los moles del componente ni en la mezcla, a temperatura T, presión p y número de moles del otro componente ni constantes o a partir de la expresión análoga escrita a la derecha de la ecuación (3). Así, para una solución binaria se tiene que:
i en una solución puede ser evaluado a partir de la derivada parcial del volumen total V con respecto a los moles del componente ni en la mezcla, a temperatura T, presión p y número de moles del otro componente ni constantes o a partir de la expresión análoga escrita a la derecha de la ecuación (3). Así, para una solución binaria se tiene que:

Los valores obtenidos para los volúmenes molares parciales para ambos componentes son mostrados en la tabla 2-5. En general, se puede observar una disminución del volumen molar parcial del soluto con la disminución de la concentración del mismo a todas las temperaturas de estudio. Este comportamiento podría ser resultado de los efectos de empaquetamiento de los componentes en la mezcla ocasionado por el reordenamiento espacial del 1-Pentanol en la red estructural de la DMF a causa de la redistribución de las fuerzas intermoleculares entre ambos componentes en la mezcla; como también al acomodomamiento de las moléculas del 1-pentanol a los espacios intersticiales de al DMF [24, 25].
Los volúmenes molares parciales a dilución infinita, pueden ser obtenidos al remplazar en la ecuación (3), el volumen molar en función del volumen molar de exceso y obteniéndose la expresión.

donde Vi∞ es el volumen molar parcial a dilución infinita del componente i. Reordenando la ecuación (4) obtenemos
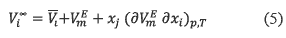
Los valores de los volúmenes molares parciales límites para la DMF y el 1-pentanol a las temperaturas de trabajo son mostrados en la tabla 6. El análisis de los datos de la tabla 6 muestra que los volúmenes molares parciales de exceso a dilución infinita  i∞-Vi0 del 1-pentanol en (DMF), son negativos, ello indica que la contribución molar de ese soluto al volumen total del sistema es menor en solución que en el estado líquido puro lo que podría indicar una contracción en el volumen de la mezcla de estudio, favoreciéndose así las interacciones soluto-solvente [26].
i∞-Vi0 del 1-pentanol en (DMF), son negativos, ello indica que la contribución molar de ese soluto al volumen total del sistema es menor en solución que en el estado líquido puro lo que podría indicar una contracción en el volumen de la mezcla de estudio, favoreciéndose así las interacciones soluto-solvente [26].
Las viscosidades dinámicas η se presentan en la tabla 7, evidenciándose un amento de la viscosidad con el aumento de la concentración del alcohol en la mezcla y una disminución de esta con temperatura.
Las desviaciones de viscosidad fueron calculadas usando la ecuación (6).

donde η es la viscosidad dinámica de la mezcla y η1 y η2 son la viscosidad de la DMF y 1-pentanol respectivamente. Los valores de en función de la fracción molar del 1-pentanol a diferentes temperaturas se muestran en las curvas presentadas en la figura 1. Las desviaciones de viscosidad son significativamente altas lo cual es indicativo de grandes desviaciones de la idealidad y de fuertes interacciones entre el 1-pentanol y la DMF. Este tipo de comportamientos ha sido previamente detectado entre algunos alcoholes y la N,N-Dimetilacetamida[27]. Los altos valores de Δη pueden ser interpretados cualitativamente por la fuerza de los enlaces de hidrógeno, el tamaño y la forma de las moléculas, para nuestro caso, los datos podrían indicar la formación de solvatos [28].
De acuerdo con Herskovits y Kelly [29], los datos de viscosidad de no electrolitos y macromoléculas pueden ser analizados de acuerdo a la ecuación:

donde B y C son parámetros ajustables, B es el coeficiente de viscosidad y es una medida del tamaño hidrodinámico, efectos de la forma, solvatación y efectos estructurales; y D es un coeficiente que debe incluir todos las interacciones soluto-solvente y soluto-soluto que no se consideran en el coeficiente B. Los resultados obtenidos para el parámetro B y dB/ dT son listados en la tabla 8, se observa que los valores de B son positivos y se disminuyen con el aumento de la temperatura, mientras que los valores de dB/dT son negativos. El signo positivo para el coeficiente B, podría indicar que el etanol se comporta como un soluto (kosmotropic) fuertemente solvatado y este grado de solvatación disminuye con el aumento de la temperatura; mientras que el signo negativo de dB/dT podría indicar que el soluto favorece la asociación que presentan las moléculas de la DMF alrededor de las moléculas de alcohol [30].
Por otro lado, la viscosidad dinámica n de un fluido Newtoniano puede ser estudiada desde la teoría de aproximación de Eyring [31] mediante la aplicación de la ecuación (8).

De acuerdo con la teoría de las cavidades de los líquidos, un líquido está compuesto por moléculas distribuidas al azar separadas por espacios libres. Las cavidades se mueven con el volumen del líquido y la mayoría de las propiedades físicas pueden ser mejor explicadas con la ayuda de este modelo. De esta manera, el flujo de los líquidos, se considera como el salto de las moléculas desde una cavidad hacia otra bajo la acción de algún esfuerzo cortante, de modo que la fluidez puede ser considerada como una función del número de cavidades en una cantidad dada de líquido. Mientras que la molécula solo puede moverse si está en la cercanía de una cavidad y posee un exceso de energía libre para pasar a ella. La viscosidad entonces es función del volumen y la temperatura tal como se precisó en la ecuación anterior. Dicha ecuación está basada en la suposición de la probabilidad de que dos moléculas se asocien es proporcional al factor exponencial [32]
Donde h es la constante de Planck, N es el número de Avogadro, V es el volumen molar del fluido, ΔG≠ ΔH≠ y ΔS≠ son la energía libre molar de Gibbs, entalpia y entropía del flujo viscoso respectivamente, R es la constante universal de los gases y T es la temperatura absoluta. De acuerdo con esta teoría grandes valores positivos de ΔG≠ podrían asociarse con la formación de complejos a través de enlaces de hidrógeno intermoleculares entre moléculas similares y disimilares. Al graficar (IηVm/hN) contra 1/T, se obtiene una curva donde la pendiente es igual a ΔH≠/R y el intercepto es igual a ΔS≠/R mientras que ΔG≠ se puede obtener utilizando la ecuación (9).

Los resultados obtenidos por este tratamiento se muestran en la tabla 9.
En la tabla 9, se observa que los valores de ΔH≠ para la DMF y sus mezclas con 1-pentanol son positivos y en general se incrementan con la concentración del alcohol a todas las temperaturas, ello podría indicar que el proceso de flujo viscoso es endotérmico debido a la formación de interacciones moleculares tipo uniones hidrógeno entre 1-pentanol-DMF. La interpretación de estos resultados también pone en evidencia que la energía de Gibbs de activación ΔG≠, controla la velocidad de flujo en el líquido, la cual se rige por la capacidad de las moléculas de la mezcla para moverse en las cavidades y por la facilidad con que las cavidades están dispuestas en ella, ya que un incremento del ΔG≠ con la concentración del alcohol, resulta de una mayor dificultad en el movimiento de las moléculas. Finalmente, los valores positivos para la entropía de activación ΔS≠ muestran que las especies que forman el estado activado son más desordenadas que el estado inicia.
Conclusiones
En este trabajo se reportan las densidades y viscosidades de las mezclas binarias de N,N- Dimetilformamida (DMF) + 1-pentanol sobre todo el intervalo de concentraciones a las temperaturas de (283,15, 288,15, 293,15, 298,15 y 313,15) K. Los volúmenes molares de exceso resultaron ser negativos y poco sensibles a los cambios de temperatura.
Se encontró que el volumen molar parcial del 1 -pentanol disminuye al aumentarla concentración de la DMF a todas las temperaturas de estudio, este comportamiento podría ser resultado de los efectos de empaquetamiento de los componentes en la mezcla ocasionado por el reordenamiento espacial del 1-Pentanol en la red estructural de la N,N-Dimetilformamida. Así mismo, los volúmenes molares parciales de exceso a dilución infinita fueron negativos, lo que podría indicar un predominio de las interacciones soluto solvente.
Las desviaciones de viscosidad son altas y negativas en todo el intervalo de concentraciones y se incrementan al aumentar la temperatura, lo cual podría indicar la presencia de interacciones específicas entre las moléculas de 1-pentanol y la DMF, mientras que los altos valores negativos se pueden interpretar considerando la fuerza de los enlaces de hidrógeno, la forma y el tamaño de las moléculas estudiadas.
Los parámetros de activación de mezcla ΔG≠, ΔH≠ y ΔS≠ son positivos en todo el intervalo de concentración a todas las temperaturas de estudio.
Referencias
1. F. Pang, C. Seng, T. Teng, M. Ibrahim. ''Densities and viscosities of aqueous solutions of 1-propanol and 2-propanol at temperatures from 293.15 K to 333.15 K''. J. Mol. Liq. Vol. 136. 2010. pp. 71-78. [ Links ]
2. S. Oswal, S. Ijardar, N. Malek. ''Studies of viscosities of dilute solutions of alkylamine in non-electrolyte solvents. II. Haloalkanes and other polar solvents''. Thermochim Acta. Vol. 427. 2009. pp. 51-60. [ Links ]
3. L. Pikkarainen. ''Densities and viscosities of binary mixtures of N, N-dimethylacetamide with aliphatic alcohols''. J. Chem. Eng. Data. Vol. 28. 1983. pp. 344-347. [ Links ]
4. H. Kumar, M. Singla. ''Viscometric studies of binary liquid mixtures of cyclopentane (1) + 2-propanol (2),+ 1-butanol (2), and+ 2-butanol (2) at T=(298.15 and 308.15) K''. J. Mol. Liq. Vol. 158. 2011. pp. 182-186. [ Links ]
5. P. Venkatesu. ''Thermophysical contribution of N, N-dimethylformamide in the molecular interactions with other solvents''. Fluid Phase Equilib. Vol. 298. 2010. pp. 173-191. [ Links ]
6. M. Almasi, L. Mousavi. ''Excess molar volumes of binary mixtures of aliphatic alcohols (C1-C5) with Nitromethane over the temperature range 293.15 to 308.15 K: Application of the ERAS model and cubic EOS''. J. Mol. Liq. Vol. 163. 2011. pp. 46-52. [ Links ]
7. M. Bhuiyan, M. Uddin. ''Excess molar volumes and excess viscosities for mixtures of N,N- dimethylformamide with methanol, ethanol and 2-propanol at different temperatures''. J. Mol. Liq. Vol. 138. 2008. pp. 139-146. [ Links ]
8. V. Aminabhavi, T. Balundgi. ''Evaluation of excess parameters from densities and viscosities of binary mixtures of ethanol with anisole, N,N-dimethylformamide, carbon tetrachloride, and acetophenone from 298.15 to 313.15 K''. Ind. Eng. Chem. Res. Vol. 29. 1990. pp. 2106-2111. [ Links ]
9. M. Saleh, M Uddin. ''Viscosity and Thermodynamics of Viscous Flow of the Systems, 1-Propanol Formamide, V-Methylformamide, V,V-Dimethylformamide''. Phys. Chem. Liq. Vol. 37. 1999. pp. 701-718. [ Links ]
10. J. Safarov, E. Hassel. ''Thermodynamic properties of 1-hexyl-3-methylimidazolium tetrafluoroborate''. J. Mol. Liq. Vol. 1153. 2010. pp. 153-158. [ Links ]
11. Y. Kao, C. Tu. ''Densities, viscosities, refractive indices, and surface tensions for binary and ternary mixtures of 2-propanol, tetrahydropyran, and 2, 2, 4-trimethylpentane''. J. Chem. Thermodyn. Vol. 43. 2011. pp. 216-226. [ Links ]
12. P. Scharlin. ''Volumetric properties of binary mixtures of N,N-dimethylformamide with water or water-d2 at temperatures from 277.13 K to 318.15 K'' . J. Chem. Thermodynamics. Vol. 34. 2002. pp. 927-957. [ Links ]
13. S. Pura. ''The Effect of Temperature on the Equivalent Conductivities and Ion-Association Constants of Some Tris-(ethylenediamine) chromium (III) Complexes in N, N-dimethylformamide and N, N-dimethylacetamide''. J. Solution Chem. Vol. 37. 2008. pp. 351-364. [ Links ]
14. J. Riddick, W. Bunger. ''Organic solvents: physical properties and methods of purification''. Tecniques of chemistry. 3rd ed. Ed. John Wiley & Sons. Hoboken, US. 1986. pp. 445-446. [ Links ]
15. C. Yang, Y. Sun, Y. He, P. Ma. ''Volumetric properties and viscosities of binary mixtures of N, N-dimethylformamide with methanol and ethanol in the temperature range (293.15 to 333.15) K''. J. Chem. Eng. Data. Vol. 53. 2007. pp. 293-297. [ Links ]
16. J. Tong. ''Excess Molar Volumes for the Ternary Mixture N,N-Dimethylformamide + Methanol + Water at the Temperature''. J. Chem. Eng. Data. Vol. 44. 1999. pp. 491-496. [ Links ]
17. S. Kharat, P. Nikam. ''Density and viscosity studies of binary mixtures of aniline+ benzene and ternary mixtures of (aniline + benzene + NN- dimethylformamide) at 298.15, 303.15, 308.15, and 313.15 K''. J. Mol. Liq. Vol. 131-132. 2007. pp. 81-86. [ Links ]
18. N. Tsierkezos, I. Molinou. ''Thermodynamic investigation of methyl salicylate/1-pentanol binary system in the temperature range from 278.15 K to 303.15 K''. J. Chem. Thermodynamics. Vol. 39. 2007. pp. 1110-1117. [ Links ]
19. H. Iloukhani, Z. Rostami. ''Measurement of some thermodynamic and acoustic properties of binary solutions of N, N-dimethylformamide with 1-alkanols at 30 C and comparison with theories''. J. Solution Chem. Vol. 32. 2003. pp. 451-462. [ Links ]
20. A. Pal, R. Gaba. ''Volumetric, acoustic, and viscometric studies of molecular interactions in binary mixtures of dipropylene glycol dimethyl ether with 1-alkanols at 298.15 K''. J. Chem. Thermodynamics. Vol. 40. 2008. pp. 818-828. [ Links ]
21. B. Garcia, C. Herrera, J. Leal. ''Shear viscosities of binary liquid mixtures: 2-pyrrolidinone with 1-alkanols''. J. Chem. Eng. Data. Vol. 36. 1991. pp. 269-274. [ Links ]
22. A. Makowska, J. Szydlowski. ''Densities, viscosities, and speeds of sound of the nitromethane+ 1-pentanol system near the critical demixing temperature: effect of deuterium substitution''. J. Chem. Eng. Data. Vol. 50. 2005. pp. 1365-1369. [ Links ]
23. P. Alfaro, E. Langa, J. Martínez, J. Urieta, A. Mainar. ''Thermophysical properties of the binary mixtures (1,8-cineole + 1-alkanol) at T = (298.15 and 313.15) K and at atmospheric pressure''. J. Chem. Thermodynamics. Vol. 42. 2010. pp. 291-303. [ Links ]
24. M. Páez, J. Lafont, A. Alvis. ''Densidades y Propiedades Volumétricas de Mezclas N, N-Dimetilformamida+ Agua a Presión Constante de 98.93 kPa y a varias Temperaturas''. Technological information. Vol. 20. 2009. pp. 47-54. [ Links ]
25. J. Jimenez, F. Martinez. ''Study of some volumetric properties of 1, 2-propanediol+ water mixtures at several temperatures''. Rev. Colomb. Cienc. Quim. Farm. Vol. 34. 2005. pp. 46-57. [ Links ]
26. M. Páez, M. Vergara, P. Cantero. ''Propiedades volumétricas de la mezcla N,N Dimetilformamida + 1-propanol a diferentes temperaturas''. Rev. Colomb. Quím. 2012. Vol. 41. pp. 75-88. [ Links ]
27. M. Saleh, O. Ahmed, M. Shamsuddin. ''Excess molar volume, viscosity and thermodynamics of viscous flow of the system dimethylsulfoxide and acetic acid''. J. Mol. Liq. Vol. 115. 2004. pp. 41-47. [ Links ]
28. U. Kapadi, D. Hundiwale, N. Patil, M. Lande, P. Patil. ''Studies of viscosity and excess molar volume of binary mixtures of propane-1, 2 diol with water at various temperatures''. Fluid Phase Equilib. Vol. 192. 2001. pp. 63-70. [ Links ]
29. T. Herskovits, T. Kelly. ''Viscosity studies of aqueous solutions of alcohols, ureas, and amides''. J. Phys. Chem. Vol. 77. 1973. pp. 381-388. [ Links ]
30. H. Zhao. ''Viscosity B-coefficients and standard partial molar volumes of amino acids, and their roles in interpreting the protein (enzyme) stabilization''. Biophys. Chem. Vol. 122. 2006. pp. 157-183. [ Links ]
31. S. Glasstone, H. Eyring. The Theory of Rate Process. 1st ed. Ed. McGraw-Hill. New York, USA. 1941. pp. 516. [ Links ]
32. T. Qreshi. Studies in the variation of free energy of mixing and temperatures derivatives of viscosity, density and refractive index for liquids and binary solutions. Thesis submitted for degree of doctor of philosophy in the facultad of science. University of Karachi. Karachi, Pakistan. 1971. pp. 5-7. [ Links ]























