Introducción
Las infecciones cutáneas pueden comenzar como foliculitis, forunculosis o celulitis, pudiendo progresar hacia el tejido subcutáneo más profundo en cualquier región del cuerpo1,2. Varios organismos que normalmente colonizan la piel pueden causar necrosis y licuefacción, con la acumulación posterior de leucocitos y desechos celulares, conduciendo a la formación de abscesos1,2. Staphylococcus aureus y Streptococcus pyogenes son los agentes más frecuentemente aislados en las distintas infecciones de piel y partes blandas2,3. Otros agentes importantes, aunque menos frecuentes son Streptococcus del grupo B, C y G, Enterococcus spp., bacilos gram negativos y anaerobios3.
Varios estudios han evidenciado el aumento de cepas de S. aureus meticilino resistente (SAMR) como causante de infecciones purulentas de piel y partes blandas3-5. SAMR se describió por primera vez en Inglaterra en 1961 poco después de la introducción de la meticilina6. Desde entonces, SAMR se ha extendido por todo el mundo y su prevalencia ha aumentado tanto en las infecciones intrahospitalarias como comunitarias7,8.
La resistencia a la meticilina está mediada por la proteína de unión a penicilina 2a, codificada en el gen mecA que permite que este microrganismo crezca y se reproduzca en presencia de meticilina y otros antibióticos beta-lactámicos. El gen mecA se encuentra en un elemento genético móvil llamado cassette del cromosoma estafilocócico (SCCmec)4,5.
En la década de 1990 se describió a S. aureus meticilino resistente adquirido en la comunidad (SAMR-AC) como patógeno en individuos sin factores de riesgo (hemodiálisis, cirugía, hospitalización reciente, portadores de dispositivos percutáneos, infección previa por SAMR, estadía en hogar o asilo de ancianos en el último año). SAMR-AC posee características distintas a las cepas nosocomiales, ya que presenta resistencia a menos antimicrobianos, no se asocia a los factores de riesgo clásicos, posee una base genética y factores de virulencia distintos, producción de leucocidina de panton valentine (LPV), además de provocar, principalmente, infecciones abscedadas de piel y neumonía necrotizante8,9.
Se han descrito brotes comunitarios por este agente principalmente en grupos de niños, hombres que tenían sexo con hombres, equipos de jugadores de deportes de contacto e internos de cárceles10,11. En Chile, se ha reportado el aislamiento de SAMR-AC tanto en niños como en adultos desde 2006, provocando infecciones superficiales y profundas12,13.
El objetivo de este trabajo es presentar un brote familiar de piodermitis por SAMR AC, revisar la epidemiología, presentación clínica, diagnóstico y tratamiento.
Descripción del brote
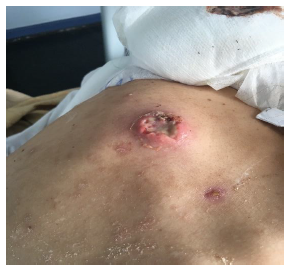
El 10 de octubre de 2018 consultó en la unidad de emergencia de adultos del Hospital Carlos van Buren de la quinta región de Valparaíso una mujer de 26 años, sin antecedentes mórbidos, quien trabajaba manipulando pescados en una céntrica calle de la ciudad y que vivía en condiciones de hacinamiento con su familia y la de su hermano (cuatro adultos y dos niños). Presentaba lesiones pustulosas y abscesos de piel en el tronco y extremidades de dos semanas de evolución (figuras 1 y 2), sin compromiso de mucosas, sin fiebre, con PCR de 125 mg/L, recuento de leucocitos de 14 300 células, además de anemia hipocrómica leve.
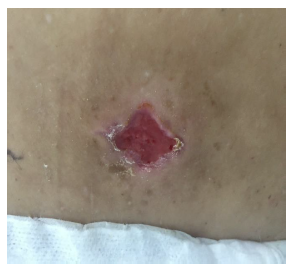
Se realizó aseo quirúrgico y toma de cultivo de secreción y de tejido, además de iniciar tratamiento con ampicilina-sulbactam 1,5 g cada ocho horas. Por mala respuesta clínica se revisaron los cultivos, los cuales informaron desarrollo de SAMR, sensible a vancomicina, clindamicina, cotrimoxazol, ciprofloxacino, rifampicina y tetraciclina. En los hemocultivos no hubo desarrollo bacteriano. Debido a esto se cambió tratamiento a cotrimoxazol forte cada ocho horas con buena respuesta clínica (figuras 3 y 4).
Se realizó ecocardiograma, el cual no mostró vegetaciones endocárdicas. La paciente fue dada de alta en buenas condiciones generales, con indicación de completar tratamiento por 14 días en su domicilio. La cepa aislada fue enviada al Instituto de Salud Pública de Chile (ISP), informándose SAMR portadora del gen de LPV.
A la interrogación dirigida y revisión de antecedentes, su hijo de 10 años, asmático y alérgico al chocolate, estuvo hospitalizado dos meses antes en el mismo centro por un cuadro que comenzó el 31 de julio con una pápula axilar derecha que evolucionó con aumento de tamaño progresivo y dolor. Consultó el 02/08 en la unidad de emergencia infantil donde se diagnosticó una celulitis y comenzó tratamiento con flucloxacilina 500 mg cada seis horas. Alcanzó a recibir cuatro dosis antes de volver a consultar y ser hospitalizado por aumento de la signología local, fiebre (38ºC), con leucocitosis de 17 400 células y 68 % neutrófilos y PCR de 34,8 mg/l. Recibió cloxacilina 100 mg/kg/día, respondiendo parcialmente, hasta que el 07 de agosto se drenó un absceso axilar y se cultivó su contenido. Ese día se suspendió la cloxacilina y se fue de alta el 09/08, completando tratamiento oral con cefadroxilo (500 mg cada 12 horas) por ocho días.
Evolucionó con resolución ad integrum, y con posterioridad, en control ambulatorio, se rescató el resultado del cultivo, el cual fue informado como SAMR con patrón de susceptibilidad idéntico al de su madre, por lo que recibió 14 días de tratamiento con cotrimoxazol forte cada 12 horas. No se pudo realizar estudio de clonalidad debido a que no se contó con la cepa de la infección del hijo de la paciente.
Además, relató que su cuñada también había presentado lesiones similares a las de ella los primeros días de septiembre del mismo año, las cuales fueron tratadas de forma ambulatoria en la atención primaria con varios esquemas antimicrobianos, entre ellos cotrimoxazol forte.
Discusión
Las infecciones por SAMR son cada vez más frecuentes en los distintos países, tanto a nivel hospitalario como en infecciones comunitarias5-7. En 2006 se publicaron en Chile los primeros cinco casos de infección de piel por SAMR-AC en adultos, quienes en su mayoría tenían el antecedente de haber viajado al extranjero12 y en 2015, cuatro casos pediátricos de osteomielitis, celulitis y un absceso perirrenal13.
Desde entonces, en nuestro país las infecciones por este agente han afectado tanto a adultos como a niños, con una incidencia que aún es baja pero que va en aumento13. Según reporta el ISP, en el período 2012 - 2016, se estudiaron 1 079 cepas de S. aureus, de las cuales 90,2 % fueron confirmadas como SAMR y el 3,7 % (36/973) fueron derivadas desde la región de Valparaíso14. El 29,4 % de las cepas de SAMR estudiadas resultaron con presencia del gen LPV, confirmándose como SAMR-AC14. En el brote descrito, las cepas aisladas, tanto por la ausencia de factores de riesgo, como por el patrón de susceptibilidad y la presencia del gen LPV, sugirieron que eran SAMR-AC.
Según el mismo reporte del ISP, el 50,3 % (144/286) de las cepas de SAMR-AC PVL positivos fueron aisladas a partir de muestras de heridas, el 30,8 % de abscesos y el 12,2 % de hisopado nasofaríngeo14. Esto coincide con los casos aquí descritos, ya que las infecciones supuradas de piel son las más frecuentes, no sólo en Chile, sino en todos los países15.
De las cepas SAMR-AC PVL positivos y reportadas por el ISP, ninguna cepa presentó resistencia a clindamicina o cotrimoxazol y el 17 % fue resistente a ciprofloxacino14; esto coincide con las cepas descritas aquí, las cuales eran susceptibles a estos tres antibacterianos.
La elección del tratamiento antibiótico debe ser realizada sobre la base de los datos microbiológicos disponibles a nivel local y considerando fundamentalmente los sitios de infección, así como la gravedad del paciente. El tratamiento de elección para infecciones supuradas de piel y partes blandas es cotrimoxazol, pero también pueden ser útiles vancomicina, linezolid, daptomicina, clindamicina, ceftarolina y tigeciclina. En infecciones graves, en especial si la cepa es productora de LPV, se sugiere combinaciones de antibióticos, como por ejemplo vancomicina, linezolid, clindamicina o rifampicina16.
Los pacientes fueron tratados con cotrimoxazol por vía oral con buena respuesta clínica, debido a que no presentaron infecciones profundas ni sepsis grave, aunque para el niño, el drenaje del absceso fue curativo.
En conclusión, consideramos importante sospechar la presencia de SAMR-AC en infecciones comunitarias, supuradas de piel y partes blandas en pacientes sin factores de riesgo clásico, realizar aseo quirúrgico con toma de muestra para identificación y estudio de susceptibilidad para los antimicrobianos frecuentemente utilizados.
Limitaciones del estudio: es un brote comunitario de solo tres casos, donde sólo en dos de ellos se obtuvo cultivos y no se pudo realizar estudio de clonalidad por contar solo con el cultivo de la paciente del caso clínico.