Introducción
En la mayoría de los sistemas sanitarios del mundo, el médico no oncólogo establece el primer contacto con el paciente en quien se sospecha cáncer. La presentación variable de la enfermedad impone un reto en la toma de decisiones que permitan hacer un diagnóstico preciso y oportuno. Esto ha llevado a que algunos países como el Reino Unido publiquen guías de reconocimiento y referencia de pacientes con sospecha de cáncer (1.
Existe asociación entre el tiempo del diagnóstico y el pronóstico en pacientes con cáncer. Una revisión sistemática reportó que el carcinoma de mama, carcinoma colorrectal, melanoma, cáncer testicular y el carcinoma de cabeza y cuello tienen mejor pronóstico cuando se hace diagnóstico temprano 2. En el Reino Unido se ha descrito una mayor mortalidad por todos los cánceres respecto a Europa, esto parece estar explicado por tiempos de diagnóstico más largos 3.
De acuerdo con las cifras de la cuenta de alto costo, para el año 2020 los tumores sólidos en Colombia demoran en promedio 42 días desde el momento de los síntomas al diagnóstico, siendo las mayores demoras en próstata, melanoma y mama 4. Este gran intervalo es multicausal, incluye: procedimientos diagnósticos innecesarios, falta de oportunidad en la realización de ayudas diagnósticas e inadecuada interpretación de dichos estudios. En el mundo se han creado estrategias para acelerar este proceso. Ejemplos de esto son las rutas de atención
integrada que facilitan el acceso al proceso de diagnóstico, agilizando la realización de pruebas y su interpretación en pacientes con riesgo o sospecha de neoplasia 5.
Enfoque
Para realizar un correcto enfoque, es necesario conocer la historia natural de la enfermedad oncológica. Contrario a lo que la intuición pudiera indicar, la enfermedad tumoral maligna no tiene un desarrollo lineal entre el tiempo que se desarrollan las alteraciones moleculares a nivel celular, las manifestaciones clínicas y la muerte como desenlace. Algunas enfermedades neoplásicas inician con crecimiento celular no controlado que lleva a formación de tumores, pero nunca desarrollarán síntomas ni complicaciones como la muerte, incluso pueden tener regresión espontánea (5. Otro grupo de pacientes, podrían nunca presentar síntomas de enfermedad primaria tumoral y desde el principio tener una enfermedad metastásica, posible teoría del carcinoma primario de origen desconocido 6.
Al momento de abordar un paciente con sospecha de neoplasia, el primer paso debe ser evaluar las posibles urgencias oncológicas que puedan comprometer la vida del paciente o su funcionalidad; entre el 11-29% de las neoplasias debutan con una urgencia oncológica 7. Esto incluye la enfermedad tromboembólica venosa, hipercalcemia asociada a malignidad, el síndrome de compresión medular, el síndrome de vena cava superior, infecciones, entre otros.
El inicio de terapias efectivas para el control de las urgencias oncológicas se basa en dar el tratamiento dirigido a la misma, sea radioterapia o quimioterapia. Por lo tanto, la confirmación histológica de la neoplasia hace parte de las medidas prioritarias que deben tomarse en los pacientes que se presentan con urgencia oncológica, dado que sin esta no se podría iniciar tratamiento específico 8. Posterior a su estabilización, deberá evaluarse la funcionalidad residual por medio de escalas objetivas como la de Eastern Cooperative Oncology Group (ECOG), e índices como Karnofsky para definir el avance en otros estudios de estadificación y definir posibles terapias si la funcionalidad residual así lo amerita (8.
Como se mencionó anteriormente, la confirmación histológica debe ser una meta por seguir en el paciente con sospecha de cáncer. Esto inicia con una historia clínica completa, evaluando el tiempo de evolución de los síntomas, factores de riesgo y un examen físico que permita detectar masas o efusiones de fácil acceso para un diagnóstico histológico. Sitios frecuentemente olvidados de revisar y que llevan a retraso del diagnóstico son: genitales masculinos, plantas y palmas junto con región interdigital (lesiones melanocíticas) y región axilar en búsqueda de ganglios 8.
Las imágenes deben ir dirigidas hacía donde la sospecha clínica indique compromiso tumoral primario, en la sospecha de escenario metastásico, será necesaria tomografía contrastada de tórax y abdomen. Cabe aclarar que las imágenes no son suficientes para el diagnóstico e inicio de tratamiento en los tumores sólidos, con dos excepciones: 1. El carcinoma hepatocelular, donde una resonancia de abdomen interpretada por un radiólogo experto es suficiente para confirmar el diagnóstico 9. 2. El carcinoma renal, donde una tomografía que sea altamente compatible con un cáncer puede llevar a la decisión de realizar extracción de la masa o nefrectomía completa, con confirmación histológica de la pieza quirúrgica. En las demás neoplasias, siempre será importante la confirmación histológica de cáncer 10.
Existen diferenciales de lesiones sólidas que simulan ser cáncer como nódulos inflamatorios (vasculitis), infecciones micóticas, infecciones por nocardia, entre otros. Por lo tanto, es una premisa el diagnóstico histológico del cáncer 10.
Abordaremos 4 escenarios diferentes en cómo se presentan las neoplasias y que suponen retos en el abordaje del paciente con sospecha de cáncer.
Efusiones
La presencia de líquido en la cavidad pleural, pericárdica y peritoneal son frecuentes en el paciente con cáncer. Cuando se tiene alta sospecha de una neoplasia que compromete estas cavidades, el estudio de dichos derrames puede ayudar al diagnóstico de una manera expedita 11.
La ascitis, siempre debe estudiarse pues el 85% son secundarias a hipertensión portal, mientras que solo el 10% de las ascitis son por carcinomatosis peritoneal 11, por lo tanto, la realización del gradiente de albúmina junto con el citoquímico es siempre necesario para el estudio de diagnósticos diferenciales. Adicionalmente para evitar repetir la paracentesis, si hay sospecha de cáncer debe tomarse una muestra para patología donde se realizará una citología, la cual consiste en la observación directa de las células al microscopio por el patólogo después de una centrifugación a 1500 rpm por 1 minuto 12.
Además, deberá ordenarse siempre un bloque celular, técnica en la cual se hace una centrifugación del líquido a 2500 rpm por 2 minutos, se toman las células sedimentadas, se fija en una placa con parafina y se realiza una segunda centrifugación a 3000 rpm, luego se visualiza al microscopio. Si la cantidad de células lo permite, se practican tinciones especiales e inmunohistoquímica permitiendo un diagnóstico preciso de la neoplasia. Esta técnica no es inferior en su especificidad (93%) a la biopsia con aguja guiada por imágenes, tiene una sensibilidad del 86% y es superior a la realización de la relación CA-125/Antígeno carcinoembrionario, permitiendo diagnóstico con un procedimiento sencillo como es la paracentesis 12.
Hablando propiamente de la ascitis en el paciente con cáncer, esta puede ser el debut de la neoplasia en un 20% de los pacientes con cáncer. Las neoplasias más frecuentes que la condicionan son en orden: Carcinoma de ovario, neoplasias del tracto gastrointestinal, páncreas, mama y linfomas. Es importante resaltar que la presencia de líquido ascítico no es un equivalente a carcinomatosis peritoneal. Muchas veces es explicada por factores angiogénicos e inflamatorios que se liberan en pacientes con enfermedades tumorales, pero no por invasión directa de células tumorales al peritoneo. Otro mecanismo fisiopatológico, es el bloqueo del drenaje linfático por compromiso tumoral ganglionar 13. Por último, se deberá tener en cuenta la trombosis portal maligna con hipertensión portal como causa de la ascitis 14.
La minoría de las veces se requerirá laparoscopia, este procedimiento queda reservado para el cáncer de ovario con ascitis donde se debe definir citorreducción de acuerdo con los hallazgos de la laparoscopia. Además, en los pacientes con alta sospecha de carcinomatosis por clínica e imágenes, pero con bloque celular no diagnóstico, lo cual ocurre en la minoría de las ascitis malignas 14.
En cuanto a la cavidad pericárdica, la efusión por tumor primario es excepcional, siendo el debut de la enfermedad en solo el 4% de los pacientes con cáncer 15. Por lo tanto, el estudio citológico y de marcadores tumorales en general tiene poca evidencia en esta cavidad dado que la mayoría de pacientes con cáncer y derrame pericárdico se obtiene el diagnóstico de la neoplasia primaria por otros métodos. Los tumores secundarios que comprometen el pericardio con mayor frecuencia son el de mama, escamocelular de pulmón, escamocelular de esófago y melanoma, lugares que debemos explorar en el paciente con líquido en el saco pericárdico. Por último, el derrame pericárdico en el paciente con neoplasia diagnosticada no necesariamente indica invasión tumoral, puede ser asociado a radioterapia o etiologías benignas como pericarditis o falla cardíaca 16.
En la cavidad pleural, el 30% del debut de las neoplasias lo hacen como un derrame pleural. Por lo tanto, el estudio de esta efusión es de gran valor. Los más frecuentes son el cáncer de pulmón, mama, linfoma, ovario y gástrico 17.
Al igual que en la cavidad peritoneal, se debe hacer diferencia entre derrame pleural maligno y paramaligno 18. El 50% de las efusiones pleurales en el paciente con cáncer no son malignos, incluso así las imágenes muestren posibles lesiones malignas en la pleura, siempre se debe confirmar en el laboratorio de patología la presencia de células malignas. La ausencia de malignidad, debe poner en la mesa diferenciales como embolia pulmonar (eosinófilos aumentados en citoquímico), paraneumónico, falla cardíaca, tuberculosis, entre otros. Por lo tanto, debemos solicitar estudios como deshidrogenasa láctica, citoquímico, proteínas totales, del líquido y suero para realizar el análisis de la celularidad junto con el tipo de derrame: exudado o trasudado, de acuerdo a criterios convencionales 18.
La cantidad de líquido que debe enviarse para el estudio completo con bloque celular y citología es de 40 ml, en caso de que se desee hacer citometría de flujo por sospecha de neoplasia hematológica, deberá enviarse 60 ml al laboratorio de patología. Normalmente el estudio evidencia un exudado linfocítico, pero este hallazgo no es específico y no descarta otros diferenciales 18.
Lesión primaria altamente sospechosa por imagen sin posibles metástasis
En ocasiones las imágenes pueden identificar una lesión posiblemente primaria sin lesiones a distancia. En ese caso el primer paso es realizar un examen físico completo en búsqueda de lesiones que puedan ser malignas y escapen a las imágenes convencionales como ganglios, testículos en hombres y lesiones en piel. Sino se evidencian estas lesiones, se deberá tomar una muestra del órgano que por imágenes esté comprometido por el tumor. Si es accesible guiado por imágenes y la muestra es representativa, esta técnica es la ideal, de lo contrario, requerirá biopsia quirúrgica, dado que, en este escenario macroscópicamente no habrá otros órganos por estudiar 19.
Merecen una mención aparte: el carcinoma hepatocelular el cual puede confirmarse por imágenes interpretadas por un radiólogo experto 19 y el cáncer renal localizado, el cual se confirmará una vez se haya extraído la lesión o el riñón por urología, dado que las imágenes tienen un buen rendimiento cuando la sospecha es alta. Si la lesión es indeterminada y mide menos de 2 cm, la biopsia será necesaria para confirmar benignidad y evitar tratamientos quirúrgicos innecesarios 20.
Paciente con Lesión primaria altamente sospechosa por imagen y metástasis posibles
El siguiente escenario será el paciente con enfermedad metastásica y un posible primario por imagen. En este caso, no debe intentarse necesariamente el estudio histológico de la lesión primaria, sino que regirá el principio de tomar: la lesión más representativa y menos invasiva posible. Se deben evitar biopsias de lesiones con alto grado de necrosis en la tomografía. De la misma manera, se debe evitar lesiones que posiblemente no representen patología avanzada como nódulos tiroideos en pacientes sin antecedentes de cáncer de tiroides, dado que solo el 1% debutan como enfermedad metastásica 21.
Sospecha de metástasis sin lesión primaria clara por imagen convencional
Merecen un capítulo aparte la sospecha de metástasis de primario de origen desconocido y el carcinoma de primario de origen desconocido. El primero hace referencia a un paciente que las imágenes (tomografía o resonancia) reportan posible enfermedad metastásica, sin una lesión dominante y aún no se tiene confirmación histológica. Este caso obliga a buscar el diagnóstico histológico si la funcionalidad del paciente permite un tratamiento de su enfermedad oncológica, las imágenes en enfermedad metastásica no se deben tomar como una confirmación de neoplasia 22. Se aplicarán los principios de enfermedad metastásica previamente mencionados: iniciar por las efusiones, luego escoger las lesiones sólidas más representativas y de más fácil acceso 23.
Con frecuencia en estos pacientes se realizan estudios endoscópicos del tracto gastrointestinal de manera rutinaria buscando el tumor primario, sin tener manifestaciones clínicas de tumor gastrointestinal. Esta práctica se desaconseja, al igual que la solicitud rutinaria de antígenos tumorales que pueden estar elevados en condiciones benignas y no hacen diagnóstico, por el contrario, pueden confundir al clínico 24.
Hay escenarios que podrían ayudar como lo es el carcinoma de línea media donde la sospecha de tumores de células germinales se puede apoyar con una gonadotropina coriónica humana. En los pacientes hombres con metástasis esqueléticas blásticas podría ayudar el antígeno prostático. Por último, en la mujer con ascitis y carcinomatosis peritoneal se puede solicitar Ca-125 si la patología no logra establecer el origen primario 23. Pero recalcamos que estos no se deben solicitar de rutina pues se pueden elevar por muchas condiciones benignas 24.
Otro posible escenario es un paciente que se ha llevado a biopsia de las lesiones, se confirma la presencia un carcinoma, pero a pesar de un coctel de citoqueratinas básico no se logra establecer el órgano primario del cual viene el tumor. Para abordar estos pacientes se debe dar información al patólogo de los factores de riesgo y sospecha clínica para guiar los estudios de inmunohistoquímica. Se correlacionará los estudios de patología con la distribución clínica, para lograr distinguir 7 grupos de tumores que comparten características clínicas y podrían tener buen pronóstico, los cuales se mencionan en la Tabla 1 24.
Tabla 1 Grupos de Buen Pronóstico en Pacientes con Carcinoma Primario de Origen Desconocido.
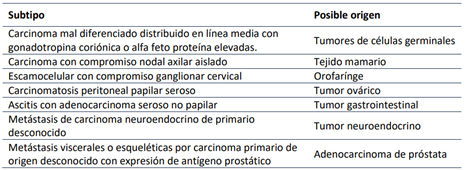
Adaptado de Shreenivas Av 25
Por último, en este grupo de pacientes cada vez se estudia más el análisis genómico de los tumores con técnicas como la secuenciación de nueva generación. Sin embargo, aún no hay claridad si el conocer una mutación “driver” realmente permita tomar decisiones terapéuticas en el escenario de primario desconocido 25.
Conclusión
El médico no oncólogo es un eslabón importante en el proceso diagnóstico de los pacientes con sospecha de cáncer. Conocer la historia natural del mismo y la heterogeneidad de la historia natural es fundamental para el enfoque. Esto incluye hacer un enfoque adecuado de las efusiones en cavidad abdominal, peritoneal y pericárdica, al igual que guiar el estudio histológico buscando lesiones representativas y de fácil acceso. Será importante además que el clínico guie a los especialistas en ayudas diagnósticas en la presentación clínica del paciente para hacer una búsqueda racional del tumor primario que está generando enfermedad. Este estudio debe avanzar siempre y cuando se hayan identificado las urgencias oncológicas y la funcionalidad permita instaurar un tratamiento oncológico posterior.















