INTRODUCCIÓN
La familia Herpesviridae está constituida por ocho tipos de herpes que afectan al humano, de los cuales se consideran neurotrópicos (subfamilia Alphaherpesvirinaee) el HSV-1, el HSV-2 y el VZV. Estos tres varían en su estructura, pero tienen casi un 70 % de homología genómica, con diferencias en expresión antigénica 1.
Según la Organización Mundial de la Salud (OMS), varios miles de millones tienen una infección por herpes oral (HSV-1), mientras que aproximadamente 500 millones de personas en todo el mundo tienen herpes genital; así, se observa que el HSV-2 aumenta el riesgo de contraer el virus de inmunodeficiencia humana (VIH) de dos a cuatro veces. En personas menores de 50 años, alrededor del 67 % tiene infección por HSV-1, en tanto que el 13 % entre 15 y 49 años tiene infección por HSV-2, sin variaciones en género, geográficas o estacionales, lo que sí ocurre con otros virus como los Arboviridae. Por consiguiente, sin importar las manifestaciones clínicas, se debe siempre preguntar acerca de estas variables tanto al paciente como a los acompañantes 2.
En cuanto al VVZ, la varicela es la infección primaria en el 90 % de los casos. Las diferencias con los dos anteriores son varias: se presenta antes de la adolescencia, no obstante, en muchas áreas del trópico la presentación es de forma tardía y con mayor frecuencia en adultos. Estas variaciones epidemiológicas pueden relacionarse con diferencias de densidad de población, condiciones sociales (nivel socioeconómico bajo y un 80 % de seropositividad), diferencias en la transmisibilidad, termolabilidad del virus (invierno-primavera, con tendencia a las epidemias cada dos a cinco años), factores individuales (edad avanzada, inmuno-comprometidos y embarazo), o combinación de todas 1,3.
La naturaleza extendida de la infección al sistema nervioso se debe en gran parte a la capacidad de establecer una infección latente durante la vida del huésped humano en el sistema nervioso periférico (SNP) y en los ganglios de la raíz dorsal (GRD). La encefalitis esporádica en adultos es la causa más frecuente de HSV-1, con una incidencia entre uno y tres casos por millón/habitantes, mientras que el HSV-2 produce principalmente meningitis, con cifras no muy claras dado que el curso clínico tiene menos complicaciones y mejor pronóstico. El VZV es el segundo virus que con mayor frecuencia causa encefalitis o meningitis posteriormente a su reactivación (herpes zóster y ganglionitis), puede dejar graves secuelas e incluso ser fatal 1,3.
En América Latina se registra un número creciente de casos de meningoencefalitis relacionados con herpesvirus, en reportes del 2016 se encuentra un caso por cada 250 000 a 500 000. Los informes en Colombia no son concluyentes, con una prevalencia y una incidencia prácticamente desconocidas. Sin embargo, en un estudio epidemiológico realizado en el departamento de Córdoba, hasta el 18,6 % presentaba VHS-1 y 2, en tanto que el 0,8 % tenía VVZ, con coinfecciones hasta el 2,5 % por VHS-VZV y una letalidad hasta del 20 % de los casos 4.
El objetivo de esta revisión es resaltar las manifestaciones clínicas neurológicas de las infecciones por herpesvirus simple tipo I-II y varicela zóster, así como detectarlas y tratarlas tempranamente, para minimizar sus complicaciones y secuelas neurológicas a largo plazo.
FISIOPATOLOGÍA
Los virus ingresan al sistema nervioso por dos mecanismos principales: diseminación hematógena (lesiones distales-ruta placentaria) y neuronal (nervio olfatorio y trigémino con predilección de corteza orbitofrontal y temporal). Después de la infección inicial del epitelio en el área expuesta, el virus ingresa a los extremos de las neuronas sensitivas y alcanza el cuerpo celular por transporte retrógrado a través de axones. La replicación del virus en la neurona conlleva activación de respuestas inmunitarias del huésped, atocinas (TNF-α, IL-1β, IL-10, IL-6, IL-12, IL-8, macrófagos, proteína 1- α (MIP-1 α)) y quimiocinas de ligando (CCL5-CXCL10) con migración de linfocitos periféricos. En el caso de la encefalitis, los linfocitos circulantes son reclutados por los astrocitos, oligodendrocitos y microglía, donde los receptores de reconocimiento de patrones específicos (PRR), como son los receptores tipo TOLL, reconocen estructuras invariantes de herpesvirus (ácidos nucleicos y patrones moleculares asociados con patógenos-PAMP) tanto extracelular (TLR2, TLR4- se une a los componentes lipoproteicos), como intracelular (TLR3, TLR9- compartimentos endosomales), con posterior activación de señalizaciones intracelulares: factor nuclear κB (NF- κB) e IFN-I y reconocimiento del dsDNA del HSV citosólico 5,6.
La microglía media la eliminación de moléculas neu-rotóxicas, con mayor expresión de óxido nítrico y factor neurotrófico derivado del cerebro (BDNF), alterando la homeostasis del cerebro. La capacidad de establecer una infección latente, que se define como la presencia del genoma viral en el tejido del huésped sin producción de partículas virales infecciosas, puede conllevar la reactivación de la latencia viral, donde los viriones recién replicados en los ganglios sensitivos se someten a un transporte anterógrado a lo largo de los microtúbulos para alcanzar las células epiteliales, con diseminación axonal resultante a través del nervio trigémino (ganglio de Gasser) hacia los lóbulos frontal y temporal, además del cerebelo, el bulbo olfatorio y el hipocampo, con replicación de crecimiento neuronal, infiltración de células T CD8 + y CD4 + y posteriormente exocitosis de vesículas grandes, lo que da como resultado la lisis de la célula infectada, necrosis y apoptosis dentro de los siete días posteriores a la infección. La activación microglial prolongada puede durar hasta 30 días después de la infección, donde citocinas tales como TNF-α, IFN-y e IL-1β pueden afectar la barrera hematoencefálica, exacerbando con ello la inflamación cerebral, con efectos sinérgicos entre TNF-α e IFN-y que conducen a un aumento de la neurodegeneración y la desmielinización 7,8.
La reacción inflamatoria con infiltrado de predominio linfocitario, o desmielinización con macrofagia, conlleva un aumento de la presión intracraneal, que alcanza su punto máximo a los 12 días, con ruptura de pequeños vasos y simultáneamente presencia de inclusiones intranucleares en la oligodendroglia (inclusiones de Cowdry tipo A), lo que genern una vasculomielinopatía diseminada. Esta reacción hiperérgica genera necrosis fibrinoide de tipo agudo o granulomatoso, con desarrollo de complejos inmunes, propagación proliferativa ateroesclerótica (proceso inflamatorio crónico) e infiltración del exudado subaracnoideo inflamatorio, lo cual ocasiona una invasión directa de las paredes de los vasos (extensión directa del virus a través de la división oftálmica del nervio trigémino y angeítis de la arteria carótida interna), con vasculopatía necrotizante atribuida a una necrosis hemorrágica intensa cortical-subcortical y perivascular en las regiones temporal medial y orbitofrontal 9. La diapédesis de los glóbulos rojos del cuerpo amigdaloide y el estado procoagulante alterado, inducido por la vasculopatía inflamatoria intensa, pueden causar necrosis de la pared vascular y hemorragia subsiguiente, lo que lleva a la diseminación hematógena al espacio del LCR 9. El flujo de cascada inflamatoria, vasculopatía con vasculitis y sangrado, lleva finalmente a edema focal que aumenta de manera proporcional al ciclo establecido, con encefalitis en un inicio focal y luego difusa que puede llevar a la muerte.
CLÍNICA
Aunque clásicamente se ha descrito cefalea, fiebre y signos meníngeos como la clínica para tener en cuenta, puesto que se asocian con alarma, las manifestaciones neurológicas son muy variadas; la anamnesis y el examen neurológico deben ser exhaustivos. Se pueden observar signos y síntomas que indican la extensión del compromiso parenquimatoso y la severidad, tal como ocurre con el estado de conciencia al ingreso, lo que a su vez puede indicar el pronóstico. En la tabla 1 se resumen las manifestaciones neurológicas.
Encefalitis
Presenta una distribución bimodal (HVS 1-2) < 20 años o > 51 años, con un pico entre los 60 y los 64 años, y VVZ > 50 años, con un pico en la octava década de la vida (tabla 2). Los signos y los síntomas clínicos no son patognomónicos; aunque la confusión o desorientación, la cefalea y la fiebre pueden estar en aproximadamente el 89 % de los pacientes, los déficits focales (afasia, hemiparesia, percepción sensorial anormal) y las crisis epilépticas son las manifestaciones más frecuentes. Estas últimas pueden desarrollarse rápidamente, en general, entre uno y cinco días. La alteración del nivel de conciencia se puede observar en casos más graves o avanzados, y en cuanto a la fiebre, aunque es una de las manifestaciones más frecuentes, no es uniforme e incluso al inicio puede estar precedida de un cuadro pseudogripal 1,10-16.
Crisis epilépticas
Hasta el 50 % de los pacientes adultos con encefalitis herpética presenta crisis epilépticas. En cuanto a la clasificación del tipo de crisis, la mayoría fue de origen focal (65 %), seguidas de las generalizadas (23 %), y por último la focal, a progresión bilateral tónico-clónica (12 %), con alteración de la conciencia (42 %) y sin alteración de la conciencia (55 %) 17.
El curso clínico puede complicarse por un estado epiléptico refractario en un 29 %, donde el nistagmo epiléptico es el único síntoma del estado epiléptico no convulsivo (localización temporoparietooccipital). Se debe hacer monitoreo electroencefalográfico, buscando complejos periódicos de ondas agudas y puntas lentas, denominados descargas epileptiformes lateralizadas periódicas (PLEDS) (figura 1), con episodios de crisis de novo o deterioro neurológico. Las crisis recurrentes dan lugar a un aumento de la presión intracraneal, aumento de la actividad metabólica, acidosis y vasodilatación. El propio virus es capaz de inducir hiperexcitabilidad neuronal, con reducción del umbral de despolarización, y liberación de GABA dentro del circuito límbico y CA3 (mediado por la dinorfina, un transmisor inhibidor en las fibras musgosas aferentes) del hipocampo 17.
Necrosis retiniana aguda
La presentación clínica tiene un comportamiento bimodal, siendo más frecuente en la tercera década de la vida y en adultos mayores. Clínicamente se observa ojo rojo, dolor periorbitario y deterioro de la agudeza visual, con hallazgo de epiescleritis, precipitados queráticos, vasculitis retiniana y necrosis con desprendimiento de retina 18.
Compromiso neurológico por herpesvirus simple tipo II
El compromiso variable, con menos compromiso encefalítico se resumen en la gráfica 1 18,19.
Compromiso neurológico por varicela zóster
Cualquier neuroeje puede estar implicado, tiende a afectar los sitios cutáneos donde estuvo presente la mayor carga de las lesiones: tórax y cara dentro de la distribución del nervio trigémino. Los factores predisponentes incluyen diabetes mellitus, anestesia espinal, neoplasias -especialmente linfoma-, terapia con esteroides, agentes inmunosupresores y SIDA 1,3,20; se encuentra con mayor frecuencia en pacientes inmunosuprimidos y afecta al 0,5 % de los pacientes inmunocompetentes.
La neuralgia posherpética es la complicación neurológica más común del herpes zóster. Se define como dolor tipo ardor lancinante, en la distribución de la erupción, que persiste más de 4-6 semanas después del herpes zóster; aumenta con la edad, siendo más susceptibles los pacientes inmunosuprimidos 1,3).
La mielitis y las radiculitis (subaguda-crónica) se han identificado en el 50 % de los pacientes, consistentes en paraparesia, alteración de la sensibilidad en el nivel compatible con el segmento de reactivación del VZV y disfunción del esfínter; en este caso la neuritis óptica puede seguir en raras ocasiones como reacción inmunomediada 1,3.
En cuanto a la vasculitis, esta varía en función del tamaño de los vasos sanguíneos afectados: la arteritis granulomatosa unifocal de grandes vasos suele ser un trastorno en pacientes inmunocompetentes, en personas de edad avanzada, en el que se desarrolla isquemia cerebral semanas o meses después del compromiso trigeminal ipsilateral. La vasculopatía multifocal de vasos pequeños suele aparecer en pacientes inmunodeprimidos, se presenta sin lesiones cutáneas y consiste en déficits neurológicos multifocales subagudos acompañados de cefalea, fiebre, cambios comportamentales y episodios de crisis epilépticas 1,3.
El síndrome motor puede ocurrir dentro del primer día hasta cuatro meses, involucrando el segmento que se ve afectado por la erupción: parálisis facial periférica con herpes zóster ótico y erupción dentro del canal auditivo y la piel adyacente (síndrome de Ramsay-Hunt); oftalmoplejía por compromiso de tercer par craneal; y síndrome de debilidad en extremidades en asociación con herpes zóster dentro de los dermatomas cervicales y lumbosacro. La vejiga neurogénica y la pérdida del control del esfínter anal pueden seguir al herpes zóster sacro (gráfica 2) 1,3.
DIAGNÓSTICO
El diagnóstico requiere análisis paraclínicos en general, que incluyen el hemograma, buscando cambios leucocitarios y en plaquetas. De acuerdo con la anamnesis, deben ordenarse paraclínicos tóxicos o metabólicos, y en todo paciente en el que se encuentren lesiones por herpes virus genital debe descartarse infección por VIH; este virus puede producir un cuadro más larvado pero finalmente se puede confundir clínicamente con infección por VHS.
El estudio de líquido cefalorraquídeo (LCR) es obligatorio después de descartar riesgos de herniación y otras complicaciones. En caso de infección por virus, en el cito-químico se puede encontrar hiperproteinorraquia moderada o pleocitosis linfocítica (> 5/mm3), con glucosa baja o normal. La prueba de reacción en cadena de la polimerasa (PCR) se ha convertido en el estándar de oro para detectar herpesvirus tales como HSV-1, HSV-2 o VZV, pero también Epstein-Barr y citomegalovirus, con una sensibilidad del 96 % y una especificidad del 99 %. Es importante señalar que la ausencia de pleocitosis y una PCR falsamente negativa pueden presentarse al principio del cuadro clínico y en pacientes inmunodeprimidos (2-10 días después del inicio de la enfermedad). Un estudio demostró que el 26 % de los pacientes (sanos o inmunodeprimidos) con encefalitis por HSV tenía un recuento normal de glóbulos blancos en el LCR (menos de 5 células/mm 3). En caso de encontrarse hematíes, debe sospecharse una encefalitis necrotizante aguda con hemorragia que puede no verse claramente en las neuroimágenes. Cuando la sospecha es alta, los pacientes deben continuar el tratamiento y la PCR del VHS debe repetirse en 3 a 7 días. Se puede ver una carga viral de ADN de LCR inicial alta con un tiempo más prolongado de positividad de la PCR, por lo que puede requerir una duración prolongada del tratamiento 1,20.
Neuroimagen
La tomografía computarizada (TC) tiene una baja sensibilidad al principio del curso agudo (< 7 días). Se presenta hipodensidad de las regiones afectadas, típicamente el lóbulo temporal y la ínsula, lo que refleja el edema en la fase aguda o subaguda de la enfermedad y la encefalomalacia en la fase crónica. El sangrado también puede observarse en la TC 14,20,21.
La resonancia magnética puede mostrar hemorragia, necrosis y edema en los lóbulos temporales mediales, con extensión a otras áreas límbicas, incluidas ínsula, cíngulo y las cortezas frontales inferolaterales; la preservación de los núcleos lentiformes es típica en encefalitis. Es importante reconocer que hasta el 5 % de los pacientes con encefalitis tendrá una resonancia magnética normal; por lo tanto, las imágenes por sí solas no deben excluir el diagnóstico puesto que carece de especificidad. Las imágenes ponderadas por difusión (DWI) pueden revelar cambios en la intensidad de la señal (restricción), los cuales son más notorios que los de la inversión-recuperación atenuada por líquido (FLAIR), imágenes ponderadas en T2 o T1. La presencia de hallazgos anormales de imágenes de RM dentro del lóbulo temporal, especialmente en la región inferomedial y la corteza insular, se correlaciona estadísticamente con la positividad de la PCR. El realce parenquimatoso a menudo conforma un patrón irregular o giriforme, con contraste generalmente a los 10 días de síntomas (tabla 3 y figuras 2-4) 21.

Fuente: Autores
Figura 2 Caso 1: corte axial de RMN en secuencia T2 (A) y FLAIR (B) hiperintensidad temporal y parietal derecha con edema perilesional.
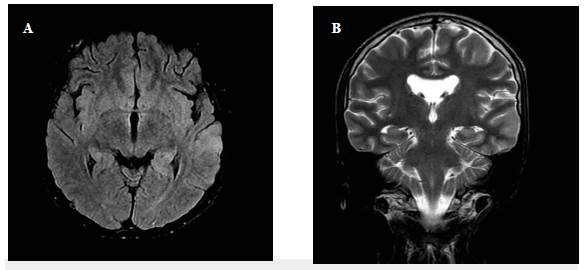
Fuente: Autores
Figura 3 Caso 2: corte axial de RMN en secuencia FLAIR (A) y coronal en T2 (B), hiperintensidad temporal izquierda.
TRATAMIENTO
1. La encefalitis es una emergencia médica, el tratamiento con aciclovir intravenoso reduce la mortalidad y la morbilidad ligadas a esta enfermedad. La dosis recomendada es de 10 mg/kg IV cada 8 horas durante 14-21 días, (recomendación de nivel A y calidad de la evidencia de nivel I de la Sociedad de Enfermedades Infecciosas de América (IDSA, por sus siglas en inglés) 22.
2. El tratamiento empírico se considera si:
- El LCR inicial o los hallazgos imagenológicos sugieren encefalitis viral, o dentro de las seis horas posteriores al ingreso si estos resultados no se encuentran disponibles, o si el paciente presenta deterioro progresivo del estado de conciencia (recomendación de nivel A y calidad de la evidencia de nivel II de las Guías Británicas)23.
- LCR normal, pero persiste la sospecha clínica de encefalitis por VHS o VZV (recomendación de nivel Ay calidad de la evidencia de nivel II de las Guías Británicas)23. Posteriormente al tratamiento debe repetirse la punción lumbar para confirmar que el LCR es negativo por PCR. Si el LCR sigue siendo positivo, se debe continuar con aciclovir por vía intravenosa, con PCR semanal hasta que sea negativo (recomendación de nivel By calidad de la evidencia de nivel II de las Guías Británicas)23.
3. El aciclovir puede interrumpirse en pacientes inmunocompetentes si:
- Se ha realizado un diagnóstico alternativo 23.
- La PCR en LCR es negativa en dos ocasiones con un intervalo de 24-48 horas, y la RM no es característica de encefalitis 23.
- La PCR del VHS en el LCR es negativa > 72 horas después del inicio de los síntomas neurológicos, RMN normal (realizada > 72 horas después del inicio de los síntomas) y un recuento de glóbulos blancos en el LCR < 5 mm3 (recomendación de nivel B y calidad de la evidencia de nivel III de las Guías Británicas)23.
4. Otros tratamientos
- Los corticosteroides no deben usarse de forma rutinaria en pacientes con encefalitis por HSV 22.
- VVZ: ciclo corto de corticoesteroides en pacientes con vasculitis (recomendación de nivel B y calidad de la evidencia de nivel II)22,23.
- Foscarnet 90 mg/kg iv cada 12 horas o 60 mg / kg iv cada 8 horas 14.
- Ganciclovir 5 mg/kg cada 12 horas 14.
Ajuste renal: la semivida plasmática del aciclovir es de aproximadamente 2-3 horas en pacientes con función renal normal, pero es más prolongada en aquellos con insuficiencia renal, para quienes se debe reducir las dosis, dado que puede precipitarse en los túbulos renales y causar nefropatía obstructiva 14,24.
- CrCl 25-50 ml/min: 10 mg/kg cada 12 horas.
- CrCl 10-25 ml/min: 10 mgkg cada 24 horas.
- CrCl <10 ml/min: 5 mg/ kg cada 24 horas.
5. Monitorización
En caso de requerir manejo en cuidado intensivo se sugiere seguir las recomendaciones de la tabla 4 14,24.
COMPLICACIONES
Encefalitis por anticuerpos anti-NMDA
Es una encefalitis autoinmune asociada con psicosis, crisis epilépticas, discinesias, hipoventilación e inestabilidad autonómica, atribuida a anticuerpos contra la subunidad GluNl del receptor de NMDA. Aproximadamente entre el 10 % y el 25 % de los pacientes se asocia con HSV-1, con una seroprevalencia de IgG superior al 60 % dentro de 3-5 semanas después de la recaída de los síntomas (LCR negativo para HVS, sin nuevas lesiones necróticas y sin respuesta al aciclovir) 25. La síntesis de anticuerpos puede comenzar entre 1-4 semanas (anticuerpos IgG contra receptores sinápticos NMDAR IgG e IgM positivos) después, con mejoría con inmunoterapia 26,27. Es importante destacar que la sintomatologia difiere en niños y adultos, con un intervalo de alrededor de 10 días entre el inicio de los síntomas. En cuanto a los niños, la coreoatetosis fue el hallazgo más destacado, seguido de irritabilidad, trastornos del sueño y falta de respuesta. En el paciente adulto se manifiesta con psicosis, comportamiento anormal o disfunción cognitiva, disfunción del habla (reducción verbal o mutismo), crisis epilépticas, discinesias, rigidez o posturas anormales, disfunción autónoma o hipoventilación central 28,29,30.
El diagnóstico con LCR muestra pleocitosis linfocítica, con resonancia cerebral sin progresión de anomalías en la señal T2 / FLAIR e imágenes ponderadas por difusión (DWI), ni lesiones necróticas 28-30. En cuanto al tratamiento, generalmente se opta con un segundo ciclo de aciclovir de 15-21 días e inmunoterapia (metilprednisolona 1 g al día por 5 días), inmunoglobulina intravenosa (Ig IV 0. 4 g/kg/día por 5 días) y plasmaféresis 5-7 ciclos (25); si no presenta mejoría puede tratarse con un ciclo de rituximab (375 mg/kg, semanal, 4 semanas) y ciclofosfamida (pulsos intravenosos mensuales, primera dosis: 500 mg/m2, segunda y siguientes dosis: 750 mg/m 2) 29. Los mecanismos establecidos son:
Lesión cerebral mediada por HSV que expone los anticuerpos al sistema inmunológico, lo que hace que el receptor sea más inmunogénico.
Alteración de la respuesta de la proteína desplegada, con el reconocimiento de las células inmunes autorreactivas.
Mimetismo molecular secundario.
Autoinmunidad sináptica: lisis neuronal viral e inflamación 29.
Secuelas
Se han observado hasta en un 40-50 % de los pacientes con encefalitis por HSV. El deterioro cognitivo es variable, con riesgo de demencia a cinco años del 4,6 % con HVS-1, sin secuelas neurológicas en pacientes con meningitis por HSV-2. El deterioro de la memoria reciente y episódica conlleva déficits de consolidación que impiden un nuevo aprendizaje. Las habilidades perceptivas, intelectuales y lingüísticas se conservan. La memoria semántica puede verse afectada, con alteración de identificación visuoespacial (GPS), el dibujo o la clasificación de imágenes de los elementos probados. Se observa una morbilidad considerable, especialmente por episodios de epilepsia y afecciones neuropsiquiátricas en el 24 % y el 22 %, respectivamente 31. Las alteraciones neuropsiquiátricas incluyen impulsividad, apatía, falta de planificación, perseverancia en la acción, dificultad para realizar cambios en la atención, rigidez, aplanamiento o labilidad emocional. Los síntomas psiquiátricos y conductuales preceden, acompañan y siguen la enfermedad aguda, probablemente relacionado con el compromiso del sistema límbico y las vías amigdalo-frontales como irritabilidad, depresión, manía, delirio, alucinaciones, trastornos de ansiedad y episodios disociativos, así como cambios en la sexualidad e hiperoralidad 32.
También se deben considerar teorías acerca de enfermedades neurodegenerativas a largo plazo con una alta probabilidad de causalidad con:
- Esclerosis múltiple (EM): la presencia de infiltración linfocítica autorreactiva multifocal genera afectación de la mielina y los axones. En muestras de tejido, fluidos corporales o células sanguíneas de pacientes con EM, el ADN del VHS fue positivo en el 45,1 % de los pacientes, por lo que se reactiva en la sangre durante los episodios clínicos agudos y las recaídas. Los estudios que utilizan HSV-1 recombinante que expresa IL-2 informaron la presencia de células T autorreactivas en el cerebro y la desmielinización del SNC, con porcentajes reducidos de CD8 +, lo que podrían esta asociado con respuestas deterioradas contra infecciones virales, control deficiente y agotamiento de las células T de la infección por HSV-1 5,33,34.
- Enfermedad Alzheimer: se presenta con formación de placas seniles y ovillos neurofibrilares. Los hallazgos epidemiológicos y experimentales de los últimos 20 años implican la activación repetida del HSV-1 en la patogénesis del deterioro cognitivo leve amnésico (aMCI) y la enfermedad de Alzheimer (EA). El aMCI produce déficits de memoria que no afectan las actividades diarias normales y puede ser prodrómica en EA con deterioro del control emocional, las rutinas diarias y la función. Las placas seniles se forman por la acumulación de beta amiloide (Aβ) y proteínas tau hiperfosforiladas con alteración de ensamblaje de microtúbulos, plasticidad sináptica y la función de las neuronas (daño sináptico y neurodegeneración). El HSV-1 se colocaliza con Aβ (produciendo acumulación y reducción de expresión del precursor de la proteína β amiloide), especialmente en portadores del alelo tipo 4 del gen de la apolipopro-teína E, con la presencia de anticuerpos IgM positivos. El compromiso con el sistema límbico (memoria y los procesos cognitivos) se relaciona con patrones de distribución de placa, lo que sugiere que este es un factor de susceptibilidad en enfermedad de Alzheimer 5,34.
PRONÓSTICO
La encefalitis puede alcanzar una mortalidad del 70 % en pacientes no tratados, con una mortalidad combinada del 30 % en pacientes tratados con antivirales, lo que conlleva una alta incidencia de secuelas neurológicas. En cuanto al compromiso por meningitis, mielitis, debilidad motora focal, neuropatía craneal múltiple, síndrome de Guillain Barré y neuralgia postherpética, el pronóstico es bueno posteriormente al manejo. La vasculopatía presenta un pronóstico desfavorable en la mayoría de los casos; alcanza una mortalidad de hasta un 25 % 1,3.