INTRODUCCIÓN
El síndrome de Guillain-Barré (SGB) es un trastorno neurológico caracterizado por polineuropatía mixta, desmielinizante y axonal; su etiopatogenia no está clara, pero se sabe que implica factores inmunológicos asociados con la destrucción de la mielina de los nervios periféricos 1. Es la causa más frecuente de parálisis flácida aguda no traumática en el mundo y, generalmente, se asocia con una infección viral previa al inicio de los síntomas 2). El cuadro clínico típico de SGB es la debilidad bilateral rápidamente progresiva, que en la mayoría de los casos inicia de manera distal en miembros inferiores y progresa de forma ascendente, acompañada de ausencia o supresión de los reflejos tendinosos 2. En la actualidad, los microorganismos más asociados con SGB son: Camppylobacter jejuni, Cytomegalovirus, Epstein-B arr, Mycoplasma pneumoniae y Haemophilus influen%ae3. En Colombia se ha visto un aumento de los casos de SGB posteriormente a la infección por el virus del zika y el chikungunya 4. El SGB también se ha descrito luego de la inmunización contra la influenza A, tétanos, difteria y rabia 5, sin embargo, esto representa menos del 10 % de los casos 6.
La infección por SARS-CoV-2 se ha asociado principalmente con síntomas respiratorios, no obstante, hay reportes de manifestaciones neurológicas secundarias a la infección, lo cual pone en evidencia el potencial neurotrópico del virus. Este se ha planteado mediante varios mecanismos: diseminación hematógena que invade las células endoteliales y los leucocitos, o vía transneuronal a través del tracto olfatorio o los pares craneales. También se ha documentado una respuesta anormal del sistema inmune, con componente humoral, en la cual los anticuerpos producidos se pueden unir a glucanos que son estructuralmente similares a los que se encuentran en los gangliósidos de las células de Schwann y de los oligodendrocitos, lo que lleva a una polineuropatía aguda desmielinizante 7. El virus tiene afinidad por los receptores de la enzima convertidora de angiotensina 2 (ECA2), los cuales se encuentran expresados a nivel cerebral, específicamente en células gliales, neuronas, células de la mucosa nasal epiteliales y ciliadas (8), e incluso en algunos pacientes se ha observado la presencia del SARS-CoV-2 en el líquido cefalorraquídeo (LCR) 9. En el 57 % de los casos se ha reportado síntomas neurológicos 10, los cuales pueden agruparse de acuerdo con la complicación neurológica que los desencadene: infección intracraneal, enfermedad cerebrovascular aguda, síntomas neuromusculares y síntomas por lesión en el sistema nervioso periférico, siendo esta última la complicación presente en el SGB 11.
En la actualidad, en la literatura se han reportado casos de SGB como complicación neurológica secundaria a infección por SARS-CoV-2 1, adicionalmente, la FDA emitió un comunicado el 13 de julio del 2021 que informa sobre el incremento de los casos de SGB después de la aplicación de la vacuna de Janssen 12. En Colombia, en mayo del 2021 se reportó el primer caso de SGB tras la primera dosis de la vacuna Sinovac 13. Dado el limitado conocimiento de la relación que pueden tener la infección por este nuevo virus y su vacunación con la presentación clínica del SGB, este artículo presenta una revisión sistemática de estudios de casos y series de casos que busca describir las características clínicas y sociodemográficas de pacientes diagnosticados con SGB postinfección o postvacunación contra SARS-CoV-2.
MATERIALES Y MÉTODOS
Criterios de elegibilidad
Se incluyeron artículos de reportes de caso y series de casos escritos en inglés o español, publicados entre el 2021 y el 2022. En los casos postinfección por SARS-CoV-2 se incluyeron los que presentaron diagnóstico confirmado por reacción en cadena de la polimerasa (PCR) positiva para ARN viral. En el grupo postvacunación se incluyeron casos con PCR negativa y sin inmunización previa con otras vacunas en los 3 meses anteriores. Se excluyeron los casos en población pediátrica, gestante y con presencia de otra emergencia médica concomitante, debido a las diferencias de la presentación clínica y de la implementación de la vacunación.
Métodos de búsqueda
Se realizó una búsqueda sistemática en las bases de datos de Pubmed, Embase y LILACS. Se utilizaron los descriptores MeSH "COVID-19", "Guillain Barré Syndrome" y el operador booleano AND. La búsqueda se realizó hasta junio del 2022. Se revisaron títulos y resúmenes de los artículos que cumplieran con ser reporte de caso o serie de casos, el resumen del caso debía ser de SGB postinfección por SARS-CoV-2 o postvacunación. Los artículos que cumplieron estos criterios fueron seleccionados para lectura completa del texto y posterior aceptación de al menos 2 de los autores, según el objetivo de la revisión y de conformidad con los criterios de elegibilidad descritos.
Extracción y análisis de datos
De los artículos seleccionados se registraron edad, sexo, comorbilidades, laboratorio de la vacuna, tiempo de inicio de síntomas, manifestaciones clínicas, método diagnóstico, tratamiento recibido y mortalidad. Para la síntesis de los datos, los casos clínicos se separaron en dos grupos: postinfección y postvacunación. Los resultados se registraron en una tabla, con las variables de interés y, a partir del total de casos, se calcularon la frecuencia absoluta y la relativa (porcentaje). A partir de los datos registrados se hizo una síntesis narrativa.
RESULTADOS
Búsqueda de literatura
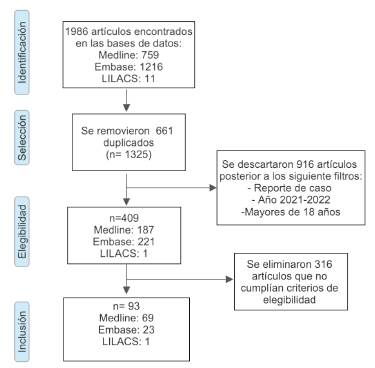
Inicialmente, se identificaron 1986 artículos en las tres bases de datos consultadas, y después de la aplicación de filtros y de la eliminación de reportes repetidos se obtuvieron 409 artículos, de los cuales se excluyeron 316 por no cumplir los criterios de elegibilidad. Se seleccionó un total de 93 estudios 14-106, de los cuales 77 fueron reportes de casos y 16 fueron series de casos, con un total de 131 casos (figura 1). De estos, se describieron 82 casos postinfección por SARS-CoV-2 y 49 casos postvacunación. En las tablas 1 y 2 se muestran las características de los casos incluidos.
SGB postinfección por SARS-CoV-2
En los casos postinfección, el sexo más afectado con SGB fueron los hombres, con un 63,8 %. Más de la mitad de los pacientes fueron adultos mayores entre 31 y 65 años, con el 62,1 % de los casos. De los 82 casos clínicos analizados, el 37,8 % presentó al menos una enfermedad de base, siendo la más frecuente la hipertensión arterial. La aparición de los síntomas neurológicos posteriormente al diagnóstico de covid-19 tuvo lugar mayoritariamente en los primeros 30 días, con un 71,9 % de los casos.
La clínica de SGB se caracterizó principalmente por paresia en las extremidades (93,9 % de los casos), que inició las más de las veces en las extremidades inferiores. Se describieron las alteraciones en la sensibilidad en un 46,3 % de los casos. Al examen físico la arreflexia estaba presente como signo en el 89 % de los casos. El compromiso de los pares craneales se encontró en el 36,5 % de los casos, siendo el principal afectado el nervio facial. La complicación más frecuente fue el compromiso respiratorio, en el 28 % de los casos, seguido de la disautonomía en el 18,2 %.
El diagnóstico de SGB se llevó a cabo mediante punción lumbar, con evidencia de disociación albuminocitológica en el 81,7 % de los casos y mediante electromiografía, en donde el 70,7 % de los casos presentó un patrón consistente con SGB.
El tratamiento más usado fue la inmunoglobulina intravenosa, en el 74,3 % de los casos, seguido de la plasmaféresis en el 8,5 %. En el 7,3 % de los casos fue necesario usar ambas terapias. El 8,5 % de los pacientes recibió manejo conservador. El 9,7 % de los pacientes falleció, principalmente por compromiso respiratorio (tabla 3).
Tabla 1 Características de los casos postinfección.
| Referenda | País | Edad (años) | Sexo (H: hombre M: mujer) | Comorbilidad | Periodo delatencia* (días) | Paresia en extremidades | Compromiso de sensibilidad | Arreflexia | Compromiso respiratorio | Disau tono mia | Compromiso de pares craneales | Disociación albunocitológica en LCR | EMG consistente con SGB | Tto | Mortalidad |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Reportes de caso | |||||||||||||||
| Bueso et al. (2021) | USA | 60 | M | No | 22 | Sí | No | Sí | Sí | Sí | No | Sí | No se realizó | IglV | No |
| Agosti et al. (2021) | Italia | 68 | H | Sí | 5 | Sí | No | Sí | No | No | Sí | Sí | Sí | IglV | No |
| Dufour et al. (2021) | USA | 36 | M | Sí | 21 | Sí | No | Sí | No | No | No | Sí | No se realizó | IglV | No |
| Raahimi et al. (2021) | UK | 46 | H | Sí | 53 | Sí | Sí | Sí | Sí | No | Sí | Sí | Sí | IglV | No |
| Defabio et al. (2021) | USA | 70 | M | Sí | 90 | Sí | Sí | Sí | No | Sí | No | Sí | No se realizó | IglV | No |
| Pelea et al. (2021) | Alemania | 56 | M | Sí | 7 | Sí | Sí | Sí | No | Sí | Sí | Sí | Sí | IgIV + Plasma- féresis | No |
| Singh et al. (2021) | USA | 45 | H | Sí | 7 | Sí | Sí | Sí | No | No | Sí | Sí | Sí | IgIV | No |
| Mackenzie et al. (2021) | Colombia | 39 | M | Sí | 0 | Sí | Sí | Sí | No | Sí | Sí | Sí | Sí | Plasma-féresis | No |
| Singhai et al. (2021) | India | 36 | H | No | 7 | Sí | No | Sí | No | No | No | Sí | Sí | IgIV | No |
| Hanif et al. (2021) | Pakistán | 32 | M | No | 21 | Sí | No | Sí | No | No | No | Sí | Sí | Plasma-féresis | No |
| Meshref et al. (2021) | Egipto | 18 | M | No | 0 | Sí | No | Sí | No | No | No | No se realizó | No se realizó | IgIV | No |
| Gagarkin et al. (2021) | USA | 70 | M | Sí | 21 | Sí | Sí | Sí | Sí | No | No | No se realizó | No se realizó | IgIV | No |
| ElAidouni et al. (2021) | Marruecos | 49 | H | No | 14 | Sí | Sí | Sí | No | Sí | No | Sí | Sí | IgIV + Plasma-féresis | No |
| Mokhashi et al. (2021) | USA | 56 | M | Sí | 0 | Sí | Sí | Sí | No | No | No | Sí | No se realizó | IgIV | No |
| Papri et al. (2021) | Bangladesh | 50 | H | Sí | 45 | Sí | Sí | Sí | No | Sí | No | No se realizó | Sí | IgIV | No |
| Brown et al. (2021) | USA | 53 | H | Sí | 9 | Sí | Sí | Sí | Sí | No | Sí | No se realizó | Sí | IgIV + Plasma-féresis | No |
| Haidary et al. (2021) | Afganistán | 61 | H | No | 21 | Sí | No | No | No | No | No | No se realizó | Sí | IgIV | No |
| Chmiela et al. (2021) | Polonia | 50 | H | No | 17 | Sí | Sí | Sí | No | No | Sí | Sí | Sí | Plasma-féresis | No |
| Sidhom et al. (2021) | USA | 59 | M | Sí | 0 | Sí | No | Sí | Sí | No | No | Sí | No se realizó | Conservador | Sí |
| Kajita et al. (2021) | Japón | 50 | M | No | 9 | Sí | Sí | Sí | No | No | No | Sí | Sí | IgIV | No |
| Brooks et al. (2021) | USA | 47 | H | Sí | 7 | Sí | No | No | No | Sí | Sí | No se realizó | No se realizó | IgIV | No |
| Kakumoto et al. (2021) | Japón | 22 | H | No | 16 | Sí | No | No | Sí | Sí | Sí | Sí | Sí | IgIV | No |
| Nejad et al. (2021) | Irán | 70 | H | No | 0 | Sí | Sí | Sí | Sí | No | No | Sí | No se realizó | IgIV | Sí |
| Censcak et al. (2021) | República Checa | 42 | H | Sí | 14 | Sí | Sí | No | No | Sí | Sí | Sí | Sí | IgIV | No |
| Biassoni et al. (2021) | Italia | 79 | H | Sí | 10 | No | No | Sí | No | Sí | No | Sí | Sí | IgIV | No |
| Yakoby et al. (2021) | USA | 35 | H | No | 16 | Sí | No | Sí | No | No | No | Sí | No se realizó | IgIV | No |
| Kang et al. (2022) | Corea del Sur | 73 | M | No | 0 | Sí | No | Sí | No | No | No | No | Sí | IgIV | No |
| Miyajan et al. (2021) | Arabia Saudita | 66 | H | Sí | 25 | Sí | No | Sí | No | No | No | Sí | Sí | IgIV | No |
| Shrestha et al. (2021) | Nepal | 64 | M | Sí | 17 | Sí | No | Sí | No | No | No | Sí | Sí | IgIV | No |
| Randhawa et al. (2021) | India | 33 | H | No | 14 | Sí | No | Sí | No | No | No | No se realizó | Sí | IgIV | No |
| Mehta et al. (2021) | India | 84 | H | Sí | 22 | Sí | No | Sí | No | No | No | Sí | Sí | IgIV | No |
| Biswas et al. (2021) | India | 49 | H | No | 7 | Sí | No | Sí | No | No | Sí | No se realizó | Sí | IgIV | No |
| Kaeley et al. (2022) | India | 40 | M | No | 12 | Sí | No | Sí | No | No | No | Sí | Sí | Conservador | No |
| Seixas et al. (2021) | Portugal | 85 | M | No | 0 | Sí | No | No | No | Sí | No | Sí | No se realizó | IgIV | No |
| Taguchi et al. (2022) | USA | 70 | M | No | 60 | Sí | No | Sí | No | No | Sí | Sí | Sí | IgIV | No |
| Ramirez et al. (2021) | Colombia | 50 | H | No | 19 | No | No | No | No | No | Sí | Sí | Sí | IgIV | No |
| Toy et al. (2022) | Turquía | 68 | H | Sí | 38 | Sí | No | Sí | No | No | No | Sí | Sí | Conservador | No |
| Nigatu et al. (2022) | Etiopía | 70 | H | No | 4 | Sí | No | Sí | Sí | No | No | Sí | Sí | IglV | No |
| Aryal et al. (2022) | Nepal | 68 | H | No | 5 | Sí | No | Sí | No | No | No | Sí | No se realizó | IglV | No |
| Mohammadi et al. (2022) | Irán | 30 | M | No | 30 | Sí | Sí | Sí | No | Sí | Sí | No se realizó | Sí | IglV | No |
| Zlvkovic et al. (2022) | Serbia | 57 | M | No | 9 | Sí | Sí | Sí | Sí | No | No | Sí | No se realizó | Conservador | Sí |
| Almeida et al. (2022) | Catar | 58 | H | Sí | 11 | Sí | Sí | Sí | Sí | No | No | Sí | No se realizó | IgIV | No |
| Faulkner et al. (2022) | UK | 66 | H | Sí | 14 | Sí | Sí | Sí | Sí | No | Sí | Sí | Sí | IgIV | No |
| Fletman et al. (2021) | USA | 67 | M | No | 71 | Sí | Sí | Sí | No | No | No | Sí | Sí | IgIV | No |
| Yang et al. (2021) | Corea del Sur | 62 | H | No | 17 | No | No | No | No | No | Sí | Sí | Sí | Conservador | No |
| Minalyan et al. (2021) | USA | 64 | H | No | No reporte | Sí | No | Sí | No | No | No | Sí | No se realizó | Plasma-féresis | No |
| Patti et al. (2021) | USA | 66 | H | No | 21 | Sí | No | No | Sí | No | No | Sí | Sí | IgIV + Plasma- féresis | No |
| Kamell et al. (2021) | Kuwait | 72 | H | Sí | 21 | Sí | Sí | Sí | No | No | No | Sí | Sí | IgIV | No |
| Ocak et al. (2021) | USA | 48 | H | No | 8 | No | No | No | No | No | Sí | Sí | Sí | IgIV | No |
| Series de casos | |||||||||||||||
| Abolmaali et al. (2021) | Irán | 88 | M | Sí | 0 | Sí | Sí | Sí | Sí | Sí | No | Sí | Sí | Plasma-féresis | No |
| 47 | H | No | 10 | Sí | No | Sí | Sí | Sí | Sí | Sí | Sí | Plasma-féresis | Sí | ||
| 58 | H | No | 7 | Sí | No | Sí | Sí | No | No | Sí | Sí | IgIV + Plasma-féresis | Si | ||
| Zubair et al. (2021) | USA | 32 | H | No | 65 | Sí | Sí | Sí | No | No | No | Sí | Sí | IgIv | No |
| 61 | H | Sí | 60 | Sí | Sí | Sí | Sí | No | No | Sí | Sí | Iglv | No | ||
| Manganotti et al. (2021) | Italia | 72 | H | No | 18 | Sí | Sí | Sí | Sí | No | Sí | Sí | No se realizó | IgIV | No |
| 72 | H | No | 30 | Sí | No | Sí | Sí | No | No | No | No se realizó | IgIV | No | ||
| 49 | M | No | 14 | Sí | Sí | Sí | No | No | Sí | Sí | No se realizó | IgIV | No | ||
| 94 | H | No | 33 | Sí | No | Sí | No | No | No | No se realizó | No se realizó | Esteroide | No | ||
| 76 | H | No | 22 | Sí | No | Sí | Sí | No | Sí | Sí | No se realizó | IgIV | No | ||
| Nanda et al. (2021) | India | 55 | M | Sí | 7 | Sí | No | Sí | Sí | No | No | Sí | Sí | IgIV | No |
| 72 | H | Sí | 4 | Sí | No | Sí | No | No | No | Sí | No se realizó | IgIV | Sí | ||
| 55 | H | Sí | 6 | Sí | Sí | Sí | No | No | No | Sí | Sí | IgIV | No | ||
| 49 | H | Sí | 6 | Sí | No | Sí | No | No | Sí | Sí | Sí | IgIV | No | ||
| Khan et al. (2021) | India | 27 | H | No | 5 | Sí | No | Sí | No | No | No | Sí | Sí | IgIV | No |
| 35 | M | No | 9 | Sí | Sí | Sí | No | No | No | Sí | Sí | Conservador | No | ||
| 40 | M | No | 20 | Sí | Sí | Sí | Sí | No | No | Sí | Sí | IgIV | Sí | ||
| 48 | M | No | 1 | Sí | No | Sí | No | No | No | Sí | Sí | IgIV | No | ||
| 50 | H | No | 2 | Sí | Sí | Sí | No | No | No | Sí | No se realizó | IgIV | No | ||
| Chan et al. (2021) | USA | 68 | H | No | 18 | Sí | Sí | Sí | No | No | Sí | Sí | No se realizó | Plasma-féresis | No |
| 84 | H | No | 23 | Sí | No | Sí | Sí | Sí | Sí | Sí | No se realizó | IgIV + Plasma- féresis | No | ||
| Jasso et al. (2022) | México | 53 | H | Sí | 8 | Sí | Sí | Sí | No | No | No | Sí | Sí | IgIV | No |
| 29 | M | Sí | 0 | Sí | No | Sí | No | No | Sí | Sí | Sí | IgIV | No | ||
| Saini et al. (2022) | India | 41 | H | No | 20 | Sí | Sí | Sí | No | No | Sí | Sí | Sí | IgIV | No |
| 35 | M | No | 6 | No | Sí | Sí | No | No | Sí | Sí | Sí | IgIV | No | ||
| 50 | M | No | 4 | Sí | Sí | Sí | No | No | Sí | Sí | Sí | IgIV | No | ||
| 65 | H | Sí | 60 | Sí | Sí | Sí | No | No | Sí | Sí | Sí | IglV | No | ||
| Ünlütürk et al. (2022) | Turquía | 61 | H | No | 0 | Sí | No | Sí | Sí | No | No | No se realizó | Sí | IglV | Sí |
| 47 | H | No | 14 | Sí | No | Sí | No | No | No | No se realizó | Sí | Conser | No | ||
| 79 | H | No | 30 | Sí | Sí | Sí | No | No | No | Sí | Sí | IglV | No | ||
| 46 | M | No | 21 | Sí | No | Sí | No | No | Sí | No se realizó | Sí | IglV | No | ||
| Elzouki et al. (2021) | Qatar | 49 | H | No | 0 | Sí | Sí | Sí | No | No | No | Sí | Sí | IglV | No |
| 43 | H | No | 0 | Sí | Sí | Sí | No | No | No | Sí | Sí | IgIV | No | ||
IgIV: Inmunoglobulina intravenosa; LCR: líquido cefalorraquídeo; EMG: electromiografía; USA: Estados Unidos; UK: Reino Unido.
* Periodo de latencia: tiempo transcurrido entre el inicio de síntomas respiratorios y el inicio de los síntomas neurológicos.
Fuente: propia de los autores.
Tabla 2 Características de los casos postvacunación.
IgIV: inmunoglobulina intravenosa; LCR: líquido cefalorraquídeo; EMG: electromiografía; USA: Estados Unidos; UK: Reino Unido.
* Periodo de latencia: tiempo transcurrido entre la aplicación de la vacuna y el inicio de los síntomas neurológicos.
Fuente: propia de los autores.
SGB postvacunación contra covid-19
La mayoría de los casos postvacunación se presentaron en adultos entre 31 y 65 años, con un 55,1 %. El 46,9 % de los casos presentó al menos una comorbilidad. Los síntomas iniciaron hasta 30 días después de la aplicación de la dosis, con un 75,5 % de los casos iniciando antes de los primeros 15 días. Más de la mitad de los casos ocurrió de forma posterior a la vacunación con AstraZeneca (51 %), seguidos de Pfizer (28,5 %).
El cuadro clínico en estos pacientes se caracterizó principalmente por paresia en extremidades y arreflexia, presente en el 83,6 % de los casos, seguido de compromiso de los pares craneales en el 51 % de los casos. El compromiso de la sensibilidad estuvo presente en el 48,9 % de los casos. Dentro de las complicaciones asociadas se describieron el compromiso respiratorio en el 26,5 % de los casos y la disautonomía en el 12,2 %.
El diagnóstico se hizo principalmente por medio de disociación albuminocitológica en líquido cefalorraquídeo, en el 81,6 % de los pacientes, mientras que los estudios de conducción nerviosa fueron indicativos de SGB en el 67,3 % de los casos.
En el 79,5 % de los casos se realizó tratamiento con inmunoglobulina intravenosa, en el 4 % con plasmaféresis y en el 10,3 % se hizo uso de ambas. El 2 % tuvo manejo conservador. Todos los pacientes presentaron mejoría de los síntomas (tabla 3).
Tabla 3 Síntesis de las características de casos de SGB
| Postvacunación n (%) | Postinfección n (%) | |
|---|---|---|
| Mujer | 24 (48,9 %) | 29 (35,3 %) |
| Hombre | 25 (51 %) | 53 (63,8 %) |
| 18-30 años | 4 (8,1 %) | 5 (6 %) |
| 31-65 años | 27 (55,1 %) | 51 (62,1 %) |
| > 65 años | 18 (36,7 %) | 26 (31,7 %) |
| Presencia de comorbilidades | 23 (46,9 %) | 31 (37,8 %) |
| Laboratorio de vacuna | AstraZeneca: 25 (51 %) | |
| Pfizer: 14 (28,5 %) | ||
| Janssen: 4 (8,1 %) | ||
| Moderna: 3 (6,1 %) | ||
| Sinopharm: 2 (4%) | ||
| Concomitante: 12 (14,6 %) | ||
| Inicio de aparición de los síntomas neurológicos | <15 días: 37 (75,5 %) | <30 días: 59 (71,9 %) |
| 15-30 días: 11(22,4 %) | 30-60 días :7 (8,5 %) | |
| No reporta: 1 (2 %) | >60 días: 3 (3,6 %) | |
| No reporta: 1 (1,2 %) | ||
| Paresia de extremidades | 41(83,6 %) | 77 (93,9 %) |
| Arreflexia | 41 (83.6 %) | 73 (89 %) |
| Compromiso de la sensibilidad | 24 (48,9 %) | 38 (46,3 %) |
| Disautonomía | 6 (12,2 %) | 15 (18,2 %) |
| Compromiso respiratorio | (26,5 %) | 23 (28 %) |
| Compromiso de pares craneales | 25 (51 %) | 30 (36,5 %) |
| Disociación albuminocitológica en LCR | 40 (81,6 %) | 67 (81,7 %) |
| EMG consistente con SGB | 33 (67,3 %) | 58 (70,7 %) |
| Tratamiento | ||
| -IgIV | 39 (79,5 %) | 61 (74,3 %) |
| -Plasmaféresis | 2 (4 %) | 7 (8,5 %) |
| -IgIV + Plasmaféresis | 5 (103 %) | 6 (7.3 %) |
| -Conservador | 1 (2 %) | 7 (8,5 %) |
| -Mortalidad | 0 | 8 (9,7 %) |
LCR: líquido cefalorraquídeo; IGIV: inmunoglobulina intravenosa; EMG: electromiografía.
Fuente: propia de los autores.
DISCUSIÓN
Este artículo busca describir las principales características del SGB postinfección por SARS-CoV-2 y postvacunación. Los datos registrados en esta revisión sobre grupo etario y sexo más afectados son consistentes con un metaanálisis de estudios observacionales realizado por Palaiodimou et al. en el 2021, quienes encontraron que la edad promedio fue de 58,9 años y que el sexo masculino fue más prevalente. Estos autores también estimaron la tasa de prevalencia de SGB en pacientes con infección por SARS-CoV-2, que fue de 0,015 %, correspondiente a 15 por cada 100.000 casos 107. Para patógenos más asociados con SGB, Campylobacter jejuni y citomegalovirus, se ha descrito una incidencia de 25 a 65 (0,025-0,065 %) y 60 a 220 (0,060-0,22 %) por cada 100.000 casos de infección, respectivamente 108. La menor asociación entre SGB y SARS-CoV-2 en comparación con estos otros microorganismos podría relacionarse con mecanismos moleculares particulares de este virus para la polineuropatía, los cuales aún no han sido dilucidados.
El SGB se subclasifica clínicamente, siendo cuatro las variantes más destacadas: la polirradiculoneuropatía des-mielinizante inflamatoria aguda es la variante más frecuente, con pronóstico favorable y manifestaciones principalmente desmielinizantes; la neuropatía motora axonal aguda, que es menos común, con peor pronóstico y se manifiesta con afectación motora pura y lesión axonal; la neuropatía sensitivo-motora axonal aguda que comparte patogénesis con la anterior variante y adicionalmente presenta compromiso sensorial; y el síndrome de Miller-Fisher, que difiere clínicamente de las demás variantes y presenta una triada clásica de oftalmoparesia, arreflexia y ataxia 109. En esta revisión, los casos postinfección se manifestaron en su mayoría como el SGB clásico, con paresia en miembros inferiores que progresó ascendentemente hasta comprometer los miembros superiores y se asoció con arreflexia en el examen físico. En el 2021 Sheikh et al. realizaron una revisión sistemática que incluyó 94 casos de SGB asociados con infección por SARS-CoV-2, y el cuadro clínico predominante fue también similar al clásico 110. Estos datos son similares a los reportados para SGB asociado con virus del zika, donde se ha descrito debilidad de las extremidades en el 97% (IC 95% 93-99), reflejos disminuidos/ausentes en el 96 % (IC 95 % 88-100), compromiso de la sensibilidad en el 82 % (IC 95 % 76-88) y parálisis facial en el 51 % (IC 95 % 44-58). Sin embargo, para el SGB asociado con zika se describe un periodo de latencia entre los síntomas infecciosos y neurológicos de 5 a 12 días, mientras que en nuestros resultados evidenciamos que los síntomas neurológicos pueden aparecer concomitante hasta 60 días después del inicio de los síntomas respiratorios 111.
En nuestra revisión sistemática, el cuadro clínico de SGB postvacunación también se caracterizó mayoritariamente por paresia de extremidades y arreflexia, pero hubo un número destacable de casos en los cuales la principal manifestación fue el compromiso de la sensibilidad y la afectación de los nervios craneales, principalmente el compromiso del nervio facial. Estos datos podrían sugerir que la presentación postvacunación puede ser atípica o correlacionarse con las variantes clínicas menos comunes del SGB. No se encontraron estudios en la literatura que describan el cuadro clínico de SGB posterior a vacunación viral.
El SGB se ha asociado con la vacuna de la influenza y se sabe que el riesgo de presentarlo es de 1-2 casos por cada millón de dosis aplicadas 112. En el 2020 Wang et al. llevaron a cabo una revisión sistemática y un metaanálisis y estimaron la incidencia de SGB asociada con vacunas virales, incluyendo contra la influenza, virus del papiloma humano, poliomielitis, hepatitis, sarampión y rubéola, con un resultado de 5,29 por cada millón de inmunizados (IC 95 %: 3,66-6,93 por millón), siendo con mayor frecuencia la vacuna viral inactivada 113. Sin embargo, para la vacunación contra SARS-CoV-2, no hay estudios hasta el momento que demuestren una clara asociación.
Las dos complicaciones potencialmente mortales del SGB son la disautonomía y el compromiso respiratorio. La primera puede estar presente hasta en el 65 % de los pacientes, se caracteriza por arritmias cardiacas, variaciones en la presión arterial, retención urinaria y disfunción gastrointestinal, entre otras manifestaciones 114. Esta complicación puede estar asociada con un grado de discapacidad más alto y un aumento en el riesgo de mortalidad en pacientes con SGB 15. La complicación del sistema respiratorio ocurre en la fase aguda por compromiso del diafragma 114. En un estudio observacional publicado en el 2020 por Gupta et al. se incluyeron 96 pacientes, de los cuales el 54,2 % presentó manifestaciones cardiovasculares. Estos autores evidenciaron que la afectación bilateral del nervio facial, las complicaciones cardiovasculares y la disautonomía se asociaron con peor desenlace 115. De los casos incluidos en la presente revisión, 8 fallecieron, todos casos postinfección, de los cuales 6 presentaron falla respiratoria y 2 presentaron disautonomía manifiesta en retención urinaria, alteración en la presión arterial y alteración de la frecuencia cardiaca, la cual progresó hasta llevar a compromiso respiratorio y deceso del paciente. Uno de estos pacientes presentó compromiso bilateral del nervio facial. Es importante aclarar que, aun cuando la principal causa de muerte fue el compromiso respiratorio, no se puede estimar si este fue una complicación directa del SGB o se relacionó con covid-19.
El diagnóstico de SGB se realizó principalmente con disociación albuminocitológica y electromiografía. En el trabajo publicado por Sheikh et al. se puso en evidencia, adicionalmente, un aumento de los niveles de glucosa en los estudios de LCR, en especial en los casos con presentación clásica de SGB 110. En los casos incluidos en esta revisión no se reportaron los estudios citoquímicos completos del LCR.
El tratamiento para SGB disponible en la actualidad incluye plasmaféresis e inmunoglobulina intravenosa (IgIV), ambas terapias con efectos benéficos sobre la respuesta inmunológica generada por el SGB 116. No hay evidencia sobre diferencias en efectividad entre ambas. En los casos descritos en este artículo la mayoría de los pacientes recibió 5 dosis de IgIV a 0,4 mg/kg. Este esquema fue utilizado según los protocolos de las instituciones de salud donde se encontraban los pacientes. En menor frecuencia se usó la plasmaféresis. En los pacientes que no presentaban mejoría con un solo manejo, se utilizaron ambas terapias. No se describieron diferencias en la evolución del SGB según los tratamientos utilizados.
El SGB se puede desarrollar tanto postvacunación como postinfección por SARS-CoV-2, pero se requieren estudios a más largo plazo y con mayor población que permitan caracterizar mejor esta entidad en los casos postvacunación y estimar con precisión la relación entre las vacunas y otros factores de riesgo asociados con el desarrollo de SGB. Hasta el momento, la vacunación ha demostrado disminuir la mortalidad asociada con la infección y evitar que se desarrollen formas graves de la enfermedad diferentes a las neurológicas 116.
La presente revisión sistemática se basa en reportes de casos y series de casos, por tanto, se ve limitada en relación con el establecimiento de causalidad, puede excluir estudios de menor calidad en la búsqueda, por reducir el sesgo de selección, e impide la estimación de un tamaño del efecto, porque no se trata de casos o series de casos controlados.
La síntesis cualitativa presentada no permite realizar estimaciones inferenciales para determinar el riesgo de presentar SGB postvacunación.
CONCLUSIONES
El SGB se puede presentar como complicación neurológica post o parainfecciosa en los casos de covid-19, por lo cual debe sospecharse ante el cuadro clínico de neuropatía desmielinizante con antecedentes o síntomas concomitantes sugestivos de covid-19 117. Esta revisión sistemática es una de las pocas que recopilan variables sociodemográficas y clínicas del SGB postinfección o postvacunación para covid-19, utilizando reportes y series de casos. Estos datos aportan a la caracterización de una complicación de una entidad emergente de impacto mundial y sugieren diferencias entre los casos postinfecciosos y postvacunación en relación con las variables incluidas. Los resultados pueden resultar de interés tanto en la práctica clínica actual como en el consejo médico asociados con el covid-19 y su vacunación.