Introducción
El vínculo entre la depresión y la ansiedad con la disbiosis se encuentra respaldado por evidencia científica, tanto en estudios preclínicos, como en correlaciones epidemiológicas y clínicas 1-3. Sin embargo, los mecanismos moleculares que vinculan las dos condiciones no han sido totalmente dilucidados, y es de particular interés de los autores consolidar y organizar información reciente sobre los principales y potenciales mecanismos identificados.
Según el DSM-5, el trastorno depresivo mayor puede diagnosticarse clínicamente en las personas que cuenten con cinco o más de los siguientes síntomas durante dos semanas, siempre y cuando estos representen un cambio sobre el funcionamiento previo: estado de ánimo deprimido la mayor parte del día, disminución del interés o placer por las actividades diarias, pérdida importante o aumento de peso, insomnio o hipersomnia, agitación o retraso psicomotor, fatiga, sentimiento de inutilidad o culpabilidad y disminución de las capacidades de concentración y de toma de decisiones 4. El espectro de la depresión no se limita a este trastorno y se considera que, en términos generales, encabeza las listas de contribución a la carga global de enfermedad con aproximadamente 350 millones de personas afectadas, siendo también para el año 2023, la primera causa de carga mundial de morbilidad 5-8. La depresión constituye un problema de salud pública e implica altos costos socioeconómicos, además, se tiene estimado que entre los años 2016 y 2030, la atención e intervención a pacientes con depresión implicará un total de gastos que se elevarán a USD 147 000 billones a nivel global 9. En Colombia, el Ministerio de Salud ha arrojado cifras de prevalencia hasta de un 11,7 % 10. Concomitantemente, la ansiedad se define como la presencia de dos o más de los siguientes síntomas durante la mayoría de los días de un episodio de depresión mayor o de un trastorno depresivo persistente: sensación de tensión o nerviosismo, inquietud inhabitual, dificultad para concentrarse debido a las preocupaciones, miedo a que suceda algo terrible o sentimiento de perder el control de sí mismo 4. Según la Organización Mundial de la Salud (OMS), en el 2019, 301 millones de personas vivieron con ansiedad, incluyendo 58 millones de niños y adolescentes 11. Los trastornos de depresión y ansiedad tienen un gran impacto en la vida de las personas, afectan sus relaciones interpersonales y su calidad de vida, además de desencadenar síntomas físicos como tensión muscular, fatiga, trastornos del sueño, favorecer el abuso de sustancias y aumentar el riesgo de padecer otros desórdenes mentales 12.
La microbiota, por su parte, ha sido definida como el conjunto de microorganismos (virus, bacterias, arqueas y eucariotas inferiores y superiores) que coexisten simbióticamente en nuestros cuerpos; y el microbioma ha sido definido como el hábitat entero de estos microorganismos: los productos génicos expresados por ellos que entran en interacción con nuestro cuerpo y las condiciones ambientales exteriores a los mismos. El microbioma intestinal, en relación con el sistema nervioso central (SNC), el sistema nervioso entérico (SNE) y el sistema inmune de mucosas, ha constituido un punto de alto interés en la ciencia global durante la última década. Esta asociación establecida entre el intestino y el cerebro se basa en una comunicación mediada por vías neuronales, sensoriales y neuroendocrinas, donde la alteración del llamado eje cerebro-intestino, con incremento de la permeabilidad intestinal secundaria a alteraciones de la composición de la microbiota o "disbiosis", se ha asociado con enfermedades neurológicas y neuropsiquiátricas, como la depresión y la ansiedad 13-15.
El presente artículo pretende describir los principales mecanismos biológicos que explicarían la aparición de los síntomas depresivos y ansiosos asociados a la alteración de la microbiota, a partir de la evidencia de trabajos clínicos y preclínicos. La revisión de literatura con respecto a la pregunta central de investigación se realizó desde el año 2010 hasta el 2024, buscando con los términos MeSH: Anxiety, Depressione IntestinalMicrobiome, y palabras clave como: Dysbiosis, Gut-Brain Axis, Intestinal Permeability, Molecularmechanisms y Neurobiology. Estas búsquedas se realizaron en las bases de datos PubMed y Scielo, incluyendo 15 revisiones de literatura, 4 revisiones sistemáticas y 11 documentos científicos originales; seleccionados a criterio de los autores según el objetivo de la revisión (tabla 1). La búsqueda se hizo en idiomas español e inglés.
Tabla 1 Artículos seleccionados
| Tipo de artículo | Año de publicación | Total de artículos revisados | Total de artículos revisados de cada tipología |
|---|---|---|---|
| Revisión | 2010 | 1 | 15 |
| 2011 | 1 | ||
| 2012 | 2 | ||
| 2013 | 1 | ||
| 2018 | 2 | ||
| 2020 | 2 | ||
| 2022 | 1 | ||
| 2023 | 1 | ||
| 2024 | 4 | ||
| Investigación original | 2010 | 1 | 11 |
| 2011 | 2 | ||
| 2012 | 3 | ||
| 2015 | 1 | ||
| 2018 | 1 | ||
| 2022 | 1 | ||
| 2023 | 2 | ||
| Revisión sistemática | 2020 | 3 | 4 |
| 2022 | 1 |
Fuente: elaboración propia.
Un punto crucial en cualquier discusión sobre este tema se relaciona con la cuestión de cómo la microbiota puede influir en un órgano remoto como lo es el cerebro. Teóricamente, se han planteado múltiples y posibles mecanismos relacionados entre sí basados en las interacciones bidireccionales entre la microbiota intestinal, la permeabilidad intestinal y el SNC.
La vía vagal en el contexto de la depresión y la ansiedad
El nervio vago es un nervio mixto compuesto por un 80 % de fibras aferentes y un 20 % de fibras eferentes. Tiene un papel fundamental en la conciencia interoceptiva, gracias a la capacidad de detectar diferentes metabolitos, producto del microbioma por medio de sus fibras aferentes y la posterior transferencia de esa información al SNC, específicamente al núcleo solitario del bulbo raquídeo, para que posteriormente sea integrada por vías solitario-hipotalámicas y solitario-talámicas-insulares, y se genere una respuesta adaptada o inapropiada según el caso 16-17.
Se ha demostrado que las fibras aferentes vagales se distribuyen en: las puntas apicales de las vellosidades intestinales, por debajo de la pared epitelial, alrededor de las glándulas intestinales o criptas y a lo largo de las glándulas antrales gástricas, sin embargo, estas fibras no cruzan la capa epitelial, es decir, no están en contacto directo con la microbiota luminal intestinal, por lo que algunos mecanismos por los cuales se detectan las señales de la microbiota parecen ser indirectos 16,18. La difusión de metabolitos o compuestos bacterianos y la mediación de las células transmisoras de señales luminales parecen ser importantes en este proceso, especialmente las células enteroendocrinas (EEC). Estas corresponden al 1 % de las células epiteliales intestinales y exponen su contenido al exterior ante la presencia de proteínas, triglicéridos y ciertos carbohidratos, modulando la motilidad intestinal y la ingesta de alimentos 19. Las EEC interactúan con las aferentes vagales, ya sea por medio de la activación de los receptores 5-HT3 secundaria a la liberación local de serotonina, o por la acción de moléculas intestinales como la colecistoquinina (CCK, según sus siglas en inglés) y el péptido-1 similar al glucagón, sobre receptores específicos expresados en las aferentes vagales 16.
También se ha descrito que los ácidos grasos de cadena corta (SCFA, según sus siglas en inglés) y algunos de cadena larga, como el oleato, están involucrados en la detección de señales de la micro-biota a través del nervio vago. Los ácidos grasos que son producidos por la misma microbiota tienen la capacidad de activar fibras vagales en dependencia al compuesto específico: así, mientras el oleato actua mediante un mecanismo mediado por CCK, el butirato tiene un efecto directo sobre las aferentes vagales 20. Adicionalmente a estos mecanismos, se ha descrito que los receptores tipo Toll 4 (TLR4) se expresan en las fibras aferentes vagales, confiriendo la capacidad de detectar productos bacterianos como lipopolisacáridos (LPS) para activar el sistema a nivel de los ganglios nodosos o inferiores del vago 21-22.
En los modelos animales, la administración de Campylobacter jejuni en el intestino provoca un cuadro similar a la ansiedad, en cuyo contexto se evidencia un incremento de la actividad en el núcleo solitario y en otras áreas relacionadas con el relevo de la sensibilidad visceral del vago 23. Además, en el caso de ratones infectados intestinalmente con el parásito no invasivo Trichuris muris, estos también exhiben un comportamiento similar a la ansiedad, asociado a una disminución de la expresión del factor neurotrófico derivado del cerebro (BDNF, según sus siglas en inglés) en el hipocampo, junto con aumentos en la circulación de citoquinas como TNF-α e IFN-y, cambios que se han explicado a través de la vía neural vagal 24. También se ha descrito la relación del nervio vago con los efectos conductuales de los LPS microbianos, ya que los LPS pueden provocar comportamientos ansiosos y depresivos en modelos animales y hay evidencia de que los ratones sometidos a vagotomía previa a la exposición a LPS no muestran estos comportamientos depresivos 25-26. Por otro lado, la administración intraduo-denal de probióticos o bacterias no patógenas como Bifidobacterium longum y Lactobacillus rhamnosus dan como resultado un efecto ansiolítico y generan cambios en la expresión de las subunidades de los receptores de GABA, en sectores límbicos como la amígdala y en el hipocampo, efectos que se sugieren son mediados vía vagal 27.
Según estos datos, las fibras aferentes del vago, de manera directa o indirecta, pueden detectar y transmitir señales de la microbiota intestinal al cerebro, lo que podría influir en la aparición de depresión. Asimismo, los cambios cerebrales en respuesta al estrés pueden causar hiperpermeabilidad intestinal e inflamación mediada por las fibras eferentes del vago, lo cual podría agravar la depresión. En humanos, es notable que la estimulación del nervio vago tiene un efecto antiinflamatorio y ha demostrado ser eficaz en el tratamiento de la depresión; no obstante, la depresión suele estar acompañada de un tono vagal bajo, lo cual puede deberse a la respuesta al estrés y contribuir a la patogénesis de la depresión 28-30.
El incremento de la permeabilidad intestinal y la vía circulatoria
El epitelio intestinal actúa como barrera física, absorbe nutrientes, contiene las células entero-endocrinas y, en conjunto con la lámina propia, contiene un gran depósito de células inmunitarias, en su mayoría linfocitos CD8+ 31-33. El deterioro de la función de la barrera intestinal, y por ende, el aumento de su permeabilidad, permite la translocación bacteriana y de metabolitos a través de la pared hacia la circulación y en el tejido linfoide 34, y aunque los mecanismos de daño de la barrera intestinal no están totalmente dilucidados, el contexto de la disbiosis y la prevalencia de cepas bacterianas patogénicas podría explicar la pérdida de las proteínas de oclusión en las uniones estrechas de la misma. La evidencia sugiere una relación directa entre dietas altas en grasas y dietas no saludables, la aparición de disbiosis y la alteración de la permeabilidad intestinal 35; además, el aumento de la exposición a estas bacterias por parte de las células inmunes de la mucosa produce una respuesta inmunitaria que desencadena liberación de citocinas proinflamatorias, la activación del sistema vagal y una modulación del SNE y del SNC, amplificando el daño (figura 1) 34.
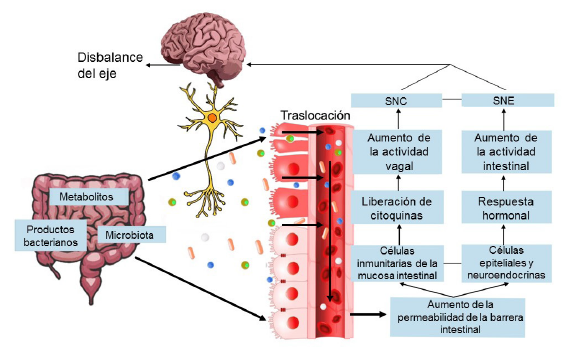
Notas: la exposición de las células epiteliales, neuroendocrinas o inmunitarias de la mucosa intestinal puede provocar la activación de una respuesta inmunitaria y la liberación de citoquinas proinflamatorias, que dan como resultado un aumento de la actividad vagal y de la actividad intestinal, que repercute sobre el SNC, dando como resultado final un desbalance del eje microbiota-intestino-cerebro.
SNC: sistema nervioso central; SNE: sistema nervioso entérico; LPS: lipopolisacárido.
Fuente: elaboración propia.
Figura 1 Permeabilidad y microbiota intestinal
En el año 2017, Stevens et al. 36 llevaron a cabo un estudio observacional transversal para investigar la posible relación entre la disbiosis intestinal, la ansiedad y la depresión en humanos, comparando pacientes con estos diagnósticos con un grupo control. En este estudio se midió la permeabilidad intestinal con niveles de los biomarcadores zonulina y proteína ligante de ácidos grasos intestinal (FABP2) en plasma, y se registraron también los niveles de LPS en plasma. Adicionalmente, se analizaron muestras de heces de todos los participantes para determinar la composición de la microbiota intestinal. Los pacientes con ansiedad o depresión presentaron niveles más altos de zonulina y FABP2 en plasma que los controles sanos, tenían niveles elevados de LPS en plasma y presentaron cambios en la composición de su microbiota intestinal, incluyendo una disminución en la diversidad de la microbiota y abundancia relativa de ciertas especies de patobiontes 36. Recientemente, también se ha documentado que los biomarcadores de permeabilidad intestinal, como la calprotectina y la LBP (lipo-polysaccharide-bindingprotein o proteína de unión a lipopolisacáridos), están correlacionados con la depresión en pacientes con enfermedad inflamatoria intestinal y que los niveles de zonulina en heces están estrechamente relacionados con la nutrición, los niveles de ansiedad, el cortisol y la secreción de serotonina en pacientes con síndrome del intestino irritable 37-38. La alteración de la permeabilidad intestinal con el abordaje a circulación y la vía vagal constituyen los dos medios más descritos en la literatura científica actual para la diseminación de bacterias, subproductos y metabolitos hacia el SNC, donde generan fenómenos inflamatorios que afectan las funciones emergentes del mismo 39-40.
Metabolitos bacterianos: acción en el sistema nervioso central
Como se ha mencionado previamente, los LPS y los SCFA parecen ocupar un lugar protagónico en la alteración del eje cerebro-intestino. Localmente, los LPS activan los receptores toll-like presentes en neuronas aferentes sensoriales, células epiteliales y neuronas entéricas, donde en conjunto con otras sustancias producidas por bacterias, modulan su actividad y, a través de la vía vagal, alteran la función del SNC 41. Así mismo, se ha descrito como un producto bacteriano que puede ser absorbido por el torrente sanguíneo y afectar diferentes sitios del encéfalo a través de esa vía. En el SNC se ha reportado que los LPS activan el receptor Toll tipo 4 en las células microgliales, las cuales inducen la liberación de citocinas inflamatorias 42. También se ha descrito una asociación entre el incremento de LPS y los cambios de comportamiento y estados de ánimo durante (o posteriores) una enfermedad aguda, lo cual los ha postulado como un factor relacionado con los mecanismos de depresión y ansiedad. Además, la IgA y la IgM anti-LPS de las bacterias intestinales se han encontrado elevadas en sangre de pacientes con diagnóstico de depresión, ansiedad, y síndrome de fatiga crónica, reflejando un potencial papel de LPS en la patogénesis de estas condiciones 43.
Por otro lado, los ácidos grasos de cadena corta son en su mayoría derivados del catabolismo bacteriano de los carbohidratos por parte del microbioma gastrointestinal, siendo afectada su producción según la disponibilidad del sustrato, la composición bacteriana de la microbiota y el tiempo de tránsito intestinal 44-45. Estos ácidos actúan como moléculas de señalización al unirse a receptores acoplados a proteínas G, Gpr41 y Gpr43, presentes en las células epiteliales e inmunitarias intestinales, provocando una respuesta inflamatoria e inmune que puede ser de utilidad durante un cuadro clínico de infección aguda. En relación con la síntesis de neurotransmisores, el butirato ha evidenciado incrementar la producción serotoninérgica y dopaminérgica, tanto a nivel entérico como central, estando estas sustancias involucradas en la regulación de funciones perceptuales, afectivas, autonómicas y de aprendizaje por gratificación, entre otros 46. Así mismo, los SCFA han evidenciado una disminución de la inflamación por medio de la acción directa en las microglías y la regulación de la plasticidad sináptica, a través de la activación de cascadas de señalización mediadas por sus receptores 47-48. La desregulación de esta activación puede provocar una respuesta exagerada con inflamación y activación del sistema nervioso simpático a través de las neuronas ganglionares, influyendo también en el comportamiento, en la producción de neurotransmisores y en la señalización neuronal 49-50. Esta desregulación se caracteriza por estrés oxidativo, depleción de glutatión y perfiles de fosfolípidos y acilcarnitina alterados 51.
En el año 2018, un estudio preclínico evaluó si los ácidos grasos de cadena corta podrían contrarrestar los efectos del estrés crónico, a través de suple-mentación oral de acetato, propionato y butirato en modelos murinos. Se encontró disminución de las alteraciones del comportamiento en la búsqueda de recompensa y de la capacidad de respuesta a desencadenantes agudos, asociados a disminución de la permeabilidad intestinal y, adicionalmente, se exhibieron efectos antidepresivos 52. En estudios realizados en humanos, se ha documentado que el contenido de ácidos grasos de cadena corta en el suero de pacientes que experimentan un primer episodio de depresión es significativamente mayor en comparación con el grupo control, además, se ha observado que este contenido muestra una correlación positiva con las puntuaciones en escalas de ansiedad, sugiriendo una relación directa entre los niveles de estos ácidos y el aumento de los síntomas ansiosos 53. Asimismo, se ha descrito que las alteraciones en los niveles de estos ácidos grasos están asociadas tanto con síntomas depresivos como con problemas gastrointestinales en adultos jóvenes, lo que refuerza la conexión entre el eje intestino-cerebro y las manifestaciones psiquiátricas. Estos hallazgos destacan a los SCFA, no solo como actores clave en las alteraciones conductuales y afectivas vinculadas a la disbiosis intestinal, sino también como posibles blancos para el desarrollo de nuevas estrategias terapéuticas en el tratamiento de trastornos afectivos y gastrointestinales asociados 54-55.
Es importante considerar que la relación entre el intestino y el cerebro es bidireccional y es así como la disbiosis se ha relacionado con los mecanismos neurobiológicos de depresión y ansiedad a través de las vías vagal y circulatoria, los cambios neurológicos asociados al estrés propio de estas condiciones activan mecanismos centrales que agravan el contexto de la microbiota intestinal o incluso, generan la disbiosis 56-57. En el estado de estrés crónico, la activación del eje hipotalámico hipofisiario adrenal (HHA) genera la síntesis y secreción de cortisol, el cual aumenta sus niveles, pero presenta una respuesta atenuada, lo que resulta en una falla para amortiguar la respuesta inflamatoria. La sola percepción del estrés estimula el hipotálamo para secretar hormonas liberadoras que actúan sobre la adenohipófisis para promover la secreción de hormona adrenocorticotrópica, que a su vez actúa sobre la corteza suprarrenal para iniciar la síntesis y liberación de hormonas glucocorticoides. Se ha descrito que la activación del eje HHA, la activación alterada del sistema vagal y la activación de una respuesta inmune con liberación de citocinas como IFN-y, TNF-α e IL-4 son factores determinantes en la disbiosis inducida desde mecanismos centrales 58.
Conclusiones
Los procesos de disbiosis han sido descritos en el contexto de la depresión y la ansiedad, teniendo como punto vinculante el eje cerebro-intestino y las dos vías fundamentales para la diseminación de factores relacionados: la vía vagal y la vía circulatoria, esta última secundaria a un incremento en la permeabilidad intestinal.
Los diferentes hallazgos sugieren que la alteración de la composición de la microbiota intestinal juega un rol importante en las alteraciones características de estas entidades clínicas, a través de mecanismos neuroinflamatorios, autonómicos y de plasticidad neuronal. Las moléculas que parecen estar más asociadas a los cambios reportados son el lipopoli-sacárido y los ácidos grasos de cadena corta que, al mostrar variaciones, pueden influir sobre el contexto local intestinal y sobre el sistema nervioso central, generando cambios a distancia. Estos metabolitos y la comprensión de los mecanismos en los cuales se encuentran involucrados podrían constituir un punto de partida para el diseño de nuevas terapéuticas en los contextos de trastornos del afecto.















