Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.27 no.4 Bogotá Oct./Dec. 2012
Revisión de tema
(1) Internista, Gastroenterólogo, Hepatólogo. Hepatólogo Clínica Colombia (Organización Sanitas). Hepatólogo Clínica del Country. Bogotá, Colombia.
(2) Residente II Gastroenterología (Organización Sanitas).
(3) Médica Patóloga, Epidemióloga. Clínicas Colombia y Reina Sofía (Organización Sanitas). Docente Universidad Nacional de Colombia. Bogotá -Colombia
Fecha recibido: 17-04-12 Fecha aceptado: 23-10-12
Resumen
La hepatitis autoinmune es una entidad que se puede presentar en forma asintomática, como hepatitis aguda o como cirrosis hepática; el diagnóstico se basa en criterios clínicos, de laboratorio basados en niveles elevados de inmunoglobulina G y autoanticuerpos y en criterios histológicos como la hepatitis de interfase, la presencia de células plasmáticas e infiltrado linfocitario, en casos de difícil diagnóstico se pueden utilizar los sistemas de puntuación original o modificado. El tratamiento se basa en la utilización de inmunosupresores como corticoides y azatioprina que cambiaron la historia natural de la enfermedad.
Palabras clave:
Hepatitis autoinmune, hepatitis aguda, cirrosis, hepatitis de interfase, sistemas de puntuación, corticoides.
Abstract
Autoimmune hepatitis is a condition which can be asymptomatic or can present as acute hepatitis or liver cirrhosis. Diagnosis is based on clinical criteria and laboratory criteria. Laboratory criteria include elevated levels of immunoglobulin G and/or autoantibodies and histological criteria such as hepatitis interface, the presence of plasma cells and lymphocytic infiltrate. In difficult to diagnose cases original or modified scoring systems can be used. Treatment is based on the use of immunosuppressants such as corticosteroids and azathioprine that have changed the natural history of disease.
Key words:
Autoimmune hepatitis, acute hepatitis, cirrhosis, hepatitis interface, scoring systems, steroids.
DEFINICIÓN
La hepatitis autoinmune (HAI) es una entidad descrita por primera vez en 1950 y conocida desde entonces con diferentes términos, hepatitis crónica activa, hepatitis crónica agresiva, hepatitis lupoide, hepatitis de células plasmáticas y más comúnmente, hepatitis crónica activa autoinmune; en 1992, el Grupo Internacional de Hepatitis Autoinmune recomienda hepatitis autoinmune como el término más apropiado para esta enfermedad (1). La HAI se define como una inflamación del hígado generalmente persistente o no resuelta (hepatitis crónica) de origen desconocido (2).
EPIDEMIOLOGÍA
La enfermedad se presenta en todas las razas y en todas las áreas geográficas del mundo (2, 3). Como en otras enfermedades autoinmunes, la edad promedio inicial de presentación es hacia los cuarenta años, pero es muy variable y puede ir desde el primer año de vida hasta los ochenta años, en los niños, la edad media de inicio para el tipo de hepatitis autoinmune tipo 1 es entre 10 y 11 años de edad y para HAI tipo 2 entre 6 y 7 años (3-6). Las mujeres son afectadas con mayor frecuencia que los hombres, razón de sexo 3,6:1 (7). En USA no hay datos epidemiológicos claros; sin embargo, se sabe que en Noruega y Suecia, la incidencia media es 1 a 2 por 100.000 personas por año, y su prevalencia es de 11 a 17 por 100.000 personas por año, por lo cual se asume una incidencia y prevalencia similar para la población caucásica de América del Norte, aunque debido al carácter subclínico de la enfermedad en una proporción importante de pacientes estos datos posiblemente sean mayores (8, 9).
HISTORIA NATURAL
La evolución natural de la enfermedad no tratada se conoce por las experiencias publicadas antes del uso generalizado de los agentes inmunosupresores para la HAI y antes de la detección de la hepatitis C (VHC). Estos estudios mostraron que el 40% de los pacientes con enfermedad severa no tratada mueren dentro de los 6 meses posteriores al diagnóstico, y que los sobrevivientes con frecuencia desarrollan cirrosis con várices esofágicas y posterior hemorragia (10-15). La presentación aguda de la enfermedad es común (40%), y puede presentarse incluso con insuficiencia hepática aguda grave, con encefalopatía hepática dentro de las 8 semanas de síntomas clínicos (16-19). Un 30% aproximadamente se presenta en forma insidiosa completamente asintomática y un 30% debuta como cirrótico. La posibilidad de cirrosis podría predecirse por los hallazgos histológicos; hepatitis de interfase 17% a 5 años, alteraciones leves a moderadas 49% a 15 años, necrosis en puentes o multilobulillar, 82% con mortalidad de 44% a los 5 años (10, 12).
Tres ensayos clínicos aleatorizados, controlados de tratamiento establecieron que la prednisona sola o en combinación con azatioprina mejora los síntomas; pruebas de laboratorio, resultados histológicos, e inmediata sobrevida (11-13), estos estudios llevaron a la aceptación de regímenes inmunosupresores como el tratamiento estándar y apoyaron una patogénesis autoinmune de la enfermedad.
El trasplante de hígado también ha evolucionado como un tratamiento eficaz para el paciente con cirrosis descompensada y la sobrevida del paciente y del injerto ahora supera el 80% a 5 años (20-23).
PATOGENIA Y GENÉTICA
La patogénesis exacta es desconocida, se considera al "mimetismo molecular" como el generador de la autoinmunidad. Una teoría postula que desencadenantes ambientales disparan los mecanismos de pérdida de la tolerancia inmune en un paciente predispuesto genéticamente lo que induce un ataque inmunológico mediado por células T sobre antígenos del hígado, que lleva a una progresiva necroinflamación y fibrosis (24).
La relación exacta entre los genes y el proceso autoinmune no se han definido pero a nivel molecular se cree que está implicado el antígeno, el complejo mayor de histo-compatibilidad (MHC) y el receptor de células T (TCR), donde pequeños segmentos llamados regiones determinantes complementarias (CDR) identifican y contactan el complejo antígeno-MHC.
Los virus, medicamentos, hierbas y las vacunas han sido sugeridos como agentes desencadenantes, pero la naturaleza de los antígenos no es clara todavía y en la mayoría de los casos, ningún inductor específico de la autoinmunidad ha sido identificado. Se han implicación virus del sarampión, virus de la hepatitis, virus del herpes simple, virus varicela zoster, citomegalovirus y virus de Epstein-Barr como iniciadores de la enfermedad, medicamentos como la oxifenisatina, metildopa, nitrofurantoína, diclofenaco, minociclina y, posiblemente, las estatinas (11). La administración de interferón puede enmascarar o inducir autoinmunidad, y el tratamiento de la hepatitis viral crónica con interferón alfa puede inducir o desenmascarar una hepatitis autoinmune (12).
La mayor parte de la evidencia apoya como papel central una alteración de la función de células T en la patogénesis de la HAI y anomalías en la función de células B que también pueden ser importantes. Con la pérdida de la tolerancia se presenta un escape de la supresión normal de la autorreactividad de células T, lo que resulta en la inflamación y necrosis (24-27).
En los caucásicos, la HAI clásica (tipo 1) está fuertemente asociada con el serotipo HLA-DR3 y con HLA-DR4. DRB1 * 0301 y DRB3 * 0101 genotipos comunes en América del Norte, en América del Sur DRB1 * 1301 es más común. En HAI tipo 2 se encuentra asociación con alelos de HLA-DRB1 * 07, HLA-DRB1 * 03 y DQB1 * 0201, en Japón, donde el HLA-DR3 es poco frecuente, hay una asociación primaria con el serotipo HLA-DR4 (genotipo DRB1 * 0405 y el genotipo DQB1 * 0401) (25-27).
CLÍNICA
El espectro clínico es muy amplio abarcando desde los pacientes asintomáticos, aquellos con síntomas importantes y variados, tales como astenia adinamia, malestar general, anorexia, náuseas, dolor abdominal y prurito y aquellos con insuficiencia hepática aguda que cursan con ictericia y coagulopatía.
Los pacientes asintomáticos pueden ser identificados por exámenes de rutina, donde la única evidencia de enfermedad hepática puede ser una transaminasa elevada, en otras ocasiones el paciente asintomático se descubre durante una cirugía abdominal de causa variada. En el otro extremo del espectro están los pacientes que se presentan de forma aguda, a veces con insuficiencia hepática aguda, con ictericia severa, coagulación prolongada y los valores de transaminasas > 1.000 U/L (1, 2, 4), y pueden o no tener una cirrosis establecida (figura 1).

Al examen físico podemos encontrar una exploración normal, presencia de hepatomegalia, esplenomegalia, estigmas de la enfermedad crónica del hígado e ictericia (1, 2, 4).
La HAI puede estar asociada con otras enfermedades con características autoinmunes; Siogren, Crest, LES, anemia hemolítica, púrpura trombocitopénica idiopática, diabetes mellitus, hipotiroidismo, tiroiditis, enfermedad celíaca, colitis ulcerativa, vitíligo etc. Un estudio prospectivo, por ejemplo, encontró enfermedades inmunológicas concurrentes presentes en 38% de 122 pacientes con hepatitis autoinmune en comparación con el 22% de 63 pacientes con hepatitis viral crónica (30).
Debido a que hasta el 70% de los pacientes asintomáticos se vuelven sintomáticos durante el curso de su la enfermedad, los asintomáticos deben ser seguidos toda la vida para supervisar los cambios de actividad de la enfermedad (28, 29).
DIAGNÓSTICO
Las guías de la Asociación Americana para el estudio de enfermedades hepáticas en 2010 sugieren las consideraciones siguientes (4):
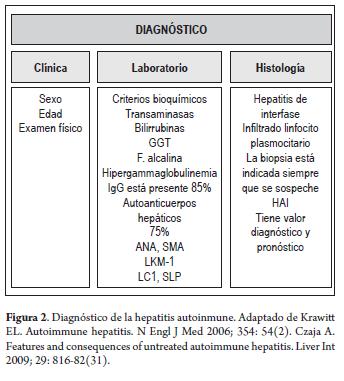
- El diagnóstico debe ser realizado en pacientes con clínica, alteraciones de laboratorio e histológicas compatibles e incluyen pruebas bioquímicas hepáticas anormales, un aumento de IgG total o niveles de gamma-globulinas, marcadores serológicos (ANA, SMA, anti-LKM-1, o anti-LC1), hepatitis de interfase (figura 2).
- Otras condiciones que pueden causar hepatitis crónica deben ser excluidas.
- En los casos poco claros el sistema de puntuación estandarizado debe ser utilizado en la evaluación.
- En los que son negativos para los anticuerpos convencionales, se debe buscar anticuerpos adicionales, como mínimo esto debe incluir anti-SLA y pANCA atípicos.
- Los estudios de colangiografía deben ser considerados para excluir la colangitis esclerosante primaria en adultos que no responden al tratamiento con corticosteroides después de tres meses.
- En los niños, los estudios colangiográficos deben ser considerados para excluir colangitis esclerosante autoinmune.
- Todos los pacientes con hepatitis autoinmune y enfermedad intestinal inflamatoria deben ser sometidos a estudios colangiográficos para excluir la colangitis esclerosante primaria.
LABORATORIO
Debe incluir las determinaciones usuales de pruebas que evalúan la función hepática: aminotransferasas (ALT y AST), gamma glutamil tranferasa (GGT), fosfatasa alcalina (FA), proteínas totales y diferenciales, bilirrubinas (conjugada y no conjugada), inmunoglobulina G sérica (IgG) y o electroforesis de proteínas.
Como regla general, las elevaciones de transaminasas son más llamativas en la hepatitis autoinmune que las de la bilirrubina y fosfatasa alcalina. En algunos casos, sin embargo, la hepatitis autoinmune tiene un cuadro colestásico (28, 29).
Un rasgo característico de laboratorio de la hepatitis autoinmune es una elevación de las globulinas en suero, especialmente gammaglobulinas e IgG (figura 1). Hiperglobulinemia está generalmente asociada con autoanticuerpos circulantes, que son particularmente útiles en la identificación de la hepatitis autoinmune (31).
Autoanticuerpos: permiten identificar a los pacientes con hepatitis autoinmune, clasificarlos y orientan hacia el tratamiento adecuado; sin embargo, no son específicos de AIH, sus expresiones pueden variar a lo largo de la enfermedad y se cree que no están involucrados en la patogénesis de la entidad (32-37). Se ha evidenciado que bajos títulos de autoanticuerpos no excluyen el diagnóstico de hepatitis autoinmune, ni títulos altos en ausencia de otros hallazgos de apoyo establecen el diagnóstico (38). En los adultos los títulos solo se correlacionan con la severidad de la enfermedad, curso clínico y respuesta al tratamiento en forma mediana o aproximada, en la población pediátrica (pacientes < 18 años), los títulos son útiles biomarcadores de actividad de la enfermedad y pueden ser utilizados para monitorear la respuesta al tratamiento (34-36).
Anticuerpos antinucleares (ANAS): son los anticuerpos más comunes en circulación en la hepatitis autoinmune. Se observan en adultos y niños con HAI tipo 1 y rara vez en la HAI tipo 2. Los títulos considerados positivos dependen en parte de la metodología utilizada y la edad del paciente, en la mayoría de los laboratorios, títulos en el rango de 1:80 a 1:100 o superiores se consideran positivos en los adultos, en los niños los títulos de 1:20 o superiores se consideran positivos. Los patrones de inmunofluorescencia no son útiles en la determinación de las características clínicas distintivas (2, 32, 34, 38).
Anticuerpos antimúsculo liso (ASMA): son la segunda clase importante de autoanticuerpos, que han demostrado su utilidad en el diagnóstico de hepatitis autoinmune tipo 1. Aunque menos frecuente que ANAS son más específicas, sobre todo cuando están presentes en los títulos de 1:180 o más. En los niños, los títulos de 1:20 o superiores se consideran positivos. Los anticuerpos antiactina (AAA) son más específicos para la hepatitis autoinmune tipo 1 que otros anticuerpos, títulos de ASMA de 1:320 o mayor en general, reflejan la presencia de AAA y pueden servir como un marcador sustituto para estos anticuerpos (33, 39).
Anticuerpos antimicrosomales 1- hígado-riñón (A-LKM-1): ALKM-1 son los principales autoanticuerpos de la hepatitis autoinmune tipo 2, están dirigidos a la enzima del citocromo P450 CYP2D6 (34-36).
Anticuerpo antihígado citosol-1 (ALC-1 o LC1): marcador de la hepatitis autoinmune tipo 2, por lo general se presenta junto con con LKM-1, pero puede ser el único autoanticuerpo (40). El antígeno reconocido por LC1 es la ciclodeaminasa formiminotransferasa (FTCD), una enzima metabólica específica del hígado (41).
Anticuerpos antiantígeno soluble hepático/hígado páncreas (anti-SLA/LP): se han encontrado en un 10 a 30% de los pacientes adultos con hepatitis autoinmune tipo 1, pero son más comunes en los niños con ambos tipos de HAI. Son anticuerpos dirigidos contra una única enzima (posiblemente una proteína supresora de UGA o una proteína asociada a tRNA, miembro de la superfamilia de transferasas dependiente de piridoxal fosfato). Anti-SLA/ LP es el único anticuerpo que circula en algunos pacientes, que originariamente condujo a su consideración como un tipo distinto (tipo 3) (42, 43).
Anticuerpos citoplasmáticos antineutrófilo (ANCA): ANCA son un grupo de anticuerpos que reconocen proteínas de neutrófilos, p-ANCA atípicos han sido identificados en hepatitis autoinmune tipo 1, pero no en el tipo 2 (44).
HISTOLOGÍA
La biopsia hepática al inicio del estudio se recomienda para establecer el diagnóstico y guiar la decisión de tratamiento (2, 4, 12, 38, 49). La hepatitis autoinmune se caracteriza histológicamente por los siguientes hallazgos no específicos (45):- Infiltrado portal de linfoplasmocitario, con eosinófilos ocasionales.
- Hepatitis de interfase o invasión de la placa limitante que rodea la tríada portal por el infiltrado linfoplasmocitario portal extendiéndose al lobulillo (infiltrado periportal).
- Compromiso lobulillar ocasional, incluso con necrosis centrizonal.
- Cambios de la vía biliar (colangitis destructiva, no destructiva y ductopenia) presentes en aproximadamente el 25 por ciento de los pacientes.
- Granulomas son vistos rara vez.
- Infiltrados de células plasmáticas, rosetas de hepatocitos y células gigantes multinucleadas.
La fibrosis está presente en todas las formas de hepatitis autoinmune incluso las más leves y su grado puede ser variable desde muy leve hasta avanzada con puentes con distorsión de la arquitectura y aparición de nódulos de regeneración resultando en cirrosis (46).
Los resultados histológicos varían de acuerdo a la evolución de la enfermedad, en comparación con los pacientes con un inicio insidioso (48), los pacientes con insuficiencia hepática aguda severa muestran más hepatitis de interfase, hepatitis lobulillar, desorden lobular, necrosis de hepatocitos, necrosis central y submasiva pero menos fibrosis y cirrosis (47, 48).
Los hallazgos histológicos, incluyendo la frecuencia de la cirrosis, son similares entre los pacientes sintomáticos y asintomáticos (figura 3) (45).

CLASIFICACIÓN
Dos tipos de HAI, tipo 1 y tipo 2 han sido reconocidos basados en los marcadores serológicos (32-44), pero no se han establecido como entidades clínicas o patológicas válidas. Un tercer tipo propuesto (tipo 3) se ha abandonado, puesto que su marcador serológico (anti-SLA) también se encuentra en el tipo 1 HAI y de tipo 2 AIH hasta en 10-30 % (42-43).
AIH Tipo 1 o clásica: se caracteriza por la presencia básica de ANAS, SMA o ambos, y constituye 80% de los casos de HAI; 75% de los pacientes son de sexo femenino, con un pico de incidencia entre las edades de 16 y 30 años, 50% son mayores de 30 años y 23% mayores de 60 años. Son comunes las asociaciones con otras enfermedades autoinmunes (15%-34%); en el momento del diagnóstico la cirrosis está presente en 25% de pacientes (2, 4, 38-40, 45).
AIH tipo 2: se caracteriza por la presencia de anti-LKM1 y/o anti-LC1. La mayoría de los pacientes con hepatitis autoinmune tipo 2 son niños y los niveles séricos de inmunoglobulinas son generalmente elevados. La enfermedad tiende a ser más agresiva y se encuentra cirrosis hasta en la mitad de los pacientes al momento del diagnóstico, aunque una forma aguda grave también se puede presentar (2, 4, 5, 40, 43, 44).
SISTEMAS DE PUNTUACIÓN
Original: los criterios diagnósticos de hepatitis autoinmune y el sistema de puntuación del diagnóstico fueron desarrollados por un panel internacional en 1993 como herramienta de investigación para estandarizar los estudios de población y ensayos clínicos (1) y se revisaron en 1999 (50) (tabla 1). Este sistema asigna un puntaje a los diferentes elementos clínicos de laboratorio e histología y puede aplicarse tanto antes como después del tratamiento. Una puntuación pretratamiento de 10 puntos o más, o después del tratamiento una puntuación de 12 puntos o más, indican "HAI probable". Una puntuación de 10 puntos antes del tratamiento tiene una sensibilidad del 100%, una especificidad de 73% y precisión diagnóstica de 67%. Un puntaje pretratamiento de 15 puntos HAI definida tiene una sensibilidad de 95%, una especificidad de 97% y una precisión diagnóstica de 94% (51). Los criterios clínicos son suficientes para diagnosticar HAI definitiva o probable en la mayoría de pacientes, en los casos difíciles se puede aplicar el sistema de puntuación diagnóstico (50).

Sistema simplificado: en 2008 se desarrolló un sistema con criterios simplificados basado en la determinación de 4 aspectos, títulos de anticuerpos, los niveles de IgG, la histología hepática y la exclusión de la hepatitis viral (52). Un diagnóstico de hepatitis autoinmune probable se establece con un total de 6 puntos y un diagnóstico definitivo con ≥ 7 puntos.
En un estudio de validación con la participación de 11 centros internacionales, el sistema de puntuación simplificado con un punto de corte ≥ seis, tenía 88% de sensibilidad y 97% de especificidad en comparación con un estándar de referencia clínico e histológico, cuando se utiliza un punto de corte ≥ 7, los valores correspondientes fueron de 81 y 99%, respectivamente (53). La sensibilidad fue algo menor, pero la especificidad se mantuvo alta en un estudio de validación posterior con un punto de corte ≥ 7 (70 y 100%, respectivamente) (54). La versión simplificada del sistema de puntuación muestra una alta sensibilidad y especificidad en el diagnóstico de hepatitis autoinmune, pero aún no se ha validado completamente en estudios prospectivos (tabla 2) (52-55).

DIAGNÓSTICO DIFERENCIAL
Por las características enunciadas tan amplias de la HAI en cuanto a edad de presentación, manifestaciones clínicas, la participación de ambos sexos, la entidad debe ser considerada en el diagnóstico diferencial de cualquier paciente con evidencia de enfermedad hepática aguda o crónica (figura 4) (2-4, 6, 38).

TRATAMIENTO
A partir de los estudios iniciales con GCT en HAI, se demostró el beneficio del tratamiento en pacientes graves, que justifica el uso de inmunosupresores (11-13) y se sabe que un manejo adecuado mejora la calidad de vida, prolonga la supervivencia y retrasa la necesidad de un trasplante hepático. En los casos de menor gravedad clínica bioquímica o histológica, no hay estudios suficientes que orienten al tratamiento, por lo tanto no siempre que diagnosticamos hepatitis autoinmune hay indicación de tratamiento (2, 4, 7, 22, 56). La decisión de tratar debe ser individualizada basada en:
- La severidad de los síntomas
- El grado de elevación de las aminotransferasas séricas e IgG
- Los hallazgos histológicos
- La posibilidad de efectos secundarios.
Las guías de la AASLD (4) establecen:
Indicaciones absolutas
- AST de por lo menos 10 veces el límite superior del rango normal.
- AST más de cinco veces el límite superior normal, junto con un nivel en suero de gammaglobulina más de dos veces el límite superior normal.
- Hallazgos histológicos de necrosis en puente o necrosis multilobulillar.
- Síntomas incapacitantes asociados con la inflamación hepática, como la fatiga y artralgia, independientemente de otros índices de gravedad de la enfermedad.
Indicaciones para el tratamiento inciertas
Adultos sin síntomas y cambios leves de laboratorio e histológicos la decisión debe ser individualizada y equilibrada frente a los riesgos de la terapia; la AASLD recomienda la derivación de estos pacientes a un hepatólogo.
Contraindicaciones para el tratamiento
- Cirrosis inactiva.
- Actividad de la enfermedad mínima o ninguna; estos pacientes deben ser seguidos cada tres a seis meses.
- Pacientes con enfermedades graves preexistentes o condiciones de comorbilidad (compresión vertebral, psicosis, osteoporosis, diabetes o hipertensión no controlada) o conocida intolerancia anterior a la prednisona, a menos que la enfermedad sea severa y progresiva y puedan ser instituidas medidas de control adecuadas para las condiciones de comorbilidad.
- Pacientes con citopenias graves pretratamiento: recuento de glóbulos blancos por debajo de 2.500 o recuento de plaquetas por debajo de 50.000 o deficiencia completa conocida de la actividad tiopurina metiltransferasa.
Esquemas de tratamiento
Se basan en la utilización de glucocorticoides en monoterapia o en combinación con ahorradores de esteroides como azatioprina buscando la reducción de los efectos adversos de los glucocorticoides. Estos dos esquemas no se han comparado directamente en ensayos clínicos controlados con seguimientos a largo plazo, pero datos y la experiencia clínica sugieren una eficacia similar (2, 4, 56-61).
- Prednisona sola (60 mg al día).
- Prednisona a dosis más bajas (30 mg al día), junto con azatioprina (50 mg utilizados en los Estados Unidos ó 1-2 mg/kg de peso corporal, utilizado en Europa) (tabla 1).
La prednisona se puede reducir hasta un nivel suficiente para mantener la remisión, luego de 20 mg al día las reducciones deben ser de 5 mg/semana hasta 10 mg/día, reducciones mayores deben ser de 2,5 mg/semana hasta 5 mg/día (4).
El tratamiento combinado es adecuado en pacientes que serán tratados de forma continua durante al menos 6 meses o que están en mayor riesgo de complicaciones relacionadas con los corticoides. Una vez alcanzadas dosis de mantenimiento se deben continuar hasta la resolución de la enfermedad, falla del tratamiento, o intolerancia a los medicamentos, no hay una duración mínima o máxima del tratamiento, se individualiza según el resultado, respuesta deseada y la tolerancia (2, 4, 56-61) (figura 5).

Remisión o resolución de la enfermedad: es la metal ideal de tratamiento caracterizada por la normalización de las alteraciones de laboratorio (AST o ALT, gammaglobulina, niveles de Ig G sérica normales) y la normalización de la histología, se alcanza en 10 a 40% de los pacientes (2, 4, 56-61), 90% de adultos tiene mejoría en la AST, la bilirrubina y niveles de gammaglobulina luego de 2 semanas de inicio del tratamiento (62). La mejoría histológica va atrás de la mejoría clínica y de laboratorio 3-8 meses (12, 47-49). Los adultos rara vez logran resolución de sus anomalías histológicas en menos de 12 meses y la probabilidad de la remisión durante el tratamiento disminuye después de 2 años; valores de laboratorio normales antes de la terminación del tratamiento reduce el riesgo relativo de recaída después de la retirada del fármaco 3-11 veces en comparación con pacientes que no logran los resultados (47-49); en un estudio, 87% de pacientes que alcanzaron la remisión a largo plazo habían normalizado los índices de laboratorio antes de la finalización de la terapia (63).
Se recomienda mantener a los pacientes con una dosis de mantenimiento diaria fija, hasta conseguir la remisión pues intentos tempranos de ajustar la dosis según la respuesta clínica pueden retrasar o impedir la mejoría histológica. Por otro lado, la terapia diaria es recomendable sobre la de días alternos o con pulsos de esteroides ya que estas pueden provocar mejoría de los síntomas y de laboratorio pero no resolución histológica (63).
El fin de la terapia debe considerarse después de un tratamiento no menor de 2 años, cuando las pruebas de función hepática y los niveles de inmunoglobulinas sean repetidamente normales; la biopsia de hígado para evaluación antes de la terminación de tratamiento es el único método para asegurar la plena resolución de la enfermedad (48, 49, 56-63).
Fracaso del tratamiento: aproximadamente 10% de los pacientes tiene un deterioro clínico y de laboratorio, a pesar de cumplir con el tratamiento convencional (4). El fracaso se caracteriza por una actividad inflamatoria sostenida que lleva al desarrollo o empeoramiento de la cirrosis, con eventuales complicaciones y la muerte o la necesidad de trasplante hepático; es más frecuente en tres grupos de pacientes (22):
- Las personas con cirrosis establecida,
- Las personas que desarrollan la enfermedad a una edad más temprana o han tenido una mayor duración de la enfermedad antes del tratamiento.
- Los que poseen el alelo HLA-B8 o fenotipos HLA-DR3.
El tratamiento óptimo de la enfermedad resistente no está bien establecido, la AASLD propone terapia con prednisona 60 mg al día o prednisona 30 mg al día y azatioprina 150 mg al día durante al menos un mes; a partir de ese momento la dosis de prednisona se reduce en 10 mg y la dosis de azatioprina reduce en 50 mg después de cada mes de mejoría clínica, hasta que las dosis convencionales de mantenimiento hayan sido alcanzadas (4). El 70% de los pacientes mejora su clínica y resultados de laboratorio dentro de 2 años y la supervivencia se conserva, remisión histológica se logra solo en 20% y la mayoría de los pacientes permanece en terapia y en situación de riesgo relacionados con efectos secundarios de los medicamentos y/o progresión de la enfermedad (63, 64).
Respuesta incompleta: son los pacientes que han mejorado la clínica, laboratorio y los índices histológicos, pero sin resolución completa. Corresponde más o menos a 13% después de 36 meses de tratamiento (59-63). Se deben considerar estrategias alternativas de tratamiento, a largo plazo dosis bajas de corticosteroides con una gradual disminución de la dosis de prednisona de 2,5 mg por mes hasta el nivel más bajo (10 mg al día) con AST o ALT normales o azatioprina (2 mg/kg al día) en personas que no toleran el corticosteroide y que requieren continuar el tratamiento (59-63).
Toxicidad de medicamentos: la toxicidad del fármaco justifica la interrupción prematura o alteración de la terapia convencional en 10-13% de los pacientes, en estos casos la terapia con el agente tolerado debe ser mantenido en una dosis ajustada (59-63).
Efectos secundarios relacionados con el tratamiento
Relacionados con los corticosteroides
- Estéticos: incluyen cara de luna llena, joroba dorsal, estrías, aumento de peso, acné, alopecia e hirsutismo facial, se producen en el 80% de los pacientes después de 2 años de tratamiento con corticosteroides (65, 66).
- Sistémicos: más graves, incluyen osteopenia con compresión vertebral, diabetes, psicosis, pancreatitis, infecciones oportunistas, hipertensión arterial y malignidad ocurren por lo general después de tratamientos prolongados (4-60, 65, 66).
Relacionados con azatioprina
La citopenia es el principal efecto secundario y la consecuencia más grave es la falla de la médula ósea (65), la frecuencia de la citopenia en pacientes tratados con hepatitis autoinmune con azatioprina es de 46% y la aparición de anomalías hematológicas graves es de 6% (68); los pacientes en tratamiento con azatioprina deben tener recuentos de leucocitos y plaquetas cada 6 meses (65). Otras complicaciones del tratamiento con azatioprina en hepatitis autoinmune son la hepatitis colestásica, pancreatitis, náuseas, vómitos, rash, infecciones oportunistas, malignidad (65), la incidencia de neoplasia extrahepática en la hepatitis autoinmune tratada es de 1 por 194 pacientes año, y la probabilidad de incidencia de tumor es de 3% después de 10 años (67).
Todos estos efectos adversos deben ser explicados ampliamente a los pacientes antes del inicio del tratamiento.
Medidas adicionales que buscan disminuir los efectos adversos de los medicamentos, deben ser introducidas según la percepción de riesgo del individuo (2, 4, 5, 11-13).
Con prednisona: valoración oftalmológica periódica para evaluación de cataratas y glaucoma, prevención de la osteoporosis con densitometría basal y anuales de la columna lumbar y cadera, programa de ejercicio regular, suplementos de vitamina D y calcio y/o agentes activos para el hueso como los bifosfonatos (63, 65, 66).
Con azatioprina: con cualquier dosis deben ser monitoreados para leucopenia y trombocitopenia con intervalos de 6 meses (2, 4, 5, 58-61).
Como en otras hepatopatías, los pacientes con HAI que tienen marcadores virales negativos deben ser vacunados contra hepatitis B (VHB) y hepatitis A (VHA) idealmente antes del inicio de la terapia (2, 4, 58-61).
Alternativas de tratamiento
Se han publicado series de pocos pacientes utilizando medicamentos variados como ciclosporina, tacrolimus, metotrexato, micofenolato mofetilo, budesonida, en aquellos refractarios o intolerantes a la azatioprina y/o 6-MP (64, 69-73). Ningún medicamento utilizado en las terapias de rescate empíricas ha sido incorporado a un algoritmo de manejo estándar, el micofenolato mofetilo es el fármaco más prometedor actualmente y la AASLD también lo sugiere (dosis de 2 g por vía oral al día) (4, 64, 65,69); ocurre mejoría en el 39%-84% de los pacientes que toleran el micofenolato, pero en 34%-78% se suspende el medicamento por intolerancia (náuseas, vómitos, pancreatitis, rash, alopecia, trombosis venosa profunda, diarrea y falta de normalización en pruebas de función hepática) (69, 74).
Tratamiento de la HAI en niños
La evolución de la enfermedad en los niños parece ser más grave que en los adultos, quizás debido a retrasos en el diagnóstico u otras enfermedades autoinmunes concurrentes, como la colangitis esclerosante (2, 4, 5). Más del 50% de los niños tiene cirrosis al inicio y las formas más leves de la enfermedad descrita en los adultos no se ven típicamente en los niños, esto hace que la terapia con medicamentos esté justificada en el momento del diagnóstico (2, 4, 5, 57-61). La prednisona es el pilar fundamental en todos los esquemas en niños, administrada inicialmente en una dosis de 1-2 mg/kg al día (hasta 60 mg al día), debido a los efectos nocivos significativos a largo plazo de dosis altas o intermedias de corticoides sobre el crecimiento lineal, desarrollo de los huesos y apariencia física, se recomienda el uso temprano de la azatioprina (1-2 mg/kg al día) ó 6-mercaptopurina (1,5 mg/kg al día) para todos los niños sin contraindicaciones(2, 4, 5, 57-61).
Tratamiento de la cirrosis por HAI activa
Estos pacientes tienen una mayor frecuencia de complicaciones relacionadas con los medicamentos que aquellos sin cirrosis (25% versus 8%) (2, 4, 11-13); deben ser monitorizados estrechamente durante el tratamiento y a las personas con citopenias se les deben evaluar la actividad de tiopurina metiltransferasa antes de la administración de azatioprina (2, 4, 11-13, 11, 65, 66, 68, 75). La respuesta puede ser excelente, incluso en aquellos que ya han experimentado sangrado de las várices esofágicas o que tienen ascitis importante, mencionando incluso la posibilidad de reversión de la cirrosis (76). Muchos pacientes responden cuando el tratamiento se inicia y la supervivencia a 10 años para los pacientes tratados, incluyendo aquellos con cirrosis, supera el 90% (4, 61, 66,75).
Tratamiento de la HAI en el embarazo
Los glucocorticoides y la azatioprina probablemente son seguros durante el embarazo, sin embargo la azatioprina tiene una categoría D del embarazo por la FDA, se ha asociado con malformaciones congénitas en ratas preñadas y bajos niveles de los nucleótidos de 6-tioguanina son detectables en los recién nacidos de madres tratadas para la enfermedad de Crohn (75, 77-79) y aunque no se han reportado incrementos en los defectos de nacimiento en madres que reciben este tratamiento, ni ha habido evidentes consecuencias negativas de la alimentación con leche materna de las madres tratadas, se justifica precaución al usar la azatioprina durante el embarazo (4, 75, 79). El embarazo en mujeres con hepatitis autoinmune se ha asociado con un mayor riesgo de prematuridad, bajo peso al nacer y muerte fetal. Los pacientes deben ser monitorizados cuidadosamente durante el embarazo y durante varios meses después del parto debido al riesgo de brotes en la actividad de la enfermedad; en tanto los niveles de estrógeno en la sangre caen, la terapia convencional se debe reanudar de manera preventiva 2 semanas antes del parto y mantenerse durante todo el postparto (4, 63, 64, 75, 79).
CARCINOMA HEPATOCELULAR
El carcinoma hepatocelular se produce en el 4% de pacientes con HAI tipo 1, y la probabilidad a 10 años de desarrollo de esta neoplasia es 2,9% (81). En América del Norte el riesgo de carcinoma hepatocelular se relaciona con el sexo masculino, la hipertensión portal (ascitis, várices o trombocitopenia), tratamiento inmunosupresor durante al menos 3 años y cirrosis de por lo menos 10 años de duración (80). Una estrategia de vigilancia basada en la ecografía hepática a intervalos de 6 meses se recomienda para estos individuos (82).
TRASPLANTE EN LA HEPATITIS AUTOINMUNE
HAI es indicación de trasplante hepático (TH) en aproximadamente 2%-3% de los pediátricos y 4%-6% de los adultos en los Estados Unidos y Europa (83, 84); el TH está indicado para pacientes con falla hepática aguda y es el tratamiento de elección para pacientes con progresión a cirrosis descompensada con un MELD igual o mayor de 15 o aquellos con carcinoma hepatocelular que cumple criterios de trasplante (85-87). Pacientes no tratados tienen una supervivencia a 10 años < 30% (20-22) y el fracaso del tratamiento que requiere LT se asocia a menudo con el genotipo HLA DRB1 * 0301 (88). El trasplante para la AIH tiene buenos resultados, con supervivencias a 5 y 10 años aproximadamente del 75% (4, 85-87); las características previas de los pacientes no parecen influenciar estos resultados de trasplante ni la recurrencia de la HAI (89).
REFERENCIAS
1. Johnson PJ, McFarlane IG. Meeting report: International Autoimmune Hepatitis Group. Hepatology 1993; 18: 998-1005. [ Links ]
2. Krawit EL. Autoimmune hepatitis. N Engl J Med 2006; 354: 54. [ Links ]
3. Mieli-Vergani G, Vergani D. Autoimmune paediatric liver disease. World J Gastroenterol. 2008; 14: 3360-3367. [ Links ]
4. Manns MP, Czaja AJ, et al. Diagnosis and management of autoimmune hepatitis. Hepatology 2010; 51: 2193. [ Links ]
5. Gregorio GV, Portman B, Reid F, Donaldson PT, Doherty DG, McCartney M, et al. Autoimmune hepatitis in childhood: a 20-year experience. Hepatology 1997; 25: 541-547. [ Links ]
6. Schramm C, Kanzler S, Galle PR. Meyer zum Büschenfelde KH, Lohse AW. Autoimmune hepatitis in the elderly. Am J Gastroenterol 2001; 96: 1587-1591. [ Links ]
7. Al-Chalabi T, Underhill JA, Portmann BC, McFarlane IG, Heneghan MA. Impact of gender on the long-term outcome and survival of patients with autoimmune hepatitis. J Hepatol 2008; 48: 140-147. [ Links ]
8. Boberg KM, Aadland E, Jahnsen J, Raknerud N, Stiris M, Bell H. Incidence and prevalence of primary biliary cirrhosis, primary sclerosing cholangitis, and autoimmune hepatitis in a Norwegian population. Scand. J. Gastroenterol 1998; 33: 99-103. [ Links ]
9. Werner M, Prytz H, Ohlsson B, Almer S, Bjornsson E, Bergquist A, et al. Epidemiology and the initial presentation of autoimmune hepatitis in Sweden: a nationwide study. Scand J Gastroenterol 2008; 43: 1232-1240. [ Links ]
10. Mistilis SP, Skyring AP, Blackburn CR. Natural history of active chronic hepatitis. Clinical features, course, diagnostic criteria, morbidity, mortality and survival. Australas Ann Med 1968; 17: 214-223. [ Links ]
11. Cook GC, Mulligan R, Sherlock S. Controlled prospective trial of corticosteroid therapy in active chronic hepatitis. Q J Med 1971; 40: 159-185. [ Links ]
12. Soloway RD, Summerskill WH, Baggenstoss AH, Geall MG, Gitnick GL, Elveback IR, Schoenfield LJ. Clinical, biochemical, and histological remission of severe chronic active liver disease: a controlled study of treatments and early prognosis. Gastroenterology 1972; 63: 820-833. [ Links ]
13. Murray-Lyon IM, Stern RB, Williams R. Controlled trial of prednisone and azathioprine in active chronic hepatitis. Lancet 1973; I: 735-737. [ Links ]
14. De Groote J, Fevery J, Lepoutre L. Long-term follow-up of chronic active hepatitis of moderate severity. Gut 1978; 19: 510-513. [ Links ]
15. Fevery J DV, DeGroote J. Long-term follow-up and management of asymptomatic chronic active hepatitis. En: S Cohen and RD Soloway (eds.). Chronic Active Liver Disease. Churchill Livingstone: New York; 1983. p. 51-64. [ Links ]
16. Crapper RM, Bhathal PS, Mackay IR, Frazer IH. 'Acute' autoimmune hepatitis. Digestion 1986; 34: 216-225. [ Links ]
17. Nikias GA, Bats KP, Czaja AJ. The nature and prognostic implications of autoimmune hepatitis with acute presentation. J Hepatol 1994; 21: 866-871. [ Links ]
18. Abe M, Hiasa Y, Masumoto T, Kumagi T, Akbar SM, Ninomiya T, Matsui H, et al. Clinical characteristics of autoimmune hepatitis with histological features of acute hepatitis. Hepatol Res 2001; 21: 213-219. [ Links ]
19. Kanda T, Yokosuka O, Hirasawa Y, Imazeki F, Nagao K, Suzuki Y, Saisho H. Acute-onset autoimmune hepatitis resembling acute hepatitis: a case report and review of reported cases. Hepatogastroenterology 2005; 52: 1233-1235. [ Links ]
20. Seaberg EC, Belle SH, Beringer KC, Schivins JL, Detre KM. Liver transplantation in the United States from 1987-1998: updated results from the Pit-UNOS Liver Transplant Registry. Clin Transpl 1998; 17-37. [ Links ]
21. Khalaf H, Mourad W, El-Sheikh Y, Abdo A, Helmy A, Medhat Y, et al. Liver transplantation for autoimmune hepatitis: a single-center experience. Transplant Proc 2007; 39: 1166-1170. [ Links ]
22. Sanchez-Urdazpal L, Czaja AJ, van Hoek B, Krom R, Wiesner RH. Prognostic features and role of liver transplantation in severe corticosteroid-treated autoimmune chronic active hepatitis. Hepatology 1992; 15: 215-221. [ Links ]
23. Campsen J, Zimmerman MA, Troter JF, Wachs M, Bak T, Steinberg T, Kaplan M, et al. Liver transplantation for autoimmune hepatitis and the success of aggressive corticosteroid withdrawal. Liver Transpl 2008; 14: 1281-1286. [ Links ]
24. Donaldson PT. Genetics of autoimmune and viral liver diseases; understanding the issues. J Hepatol 2004; 41: 327. [ Links ]
25. Doherty DG, Donaldson PT, Underhill JA, et al. Allelic sequence variation in the HLA class II genes and proteins in patients with autoimmune hepatitis. Hepatology 1994; 19: 609. [ Links ]
26. Whitingham S, Mathews JD, Schanfield MS, et al. Interaction of HLA and Gm in autoimmune chronic active hepatitis. Clin Exp Immunol 1981; 43: 80. [ Links ]
27. Krawit EL, Kilby AE, Albertini RJ, et al. Immunogenetic studies of autoimmune chronic active hepatitis: HLA, immunoglobulin allotypes and autoantibodies. Hepatology 1987; 7: 1305. [ Links ]
28. Kogan J, Safadi R, Ashur Y, Shouval D, Ilan Y. Prognosis of symptomatic versus asymptomatic autoimmune hepatitis: a study of 68 patients. J Clin Gastroenterol 2002; 35: 75-81. [ Links ]
29. Feld JJ, Dinh H, Arenovich T, Marcus VA, Wanless IR, Heathcote EJ. Autoimmune hepatitis: effect of symptoms and cirrhosis on natural history and outcome. Hepatology 2005; 42: 53-62. [ Links ]
30. Czaja AJ, Carpenter HA, Santrach PJ, Moore SB. Genetic predispositions for the immunological features of chronic active hepatitis. Hepatology 1993; 18:816. [ Links ]
31. Czaja A. Features and consequences of untreated autoimmune hepatitis. Liver Int 2009; 29: 816-823 [ Links ]
32. Czaja AJ. Autoantibodies in autoimmune liver disease. Adv Clin Chem 2005; 40: 127-164. [ Links ]
33. Czaja. The role of autoantibodies as diagnostic markers of autoimmune hepatitis. Expert Rev Clin Immunol 2006; 2: 33-48. [ Links ]
34. Czaja AJ, Homburger HA. Autoantibodies in liver disease. Gastroenterology 2001; 120: 239-249. [ Links ]
35. Czaja AJ, Norman GL. Autoantibodies in the diagnosis and management of liver disease. J Clin Gastroenterol 2003; 37: 315-329. [ Links ]
36. Strassburg CP, Manns MP. Autoantibodies and autoantigens in autoimmune hepatitis. Semin Liver Dis 2002; 22: 339-352. [ Links ]
37. Czaja AJ. Behavior and significance of autoantibodies in type 1 autoimmune hepatitis. J Hepatol 1999; 30: 394-401. [ Links ]
38. Czaja AJ. Autoimmune hepatitis. Part B: diagnosis. Expert Rev Gastroenterol Hepatol 2007; 1: 129-143. [ Links ]
39. Czaja AJ, Cassani F, Cataleta M, et al. Frequency and significance of antibodies to actin in type 1 autoimmune hepatitis. Hepatology 1996; 24: 1068. [ Links ]
40. Bridoux-Henno L, Maggiore G, Johanet C, et al. Features and outcome of autoimmune hepatitis type 2 presenting with isolated positivity for anti-liver cytosol antibody. Clin Gastroenterol Hepatol 2004; 2: 825. [ Links ]
41. Muratori L, Sztul E, Muratori P, et al. Distinct epitopes on formiminotransferase cyclodeaminase induce autoimmune liver cytosol antibody type 1. Hepatology 2001; 34: 494. [ Links ]
42. Manns M, Gerken G, Kyriatsoulis A, et al. Characterisation of a new subgroup of autoimmune chronic active hepatitis by autoantibodies against a soluble liver antigen. Lancet 1987; 1: 292. [ Links ]
43. Wächter B, Kyriatsoulis A, Lohse AW, et al. Characterization of liver cytokeratin as a major target antigen of anti-SLA antibodies. J Hepatol 1990; 11: 232. [ Links ]
44. Zauli D, Gheti S, Grassi A, et al. Anti-neutrophil cytoplasmic antibodies in type 1 and 2 autoimmune hepatitis. Hepatology 1997; 25: 1105. [ Links ]
45. Dienes HP, Popper H, Manns M, Baumann W, Toenes W, Meyer zum Büschenfelde K-H. Histologic features in autoimmune hepatitis. Z. Gastroenterol 1989; 27: 327-330. [ Links ]
46. Cooksley WGE, Bradbear R, Robinson W, Harrison M, Halliday JW, Powell LW, ng HS, et al. The prognosis of chronic active hepatitis without cirrhosis in relation to bridging necrosis. Hepatology 1986; 6: 345-348. [ Links ]
47. Burgart LJ, Bats KP, Ludwig J, Nikias GA, Czaja AJ. Recent-onset autoimmune hepatitis. Biopsy findings and clinical correlations. Am J Surg Pathol 1995; 19: 699-708. [ Links ]
48. Iwai M, Jo M, Ishii M, Mori T, Harada Y. Comparison of clinical features and liver histology in acute and chronic autoimmune hepatitis. Hepatol Res 2008; 38: 784-789. [ Links ]
49. Efe C, Ozaslan E, Purnak T, Ozseker B, Kav T, Bayraktar Y. Liver biopsy is a superior diagnostic method in some patients showing the typical laboratory features of autoimmune hepatitis. Clin Res Hepatol Gastroenterol 2012; 36(2): 185-8. [ Links ]
50. Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL, Chapman RW, et al. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol 1999; 31: 929-938. [ Links ]
51. Czaja AJ. Performance parameters of the diagnostic scoring systems for autoimmune hepatitis. Hepatology 2008; 48: 1540-1548. [ Links ]
52. Hennes EM, Zeniya M, Czaja AJ, Pares A, Dalekos GN, Krawit EL, Bitencourt PL, et al. Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology 2008; 48: 169-176. [ Links ]
53. Muratori P, Granito A, Pappas G, Muratori L. Validation of simplified diagnostic criteria for autoimmune hepatitis in Italian patients. Hepatology 2009; 49: 1782-1783; author reply 1783. [ Links ]
54. Yeoman AD, Westbrook RH, Al-Chalabi T, Carey I, Heaton ND, Portmann BC, Heneghan MA. Diagnostic value and utility of the simplified International Autoimmune Hepatitis Group (IAIHG) criteria in acute and chronic liver disease. Hepatology 2009; 50: 538-545. [ Links ]
55. Mileti E, Rosenthal P, Peters MG.Validation and modification of simplified diagnostic criteria for autoimmune hepatitis in children. Clin Gastroenterol Hepatol 2012; 10(4): 417-421. [ Links ]
56. Luxon BA. Diagnosis and treatment of autoimmune hepatitis. Gastroenterol Clin North Am 2008; 37: 461-478. [ Links ]
57. Lohse A, Mieli-Vergani G. Autoimmune hepatitis Journal of Hepatology 2011; 55: 171-182. [ Links ]
58. Schaefer EA, Prat DS. Autoimmune hepatitis: current challenges in diagnosis and management in a chronic progressive liver disease. Curr Opin Rheumatol 2012; 24(1): 84-9. Review. [ Links ]
59. Vierling JM. Diagnosis and treatment of autoimmune hepatitis. Curr Gastroenterol Rep 2012; 14(1): 25-36. [ Links ]
60. Strassburg CP, Manns MP. Therapy of autoimmune hepatitis. Best Pract Res Clin Gastroenterol 2011; 25(6): 673-87. [ Links ]
61. Gleeson D, Heneghan MA; British Society of Gastroenterology. British Society of Gastroenterology (BSG) guidelines for management of autoimmune hepatitis. Gut 2011; 60(12): 1611-29. [ Links ]
62. Czaja AJ, Rakela J, Ludwig J. Features reflective of early prognosis in corticosteroid-treated severe autoimmune chronic active hepatitis. Gastroenterology 1988; 95: 448-453. [ Links ]
63. Montano-Loza AJ, Carpenter HA, Czaja AJ. Improving the end point of corticosteroid therapy in type 1 autoimmune hepatitis to reduce the frequency of relapse. Am J Gastroenterol 2007; 102: 1005-1012. [ Links ]
64. Czaja AJ, Carpenter HA. Empiric therapy of autoimmune hepatitis with mycophenolate mofetil: comparison with conventional treatment for refractory disease. J Clin Gastroenterol 2005; 39: 819-825. [ Links ]
65. Czaja AJ. Safety issues in the management of autoimmune hepatitis. Expert Opin Drug Safety 2008; 7: 319-333. [ Links ]
66. Uribe M, Go VL, Kluge D. Prednisone for chronic active hepatitis: pharmacokinetics and serum binding in patients with chronic active hepatitis and steroid major side effects. J Clin Gastroenterol 1984; 6: 331-335. [ Links ]
67. Aguilar HI, Burgart LJ, Geller A, Rakela J. Azathioprine-induced lymphoma manifesting as fulminant hepatic failure. Mayo Clin Proc 1997; 72: 643-645. [ Links ]
68. Czaja AJ, Carpenter HA. Tiopurine methyltransferase deficiency and azathioprine intolerance in autoimmune hepatitis. Dig Dis Sci 2006; 51: 968-975. [ Links ]
69. MM, Dhawan A, Samyn M, et al. Mycophenolate mofetil as rescue treatment for autoimmune liver disease in children: a 5-year follow-up. J Hepatol 2009; 51: 156. [ Links ]
70. Baven-Pronk AM, Coenraad MJ, van Buuren HR, et al. The role of mycophenolate mofetil in the management of autoimmune hepatitis and overlap syndromes. Aliment Pharmacol Ther 2011; 34:335. [ Links ]
71. Fernandes NF, Redeker AG, Vierling JM, et al. Cyclosporine therapy in patients with steroid resistant autoimmune hepatitis. Am J Gastroenterol 1999; 94: 241. [ Links ]
72. Manns MP, Woynarowski M, Kreisel W, Oren R, Rust C, Hultcrantz R, Spengler U, et al. Budesonide 3 mg bid in combination with azathioprine as maintenance treatment of autoimmune hepatitis--final results of a large multicenter international trial. Hepatology 2008; 48: 376A-377A. [ Links ]
73. Manns MP, Bahr MJ, Woynarowski M, Kreisel W, Oren R, Gunther R, Hultcrantz R, et al. Budesonide 3 mg tid is superior to prednisone in combination with azathioprine in the treatment of autoimmune hepatitis. J Hepatol 2008; 48: S369 -S370. [ Links ]
74. Hlivko JT, Shifman ML, Stravitz RT, Luketic VA, Sanyal AJ, Fuchs M, et al. A single center review of the use of mycophenolate mofetil in the treatment of autoimmune hepatitis. Clin Gastroenterol Hepatol 2008; 6: 1036-1040. [ Links ]
75. Czaja AJ. Autoimmune hepatitis in special patient populations. Best Pract Res Clin Gastroenterol 2011; 25(6): 689-700. [ Links ]
76. Shah AM, Malhotra A, Kothari S, Baddoura W, Depasquale J, Spira R. Reversal of liver cirrhosis in autoimmune hepatitis. Hepatogastroenterology 2011; 58(112): 2115-7. [ Links ]
77. Westbrook RH, Yeoman AD, Kriese S, Heneghan MA. Outcomes of pregnancy in women with autoimmune hepatitis. J Autoimmun 2012; 38(2-3): J239-44. [ Links ]
78. Uribe M, Chavez-Tapia NC, Mendez-Sanchez N. Pregnancy and autoimmune hepatitis. Ann Hepatol 2006; 5: 187-189. [ Links ]
79. De Boer NK, Jarbandhan SV, de Graaf P, Mulder CJ, van Elburg RM, van Bodegraven AA. Azathioprine use during pregnancy: unexpected intrauterine exposure to metabolites. Am J Gastroenterol 2006; 101: 1390-1392. [ Links ]
80. Montano-Loza AJ, Carpenter HA, Czaja AJ. Predictive factors for hepatocellular carcinoma in type 1 autoimmune hepatitis. Am J Gastroenterol 2008; 103: 1944-1951. [ Links ]
81. Yeoman AD, Al-Chalabi T, Karani JB, Quaglia A, Devlin J, Mieli-Vergani G, Bomford A, et al. Evaluation of risk factors in the development of hepatocellular carcinoma in autoimmune hepatitis: Implications for follow-up and screening. Hepatology 2008; 48: 863-870. [ Links ]
82. Bruix J, Sherman M. Management of hepatocellular carcinoma. Hepatology 2005; 42: 1208-1236. [ Links ]
83. European Liver Transplant Registry. 2008. http://www.eltr.org. [ Links ]
84. Scientifc Registry of Transplant Recipients. 2008. http://www.ustransplant.org. [ Links ]
85. Ahmed M, Mutimer D, Hathaway M, Hubscher S, McMaster P, Elias E. Liver transplantation for autoimmune hepatitis: a 12-year experience. Transplant Proc 1997; 29: 496. [ Links ]
86. Prados E, Cuervas-Mons V, De La Mata M, Fraga E, Rimola A, Prieto M, Clemente G, et al. Outcome of autoimmune hepatitis after liver transplantation. Transplantation 1998; 66: 1645-1650. [ Links ]
87. Vogel A, Heinrich E, Bahr MJ, Rifai K, Flemming P, Melter M, Klempnauer J, et al. Long-term outcome of liver transplantation for autoimmune hepatitis. Clin Transplant 2004; 18: 62-69. [ Links ]
88. Czaja AJ, Stretell M, Tomson LJ, Santrach P, Moore SB, Donaldson PT, Williams R. Associations between alleles of the major histocompatibility complex and type 1 autoimmune hepatitis. Hepatology 1997; 25: 317-323. [ Links ]
89. Dbouk N, Parekh S. Impact of pre-transplant Anti-nuclear antibody (ANA) and Anti-smooth muscle antibody (SMA) titers on disease recurrence and graft survival following liver transplantation in autoimmune hepatitis (AIH) patients. J Gastroenterol Hepatol 2012; 1440-1746. [ Links ]











 text in
text in 

