Introducción
Las proteínas de la leche de vaca son los antígenos que con mayor frecuencia producen reacciones de hipersensibilidad en los lactantes, a través de la leche materna o por la ingestión directa de la fórmula. La alergia a la proteína de la leche de vaca (APLV) conduce a una gran variedad de manifestaciones clínicas, entre las que predomina el compromiso digestivo. Este puede presentarse por segmentos o en toda su extensión y es seguido en frecuencia por el compromiso de la piel y el respiratorio 1.
La alergia alimentaria puede ser mediada por anticuerpos de tipo inmunoglobulina E (IgE), no mediada por la IgE o mediada por mecanismos mixtos. Durante el primer año de vida, la APLV es la forma más frecuente de presentación de la alergia alimentaria y sus síntomas pueden ser inespecíficos: reflujo gastroesofágico (RGE) patológico, sangre en las deposiciones, inapetencia, dolor abdominal tipo cólico, diarrea, estreñimiento y, con menor frecuencia, se describen casos de enteropatía con alteraciones en el desarrollo ponderal 1,2. Además de una menor ingesta de calcio y lípidos, en estos pacientes pediátricos también se ha observado una menor concentración sérica de retinol, betacaroteno, licopeno y 25-hidroxivitamina D 3.
El presente artículo es resultado de una revisión de la literatura y se usaron palabras claves como “cow’s milk protein allergy”, “clinical practice”, “guidelines”, “diagnosis”, “treatment” y “prevention”. Asimismo, las fuentes de los datos obtenidos fueron de Pubmed, para lo cual se realizó la búsqueda de artículos relevantes publicados en inglés y español, desde marzo de 2017 a junio de 2019.
Se incluyeron estudios clínicos aleatorizados, revisiones de literatura y publicaciones de casos. Los términos fueron desarrollados a partir de la ayuda de un especialista en epidemiología y un especialista pediatra.
Todos los títulos y resúmenes fueron recuperados de la publicación original para su selección y, posteriormente, se analizaron los artículos de forma independiente por dos revisores de la literatura. Se revisó un total de 95 artículos.
Definición
La APLV se define como una reacción adversa reproducible a una o más proteínas de la leche, usualmente caseínas, α-lactoalbúmina, β-lactoglobulina, y mediada por uno o diversos mecanismos inmunes 4,5. El mecanismo inmunológico que se presenta distingue la APLV de otras reacciones adversas a la leche de vaca, como la intolerancia a la lactosa.
Historia natural
Generalmente, los síntomas se desarrollan una semana después de la introducción de la leche de vaca, aunque pueden presentarse luego de 24 y 36 semanas 6,7. La edad media de inicio es similar a 2,8 +/- 1,8 meses y 3,5 +/- 2,8 meses 5,8.
En la mayoría de los niños, la APLV se manifiesta con síntomas anteriores a los 6 meses de edad, como se describe en múltiples revisiones de la literatura y en un estudio argentino realizado por Mehaudy y colaboradores 5-9. El desencadenante es la leche de vaca y las fórmulas o los alimentos a base de ella, posiblemente porque esta es la primera proteína alimentaria a la cual se exponen los niños. Una proporción menor de esta población puede desarrollar una reacción con la lactancia materna 10.
Estudios anteriores al 2005 mostraron que la APLV tenía un buen pronóstico, ya que se evidenció que entre un 80 y un 90 % de los niños desarrollaron tolerancia durante la edad escolar 10,11,12.
Epidemiología
Aunque no existen datos epidemiológicos internacionales comparables sobre la prevalencia de la APLV, dado que hay diferentes métodos en la evaluación clínica, los resultados de los estudios de cohortes y los metaanálisis evidencian una prevalencia general del 1,9 al 4,9 % de la APLV, con un pico de prevalencia (2-3 %) en el primer año de vida. En efecto, un estudio de Eggesbo y colaboradores describió una prevalencia <1 % en los niños mayores de 6 años en la población noruega 12.
Los padres reconocen la APLV en sus hijos con mucha más frecuencia de lo que puede ser confirmado mediante los estudios diagnósticos, y los síntomas que sugieren reacciones adversas a la proteína de la leche de vaca ocurren en el 5-15 % de los niños, lo cual excede las verdaderas aproximaciones de la prevalencia de la APLV 13.
El diagnóstico preciso es importante para evitar que los lactantes sean sometidos a dietas de exclusión inapropiadas, las cuales pueden tener un efecto sobre el crecimiento y el desarrollo a largo plazo. El pronóstico de esta entidad en la infancia es bueno y la tasa de remisión es de hasta el 85-90 % a los 3 años, con un mejor pronóstico en los casos de síntomas gastrointestinales 14.
La mayoría de los niños presentan dos o más síntomas durante el cuadro clínico. Sin embargo, la presencia de una sola de estas manifestaciones no descarta la posibilidad de alergia. Es importante mencionar que los datos proceden de centros especializados en atención a alergias y trastornos gastrointestinales, lo que refleja incidencias tan elevadas como del 14 % en consultas de primera vez, de las cuales el 71 % corresponden a APLV 2.
Fisiopatología
La leche de vaca contiene cerca de 20 proteínas potencialmente sensibilizantes, que se encuentran en las fracciones de suero y caseína, e incluyen α-lactoalbúmina, β-lactoglobulina, inmunoglobulinas bovinas y alérgenos de caseína 15. El efecto del proceso industrial sobre las propiedades antigénicas/alergénicas de las proteínas de la leche de vaca es mínimo 16.
Al igual que con otras alergias alimentarias, la predisposición genética, las infecciones y la alteración de la microflora intestinal, así como la primera exposición, la dieta materna, la transmisión del antígeno a través de la leche materna, la cantidad y la frecuencia de la carga del antígeno son factores que promueven la tolerancia oral o la sensibilización a la leche de vaca 17.
Los órganos primarios de la alergia son el tracto gastrointestinal, la piel y el tracto respiratorio, y en algunos escenarios conduce a un compromiso sistémico. El antígeno, en este caso las proteínas de la leche de vaca, pasa a través del lumen intestinal y es reconocido por la célula M de la mucosa intestinal, la cual lleva la información a las células presentadoras de antígeno, que son usualmente las células dendríticas de la submucosa.
Así, las células presentadoras muestran el antígeno al linfocito T cooperador (T helper 0 o Th 0), el cual ocasiona una sobreexpresión de la respuesta de los linfocitos T cooperadores tipo 2 (Th2), mediante las citocinas que secreta, como las interleucinas (IL) 4 y 13 18. Los Th2 estimulan los linfocitos B, que se preparan para sintetizar la IgE específica contra ese antígeno.
Por otro lado, en el caso de las expresiones clínicas no mediadas por la IgE, existen algunas citocinas, en particular la IL-5 y el factor de necrosis tumoral alfa (TNFα), secretadas por la célula Th0, las cuales promueven el reclutamiento de neutrófilos y la activación de eosinófilos y pueden determinar la aparición de edemas, dolor y funcionamiento anormal de los órganos. Así, cuando el niño es expuesto nuevamente al antígeno, se produce una reacción antígeno-anticuerpo que desencadena la respuesta de los linfocitos B previamente preparados, o la degranulación de los mastocitos/eosinófilos, lo cual genera manifestaciones en diferentes órganos 19.
Manifestaciones clínicas
El inicio de los síntomas se presenta cuando existe una exposición al alérgeno (proteína de la leche de vaca), bien sea a causa del consumo de productos lácteos por parte de la madre que se encuentra lactando, por la ingesta de fórmulas infantiles o, directamente, por el consumo de leche de origen bovino. Según la severidad y el tiempo de la reacción, las manifestaciones clínicas pueden presentarse de tres maneras:
Inmediatas: ocurren antes de 30 min y se caracterizan por la aparición de reacciones locales en la piel como urticaria, exantema (rash), síndrome alérgico oral, angioedema facial, anafilaxia y elevación de la IgE.
Mediatas: se dan luego de unas horas y son ocasionadas por reacciones no mediadas por la IgE, generalmente con síntomas gastrointestinales.
Tardías: se presentan entre el día 1 y 5, y la participación de la respuesta mediada por la IgE es incierta, caracterizada por síntomas gastrointestinales, respiratorios o cutáneos, como rinitis, eccema, urticaria, angioedema y anafilaxia, todos ellos asociados a la IgE, y la hemosiderosis pulmonar, la malabsorción con atrofia de vellosidades, la proctocolitis eosinofílica, la enterocolitis y la esofagitis, no asociados a la IgE 20.
Se estima que entre el 50 y el 60 % de las manifestaciones clínicas son digestivas 21,22 y la más frecuente es la deposición con sangre 5. Entre tanto, las manifestaciones respiratorias corresponden al 20 y 30 %, mientras que el 30-70 % son manifestaciones cutáneas 23,24. El más usual de estos signos en la piel es el exantema 25.
Además, pueden presentarse manifestaciones neurológicas y sistémicas como insomnio, edema y otras condiciones 26. De los síntomas gastrointestinales, tan solo una pequeña proporción es mediada por la IgE. La relación entre el RGE y la APLV se ha descrito en más del 50 % de los casos, cuyas evidencias conducen a que las dos entidades pueden coexistir.
Vandenplas y colaboradores reportaron una prevalencia de enfermedad por RGE, diagnosticada con pH-metría, en el 50 % de los niños con APLV, frente a un 10 % de niños sanos 26,27(Tabla 1).
Diagnóstico
Las características no específicas de las manifestaciones clínicas son la causa de que no exista un reconocimiento temprano de la enfermedad. La leche de vaca, de una forma u otra, es ingerida diariamente por los lactantes en cantidades superiores a las de cualquier otro alimento individual. Es importante describir la edad de inicio, el tipo de síntomas y su frecuencia, así como el tiempo entre la ingestión y el inicio de los síntomas, los detalles del tipo de alimentación y los antecedentes de atopia personal y familiar 26.
Es necesario, en caso de alimentación con lactancia materna, definir si la madre se encuentra consumiendo lácteos y sus derivados, dado el paso que pueden tener las proteínas de la leche de la vaca a la leche materna, con la posterior exposición al desarrollo de la APLV.
Asimismo, se debe establecer si el niño alimentado con lactancia materna exclusiva fue expuesto durante las 24 h posteriores del nacimiento a la suplementación con fórmulas sucedáneas de la leche materna, como en casos de prevención de hipoglicemia o protocolos institucionales de atención del neonato. Se ha observado que dicha práctica en estos niños se relaciona con un riesgo 7 veces mayor de sufrir de APLV que en sus controles de alimentación realizados durante las primeras 24 h con lactancia materna 27.
Ninguna de las pruebas de diagnóstico disponibles en situaciones clínicas rutinarias demuestra o excluye completamente la APLV 26. Los médicos pueden realizar una prueba de punción (skin prick test) y de determinación de la IgE específica, así como pruebas de parches. Sin embargo, estas solo indican la sensibilización al sustrato, lo cual no constituye necesariamente la confirmación de una reacción alérgica.
Algunos estudios han mostrado que la sensibilidad y la especificidad de la prueba de punción es del 31,8 y el 90,3 %, respectivamente, con un valor predictivo negativo (VPN) >95 % y un valor predictivo positivo (VPP) <50 %. Esto sirve para descartar reacciones de anticuerpos específicos y para el diagnóstico etiológico de asma, rinitis y alergia a los alimentos 28. En los casos en que no se puede ejecutar un reto alimenticio es posible utilizar tanto la prueba cutánea como la IgE 29,30.
Procedimientos de detección diagnóstica
El desafío doble ciego controlado con placebo es considerado el método de referencia en el diagnóstico de la APLV, pero en la práctica solo se realiza un desafío abierto 31. El paciente con sospecha de APLV deberá seguir una dieta de exclusión durante 2 a 4 semanas; los lactantes alimentados con fórmula iniciarán una fórmula extensamente hidrolizada (FEH), y las madres que proporcionan lactancia materna exclusiva implementarán una dieta libre de las proteínas de leche de vaca. Así, si la APLV está presente, las manifestaciones clínicas desaparecerán.
La proteína de la leche de vaca se reintroduce progresivamente y a partir de entonces los síntomas clínicos son monitorizados. El riesgo de un desafío abierto es una sobreestimación del diagnóstico 32. Un desafío doble ciego controlado con placebo cegará al padre y al médico en cuanto a la introducción de la proteína de la leche de vaca y es la única medida objetiva para hacer el diagnóstico.
Infortunadamente, este proceso es costoso, requiere de una preparación extensa, consume mucho tiempo y es difícil de realizar. La supervisión médica durante un desafío es necesaria porque la severidad de los síntomas no puede predecirse. Cuando las pruebas de alergia adicionales (IgE específica del suero, prueba cutánea) son negativas, las manifestaciones que amenazan la vida son extremadamente raras, pero en pacientes con antecedentes de reacciones graves o altos niveles de IgE se indica una atención hospitalaria con un protocolo establecido.
En los escenarios en los cuales se confirma la APLV debe mantenerse una dieta de eliminación hasta que el paciente esté en una edad entre los 9-12 meses, o por lo menos durante 6 meses. Luego de ello, al realizar un nuevo desafío, los niños que no desarrollan manifestaciones relacionadas con la alergia, y hasta una semana después, pueden reanudar su dieta normal.
La prueba intraepidérmica y la medición de la IgE específica permiten establecer la sensibilización del niño a la proteína de la leche de vaca y predecir una posible nueva reacción. La probabilidad de un resultado positivo en la prueba de reto oral controlado es >95 %, cuando se tiene una concentración de IgE específica en menores de 2 años >UI/mL y de 15 UI/mL en mayores de 2 años 33. Con la prueba intraepidérmica, el VPP de una reacción al consumo de leche es >95 %, cuando se forma un habón de 6 mm en menores de 2 años y de 8 mm en mayores de esta edad (34) (Tabla 2).
Pruebas no mediadas por la IgE: pueden ser no invasivas, como la prueba del parche atópico. Esto permite evaluar la respuesta celular, pero sus valores no están estandarizados. También existen otras pruebas como la función celular, las precipitinas, la permeabilidad intestinal, los eosinófilos y del TNFα. Entre tanto, las invasivas con endoscopia digestiva para la toma de biopsias requieren un estudio histológico, pero no se recomiendan usualmente.
Histología: a nivel del intestino delgado, el patólogo debe reportar más de 60 eosinófilos en 6 campos de alto poder, o más de 15 a 20 eosinófilos por campo, con más del 25 % de infiltrado inflamatorio, y la presencia de eosinófilos intraepiteliales más abscesos eosinofílicos en las criptas.
Tabla 2 Procedimientos de detección diagnóstica

IgE: inmunoglobulina E; IgG: inmunoglobulina G; APLV: alergia a las proteínas de la leche de vaca
En el colon, se debe encontrar macroscópicamente un eritema focal, una mucosa friable, una hiperplasia folicular linfoide (75 % de los casos) y vasculitis alérgica; a nivel microscópico, es necesario hallar el infiltrado local de eosinófilos en todos los compartimentos 33.
Herramientas de diagnóstico
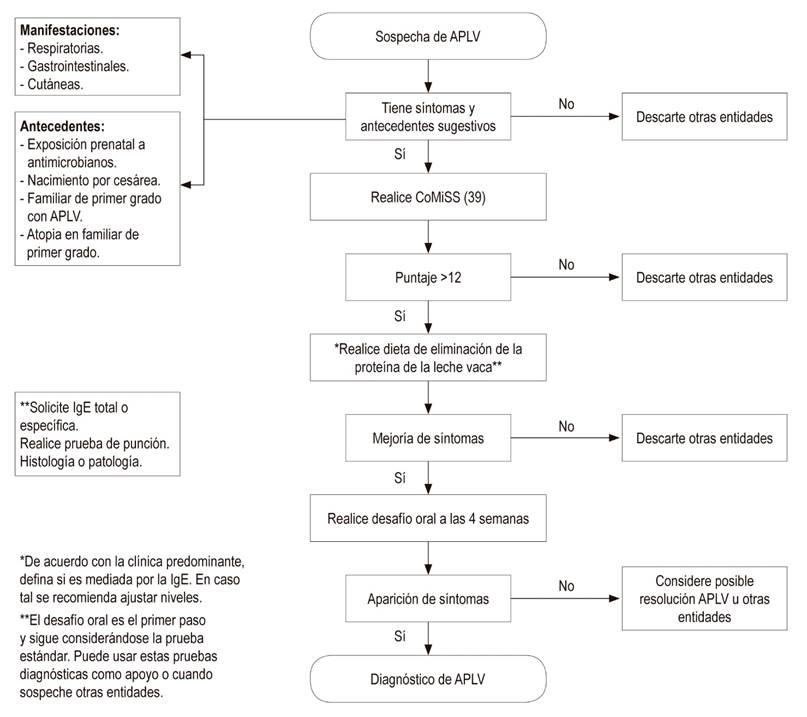
Los síntomas y signos de la APLV tienen una presentación amplia e inespecífica, lo que puede retrasar un correcto diagnóstico. Dicho diagnóstico implica una dieta de eliminación de 2 a 4 semanas, seguida por el desafío de la exposición nuevamente a la proteína de la leche de vaca. Por tanto, ha sido elaborado un recurso clínico para facilitar la identificación y el proceso de diagnóstico.
Se trata de la puntuación de síntomas relacionados con la leche de vaca (Cow’s Milk-related Symptom Score, CoMiSS) 38, la cual incluye manifestaciones gastrointestinales (regurgitación, alteración de las heces), signos cutáneos (eccema, urticaria), síntomas del tracto respiratorio y síntomas generales como el tiempo de llanto.
El CoMiSS varía de 0 a 33 puntos, los cuales van desde la ausencia de síntomas y signos a múltiples manifestaciones con gravedad de presentación de estos. Se propuso un valor de corte ≥12 como recomendación del panel de expertos. Los datos existentes muestran que el valor predictivo de la herramienta para identificar a los bebés con riesgo de APLV puede ser del 80 %.
Así, el CoMiSS fue validado en un estudio que encontró una sensibilidad del 87,5 % y una especificidad del 78,6 % 39. Esta herramienta se convierte en un paso a la reducción de retrasos y dificultades de diagnóstico de la APLV 38 (Figura 1).
Diagnóstico diferencial
La lista de posibles diagnósticos diferenciales para la APLV incluye infecciones víricas repetitivas e intolerancia transitoria a la lactosa. Por otro lado, el RGE se ha mencionado como una posible manifestación de la APLV 40,41. Asimismo, la APLV también se ha relacionado con cólicos del lactante y contribuye en alrededor del 10 % de los niños que sufren este síntoma 42,43.
Aunque en algunos lactantes se sugiere una correlación entre la dermatitis atópica y la APLV, muchos casos de este tipo de dermatitis no están asociados a la presencia de la alergia. A menor edad del lactante, o cuanto más severa sea la dermatitis atópica, más fuerte parece ser la asociación 44.
Las reacciones a otros alimentos (especialmente el huevo y la soya, el trigo, el pescado) ocurren frecuentemente en combinación con la APLV 45. Por tanto, estos alimentos deben evitarse cuando se esté realizando una prueba de exclusión diagnóstica.
Tratamiento de la APLV
La estrategia más segura para el tratamiento de la APLV es evitar estrictamente la proteína de la leche de vaca. La decisión de utilizar una fórmula sustituta y elegir la mejor opción para satisfacer las necesidades nutricionales de los niños con APLV debe hacerse, sobre todo, en función de la edad del paciente y la historia de otras alergias alimentarias. Para los lactantes que reciben lactancia materna exclusiva, el diagnóstico de eliminación implica la exclusión de los derivados lácteos de la dieta materna. Las madres necesitan recibir suplementos de calcio y asesoría dietética, a fin de evitar deficiencias nutricionales 1.
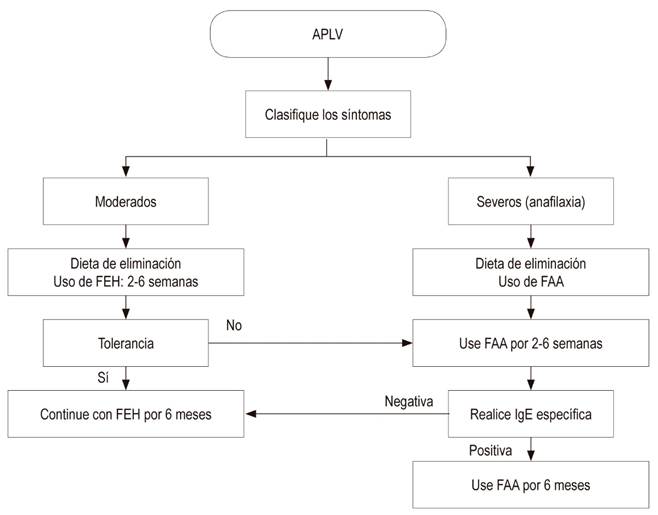
La fórmula a base de la leche de vaca, y cualquier alimento complementario que contenga sus derivados, deben evitarse en lactantes con lactancia materna exclusiva. Cuando los síntomas de alergia ocurren en lactantes alimentados con fórmula, ya sea exclusivamente o como suplemento a la lactancia materna, se les debe suministrar una fórmula terapéutica que haya demostrado reducir clínicamente la alergenicidad y tenga alta tolerabilidad 46,47. Las FEH y las fórmulas basadas en aminoácidos (FAA) son las dos alternativas recomendadas para la alimentación con fórmula entre los lactantes con APLV 25,46,48,49.
Las FEH están indicadas en el tratamiento y en la prevención de la APLV y son toleradas por la mayoría de los lactantes y niños con esta condición 1,48. Entre tanto, las FAA se desarrollan para superar la hipersensibilidad contra las proteínas residuales en la FEH, particularmente en casos con enteropatía grave o con múltiples alergias alimentarias 48. Por esta razón, las FAA pueden considerarse solo en lactantes con reacciones graves como anafilaxia, enteropatía, esofagitis eosinofílica, enterocolitis inducida por proteínas, junto con casos en los cuales existe un compromiso a nivel de múltiples sistemas, diferentes alergias alimentarias e intolerancia a las FEH 14,48,50.
Mientras que las fórmulas de soya se asocian con una menor alergenicidad que las basadas en leche de vaca 51,52, se han planteado preocupaciones por su alto contenido de isoflavonas (fitoestrógenos) 53.
La Sociedad Europea de Gastroenterología Pediátrica, Hepatología y Nutrición (The European Society for Paediatric Gastroenterology, Hepatology and Nutrition, ESPGHAN) y la Academia Americana de Pediatría (American Academy of Pediatrics, AAP) consideran el uso de las FEH y las FAA para el tratamiento de lactantes con APLV como la primera opción 52,53,54. Asimismo, no recomiendan el uso de fórmulas parcialmente hidrolizadas (FPH) basadas en proteína de la leche de vaca, ni derivados lácteos de otros mamíferos 55,56,57. Pese a ello, los países adscritos a Medio Oriente decidieron en un consenso incluir en su algoritmo de manejo el uso de las FPH como terapia puente entre las FEH y las FAA, en casos seleccionados.
En lactantes con APLV documentada, y nutridos exclusivamente con leche materna y fórmula, los alimentos de transición deben estar libres de proteínas de leche de vaca hasta que el desarrollo de la tolerancia se confirme mediante pruebas de exposición oral. En los niños con APLV que están en tratamiento con dieta de exclusión, más allá de los primeros 12 meses de edad, se recomienda la supervisión dietética realizada por un profesional de la salud especializado o capacitado en nutrición pediátrica, a fin de decidir sobre las cantidades suficientes de nutrientes, proteínas, calcio, vitamina D y vitamina A en la dieta. Esto también es fundamental para establecer la necesidad de una fórmula nutricional o los suplementos para lograr un crecimiento normal según la edad 49,56,57.
De igual forma, es primordial determinar la tolerancia a la proteína de la leche de vaca, a fin de evitar prolongar dietas restrictivas que afectan el crecimiento y el desarrollo del niño, y que, por otra parte, puedan comprometer el estado nutricional de la madre que está lactando 2,49.
Niños alimentados con lactancia materna exclusiva
Durante la alimentación con lactancia materna exclusiva, se eliminará de la dieta de la madre todo alimento que contenga proteína láctea. Es necesario indicar a la mujer la restricción de alimentos que contengan en sus rótulos información nutricional denominadas leche, suero de leche, sólidos de leche, caseína y caseinato.
Al cumplirse 6 meses, el proceso de introducción de alimentación complementaria deberá realizarse retrasando el consumo de comidas con contenido de proteína de leche de vaca. Durante el tiempo de la dieta de eliminación de la madre, ella debe recibir asesoría nutricional, suplementación de 1000 mg de calcio al día y vitamina D 800 UI al día 50.
Niños alimentados con fórmula o alimentación mixta
Estos pacientes deben recibir una dieta con exclusión de productos lácteos asociada a una fórmula terapéutica para APLV:
Fórmulas indicadas en APLV
Las fórmulas que se encuentran indicadas en la APLV son aquellas que no generan una reacción en el 90 % de los lactantes y niños con APLV confirmada.
FAA: son fórmulas sintéticas a base de aminoácidos libres. Estas se hallan libres de lactosa y constituyen la mejor opción para el tratamiento de la APLV, por lo que se consideran la primera línea.
FEH: son fórmulas adaptadas para uso en lactantes, las cuales constan de procesos de hidrólisis enzimática, tratamiento térmico y ultrafiltración. Esto facilita que dicha proteína se forme por péptidos de cadenas más cortas.
Fórmulas de aminoácidos con suplementación de oligosacáridos de la leche materna: son fórmulas que se encuentran en desarrollo, en las cuales se plantea la suplementación de una FEH con 2’fucosil-lactosa (2’FL) y lacto-N-neotetraosa (LNnT). Estos dos suplementos tienen su fundamento de uso en los oligosacáridos propios de la leche materna y con su adición podrían reducir el riesgo de infección entérica. Además, proporcionarían un sustrato para la colonización del intestino del niño con bifidobacterias benéficas y reducirían la colonización por agentes patógenos.
Asimismo, la presencia de estos suplementos afecta de forma positiva la integridad epitelial intestinal, la apoptosis y la permeabilidad intestinal. En efecto, en modelos animales, han mostrado una reducción de los síntomas alérgicos a la proteína de la leche de vaca, pero este es un campo aún por explorar 2,58.
Fórmulas inadecuadas en APLV
FPH: son fórmulas en las cuales los péptidos conservan epítopos de péptidos, capaces de producir reacciones alérgicas 49.
Leches de otros mamíferos: estas no son nutricionalmente apropiadas para el uso en los lactantes 49.
Leche de almendras, avellanas, arroz, soya, coco y otros vegetales: el jugo de estas mal llamadas leches no es nutricionalmente adecuado, ya que no proviene de la extracción de una glándula mamaria. Además, brinda un bajo aporte calórico y una baja biodisponibilidad 49.
Fórmulas de soya: la diferencia entre las fórmulas de soya y las mal llamadas leches de otros vegetales radica en que las primeras son adaptadas para el uso de lactantes. Por su contenido de fitatos, es posible que la disponibilidad de minerales como el zinc, el hierro, el magnesio y el fosforo sea menor. Además, se han reportado reacciones cruzadas en un 10 a 30 % de los casos con APLV 49.
De igual forma, se han obtenido casos de reacción cruzada con las fórmulas nutricionales infantiles a base de soya en el 17,3 % de los lactantes con APLV, independientemente de si fueron positivos o negativos en IgE específica para la proteína de la leche de vaca 52,59.
En particular, los lactantes con múltiples alergias alimentarias y enterocolitis eosinofílica también reaccionan a la proteína de soya 60. Por lo tanto, los grupos de especialistas tienen diferentes posturas sobre el uso de la fórmula de soya para la APLV, pero generalmente no se recomienda su implementación antes de los 6 meses de edad 46,52,58.
Prevención de la APLV
El riesgo de alergia tiene un componente genético y puede determinarse por un factor familiar. Datos históricos muestran que la incidencia de la enfermedad atópica es de alrededor del 15 %. Sin embargo, esta se incrementa en niños con antecedentes familiares de enfermedad atópica. Así, si dentro de una familia un niño presenta una alergia, el riesgo de que también ocurra en los hermanos es 10 veces mayor que en la población general 61.
La lactancia materna es universalmente reconocida como la mejor manera de proporcionar alimento ideal para el crecimiento y el desarrollo saludable de los lactantes. La Organización Mundial de la Salud recomienda que los lactantes sean amamantados exclusivamente durante los primeros 6 meses de vida para lograr este crecimiento y desarrollo saludables. Después de este período, los niños deben recibir alimentos complementarios nutricionalmente adecuados y seguros, mientras que la lactancia continúa hasta los 2 años o más. La lactancia materna exclusiva ha demostrado ser el mejor método para prevenir la alergia.
Se ha identificado que los niños alimentados con lactancia materna exclusiva presentan un menor riesgo de desarrollar APLV. También se ha observado que si la APLV aparece durante la infancia es menos severa en comparación con el uso de fórmulas o alimentación mixtas. La razón de este menor riesgo es que la leche materna posee 100 000 veces menos proteínas que la leche de vaca y, además, contiene inmunomoduladores 50.
Con respecto a la dieta infantil, existen pruebas contradictorias sobre el efecto preventivo de retrasar la introducción de alimentos sólidos en la incidencia de la alergia. Algunos estudios sugieren que el tipo de restricción y el retraso en el momento de la introducción de los alimentos pueden prevenir la alergia 62,63,64. En contraste, otros autores plantean que la introducción temprana no tiene ningún efecto adverso e incluso puede ser protectora contra la alergia 64,65.
Asimismo, la restricción de los alimentos sólidos más allá de los 6 meses de edad puede conducir a una ingesta inadecuada de nutrientes, problemas de alimentación y déficit en el crecimiento 65. En síntesis, la evidencia sugiere que no existe un beneficio al retrasar la introducción o imponer una restricción específica de alimentos potencialmente alergénicos más allá de 4-6 meses 2.
Entre tanto, los prebióticos y los probióticos suelen comercializarse con la promesa de que pueden ayudar en la prevención de la alergia 66,67. En efecto, existen estudios que sugieren que la suplementación probiótica de las madres durante el embarazo y la lactancia puede contribuir en la prevención de la enfermedad atópica temprana en los lactantes 68.
Una revisión sistemática encontró una mayor tasa de adquisición de tolerancia a la proteína de la leche de vaca al final de los 3 años, en niños que habían recibido probióticos, en comparación con placebo. No obstante, el nivel de evidencia es bajo, dada la calidad de los estudios incluidos 69.
También hay evidencia que sugiere que la suplementación de FEH con prebióticos puede disminuir la incidencia de manifestaciones alérgicas como la dermatitis atópica, las sibilancias recurrentes y la urticaria alérgica en la infancia 70,71. Sin embargo, aún no se han publicado estudios que demuestren si esto también ocurre con las FPH suplementadas con prebióticos.
De cualquier forma, estos datos sugieren que los prebióticos y los probióticos son seguros y que, si bien existe alguna evidencia de que pueden reducir la incidencia de alergia, se necesitan más pruebas para que puedan convertirse en una recomendación de rutina.
Otra propuesta en la modulación de la APLV es la aplicación de tratamientos térmicos a la leche de la vaca, lo cual podría inducir cambios en la estructura de la proteína. Sin embargo, estos estudios aún no son contundentes y sus resultados hasta el momento son in vitro. Por tanto, no es recomendable ofrecer lácteos hervidos, horneados o expuestos a cocción por largos períodos, pues no ofrecen ningún beneficio demostrado en la tolerancia a la proteína de la leche de vaca 72,73 (Figura 2).
Conclusiones
La APLV puede presentarse en los lactantes que reciben lactancia materna exclusiva y en los niños alimentados con fórmula. Las manifestaciones no son patognomónicas y una historia clínica completa con un examen exhaustivo son la base del diagnóstico. La confirmación mediante una prueba de punción, una IgE específica en suero o una prueba del parche atópico carecen de especificidad, mientras que el reto alimenticio doble ciego controlado con placebo sigue siendo el tratamiento de referencia 14.
El debate sobre el manejo de la APLV se prolongará según las manifestaciones clínicas predominantes y el contexto del paciente. Entre tanto, las FEH basadas en la leche de vaca siguen siendo la opción terapéutica recomendada y preferida, mientras que las FAA están reservadas para los casos más graves. Asimismo, la lactancia materna se constituye en la mejor opción -y también en la más económica- para alimentar a los niños sanos y a aquellos con APLV.











 text in
text in