Introducción
El cáncer en niños (0-14 años) y adolescentes (1519 años) es un grupo heterogéneo de neoplasias con diversos patrones de ocurrencia, etiología, tratamiento y supervivencia1. El cáncer pediátrico difiere respecto al presentado en adultos en varios aspectos como su comportamiento biológico, semiología, modos de presentación, opciones de tratamiento, desenlace, entre otras características2.
La incidencia del cáncer en niños varía de acuerdo con la región geográfica y el nivel de ingresos del país. Se estima que en países desarrollados entre 1 de cada 450 a 1 de cada 600 niños pueden desarrollar cáncer3. Sin embargo, en muchas regiones los sistemas de registro son deficientes y esto dificulta la cuantificación de la incidencia exacta1. Para 2023, se proyecta que se diagnosticarán 9910 casos de cáncer en edades comprendidas entre los 0 y 14 años, y 5280 casos en población entre los 15 y 19 años4. Se estima que 1040 niños y 550 adolescentes experimentarán un desenlace fatal como consecuencia de la enfermedad oncológica. La leucemia muestra la mayor incidencia con un 28 % de los casos de cáncer pediátrico y adolescente, seguida por tumores del sistema nervioso central (SNC) en un 21 %, y, en tercera posición, el linfoma con un 19 %4. En Colombia, en el año 2020 se notificaron 1741 casos de cáncer pediátrico5, y en Bogotá 299 casos, lo que muestra una incidencia en la ciudad de 13,7 casos por cada 100.000 habitantes6. En el mismo año se registraron 626 casos nuevos de leucemia en niños y 151 casos en adolescentes4.
Los cánceres pediátricos más comunes incluyen leucemias agudas, tumores cerebrales, linfomas, sarcomas de tejidos blandos y huesos y tumores de las células germinales. Los tumores de origen embrionario como el neuroblastoma, el tumor de Wilms y el retinoblastoma son más comunes en niños, mientras que los cánceres de origen epitelial son más comunes en los adolescentes7. Aproximadamente, el 50 % de estos cánceres tienen un pronóstico favorable si son diagnosticados y tratados apropiadamente7. En las últimas cinco décadas los avances en combinaciones de tratamiento, desarrollos de terapias avanzadas, técnicas y herramientas diagnósticas han mejorado la supervivencia de los niños con cáncer8. En países desarrollados, donde existe acceso a un diagnóstico temprano y a tratamientos óptimos, el 80 % de los niños diagnosticados con cáncer tienen una supervivencia mayor a 5 años, mientras que en países de bajos ingresos se estima que la supervivencia a 5 años es solo entre el 15 al 45 %3,9. Por lo cual, en la actualidad, se busca que los países de bajos ingresos tengan el mismo acceso que los países desarrollados, en cuanto a las terapias contra el cáncer. Además, se continúan explorando nuevas opciones de tratamiento que sean más eficaces, especialmente contra los tipos de cáncer que tienen mal pronóstico, poca respuesta al tratamiento y baja remisión.
El tratamiento del cáncer ha tenido una revolución debido al conocimiento del papel que desempeñan el microambiente tumoral (ambiente celular al que están expuestas las células neoplásicas) y la respuesta inmune durante el desarrollo del tumor. Actualmente, existe un amplio movimiento del uso de tratamientos con amplio espectro (como la quimioterapia y la radioterapia) hacia el uso de inmunoterapia basada en anticuerpos dirigidos contra proteínas del control de punto de chequeo, transferencia de células expandidas ex vivo como los linfocitos infiltrantes de tumor y células modificadas mediante ingeniería genética10. Estos tratamientos han mostrado significativos avances y buenos resultados al ser incorporados en los regímenes de tratamiento, tanto en adultos como en niños11. En cuanto a la transferencia adoptiva de células T autólogas modificadas por transferencia de genes para expresar receptores quiméricos de antígenos (CAR-T, del inglés T-cell Chimeric Antigen Receptor), esta tiene el objetivo de generar células con mayor especificidad para el reconocimiento de antígenos tumorales, lo que permite generar una respuesta inmune fuerte y específica, potencialmente capaz de eliminar tumores en un corto período de tiempo12.
Teniendo en cuenta que el tratamiento basado en células CAR-T ha tenido éxito como tratamiento alternativo para pacientes con linfomas y leucemias (CD19+), tanto en recaídas como en enfermedad refractaria13,14, la Administración de Alimentos y Medicamentos (FDA, del inglés Food Drug Administration) de los Estados Unidos y la Agencia Europea de Medicamentos (EMA, del inglés European Medicine Agency) en Europa aprobaron la terapia para pacientes pediátricos15,16. Sin embargo, la información sobre el uso de esta terapia en niños es escasa y en Colombia aún no se cuenta con la regulación para la administración de terapias adoptivas, como la terapia con células CAR-T. Por ende, esta revisión tiene el objetivo de describir la ingeniería genética de células CAR-T, sus aplicaciones clínicas y la efectividad de los ensayos clínicos actuales en pacientes pediátricos.
Metodología de búsqueda
Estrategia de búsqueda
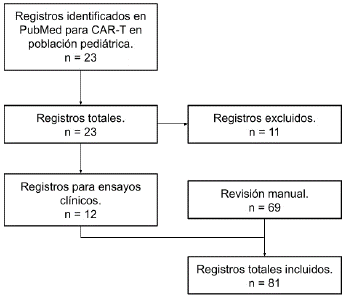
Para la búsqueda de estudios de ensayos clínicos que usaron tratamientos con células CAR-T en pacientes pediátricos se realizó una búsqueda en Medline (Pubmed), usando los siguientes términos: (CAR-T[Title/Abstract])) AND (CHILD[Title/Abstract]) OR (CAR-T[Title/Abstract])) AND (PEDIATRICS[Title/Abstract]). Se incluyeron estudios publicados entre enero de 2014 a junio de 2022. Para el apartado de historia y la generación de los anticuerpos por ingeniería genética, se realizó una revisión narrativa haciendo una búsqueda manual en Google académico. Los registros fueron revisados para duplicados, cartas a editor, poster y eliminados; posteriormente, se revisaron los artículos por título y resumen por los autores ASFD y CPJT. Los artículos potencialmente relevantes fueron revisados en su texto completo por los autores ASFD, CPTJ, BAQA y LDOS. Posteriormente, la revisión de la información fue revisada por los autores JCC y LDGC, quienes extrajeron la información. Los demás autores participaron en la extracción de la información narrativa referente a antecedentes de inmunoterapia en ingeniería genética (ver Figura 1).
Criterios de inclusión
Para la revisión narrativa de los aspectos de ingeniería genética y desarrollo de células CAR-T se seleccionaron estudios que mostraban de manera detallada el desarrollo y generación de la célula. Se tomaron artículos básicos para revisar los antecedentes de la inmunovigilancia e inmunoterapia en el cáncer. Para las aplicaciones clínicas y la efectividad se seleccionaron estudios que informaban datos clínicos y efectividad en pacientes pediátricos.
Desarrollo de tema
Antecedentes de inmunoterapia y terapia dirigida
La inmunoterapia hace parte de los tratamientos específicos contra el cáncer, junto con la cirugía, la quimioterapia citotóxica, la radiación y la terapia dirigida. La inmunoterapia actúa sobre proteínas inhibidoras del punto de control inmunitario17. Actualmente, William Bradley Coley es conocido como el padre de la inmunoterapia.
Coley estableció una asociación entre infección estreptocócica y regresión de tumores, después de observar remisión en un grupo de pacientes con cáncer, posterior a desarrollar erisipela. Coley infectó pacientes con cáncer no resecable con bacterias vivas o muertas o mezcla de bacterias (denominadas la toxina de Coley), en 1891, y observó remisión del cáncer, lo cual asoció a un efecto inmunoestimulador18. Con este descubrimiento, a pesar del rechazo generado en la época por parte de la Sociedad Americana de Cáncer hacia "la toxina de Coley", se le atribuye a este estudio el uso actual del bacilo Calmette-Guérin (BCG) como inmunoterapia contra el cáncer19.
En 1908, Paul Ehrlich confirmó las observaciones de Coley reportando la remisión de varios tumores por la acción del sistema inmune18. En 1949, Frank Macfarlane Burnet, biólogo australiano, publicó una teoría sobre la tolerancia inmunológica adquirida, y planteó el desarrollo de la capacidad de distinción entre lo propio y lo ajeno20,21. En 1957, Burnet propuso la teoría de la "inmunovigilancia"22. Estos resultados estaban en concordancia con los trabajos realizados por el estadounidense Thomas Lewis, quien en 1950 había sugerido que el sistema inmune tenía la capacidad de reconocer los tumores mediante la expresión de neoantígenos de superficie17.
En 1982, el doctor James Allison y colaboradores fabricaron anticuerpos monoclonales con la capacidad de reconocer antígenos presentes en diferentes linfomas de células T23. Como resultado, produjeron un anticuerpo monoclonal que detectaba un epítopo específico de células de linfoma24. En 1986, Schering-Plough comercializó el interferón alfa 2b (IFN-a-2b) recombinante, el cual fue aprobado por la FDA inicialmente como opción terapéutica en la leucemia de células peludas, pero en 1995 se aprobó su uso como adyuvante en el tratamiento de melanoma estado IIB/III26. En 1988, la interleucina-2 (IL-2) fue la segunda citoquina antitumoral aprobada por la FDA como tratamiento del melanoma metastásico, y posteriormente, en 1992, para el carcinoma de células renales26.
En 1994, Pierre van der Bruggen et al. evaluaron la existencia de antígenos de rechazo de tumores (MZ2-E y MUC-1), el aumento de la inmunogenicidad tumoral y el rol que juegan los linfocitos T citotóxicos (CTL) antitumorales en el reconocimiento de los antígenos, mediante la generación de clones de células T citolíticas CD8+ y CD4+27. En el año 2000, A Löffler et al. describieron el anticuerpo recombinante CD19 x CD3, un segmento es dirigido de forma específica contra el antígeno CD3 de las células T humanas, y el otro segmento del anticuerpo es dirigido contra el biomarcador de células pan-B CD19, el cual es expresado en la gran mayoría de los tumores malignos de células B28. En 2017, dos productos CAR-T autólogos fueron aprobados por parte de la FDA y varias agencias reguladoras europeas en todos los pacientes hasta los 25 años, y han demostrado efectos potentes, inductores y duraderos en el 6090 % de los cánceres de células B29.
Inmunovigilancia del cáncer
El cáncer es una enfermedad genética en donde las células iniciadoras del crecimiento presentan alteraciones genéticas y/o epigenéticas que activan o reprimen genes conductores oncogénicos. La carga mutacional de las células tumorales contribuye al reconocimiento de las células transformadas, y esto puede determinar en parte la respuesta inmune generada, y adicionalmente la respuesta a tratamientos basados en inmunoterapia30. El reconocimiento de los antígenos tumorales por el sistema inmune del individuo puede causar una reacción, caracterizada por la liberación de citoquinas inflamatorias, migración de células del sistema inmune, entre otras características31.
La evidencia en modelos de cáncer en ratón inducido por carcinógenos condujo a Schreiber et al. a postular el concepto de inmunoedición, el cual explica cómo un cáncer inmunogénico puede crecer progresivamente32. Si la respuesta inmune es adecuada, las células tumorales son eliminadas. Si la respuesta inmune no es adecuada, se genera un equilibrio en donde se establece un balance entre la vigilancia inmune y las células tumorales, lo que permite que estas escapen a la destrucción mediada por el sistema inmune31. La inmunoedición del cáncer es un mecanismo supresor tumoral extrínseco que se activa sólo después de que se ha producido la transformación celular y los mecanismos supresores tumorales intrínsecos han fallado33.
La inmunoedición es un proceso dinámico que compromete tres etapas: eliminación, equilibrio, escape. En la etapa de eliminación de células neoplásicas intervienen la inmunidad innata y adaptativa, las cuales actúan conjuntamente para destruir las células transformadas antes de que sean detectadas clínicamente, y se caracteriza por la secreción de citocinas y atracción de células NK, células y5T, macrófagos y células dendríticas al tumor.
No obstante, si las células cancerosas sobreviven a esta etapa, se inicia la etapa de equilibrio, en la cual las células tumorales hacen cambios epigenéticos y expresan neoantígenos diferentes que hacen que el sistema no las detecte. Esto lleva a que se desarrolle un lecho tumoral (donde se encuentran muchas células tumorales genéticamente inestables) y una inmunogenicidad reducida. El equilibrio es la etapa más larga y pueden transcurrir hasta 20 años entre el evento de transformación inicial y la detección clínica del tumor34,35.
En la fase de escape continúan los cambios genéticos y epigenéticos en las células tumorales, lo que genera clones celulares con características diferentes a las de las células tumorales con las cuales se inició la respuesta inmunológica. En esta fase se potencia el crecimiento celular hasta llegar a tumores clínicamente detectables36-38.
La inmunoterapia tiene la capacidad de hacer que las células cancerosas sean "visibles" para el sistema inmunitario nuevamente, lo que permite que el sistema inmune retome el control del cáncer y genere una citólisis directa de las células cancerosas. La efectividad de la inmunoterapia contra el cáncer se basa en la especificidad antigénica de las células T, la cual se logra mejorar mediante la modificación genética y la redirección de las células T a los antígenos objetivo que se sobreexpresan en los tumores. Las propias células T del paciente pueden modificarse mediante ingeniería genética para expresar el receptor de células T (TCR, del inglés T Cell Receptor) modificado o receptores de antígeno quimérico que mejorarán la especificidad por el antígeno, y de esta forma se generan células T más eficientes para atacar tumores, sin el requisito de la activación de células T de novo en el paciente33.
Células CAR-T
Los CAR son receptores únicos diseñados para reprogramar funcionalmente a los linfocitos T y dirigirlos a un antígeno tumoral específico. Esta estrategia involucra la construcción del receptor quimérico mediante ingeniería genética e integración en el linfocito T. La exposición de este receptor en su superficie extracelular aumenta la función citolítica de los linfocitos T, y pueden permanecer estables durante varios años en el cuerpo como células de memoria. Esta última característica les permite a las células CAR-T reconocer e inducir la muerte de células tumorales en casos de recaída39.
El CAR es una proteína de fusión que compromete en su porción extracelular un dominio de unión al blanco, el cual es derivado del fragmento variable de cadena sencilla (scFv) del anticuerpo monoclonal, un dominio espaciador, un dominio transmembranal, y a nivel intracelular posee el dominio común del receptor de células T y las moléculas coestimuladoras40,41 (ver Figura 2).

Fuente: realizada por los autores, adaptada de Zhao, Z. y colaboradores44.
Figura 2 Receptor CAR y sus partes. Se muestra la estructura del receptor quimérico, su posición en la membrana celular y sus partes.
A lo largo del tiempo, se han modificado los CAR por adiciones de segmentos en la estructura del receptor (ver Figura 3). En la década de los 80, se usó en las células CAR-T de primera generación el dominio CD3Z (también conocido como CD3Z) para inducir la respuesta intracelular42. Esta terapia funcionaba solo si se administraba de manera conjunta con interleucina-12 (IL-12). Esta generación de células CAR-T no fue tan efectiva por la corta vida media que poseían estas células y su proliferación inadecuada43. Posteriormente, se desarrollaron células CAR-T de segunda y tercera generación, en las que se han añadido moléculas coestimuladoras, las cuales activan vías de señalización al interactuar con la célula presentadora de antígeno44.

Fuente: realizada por los autores, adaptada de Zhao, Z. y colaboradores44.
Figura 3 Generaciones de las células CAR-T y sus principales diferencias.
En los CAR de la segunda generación se buscaba que las células CAR-T in vivo pudieran aumentar su respuesta y proliferación; esto se logró incluyendo una molécula como el CD28, CD134 (OX40) o CD137 (4-1BB), lo cual generaba a su vez la síntesis de IL-245. Además, estos receptores podían reconocer péptidos del complejo mayor de histocompatibilidad en la célula tumoral45,46.
En la tercera generación se buscó una potenciación de efectos al combinar las moléculas ya mencionadas, pero en lugar de diseñar un constructo genético con solo una de estas moléculas, se hacían constructos con varias de ellas46.
En la cuarta generación se ha agregado un factor nuclear que permite que el linfocito T pueda generar citocinas inflamatorias, especialmente la ya mencionada IL-12. Estas células de cuarta generación se conocen como TRUCKs, acrónimo proveniente de la frase en inglés "Universal Cytokine-Mediated Killing"47. Además, se ha visto que estas células pueden ser usadas como tratamiento para otras enfermedades no neoplásicas46,47. Es importante aclarar que la clasificación de estas células en las diferentes generaciones es determinada por los cambios en la porción intracelular del receptor.
En cuanto al dominio extracelular, se emplean fragmentos de un anticuerpo monoclonal, ya que esto permite manipular de manera precisa y específica hacia qué antígeno va dirigida la respuesta inmune48. Por ejemplo, en las neoplasias de células B, las células tumorales expresan de manera característica la molécula CD19, por lo cual el constructo usado en el diseño de células CAR-T está dirigido de manera específica a las células CD19+, con el objetivo de eliminarlas49. De esta forma, no es necesario que se procese el antígeno, por lo cual el proceso es independiente de las moléculas del complejo mayor de histocompatibilidad50 (ver Tabla 1).
Tabla 1 Moléculas principales y efectos diferenciales en las diversas generaciones de células CAR-T.
| Moléculas involucradas | Efectos | |
|---|---|---|
| Primera generación | CD3ζ | Permite la transmisión de señales al interior del linfocito T42. |
| Segunda generación | CD3 ζ + CD28 o CD137 (4-1BB) o CD134 (OX40) | Reconocimiento del MHC, ayuda a la proliferación de células CAR T y a mejorar la citotoxicidad de esta, estimula la producción de células de memoria y efectoras, liberación de IL-244,45. |
| Tercera generación | CD3 ζ + CD28 + CD137 (4-1BB) o CD3 ζ + CD28 + CD134 (OX40) | Se potencian efectos de la segunda generación, en especial la actividad citotóxica46. |
| Cuarta generación | TRUCKs | Capacidad de inducir la producción de IL-12 potenciando activación de linfocitos T y atraer células de la respuesta innata46,47. |
Fuente: realizada por los autores.
Generación de CAR mediante Ingeniería genética
Varias metodologías de ingeniería genética han sido usadas para el diseño básico de las células CAR. Dentro de ellas, se ha usado transducción viral, transposones y transfección de ARNm, nanopartículas, liposomas y tecnología CRISPR/Cas933.
El proceso de producción de las células CAR-T incluye los siguientes pasos51: (ver Figura 4)
Aislamiento y enriquecimiento inicial de células.
Activación de células T.
Expansión de células T.
Transferencia génica de un vector CAR.
Expansión de células CAR-T.
Control de calidad.
Administración al paciente.
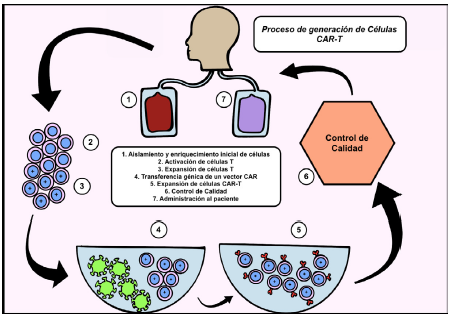
Fuente: realizada por los autores, adaptada de Mohanty, R. y colaboradores39.
Figura 4 Proceso de producción de células CAR-T.
Aislamiento y enriquecimiento inicial de células
El proceso inicia con la extracción de leucocitos de sangre periférica de los pacientes, a través de una leucoaféresis de células mononucleares de sangre periférica52. Posterior a esto, se realiza enriquecimiento, selección y activación de la población de linfocitos T usando perlas paramagnéticas unidas a anticuerpos anti-CD3/CD28 y técnicas de centrifugación53,54. Las células que se obtienen (3 x 109 a 10 x 109) se lavan y concentran usando centrifugas, y los linfocitos se separan de manera eficiente de las células mieloides mediante sistemas de centrifugación basados en el tamaño y/o en la densidad53. En este proceso hay una variabilidad entre la población celular inicial de los pacientes, que depende en gran medida de factores propios del paciente, como la edad, el sexo, el origen étnico y los factores relacionados con el tipo de tumor o la carga tumoral47.
Activación de células T
Luego de haber realizado la extracción de las células T se continúa con la activación, a través del TCR52,53. Se requiere una activación óptima conduciendo a una expansión suficiente de las células T sin causar una inmensa diferenciación o la muerte celular inducida por activación55. Las células T se activan mediante el TCR y el complejo principal de histocompatibilidad, ubicado en la superficie de la célula dendrítica, y a través de la adición de moléculas coestimuladoras como CD28, 4-1BB y OX40, desarrollando e implementando varios métodos que imitan la estimulación natural de las células T55.
Entre los métodos, se encuentra la activación mediante el uso de anticuerpos monoclonales no conjugados, y más comúnmente el uso de perlas magnéticas recubiertas con anticuerpos anti-CD3/ anti-CD28 como partículas artificiales presentadoras de antígeno. Los anticuerpos anti-CD3 proporcionan una señal proliferativa fuerte, y los anticuerpos anti-CD28 suministran una potente señal coestimuladora51. Estas perlas magnéticas recubiertas con anticuerpos anti-CD3/anti-CD28 inducen una generación de células T menos diferenciadas y potencialmente menos senescentes, así como células CAR-T con capacidad proliferativa mejorada y respuestas antitumorales tempranas in vivo en comparación con la estimulación con otros métodos como OKT-3 soluble y altas dosis de IL-251. Después de la estimulación se pueden eliminar estas perlas con un electroimán.
Expansión de células T y Transferencia génica de un vector CAR
Este proceso se realiza por medio de sistemas de transferencia de genes, con lo que se busca transferir información genética a las células T para que se exprese el CAR en su superficie56. Hay dos tipos de vectores de transferencia de genes: virales y no virales.
• Vectores virales
Los vectores más usados para terapia génica en investigación básica y clínica son los virus, debido a su alta eficiencia en la transferencia, el corto tiempo necesario para alcanzar el número de células T cultivadas para la aplicación clínica y la disponibilidad de diferentes virus57. Los vectores virales más utilizados son los gamma-vectores retrovirus, lentivirus, adenovirus y virus adeno-asociados39,57. Los retrovirus median la expresión génica estable a largo plazo, ya que el ADN viral producido se integra en el ADN del huésped. Para la producción de estos vectores retrovirales se pueden usar líneas celulares de empaquetamiento estables51. La mayor parte del genoma puede sustituirse por un transgén o transgenes de interés, y, tras la transducción, el genoma viral se integra permanentemente en el genoma de las células huésped33.
Los lentivirus son estructuralmente similares a los gamma-retrovirus, dado que sus genes virales esenciales pueden ser reemplazados por el transgén de interés; sin embargo, estos vectores insertan el material genético en el genoma de la célula huésped, en células en división celular y en células en quiescencia58. Otra ventaja importante del uso de vectores lentivirales es que tienden a integrarse en regiones del genoma que no están cerca de los promotores, lo que resulta en un riesgo relativamente bajo de aparición de mutagénesis insercional (que se relaciona con el desarrollo de leucemias), en comparación con los vectores retrovirales53,58. Por esta razón, los vectores lentivirales son cada vez más usados que los gamma-retrovirales59.
• Vectores no virales
Los vectores no virales se basan en elementos genéticos móviles denominados transposones, los cuales tienen mayor capacidad para transportar secuencias grandes de ADN y permiten la expresión de niveles persistentes del transgén60. Los plásmidos que transportan el sistema transposón/ transposasa son transferidos a las células T mediante electroporación (uso de pulsos eléctricos para generar poros transitorios en la membrana)51,60,61. Una vez dentro de las células T, el sistema elimina la secuencia blanca e integra el segmento CAR en el genoma celular, expresándolo posteriormente en la superficie de la célula T33. La ventaja de esta entrega de genes basada en plásmidos para la terapia con células CAR-T es que es una producción menos costosa y laboriosa, ya que no es necesaria la generación de virus51,60.
Otro método reportado en la literatura para la transferencia de genes son las herramientas de ingeniería del genoma, especialmente la edición de genes basada en CRISPR/Cas9, que representa un campo en evolución para las terapias basadas en CAR ya que permite la integración del transgén de forma eficiente y específica en las células huésped.
Expansión de células CAR-T y control de calidad
Al finalizar el proceso de transferencia de genes se realiza la expansión de las células CAR-T, durante este proceso el número de células aumenta continuamente (entre 7,5 x 107 a 3,4 x 108)51,62. Al final del proceso de producción se realiza la criopreservación, proceso en el que las células o tejidos son congelados a -180°C51,53. Después del control de calidad y el aseguramiento de la calidad, cuando se verifican los criterios de liberación, las células CAR-T criopreservadas o frescos se pueden transportar a la clínica para el tratamiento de los pacientes53,62.
La calidad de las células CAR-T requiere Buenas Prácticas de Manufactura (BPM) monitoreadas bajo normas ISO. Esto está integrado por: 1) instalaciones adecuadas, servicios públicos, calificación de equipos y plan de monitoreo ambiental, 2) selección de materias primas, 3) procedimientos operativos estándar y registros controlados de producción por lotes, 4) planes de muestreo durante y al final del proceso, 5) personal de fabricación capacitado y 6) control de calidad y ensayos analíticos54. Dentro de los parámetros a evaluar para la liberación de productos CAR-T se encuentran los descritos en la Tabla 2.
Tabla 2 Pruebas de liberación de células T modificadas con receptor de antígeno quimérico.
Fuente: tomada y modificada de Wang X, Rivière I (2016).
Administración al paciente
El último paso es la infusión intravenosa, similar a una transfusión, de las células CAR-T al paciente. Antes de realizar este proceso el paciente debe estar acondicionado, en un estado de linfopenia, ya que es necesario un ambiente adecuado para la expansión y supervivencia de las CAR-T in vivo; para ello, se suele administrar un régimen de quimioterapia basado en fludarabina y ciclofosfamida53.
La dosificación de las CART aún no está esclarecida y depende de diferentes protocolos adaptados al paciente y tipo de cáncer. La dosis varía desde 2 x 106 a 2 x 108 T-ce///Kg en el protocolo anti-CD19 Yescarta (Kite/Gilead) hasta 50-800 x 106 totales CAR + T-cells para anti-BMCA bb21217 (BlueBird/Celgene)53. Además, de acuerdo con el protocolo de infusión, se puede estipular la administración de las CART en única dosis o fraccionada para evitar posibles efectos secundarios.
Aplicaciones clínicas
Leucemia Linfoblástica Aguda tipo B (LLA-B)
Las células CAR-T de cuarta generación dirigidas contra el antígeno CD-19 han demostrado efectividad y seguridad para el tratamiento de la LLA-B, por lo cual se han convertido en una opción de tratamiento para la LLA-B recidivante o refractaria en la que han fracasado todos los tratamientos previos.
En el año 2013, en Estados Unidos, Brenjiens y compañía utilizaron por primera vez las CAR-T con CD-19 en cinco pacientes de edades adultas, entre los 23 y los 66 años con LLA-B recidivante, sin embargo, este estudio se vio limitado por razones éticas, en donde fue necesario la realización de un trasplante alogénico de células madre hematopoyéticas posterior al uso de las CAR T, limitando el tiempo de observación. En este caso, se reportaron remisiones morfológicas con enfermedad residual mínima a largo plazo en cuatro de los cinco pacientes tratados, en un tiempo promedio de 54,7 días, donde el menor fue de 8 días y el mayor, de 122 días. De acuerdo con este ensayo, el paciente que presentó recaída se relaciona probablemente con una terapia previa con dosis altas de esteroides para las toxicidades mediadas por citocinas, lo que implicaría una anulación de la persistencia de las CAR-T, en consecuencia, esto aumentaría la capacidad de las células tumorales CD19+ de LLA-B para escapar de la vigilancia inmunitaria mediada por este tratamiento, generando una recaída63.
En 2013, en Pensilvania, los Doctores Grupp, Kalos y compañía administraron infusiones de CAR-T transducidas con el anticuerpo anti-CD19 (CTL019) a dos niñas con LLA y LLA pre-B de 7 y 10 años, respectivamente, en quienes se lograron niveles de hasta 1000 veces más del basal, y se lograron identificar células en la médula ósea, y adicionalmente se observaron CAR-T células en el líquido cefalorraquídeo (LCR), en donde persistieron a niveles elevados durante al menos seis meses. Aproximadamente 1 mes después de la infusión, se alcanzó la remisión morfológica de la leucemia en ambos niños, sin embargo, en uno de los pacientes se dio una recaída, con células blásticas que ya no expresaban CD19, aproximadamente 2 meses después del tratamiento; en este caso indica la necesidad de atacar otras moléculas además de CD19 en algunos pacientes con LLA. Por otra parte, el segundo paciente continuó con remisión completa a los 11 meses después del tratamiento. Ahora bien, durante este ensayo clínico ambos individuos presentaron reacciones adversas grado 3 y 4, con efectos tóxicos agudos dados por fiebre, en un promedio de 5 días posterior a la aplicación, y otra sintomatología asociada, secundaria a un síndrome de Lisis Tumoral (ver tabla 3), por lo cual tuvieron que ser monitorizados y tratados de manera profiláctica; uno de ellos requirió manejo en unidad de cuidados intensivos pediátricos, intubación orotraqueal y uso de soporte vasopresor64.
En China, en el ensayo de Zuo et al., en 2018, aplicaron las CAR-T en 48 niños con edad promedio de 8 años con LLA-B CD19 positiva recurrente o refractaria, la proporción de linfocitos B positivos para CD-19 en la médula ósea disminuyó significativamente en 37 niños después de 7 a 28 días en promedio de la infusión, y 20 casos de linfocitos B positivos para CD19 desaparecieron por completo. La respuesta fue definida con remisión morfológica completa, monitoreo periódico de la médula ósea y niveles de enfermedad residual mínima inferiores a los niveles previos al tratamiento, con una tasa de respuesta temprana (respuesta fue entre el séptimo y vigésimo octavo día después de la infusión) de 77,1%65.
Un posterior estudio realizado por Hu G. et al (2022) en Pekín con 77 pacientes con enfermedad mínima residual encontró mayor supervivencia libre de enfermedad en pacientes con terapia CAR-T comparada con el grupo de pacientes tratados con quimioterapia. La supervivencia libre de leucemia (LFS) a 3 años fue significativamente mayor en los pacientes que recibieron terapia con CAR-T en comparación con aquellos que no la recibieron (77,8 % frente a 51,1%, P = 0,033). En este estudio 43 pacientes fueron tratados con CAR-T, 20 pacientes fueron tratados con quimioterapia para posterior trasplante de células hematopoyéticas alogénicas, y 14 pacientes recibieron quimioterapia intensificada. En el grupo de pacientes tratados con CAR-T, se observó que el 53,8 % experimentó síndrome de liberación de citocinas de cualquier grado, mientras que el 13,9 % presentó liberación más severa grados 3 y 4. Se reportaron eventos adversos neurológicos en el 13,9 % de los pacientes; los más comunes fueron dolor de cabeza y confusión en cuatro casos, convulsiones en uno y encefalopatía en otro. No se registraron muertes relacionadas con la terapia de CAR-T66.
Así mismo, un estudio fase 1, realizado entre julio de 2017 y junio de 2019, en tres centros de Londres con 15 pacientes pediátricos y adultos jóvenes (124 años) con recaída o LLA-B refractaria fueron tratados con CAR-T dirigidas contra CD22 y CD19. Los objetivos principales fueron evaluar la toxicidad de grado 3-5 durante el período de toxicidad limitante de dosis y la frecuencia de toxicidades limitantes de dosis. Los objetivos secundarios incluyeron analizar la tasa de remisión morfológica, la frecuencia y gravedad de los eventos adversos, la persistencia de AUTO3, la duración de la aplasia de células B y las tasas de supervivencia global y libre de eventos. El tratamiento con AUTO3 demostró un perfil de seguridad favorable, sin toxicidades limitantes de dosis o casos severos de síndrome de liberación de citocinas o neurotoxicidad relacionados con AUTO3. Al primer y doceavo mes después del tratamiento, la tasa de remisión fue del 86 % y las tasas de supervivencia global y libre de eventos fueron del 60 % y 32 %, respectivamente67.
Ma F. et al. realizaron un estudio en China, en 2019, donde se administró CAR-T de segunda generación (dominio intracelular 41 BB y una secuencia truncada de EGFR) en diez pacientes pediátricos, y obtuvieron una respuesta de remisión completa en el 80 % a los 2 años68. Maude L. et al. (2018) realizaron un ensayo clínico fase 1-2 con células T autólogas que reconocen el CD19 (Tisagenlecleucel ®), en 25 centros de estudio, de once países de América del Norte, Europa, Asia y Australia, con pacientes menores de 21 años, entre ellos 31 menores de 18 años; obtuvieron remisión completa de 81 % a los 3 meses, con supervivencia global del 90 % (IC 95 %=81-95) a los 6 meses y de 76 % (IC 95=63-86) a los 12 meses49.
Terry Fry et al. reportaron un estudio realizado en Estados Unidos, entre diciembre de 2014 y agosto de 2016, donde analizaron 21 niños con leucemia linfoblástica aguda pre-B (LLA-preB) con células CAR-T modificadas para reconocer el CD22, incluidos 17 niños que previamente habían recibido tratamiento con CAR-T anti-CD19; encontraron una adecuada respuesta. Se observó una actividad antileucémica dependiente de la dosis, y se logró una remisión completa en el 73 % (11/15) de los pacientes que recibieron ≥ 1 x 106 células CAR-T dirigidas a CD22 por kg, incluidos los 5/5 pacientes con LLA-preB CD19dim/ negativo. La mediana de duración de la remisión fue de 6 meses. Sin embargo, se observaron recaídas asociadas con una disminución en la densidad del sitio de CD22, lo que probablemente permitió que las células CAR-T dirigidas a CD22 no reconocieran adecuadamente a las células leucémicas. Estos resultados representan la primera evidencia de la actividad clínica de un CAR-T dirigido a CD22 en la LLA-preB, incluso en casos de leucemia resistentes a la inmunoterapia anti-CD19, demostrando una eficacia comparable a la de los CAR-Tdirigidos a CD19 en dosis biológicamente activas en LLA-preB69.
El siguiente estudio trató a 50 jóvenes y adultos jóvenes con LLA-B utilizando células CAR-T, en Estados Unidos, durante 2012 a 2019. Se observó que el 62 % de los pacientes logró una remisión completa, y aquellos que recibieron una cierta combinación de medicamentos tuvieron tasas de remisión mejoradas. Después del tratamiento, algunos pacientes se sometieron a trasplante de células madre hematopoyéticas, y se observó una supervivencia general mediana de 70 meses. Estos resultados sugieren que esta terapia puede ser efectiva para el control a largo plazo de la LLA-B en jóvenes y adultos jóvenes70.
Magnani CF et al., en Italia, durante 2019, realizaron un estudio con células CAR-T modificadas mediante transposición para reconocer el antígeno CD19 en cuatro niños de edades: 2, 5, 7 y 10 años; este estudio temprano de fase I/II en pacientes con leucemia linfoblástica aguda de células B, que recayeron después del trasplante alogénico de células madre hematopoyéticas, utilizó células CAR-T CD19 derivadas del donante, generadas con el transposón Sleeping Beauty, y diferenciadas en células asesinas inducidas por citocinas. El producto celular se produjo exitosamente a partir de la sangre periférica del donante y mostró un 43 % de expresión del CAR en linfocitos CD3+. Se infundieron células CAR-T en cuatro pacientes pediátricos y nueve adultos con una sola dosis, y se observaron toxicidades leves, sin casos graves de síndrome de liberación de citocinas, enfermedad injerto contra huésped o toxicidades limitantes de dosis. Finalmente, seis de siete pacientes que recibieron dosis más altas alcanzaron remisión completa el día 28 y cinco de seis pacientes en remisión también fueron negativos para enfermedad mínima residual71.
Leucemia linfoblástica aguda pediátrica con enfermedad residual mínima persistente/ recurrente
En el año 2021, en el Hospital Popular de la Universidad de Pekín, Guan-hua et al. realizaron un estudio prospectivo, explorando el papel de la terapia CAR-T en pacientes con enfermedad mínima residual (MRD, por sus siglas en inglés Minimal Residual Disease) persistente/recurrente en la remisión completa lograda después de la quimioterapia de inducción (RC1). En este estudio se incluyeron un total de 525 pacientes con LLA-B con cromosoma Filadelfia negativo entre enero de 2015 y septiembre de 2019. Los criterios de inclusión fueron (1) edad de 1 a 18 años, (2) RC1, (3) MRD positivo persistente dentro de los tres meses desde el inicio del tratamiento y (4) conversión de MRD de negativo a positivo durante la quimioterapia de consolidación71. Se excluyeron 448 pacientes, en su mayoría por MRD negativa persistente y recaída dentro de los dos meses posteriores a la MRD recurrente. De los 77 pacientes que cumplían con los criterios de inclusión, 43 pacientes se inscribieron en el grupo de aplicación de CAR-T. Los pacientes restantes se dividieron en el grupo de quimioterapia puente a trasplante alogénico de células hematopoyéticas (n = 20) y el grupo de quimioterapia intensificada (n = 14). En este estudio se implementaron células CAR-T anti-CD19 construidas con un dominio coestimulador 4-1BB (79 %) o CD28 (21 %) a través de un vector lentiviral a partir de material de leucaféresis fresco. Se administró quimioterapia basada en fludarabina (25 mg/m 2/d en los días -5 a -3) y ciclofosfamida (250 mg/m2/d en los días -5 a -3) para la depleción de linfocitos antes de la terapia CAR-T. La dosis mediana de células CAR-T infundidas fue de 3,85 x 106 (0,458,45 x 106)/Kg72.
Los resultados obtenidos del estudio con una mediana de seguimiento de 44 meses para todos los pacientes y 37,4 meses para los pacientes que recibieron terapia con CAR-T, mostraron que se logró la negatividad de la MRD después de un mes de infusión de CAR-T en el 90,7 % de los pacientes, la cual fue superior frente a los que no recibieron infusión de CAR-T (90,7 % frente a 70,5 %, p = 0,036). Los pacientes que recibieron terapia con CAR-T tuvieron una mayor supervivencia libre de leucemia (LFS, por sus siglas en inglés) a los 3 años (77,8 % vs. 51,1 %, p = 0,033). Según este estudio, se devela que la terapia CAR-T es efectiva en pacientes con cargas tumorales bajas, lo cual muestra concordancia con el ensayo ELIANA, que incluyó a niños y adultos jóvenes con R/R B-ALL, en donde la tasa de respuesta fue del 81 % y la supervivencia libre de leucemia entre los respondedores fue del 62 % a los 24 meses72.
Mieloma múltiple
Uno de los antígenos más estudiado en la actualidad es el BCMA (antígeno de maduración de células B), el cual Cohen A. (2018) presentó en un estudio que constó de 16 pacientes con diagnóstico de mieloma múltiple, de los cuales diez lograron una muy buena respuesta al par o una respuesta completa, y se evidenció que la mediana de supervivencia libre de eventos fue de aproximadamente 7,5 meses, lo cual muestra que la integración de CAR-T con otras terapias para el mieloma es un área importante de investigación futura. Las terapias CAR-T para MM se encuentran en una etapa temprana de desarrollo. De los pacientes evaluados, el 60 % respondió a la dosis más alta de células CAR-T, con una duración mediana de respuesta de 4 meses. Algunos pacientes mantuvieron respuestas duraderas por más de 1 año. Las toxicidades incluyeron síndrome de liberación de citocinas grave en el 33 % y neurotoxicidad en el 12,5 %, pero fueron manejables73.
Linfoma
En el ensayo clínico realizado por Rivers et al., y reportado en la revista de la Sociedad Americana de Hematología en el año 2018, se establecieron como objetivos de este análisis evaluar la seguridad, toxicidad, factibilidad y eficacia de SCRI-CAR19v1 en pacientes pediátricos con linfoma no Hodgkin (LNH) resistente o recurrente. Se evaluó la respuesta a las 3 y 9 semanas y los eventos adversos. Los pacientes tratados tenían LNH de células B grandes difusas (4/8), linfoma de Burkitt (2/8), linfoma de células B de zona gris (1/8) y linfoma de células B mediastinal primario (1/8), con edades entre 4 y 18 años. Todos mostraron expansión de células CAR-T en sangre periférica, médula ósea y LCR, con persistencia continua hasta el último control (14 días a 9 meses). La toxicidad hasta el día 30 reveló síndrome de liberación de citoquinas leve en cuatro pacientes (grado 1 n = 3, grado 2 n = 1) y un caso de CRS grave (grado 3). Se observó neurotoxicidad leve en dos pacientes (grado 1 n = 1, grado 2 n = 1) sin neurotoxicidad grave. La evaluación de respuesta a las 3 semanas mostró respuestas antitumorales en cinco pacientes, incluida remisión completa (CR) en dos pacientes con linfoma de células B grandes difusas refractario74.
Recaída tras terapia con CAR-T
A pesar de que la terapia con CAR-T es novedosa y tiene altas tasas de efectividad, también se ha notificado la recidiva tumoral en una proporción importante de pacientes, superando el 50 % en algunos estudios75. Varios factores limitan el poder y la eficacia de las células CAR-T. Las causas principales en las recaídas de CAR-T con CD19 positivo incluyen la persistencia limitada a largo plazo, el microambiente tumoral inmunosupresor y la disfunción intrínseca asociada con el agotamiento de las células T76. Sotillo et al. analizaron los mecanismos genéticos/epigenéticos de las recaídas negativas para CD19, y encontraron deleciones en el locus CD19 y cambios de marco de novo y mutaciones sin sentido en el exón 2 de CD19. Según Sotillo et al., el mecanismo de recaída en estos tumores fue la selección de variantes de empalme alternativo preexistentes76. Desafortunadamente, la resistencia a la terapia CAR-T anti-CD19 es una realidad; actualmente se están estudiando las CAR-T biespecíficas, como anti-CD19/CD22 y anti-CD19/CD20, en los ensayos clínicos NCT03448393 y NCT03271515, respectivamente75.
Al analizar los diferentes estudios de aplicación clínica en las diferentes patologías previamente propuestas, podemos observar que el uso de las células CAR-T muestra altas tasas de respuesta 7790 %, principalmente en tumores hematológicos, demostrando que son efectivas como alternativa para el tratamiento en cánceres de difícil manejo. En cuanto a seguridad de las terapias, en la Tabla 3 se muestran los principales efectos adversos y complicaciones de la aplicación de CAR-T; en la mayoría de los estudios evaluados son seguras o tratables, sin embargo, las respuestas no se mantienen constantemente, por lo que es un reto determinar una remisión completa y duradera, y aún es necesario más investigaciones y ensayos clínicos.
Tabla 3 Principales efectos adversos y complicaciones de la terapia con CAR-T.
| Efecto adverso | Consideraciones para tener en cuenta |
|---|---|
| Síndrome de liberación de citocinas | Es frecuente, se da por liberación masiva de citocinas en pacientes con alta carga tumoral o infección activa77. Se da de manera temprana cursando con inestabilidad hemodinámica, síntomas gastrointestinales, encefalopatía y oxigenación pulmonar deficiente78. El tratamiento consiste en la reducción de la infusión de células CAR-T y administración de IL-6 (Tocilizumab)79. |
| Aplasia de células B | Se da por proliferación exagerada de células CAR-T, de tal manera que receptores expresados de manera convencional en células normales (CD19) pueden ser reconocidos y llevar a destrucción masiva de células sanas77. Se suele presentar en pacientes con exposición a patógenos virales como Epstein Barr y múltiples fármacos78. A nivel clínico, los pacientes cursan con síndrome anémico, hemorragias cutáneas y predisposición a infecciones78. El tratamiento se basa en la administración de gammaglobulina IV79. |
| Síndrome de lisis tumoral | Es la emergencia oncológica más frecuente, se da por liberación súbita de contenido celular al torrente sanguíneo, posterior a la lisis tumoral dada por el tratamiento80. A nivel clínico, los pacientes cursan con síntomas gastrointestinales, trastornos hidroelectrolíticos, debilidad generalizada y parestesias. El manejo es dado por hidratación masiva80. |
| Enfermedad de injerto contra el huésped | Se da en pacientes con bajos conteos linfocíticos que requieren donantes externos para la fabricación de células T, por lo que se presenta incompatibilidad a nivel del complejo de antígeno leucocitario humano, llevando a eliminación de las células CAR-T y fracaso del tratamiento75,76. A nivel clínico, cursa con manifestaciones dermatológicas, alteraciones hepáticas y gastrointestinales76. El manejo es multidisciplinario y basado en el uso de corticoides, en casos donde la afección es grave se pueden llegar a usar inmunosupresores de mayor potencia como Metotrexato o Ciclofosfamida75. |
| Neurotoxicidad | Es frecuente y dada por el tratamiento concomitante con quimioterapia. Se suele dar en pacientes con alteraciones neurológicas, renales o hepáticas de base81. Se manifiesta como temblores, convulsiones, alteraciones de habla, encefalopatía y síndrome de latigazo cervical77. El tratamiento se basa en la hidratación y, de ser necesario, el uso de agentes anticonvulsivantes como levomepromazina; de la misma manera se debe considerar el uso de anti-IL 6 en caso de síndrome de latigazo cervical77. |
Fuente: elaborada por los autores, a partir de las fuentes referenciadas.
Conclusión
La terapia con células CAR-T podría ser una estrategia novedosa y prometedora para el tratamiento del cáncer pediátrico de manera más dirigida y en casos refractarios. Sin embargo, su implementación enfrenta desafíos debido a su alto costo y la necesidad de una mayor comprensión de su efectividad (selección apropiada de los casos), duración, dosis, momento apropiado de la enfermedad y efectos adversos a largo plazo. Se requieren estudios adicionales con poblaciones amplias y un seguimiento a largo plazo para evaluar completamente su potencial en el tratamiento del cáncer pediátrico.