Introducción
La obesidad se define como el exceso de peso corporal para una estatura determinada, la forma más utilizada para definir el sobrepeso (IMC de 25 a 29,9 kg/m2) y la obesidad (IMC ≥30 kg/m2) es el índice de masa corporal (IMC), aunque no es una medida real de la adiposidad, es fácil de utilizar en estudios y encuestas epidemiológicas. Sin embargo, el IMC como medida de la adiposidad a menudo se cuestiona porque el porcentaje de grasa puede ser variable debido al sexo, edad, raza/etnia, niveles de aptitud cardiovascular y otros factores del paciente, por ende, el IMC debe interpretarse con el conocimiento de los antecedentes, el examen físico y los estudios de laboratorio adicionales para llegar a una evaluación de riesgos y un plan de tratamiento preciso. La patogenia de la obesidad es compleja, si bien la ingesta calórica y los estilos de vida son evidentes en el desarrollo de esta, se debe tener en cuenta factores socioculturales, conductuales, genéticos y epigenéticos que contribuyen tanto a la causalidad como a la persistencia de esta, configurándose como una entidad multifactorial1.
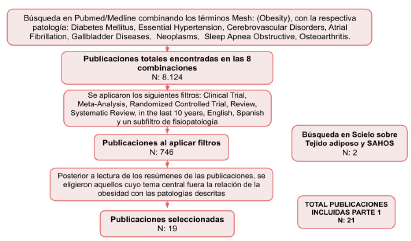
La obesidad continúa siendo un problema sanitario mundial, debido al mayor riesgo de padecer numerosas enfermedades crónicas, como diabetes mellitus tipo 2, hipertensión, enfermedades cardiovasculares, entre otras. Un análisis de datos de 195 países reveló que la prevalencia de la obesidad se ha duplicado en más de 70 países desde 1980, y en el 2015 más de 600 millones de adultos eran obesos, siendo el IMC elevado responsable de 4 millones de muertes en todo el mundo1. En Colombia, según la Encuesta Nacional de Situación Nutricional 3 (ENSIN-3) realizada en el año 2015, uno de cada tres jóvenes y adultos tiene sobrepeso (37,7 %), mientras que uno de cada cinco es obeso (18,7 %), completando un 56,4 % de la población colombiana con exceso de peso2.
El tejido adiposo actúa como reservorio pasivo para el almacenamiento de energía, el aislamiento mecánico y térmico, pero adicionalmente cumple función como órgano endocrino secretor de diversas hormonas, entre ellas, adiponectina, leptina, resistina y visfatina, importantes reguladoras del metabolismo energético, procesos reproductivos, función cardiovascular y sistema inmune, por lo que tienen influencia directa sobre órganos como cerebro, hígado, músculo esquelético y corazón3; por lo que su aumento conlleva a alteraciones bioquímicas que se aumentan el riesgo de aparición o progresión de enfermedades crónicas no transmisibles. Sin embargo, no todos los depósitos de tejido adiposo parecen conmutar la misma magnitud de riesgo de enfermedad crónica; la circunferencia de la cintura, indicador de presencia de obesidad abdominal (circunferencia de cintura >88 cm en mujeres y >102 cm en hombres), ha demostrado en varios estudios agregar o superar el valor predictivo del riesgo de mortalidad y de enfermedades relacionadas con la obesidad, frente al IMC solo4.
El objetivo de este artículo es describir de manera precisa los mecanismos fisiopatológicos por los que la obesidad desencadena varias de las enfermedades crónicas no transmisibles más prevalentes de nuestro medio, en particular, el síndrome metabólico; adicionalmente, se presenta una revisión del enfoque actual del paciente con obesidad junto con las estrategias de tratamiento descritas en la literatura, con el fin de servir como guía para el médico de atención primaria al momento de realizar el abordaje de pacientes con exceso de peso.
Metodología de búsqueda
Para la revisión se realizó una búsqueda de la literatura entre el 15 de octubre del 2022 y el 31 de enero del 2023, donde se incluyeron 38 referencias obtenidas mediante dos métodos de búsqueda diferentes, centradas en la fisiopatología de las enfermedades relacionadas con la obesidad y el abordaje de un paciente con sobrepeso/obesidad. La primera parte (ver Figura 1), se enfocó en explicar la relación de la obesidad con diversas patologías; en las bases de datos Scielo y Pubmed/Medline, se combinó el término obesidad con los términos Mesh de cada patología descrita (Diabetes Mellitus, Essential Hypertension, Cerebrovascular Disorders, Atrial Fibrillation, Gallbladder Diseases, Neoplasms, Sleep Apnea Obstructive, Osteoarthritis), filtrando publicaciones de los últimos 10 años, en idioma inglés o español, eliminando el enfoque pediátrico y utilizando el subfiltro de fisiopatología, seleccionando finalmente artículos donde el tema central fuera la explicación fisiopatológica de la enfermedad y se explicarade manera explícita su relación con la obesidad.
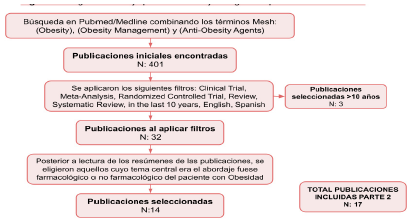
Para la segunda parte (ver Figura 2), el abordaje integral de un paciente con obesidad, se realizó una búsqueda de la literatura en la base de datos Pubmed/ Medline, combinando los siguientes términos Mesh: (Obesity) AND (Obesity Management) OR (Anti-Obesity Agents). Se eliminaron referencias escritas en un idioma diferente al inglés o español. Se seleccionaron revisiones de tema, guías de práctica clínica, ensayos clínicos, revisiones sistemáticas y metaanálisis publicados en los últimos 10 años; obteniéndose 32 resultados. Posteriormente, se revisaron los resúmenes de los artículos preseleccionados para determinar si incluían la información pertinente para ser incluida en esta revisión de tema. Finalmente, se seleccionaron 14 artículos cuyo tema central fuera el abordaje y manejo de la obesidad, ya fuera farmacológico o no farmacológico. Adicionalmente se añadieron a esta parte de revisión 3 artículos que, aunque no cumplían el criterio de tiempo de publicación, contenían información de interés para complementar esta revisión.
Desarrollo de tema
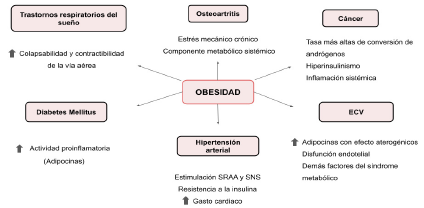
Resistencia a la insulina y Diabetes Mellitus tipo 2
En condiciones normales, el tejido adiposo secreta adipocinas con actividad proinflamatoria (leptina, visfatina y resistina), y antiinflamatoria (adiponectina y vaspina) que funcionan como redes de señalización que comunican este tejido con diferentes órganos, lo cual regula el metabolismo. Por el contrario, en un individuo con obesidad, su secreción contribuye a un estado de inflamación latente, que promueve resistencia a la insulina, uno de los mecanismos fisiopatológicos implicados en la diabetes mellitus tipo 2 (DM2)5,6.
La naturaleza inflamatoria del microambiente adiposo mediado por infiltración de macrófagos, liberación de citocinas, especies reactivas de oxígeno, liberación de ácidos grasos no esterificados proinflamatorios y otros agentes producidos por las células inmunitarias, activan importantes vías de estrés e interrumpen procesos metabólicos como la cascada de señalización de la insulina. A nivel molecular, la persistencia de citocinas proinflamatorias en sangre altera la capacidad de transducción de señales del receptor de insulina en los tejidos sensibles, la resistencia a esta, conduce al deterioro del tráfico de GLUT4 dependiente de insulina, aumentando los niveles de glucosa circulante, induciendo una secreción compensatoria de insulina y a largo plazo, generando una falla de células beta pancreáticas, lo que conlleva al desarrollo de DM27.
Hipertensión arterial
La obesidad es una causa claramente asociada al desarrollo de hipertensión arterial sistémica (HTA). Los mecanismos fisiopatológicos implicados son complejos y no se han dilucidado por completo. Algunos de estos mecanismos se describen en la Tabla 1.
Tabla 1 Mecanismos fisiopatológicos de la hipertensión arterial
| Aumento del flujo sanguíneo tisular y del gasto cardíaco debido al crecimiento de tejidos y órganos en respuesta al aumento de la carga de trabajo y las demandas metabólicas asociadas con la obesidad8,9. |
| Aumento del sistema renina-angiotensina-aldosterona (SRAA) por estimulación del sistema nervioso simpático (SNS) y producción de angiotensinógeno en el tejido adiposo8,9. |
| Compresión física de los riñones debido al aumento de la grasa visceral y retroperitoneal; la acumulación excesiva de grasa alrededor de los ríñones se asocia con presiones intrarrenales aumentadas8,9. |
| Aumento de la reabsorción renal de sodio por compresión de los riñones, activación del SRAA, y activación del SNS conllevando una presión arterial más alta para excretar la ingesta diaria de sal y mantener el equilibrio del sodio8,9. |
| Hiperinsulinemia, aumenta la presión arterial a través del aumento de la actividad simpática8,9. |
Fuente: tomado y editado de Landsberg L, et al8 y Hall JE, et al9.
En pocas palabras, la distribución de grasa visceral excesiva se acompaña de alteraciones hormonales, inflamatorias y endoteliales, induciendo una cascada de eventos como: el aumento de la resistencia a la insulina, la estimulación del SRAA y del SNS, disfunción endotelial y aumento de la retención de sodio, los cuales ocasionan una elevación de la presión arterial, incrementando el riesgo cardiovascular10.
Enfermedades cardiovasculares (ECV)
La evidencia clínica y epidemiológica relaciona la obesidad con diversas enfermedades cardiovasculares, que incluyen: enfermedad coronaria, insuficiencia cardíaca, hipertensión, accidente cerebrovascular, fibrilación auricular y muerte cardíaca súbita. La obesidad puede aumentar la morbilidad y mortalidad por ECV directa e indirectamente. Directamente, estos eventos se dan por adaptaciones estructurales y funcionales del sistema cardiovascular causadas directamente por la adaptación al exceso de peso, resultando en el aumento del volumen sanguíneo total, aumento del gasto cardiaco a través de un aumento del volumen sistólico, aumento de la frecuencia cardiaca debido a la activación simpática con el fin de satisfacer las demandas metabólicas del tejido adiposo, aumento de la resistencia vascular sistémica debido a la inflamación de bajo grado, hiperinsulinemia, hiperactividad simpática y trastornos respiratorios del sueño. Esto aumenta la carga de trabajo cardíaco y predispone a los individuos obesos a una geometría anormal del ventrículo izquierdo (VI) y a una remodelación adversa11.
Adicionalmente, en la obesidad el tejido adiposo experimenta una expansión desadaptativa que acaba comprometiendo su función, ocasionando un desequilibrio entre los compuestos pro y antiinflamatorios a favor de los proinflamatorios. En condiciones de equilibrio energético normal, los adipocitos secretan adipocinas antiinflamatorias (adiponectina, factor de crecimiento transformante, interleucina 10 y óxido nítrico) que promueven la sensibilidad a la insulina y ejercen efectos cardioprotectores y antiaterogénicos. Por el contrario, los adipocitos hipertróficos disfuncionales, en el contexto de una exposición sostenida a un exceso de grasa alimentaria, producen y liberan predominantemente adipocinas proinflamatorias (leptina, factor de necrosis tumoral, interleucina 6 y 18, la resistina, entre otras) que ejercen efectos aterogénicos, aumentan la inflamación vascular, el estrés oxidativo, la aterotrombosis, la hipertrofia del VI y la resistencia sistémica a la insulina11.
Los efectos indirectos que predisponen a ECV están mediados por factores de riesgo coexistentes, como resistencia a la insulina, hiperglucemia, hipertensión y dislipidemia11.
Fibrilación auricular (FA)
La obesidad se acompaña de un aumento en la incidencia de FA y varios estudios la destacan como un factor de riesgo independiente para su desarrollo. Los mecanismos fisiopatológicos siguen sin comprenderse por completo, pero se plantea que influyen mecanismos hemodinámicos (aumento de gasto cardiaco, presión arterial, retorno venoso), el aumento del tejido adiposo epicárdico, la inflamación sistêmica y comorbilidades asociadas que conducen a la remodelación de la aurícula izquierda, enlentecimiento y heterogeneidad de la conducción cardiaca12.
Enfermedad de la vesícula biliar
El incremento del tejido adiposo y la obesidad central generan resistencia a la insulina, lo cual se convierte en determinante para estimular la secreción de colesterol hepático, y por ende puede generar cálculos biliares de colesterol, los cuales se manifiestan como obstrucciones sintomáticas, haciendo necesario abordajes quirúrgicos13. Su aparición, se da por un desequilibrio de componentes biliares en el que predomina el colesterol en relación a las sales biliares y fosfolípidos, permitiendo la aparición de cristales de monohidrato de colesterol que se precipitan y forman cálculos. Paradójicamente, la pérdida de peso rápida (>1,5 kg/semana) y la reducción de peso excesiva (>25 % del peso corporal) también pueden iniciar un estado prolitogénico y aumentar la probabilidad de su formación o que los existentes se vuelvan sintomáticos13,14.
Cáncer
La Agencia Internacional para la Investigación del Cáncer (IARC) afirma que existe una asociación entre el exceso de grasa corporal con al menos 13 tipos de cáncer, incluyendo: adenocarcinoma de esófago; cánceres de mama en mujeres posmenopáusicas, colon y recto, endometrio, vesícula biliar, gástrico, riñón, hígado, ovario, páncreas, y tiroides; meningioma y mieloma múltiple. El sobrepeso y la obesidad aumentan el riesgo de cáncer por inflamación crónica, anomalías metabólicas y endocrinas, alteración en los niveles de insulina, factor de crecimiento similar a la insulina (IGF-1) y hormonas sexuales15,16.
Las hipótesis planteadas hasta el momento y su relación específica con algún tipo de cáncer se describen a continuación y en la Tabla 2:
Hormonas sexuales: el riesgo de cáncer aumenta con tasas más altas de conversión de precursores androgénicos en estradiol a través del aumento de la actividad de la enzima aromatasa en el tejido adiposo periférico, proceso conocido como aromatización, evidenciado en el exceso de adiposidad17.
Resistencia a la insulina e IGF-1: la hiperinsulinemia puede contribuir al desarrollo del cáncer de dos maneras: la señalización directa de niveles elevados de insulina que promueve el crecimiento, e indirectamente a través de la hipótesis de la insulina-IGF, en donde la hiperinsulinemia prolongada reduce la producción hepática de proteínas de unión hormonal (SHBG, IGFBP-1) que normalmente se unen a IGF-1 e inhiben su acción; esto conlleva a aumento en los niveles de IGF-1 libre y los cambios concomitantes en el entorno celular que favorecen el desarrollo tumoral. Adicionalmente, la activación del receptor de insulina y del receptor IGF-1 desencadena cascadas de señalización intracelular relevantes para favorecer al cáncer: mitogénesis, anti-apoptosis, angiogénesis y linfangiogénesis, que favorecen el desarrollo y la diseminación del tumor17.
Adipocinas e inflamación sistêmica: las hormonas polipeptídicas derivadas de los adipocitos están asociadas con el sistema inflamatorio; por ejemplo, la leptina es un potente agente inflamatorio, mientras que la adiponectina tiene una potente actividad antiinflamatoria. Dentro de los más de 50 tipos diferentes de adipocinas; la leptina y la adiponectina son los tipos más estudiados en el contexto del riesgo de cáncer17. La leptina es relevante para el desarrollo del cáncer porque cuenta con efectos pleiotrópicos, es mitógena, antiapoptótica, mediadora en la supresión inmunitaria y proangiogénica por sí misma y en sinergia con el factor de crecimiento endotelial vascular (VEGF)17. Mientras que la adiponectina posee efectos indirectos al sensibilizar las células a la insulina a través de acciones antiinflamatorias y efectos directos al secuestrar factores de crecimiento, lo que lleva a una reducción de la síntesis de ácidos grasos y proteínas, disminución del crecimiento celular, proliferación y mutagénesis del ADN, aumento de la detención del ciclo celular y la apoptosis17.
Tabla 2 Hipótesis de mecanismos biológicos del cáncer
| Hipótesis | Cáncer asociado |
|---|---|
| Hormonas sexuales | Cáncer posmenopáusico de mama, endometrio y ovario17. |
| Resistencia a la insulina y el IGF-1 | Cáncer de próstata, colorrectal, de mama premenopáusico y de mama posmenopáusico17. |
| Leptina | Cáncer de mama, colon y próstata17. |
| Adiponectina | Cáncer de endometrio, mama, próstata avanzada, colorrectal, renal y páncreas17. |
Fuente: tomado y editado de Renehan AG, et al17.
Trastornos respiratorios del sueño
Los efectos de la obesidad sobre el sistema respiratorio son bien conocidos, entre ellos se encuentra la apnea obstructiva del sueño (AOS) y el síndrome de hipoventilación por obesidad (SHO). Estos trastornos respiratorios del sueño son una condición caracterizada por episodios repetidos de apnea e hipopnea durante el sueño. La AOS es una afección crónica caracterizada por el colapso repetido de las vías respiratorias superiores durante el sueño, lo que provoca episodios intermitentes de desaturación y reoxigenación a lo largo de la noche, y el SHO conlleva a hipoventilación nocturna sostenida que provoca hipercapnia diurna. Las consecuencias en los pacientes incluyen somnolencia diurna excesiva, mayores días de trabajo perdidos, accidentes de tráfico, mayores comorbilidades cardiovasculares y metabólicas18.
La obesidad genera alteraciones estructurales en la vía respiratoria superior al incrementar el tejido adiposo circundante y depósitos grasos musculares, induciendo colapsabilidad y afectando su contractibilidad, además de una notable disminución de la capacidad residual funcional. En este contexto, la cantidad de tejido graso localizado en el cuello genera estrechamiento de las vías respiratorias, aumentando la probabilidad de colapso durante el sueño. Los estudios de imagen del cuello y las vías respiratorias superiores en pacientes con apnea del sueño muestran bolsas de grasa parafaríngeas laterales y paredes faríngeas más grandes en comparación con individuos no obesos, por lo tanto, la circunferencia del cuello se considera un fuerte predictor de apnea del sueño18,19.
Osteoartritis
La osteoartritis (OA) es una enfermedad articular que afecta a personas de edad media y avanzada, y por lo general se produce por «uso y desgaste» de las articulaciones, afectando sus componentes estructurales, es decir, cartílago, revestimiento de la articulación, ligamentos y hueso20. La obesidad es un factor de riesgo notable para desarrollar artrosis debido al incremento del estrés mecánico crónico ejercido sobre las articulaciones en extremidades inferiores,sin embargo, también puede afectar las manos por el papel de los mediadores circulantes liberados por el tejido adiposo, las adipocinas, estableciendo así un componente metabólico sistémico21.
La inflamación crónica de bajo grado es una característica compartida por la OA y los trastornos metabólicos, en relación a esto, estudios epidemiológicos y biológicos respaldan el concepto de OA metabólica, definida como un fenotipo clínico amplio que incluye la osteoartritis relacionada con la obesidad, demostrando la asociación entre OA con varios componentes del síndrome metabólico (HTA, DM2), independiente de la obesidad o cualquier otro factor de riesgo conocido. Adicionalmente, estudios in vitro resaltan el efecto nocivo de las anomalías de lípidos y glucosa en la homeostasis del cartílago. Asimismo, la glucosa es necesaria para la homeostasis de los condrocitos, pero en cantidades excesivas puede alterar la homeostasis condrocitaria, predisponiendo a mayor producción de especies reactivas de oxígeno (ROS) que promueven la degradación de la matriz del cartílago y la muerte celular. De igual manera, los niveles de ácidos grasos totales y ácido araquidónico en los condrocitos del cartílago osteoartrítico aumentan notablemente con la gravedad del daño cartilaginoso. Concluyendo así la relación entre el síndrome metabólico, la acumulación de anomalías metabólicas y el desarrollo de OA, y no únicamente con el estrés mecánico ya conocido21.
A continuación, se presenta la figura 3 donde se resume la fisiopatología de la obesidad en el desarrollo de las enfermedades mencionadas anteriormente:
Abordaje general del paciente con obesidad
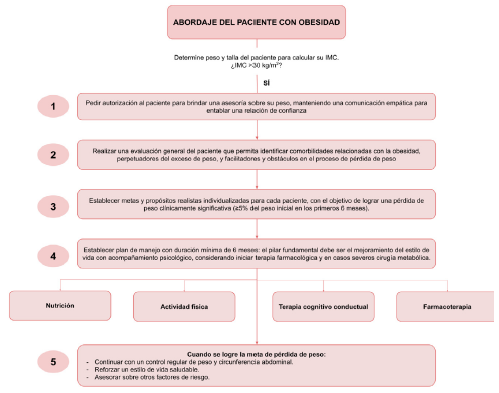
Al abordar un paciente con obesidad se debe tener en cuenta que suelen ser víctimas de estigmatización y acoso, por tal motivo, es importante dialogar sobre su peso desde una actitud empática y con términos asertivos para fortalecer la relación médico-paciente, una vez establecida una adecuada comunicación, se inicia un abordaje que incluya: tamizaje de comorbilidades asociadas a la obesidad, ingesta de medicamentos obesogénicos (ver Tabla 3), aplicación del Sistema de estadificación de Edmonton (consiste en la identificación de las comorbilidades y de la limitación funcional que pueden ocurrir en relación con la obesidad para guiar los objetivos terapéuticos), causas secundarias de obesidad (depresión, hipotiroidismo, hipercortisolismo, hipogonadismo, acromegalia) y condiciones donde perder peso no es beneficioso (sarcopenia, cáncer activo)22, así mismo, se debe indagar sobre estilos de vida, desórdenes psiquiátricos, motivaciones para perder peso y posibles barreras para lograrlo23. Finalizada la evaluación inicial, se deben plantear metas (una pérdida de peso clínicamente significativa corresponde a 5 - 10 % del peso inicial en los primeros 6 meses)1, estableciendo como pilar de manejo cambios en el estilo de vida (optimización de hábitos nutricionales, actividad física) y acompañamiento psicológico para mantener la motivación del paciente, además de educar al paciente sobre riesgos y complicaciones secundarios al exceso de peso; teniendo como opción adicional el uso de farmacoterapia para optimizar la pérdida de peso. En casos más severos, se puede plantear llevar al paciente a cirugía bariátrica/metabólica, sin embargo, este tema no será abordado en esta revisión. En la Figura 4 se presenta un algoritmo sobre el abordaje general del paciente con obesidad.
Modificaciones en el estilo de vida
Las modificaciones en el estilo de vida son la piedra angular para el manejo de la obesidad, lo que incluye mejoras de los hábitos nutricionales, actividad física y acompañamiento psicológico25. Diversas revisiones han reportado pérdidas de peso de hasta 8 kg entre 6 meses a 1 año26,27. En el año 2002 se publicaron los resultados de un ensayo clínico con 3234 participantes con sobrepeso u obesidad con estadio de hiperglucemia moderada, donde el grupo intervenido recibió entrenamiento especial con 16 sesiones individuales de asesoramiento para modificaciones intensivas en el estilo de vida, encontrándose una pérdida media de 7,1 kg (~7 % del peso inicial) en el mes 6 con mantenimiento de esta pérdida en el mes 12; por el contrario, los participantes asignados a metformina perdieron 2,8 kg en el tiempo del estudio, mientras que los participantes asignados a placebo no reportaron pérdida de peso28. Sin embargo, no basta solo con la intervención inicial, ya que la mayoría de pacientes suelen recuperar un tercio del peso perdido en el año posterior al tratamiento, con subsecuente aumento de peso gradual29. Por lo anterior, se suele recomendar que las personas que han perdido peso participen en programas de mantenimiento de pérdida de peso a largo plazo (mínimo por 1 año)25.
Dieta y cambios nutricionales
La reducción calórica es el componente más relevante para lograr perder peso, mientras que la actividad física aumentada y sostenida es importante para mantener el peso perdido. La pérdida de peso depende principalmente de la reducción de la ingesta calórica total y no de las proporciones de carbohidratos, grasas o proteínas en la dieta30. Para lograr una pérdida de peso significativa se recomienda instaurar una dieta hipocalórica, con déficit promedio de 500 kcal/día31 (típicamente 1.200-1.500 kcal/día para mujeres y 1.500-1.800 kcal/ día para hombres), además de una composición de macronutrientes basada en preferencias y estado de salud del paciente, logrando una pérdida media estimada entre 0,5-0,75 kg por semana. Las dietas que aportan menos de 1.200 kcal/día pueden producir deficiencias de micronutrientes, lo que podría tener efectos adversos en el estado nutricional y en el control del peso23. Es recomendable que los cambios y mejoras nutricionales se hagan con apoyo de profesionales en nutrición25.
Tabla 3 Medicamentos relacionados con aumento de peso.
Fuente: tomado y editado de Mayer S, et al22.
Fuente: tomado y editado de Mayer S, et al22, Yumuk V, et al23 y Wharton S, et al24.
Los programas de alimentación (ver Tabla 4) evidencian pérdidas de peso clínicamente significativas, sin embargo, existen pocas diferencias entre estos enfoques dietarios en cuanto al grado de pérdida de peso. Con esto, la mejor dieta termina siendo aquella a la que el paciente se sienta más cómodo, incrementando la probabilidad de adherencia a largo plazo32. Para el mantenimiento del peso, una vez alcanzada la meta se recomienda continuar con una dieta hipocalórica, consistente con la reducción de calorías con la composición de macronutrientes en función de las preferencias y estado de salud del paciente25. Sin embargo, se debe tener en cuenta que una composición balanceada de macronutrientes sí tiene impacto directo en la salud; por ejemplo, las dietas bajas en carbohidratos (cetogénicas) se asocian con mayor aumento en los niveles de LDL, lo que conlleva a mayor cantidad de efectos adversos cardiovasculares; por otra parte, dietas con mayor balance de macronutrientes han demostrado mayores efectos benéficos para la salud, por ejemplo, la dieta DASH ha demostrado lograr reducciones significativas en las cifras de tensión arterial, siendo más notorio en pacientes con hipertensión ya diagnosticada; la dieta mediterránea es otra dieta balanceada que cuenta con evidencia basada en ensayos clínicos que documentan una reducción estadísticamente significativa de eventos cardiovasculares mayores1.
Tabla 4 Programas de alimentación para pérdida de peso.
| Dieta DASH (Dietary to Stop Hypertension diet) | Patrón dietético que se enfoca en reducir la hipertensión, promoviendo el consumo de vegetales, frutas, granos integrales, nueces, legumbres, semillas, productos lácteos bajos en grasa y carnes magras. También limita el consumo de alimentos y bebidas azucaradas, sodio, cafeína y alcohol. Esta dieta es baja en grasas saturadas y rica en potasio, calcio, magnesio, fibra y proteínas22. |
| Dieta mediterránea | Patrón dietético centrado en el consumo de verduras, frutas, cereales integrales, frutos secos y semillas, alimentos mínimamente procesados, aceite de oliva como principal fuente de grasa, cantidades bajas a moderadas de productos lácteos, pescado y aves, y cantidades mínimas de carne roja22. |
| Dieta baja en carbohidratos | Patrón dietético con consumo diario de carbohidratos menor a 130 gr. Las dietas cetogénicas (< 50 g de carbohidratos) son efectivas para perder peso, sin embargo, suelen provocar cefalea, malestar gastrointestinal, fatiga y mareos; y pueden requerir suplementos de micronutrientes dadas las limitaciones de alimentos que contienen carbohidratos ricos en vitaminas y minerales22. |
| Dieta baja en grasas | Patrón dietético con consumo bajo en grasas (< 20-30 % del total de calorías provenientes de grasas), sin restricción energética prescrita formalmente, pero con déficit calórico. Se ha demostrado que las dietas bajas en grasas (con ingesta de grasas <10 %), con aumento en la ingesta de proteínas en un 25 %, sacian a los pacientes con menos calorías en general31. |
| Ayuno en días alternos y ayuno intermitente | Formas de restricción de energía intermitente que utilizan planes variados. La investigación actual es limitada en este enfoque dietético22. |
Fuente: tomado y editado de Mayer S, et al22 y McCafferty B, et al31
Actividad física
La Asociación Colombiana de Endocrinología recomienda la prescripción de actividad física de manera estructurada, escalonada y supervisada, integrándose con planes de rehabilitación y acondicionamiento físico teniendo en cuenta que los pacientes con obesidad tienen mayor riesgo de padecer patologías osteoarticulares y musculares, que podrían condicionar algún tipo de restricción física. En sus directrices proponen como meta realizar al menos 300 minutos semanales de ejercicio de intensidad moderada, equivalente a 1 hora diaria durante cinco días, lo cual conlleva a pérdidas significativas de peso evitando la reganancia; adicionalmente recomiendan asociar al menos tres sesiones semanales de ejercicio de resistencia para mejorar parámetros antropométricos y disminuir adiposidad central33.
De manera similar, los programas de modificación del estilo de vida suelen prescribir 150-180 minutos semanales de actividad aeróbica moderadamente vigorosa (caminar a paso rápido, montar bicicleta), logrando una pérdida de peso del 3-5%29. Con esto, tenemos que la actividad física produce una pequeña pérdida de peso a corto plazo sin combinación con restricción calórica, sin embargo, es fundamental para el mantenimiento del peso una vez cumplida la meta planteada.
Otros beneficios de la actividad aeróbica regular incluyen mejoras en la salud física (disminución de triglicéridos, cifras de presión arterial, etc.) y mental (menores tasas y mejoría de síntomas de ansiedad y depresión)29. En individuos con limitada disponibilidad de tiempo se deben motivar breves episodios de actividad a lo largo del día, aumentando la actividad física en su estilo de vida (uso de escaleras, reducción del tiempo en sedestación). Teniendo en cuenta lo anterior, el ejercicio debe adaptarse a la capacidad, oportunidades y salud del paciente, centrándose en una progresión gradual de la intensidad hasta niveles seguros23.
Acompañamiento psicológico
La terapia cognitiva conductual tiene como objetivo ayudar al paciente a modificar su visión y creencias sobre la regulación del peso, la obesidad y sus consecuencias; también aborda comportamientos que requieren cambios para una pérdida de peso exitosa y sostenida en el tiempo. Idealmente, es orientada por un psicólogo o psiquiatra23. Se deben incluir el planteamiento de objetivos específicos y alcanzables, además, de tener registro sobre la ingesta de alimentos, actividad física y peso corporal para tener información crítica sobre el progreso hacia las metas. El tratamiento conductual puede incluir entrevistas motivacionales para apoyar el compromiso de los pacientes con el cambio; De igual manera, los grupos de autoayuda pueden ser útiles en el proceso de manejo de la obesidad34.
Manejo farmacológico
La farmacoterapia ayuda a los pacientes a mantener el cumplimiento, mejorar la calidad de vida y prevenir el desarrollo de comorbilidades relacionadas con la obesidad23. De acuerdo con la guía actual de la Administración de Alimentos y Medicamentos (FDA) y según la Asociación Colombiana de Endocrinología, la farmacoterapia para pérdida de peso está aprobada para pacientes con IMC ≥30 kg/m2 o IMC ≥27 kg/m2 con enfermedades relacionadas con el peso, para apoyar la terapia de nutrición médica, actividad física e intervenciones psicológicas24. La eficacia de la farmacoterapia debe evaluarse después de los primeros 3 meses; si la pérdida de peso alcanzada es satisfactoria (>5 % en no diabéticos y >3 % en diabéticos) se debe continuar el tratamiento de manera indefinida; por el contrario, el tratamiento debe interrumpirse si no evidencia resultados23. Las características de los fármacos que se indican actualmente para el tratamiento de la obesidad se explican a continuación y se resumen en la tabla 5, donde se exponen datos de eficacia y consideraciones de seguridad. Se debe tener en cuenta que actualmente en Colombia solo se encuentran disponibles 2 de los 6 fármacos descritos: Orlistat y Liraglutide. Se hace clara la necesidad de continuar con la investigación de nuevos fármacos que optimicen la pérdida de peso, minimizando la cantidad de efectos adversos.
Inhibidores de la lipasa: Orlistat
Orlistat es un análogo sintético de la lipostatina, inhibidor de la lipasa natural, producido por el moho Streptomyces toxytricini. Su mecanismo de acción consiste en unirse e inhibir selectiva e irreversiblemente el sitio de serina activo en las lipasas pancreáticas y gástricas, necesarias para la hidrólisis de las grasas de la dieta en ácidos grasos y monoacilgliceroles en el tracto gastrointestinal. Cuando se toma según las indicaciones, el fármaco bloquea la digestión y absorción de ~30 % de la grasa de la dieta35. Dado que se absorbe mínimamente en el tracto gastrointestinal, no tiene efectos secundarios sistémicos. La tolerabilidad al fármaco está relacionada con la malabsorción de las grasas de la dieta y el posterior paso de la grasa a las heces, lo que explica que los pacientes experimenten efectos adversos gastrointestinales (flatos con secreción, heces aceitosas, aumento de la defecación, urgencia fecal). Otros eventos adversos menos comunes incluyen insuficiencia hepática y nefropatía31. El orlistat puede interferir con la absorción de vitaminas liposolubles, ciclosporina, hormona tiroidea y anticonvulsivos22.
Amina simpaticomimética anorexigénica + Antiepiléptico: Fentermina/Topiramato
Fentermina/Topiramato es una combinación sinérgica de dos fármacos con efecto en el SNC. La fentermina provoca liberación de norepinefrina, actúa como agente liberador de dopamina y serotonina menor. Este aumento en la actividad del sistema simpático disminuye el apetito a través de regulación a la baja de la actividad del nervio vago31. Por su parte, el topiramato es un antiepiléptico que modula la liberación de ácido ү-aminobutírico (GABA); en monoterapia está indicado para tratamiento de epilepsia y profilaxis de crisis migrañosas, donde se descubrió que generaba pérdida de peso, bajo un mecanismo incierto, posiblemente mediado por modulación de los receptores GABA, inhibición de la anhidrasa carbónica y antagonismo del glutamato37. Los efectos adversos más frecuentes incluyen fatiga (>70 %), parestesias, cefalea, mareos, estreñimiento, disgeusia, insomnio, palpitaciones y xerostomía. Otros efectos adversos incluyen: trastornos de atención, acidosis metabólica, cálculos renales, alopecia e hipopotasemia. Se recomienda evitar la administración de Fentermina/Topiramato en pacientes con hipertensión no controlada o enfermedad cardiovascular31. Debido a mayor riesgo de formación de hendiduras orales fetales congénitas a causa del topiramato, Fentermina/Topiramato debe administrarse bajo control de natalidad en mujeres en edad fértil y su uso se contraindica totalmente durante el embarazo37. Se debe suspender en caso de desarrollar glaucoma o miopía22. Tener en cuenta que el potencial de abuso derivado de la Fentermina.
• Dosis recomendada33:
Inicial: Fentermina 3,75 mg + Topiramato 23 mg una vez al día por la mañana durante 14 días, seguido de Fentermina 7,5 mg + Topiramato 46 mg al día durante 12 semanas.
Luego, ajuste dosis según respuesta: Fentermina 11,25 mg + Topiramato 69 mg al día durante 14 días, luego dosis máxima de Fentermina 15 mg + Topiramato 92 mg una vez al día.
Dosis máxima en insuficiencia hepática o renal moderada (CrCl <50 ml/min): Fentermina 7,5 mg + Topiramato 46 mg una vez al día.
• Contraindicaciones: Embarazo, hipertiroidismo, glaucoma, uso de inhibidores de la MAO33.
Antagonista opioide + Antidepresivo aminocetona: Naltrexona/Bupropión
Naltrexona/Bupropión es un fármaco combinado con acción en el SNC. La naltrexona es un antagonista de los receptores opioides aprobado para el manejo de la dependencia de alcohol y opiáceos. El bupropión es un inhibidor no selectivo de la recaptación de dopamina y norepinefrina que se usa en el tratamiento de la depresión y dependencia a nicotina. Se cree que el efecto anorexígeno de la combinación de Naltrexona/Bupropión se debe a la activación de las neuronas POMC (proopiomelanocortina) en el núcleo arqueado del hipotálamo por parte del bupropión; estas neuronas POMC liberan hormona estimulante de melanocitos (α-MSH), un neuropéptido de alimentación anorexígeno potente, y se proyectan a otras áreas hipotalámicas involucradas en la alimentación y el control del peso corporal. Sin embargo, el bupropión también estimula la liberación de opioides endógenos que pueden contrarrestar el efecto anorexígeno de la α-MSH31. Por tal motivo, para evitar este circuito de retroalimentación, se agrega naltrexona para bloquear los efectos inhibidores de los receptores opioides activados por la ß-endorfina liberada en el hipotálamo37. Los efectos adversos más comunes incluyen náuseas, vómitos, cefalea, mareos, insomnio y estreñimiento23. El bupropión está contraindicado en pacientes con convulsiones, mientras que la naltrexona en pacientes que toman simultáneamente opioides u otras sustancias dirigidas al GABA31.
• Dosis recomendada33:
Semana 1: 1 comprimido (Naltrexona 8 mg + Bupropion 90 mg) una vez al día.
Semana 2: 1 comprimido dos veces al día.
Semana 3: 2 comprimidos por la mañana y un comprimido por la noche.
Semana 4: 2 comprimidos dos veces al día.
Dosis máxima diaria: 4 comprimidos (Naltrexona 32 mg + Bupropion 360 mg).
• Contraindicaciones: Hipertensión no controlada, trastornos convulsivos, trastornos alimentarios, uso de otros productos que contienen bupropión, uso crónico de opioides, uso dentro de los 14 días posteriores a inhibidores de la MAO, embarazo o lactancia33.
Agonistas de GLP-1: Liraglutide
Uno de los tratamientos farmacológicos más efectivos disponibles para manejo de la obesidad es el liraglutide, análogo inyectable del péptido 1 similar al glucagón (GLP-1) de acción prolongada diseñado para resistir el rápido metabolismo de la dipeptidil peptidasa 4 (DPP-4), desarrollado originalmente para DM2, pero también aprobado para tratamiento de la obesidad. La liraglutida inhibe tanto el vaciado gástrico como la secreción de glucagón y estimula los receptores GLP-1 en el núcleo arqueado del hipotálamo para reducir la alimentación mediante aumento de la sensación de saciedad37, presenta una similitud del 97 % con el GLP-1 endógeno, pero, a diferencia de este, tiene una vida media prolongada (13 horas) mejorando su utilidad clínica. En general, la liraglutida es bien tolerada. Las alteraciones gastrointestinales son los efectos secundarios principales, pero pueden contribuir activamente a la pérdida de peso23. Otros eventos adversos incluyen cefalea, fatiga y aumento de la lipasa. Se debe advertir a los pacientes sobre los riesgos de pancreatitis e ideación suicida31. Los agonistas de GLP-1 no deben prescribirse en pacientes con antecedentes de cáncer medular de tiroides o neoplasia endocrina múltiple, debido a un riesgo teórico del incremento de cáncer tiroideo29. Liraglutide es el único fármaco aprobado para el manejo de obesidad en adolescentes, en quienes se ha comprobado que el uso de dosis de 3 mg acompañado de mejoras en el estilo de vida conduce a una reducción significativa del IMC36.
• Dosis recomendada33:
Inicial: 0,6 mg vía subcutánea al día.
Aumentar dosis a intervalos semanales (1,2 mg, 1,8 mg, 2,4 mg, 3 mg) hasta la dosis recomendada de 3 mg al día. Si no se tolera el aumento de dosis, retrasar el aumento de dosis una semana más.
• Contraindicaciones: Embarazo, enfermedad de vesícula o vías biliares, y antecedentes personales o familiares de cáncer medular de tiroides o neoplasia endocrina múltiple 2A o 2B33.
Agonistas de GLP-1: Semaglutide
El semaglutide es otro análogo de GLP-1, ha demostrado mayor reducción de peso que la liraglutida. Este fármaco se probó en un ensayo clínico que usó semaglutide subcutánea una vez a la semana a una dosis de 2,4 mg más intervenciones en el estilo de vida en el grupo intervención, y el otro grupo fue asignado a placebo más intervenciones en el estilo de vida, se encontró que el cambio medio en el peso corporal fue de -14,9 % en el grupo de semaglutide en comparación con -2,4 % del grupo placebo, para una diferencia de tratamiento estimada de -12,4 puntos porcentuales (IC 95 %: -13,4 a -11,5, p <0,001). Como beneficio extra, evidenció una mejoría en factores de riesgo cardiometabólicos e incremento en el funcionamiento físico autoinformado. En cuanto a los efectos secundarios se reportaron con mayor frecuencia náuseas y diarrea37. En Colombia el semaglutide está aprobado exclusivamente para el manejo de diabetes y no de la obesidad.
• Dosis recomendada37:
Inicial: 0,25 mg vía subcutánea una vez a la semana.
Aumentar dosis a intervalos de 4 semanas (0,5 mg, 1 mg, 1,7 mg, 2.4 mg) hasta la dosis recomendada de 2,4 mg por semana. Si no se tolera aumento de dosis, retrasar aumento en 4 semanas.
• Contraindicaciones: Al ser un aGLP-1, mismas contraindicaciones que Liraglutide37. }
Agonistas de GLP-1 y GIP: Tirzepatide
El tirzepatide es un fármaco inyectable semanal de acción dual, agonista del receptor del polipéptido inhibidor gástrico (GIP) y del péptido 1 similar al glucagón (GLP-1), que ha demostrado ser más eficaz que los aGLP-1 para reducir peso. En un ensayo clínico se incluyeron adultos con obesidad y sin diabetes, comparando una dosis semanal de tirzepatide vs placebo; la reducción del peso con todas las dosis de tirzepatida (5, 10 y 15 mg subcutáneo una vez a la semana) fue mayor en comparación al placebo, logrando un porcentaje medio de cambio de peso en la semana 72 de -15,0 % (IC 95 % -15,9 a -14,2 %) con dosis semanales de 5 mg de tirzepatida, -19,5% (IC 95 % -20,4 a -18,5 %) con dosis de 10 mg y -20,9 % (IC 95 % -21,8 a -19,95) con dosis de 15 mg (p <0,001 para todas las comparaciones con placebo); estas cifras son destacables, puesto que se estima que la pérdida de peso puede ser cercana a la lograda con ciertos tipos de cirugía bariátrica. Sin embargo, tirzepatide no cuenta actualmente con aprobación para el tratamiento de la obesidad en ausencia de diabetes, ya que el efecto en pérdida de peso sigue en estudio. Los efectos adversos más frecuentes fueron alteraciones gastrointestinales, principalmente a dosis altas38.
• Dosis recomendada38
Dosis inicial: 2,5 mg vía subcutánea una vez a la semana.
Después de 4 semanas: aumentar dosis a 5 mg por vía subcutánea una vez a la semana.
Si es necesario, aumentar dosis en incrementos de 2,5 mg después de mínimo de 4 semanas con la dosis actual. Si no se tolera el aumento de dosis, retrasar aumento en 4 semanas.
Dosis máxima: 15 mg vía subcutánea una vez a la semana
• Contraindicaciones absolutas: Mismas que los aGLP138.
Tabla 5 Farmacoterapia dirigida para pérdida de peso.
Fuente: autores.
Conclusión
La obesidad, definida como el exceso de peso corporal para una estatura determinada, condiciona el desarrollo de múltiples patologías como: Diabetes Mellitus tipo 2, hipertensión arterial, dislipidemias, trastornos respiratorios del sueño, enfermedades cardiovasculares y el incremento del riesgo de diversos tipos de cáncer. Para comprender su relación y los mecanismos fisiopatológicos, además de las adaptaciones mecánicas inducidas por la obesidad, es importante la función como órgano endocrino del tejido adiposo. Las adipocinas actúan sobre el equilibrio energético, las respuestas inmunitarias, la homeostasis vascular, la angiogénesis, la sensibilidad a la insulina y el metabolismo de la glucosa y los lípidos; en la obesidad se genera una disfunción en la secreción de adipocinas que conlleva a un estado crónico inflamatorio y a alteraciones por las funciones perse de estas hormonas.
El aumento en las últimas décadas en la prevalencia de la obesidad y de las diversas enfermedades cardiovasculares y metabólicas comórbidas, hacen necesario reforzar la implementación de intervenciones médicas integrales. El objetivo terapéutico es establecer un manejo adecuado que permita una reducción del tejido adiposo lo suficientemente sustancial que logre impactar sobre las diferentes comorbilidades que causa de manera sostenida en el tiempo y sin generar reincidencia; siendo así la base del manejo para el paciente con obesidad serán las modificaciones en el estilo de vida, pudiendo complementarse con intervenciones farmacológicas o quirúrgicas en casos más severos.