Introducción
El cáncer de próstata (CaP) es el segundo cáncer más frecuente y la quinta causa de muerte por cáncer en hombres a nivel mundial1. En Colombia, según los datos del Global Burden of Disease, en el año 2020 el CaP ocupó el primer lugar de las neoplasias en hombres, con una prevalencia de 49 172 casos a 5 años e incidencia de 14 460 casos nuevos, causante de 3846 muertes2. Dicha neoplasia en estadíos iniciales suele ser asintomática; sin embargo, puede manifestarse con disuria, polaquiuria, retención urinaria y nicturia. En etapas avanzadas de la enfermedad, puede debutar con lumbalgia la cual se ha correlacionado con enfermedad metastásica3-5. Según Desai M.M. et al, la metástasis de este cáncer se produce en aproximadamente el 6 % de los casos en un periodo de 10 años, cuyos sitios más comunes de extensión son: huesos (84 %), ganglios linfáticos regionales (10,6 %), hígado (10,2 %) y tórax (9,1 %); siendo excepcional el compromiso peritoneal, con escasos casos publicados en la literatura, a diferencia de los carcinomas de ovario y gastrointestinal que tienen la mayor tendencia de diseminación peritoneal6-9.
La carcinomatosis peritoneal (CP) tiene una incidencia variable acorde al tumor de origen primario, con una fracción casi imperceptible atribuible al CaP, siendo escasos los datos epidemiológicos nacionales. La CP tiene un pronóstico pobre, con una supervivencia global de seis meses a un año, independientemente de si se origina en un órgano intra o extraabdominal o si se recibe tratamiento sistémico10,11; no obstante, en los últimos años se han implementado nuevas estrategias terapéuticas como la quimioterapia neoadyuvante, la cirugía citorreductora/quimioterapia intraperitoneal hipertérmica (CRS/HIPEC) y la quimioterapia adyuvante, sin olvidar los nuevos fármacos para bloqueo hormonal en CaP, que han mostrado mejoras en la supervivencia global11-12. En vista de lo anterior, radica la importancia de publicar cada caso de esta localización inusual metastásica del CaP, buscando recordar con detenimiento su presentación clínica y los estudios paraclínicos e imagenológicos claves en el proceso de aproximación diagnóstica, resaltando la importancia de un diagnóstico temprano que permita plantear nuevas opciones terapéuticas que impacten en la supervivencia global del paciente. Por tanto, se presenta uno de los primeros reportes en Colombia sobre carcinomatosis peritoneal por adenocarcinoma prostático.
Presentación del caso
Masculino de 71 años, residente en el departamento de La Guajira, Colombia, agricultor, con independencia funcional (Barthel 95/100), con antecedente de hiperplasia prostática benigna sin actual tratamiento farmacológico. Sin antecedentes quirúrgicos, toxicológicos o alérgicos. Consulta al servicio de urgencias de una institución de tercer nivel por cuadro de dos meses de aumento gradual de perímetro abdominal asociado a sensación de plenitud gástrica, edema progresivo en miembros inferiores y dolor abdominal de predominio en hemiabdomen inferior de forma intermitente, sin atenuantes o exacerbantes. Adicionalmente, pérdida de peso no intencionada de aproximadamente ocho kilogramos en los últimos dos meses. Al examen físico signos vitales normales, IMC de 16 Kg/m2, abdomen con distensión marcada, onda ascítica positiva y edema grado II en miembros inferiores, sin otros hallazgos relevantes. Paraclínicos séricos iniciales con anemia normocrómica homogénea de volúmenes normales, sin alteración de otras líneas celulares e hipoalbuminemia moderada, resto dentro de la normalidad (ver Tabla 1). Perfil infeccioso (Hepatitis B, Hepatitis C, VDRL y elisa VIH 1/2) negativo. Ecografía de abdomen con ascitis marcada, hepatomegalia y engrosamiento de epiplón, sin datos que sugieran cirrosis hepática. Doppler hepatoportoesplénico negativo para hipertensión portal.
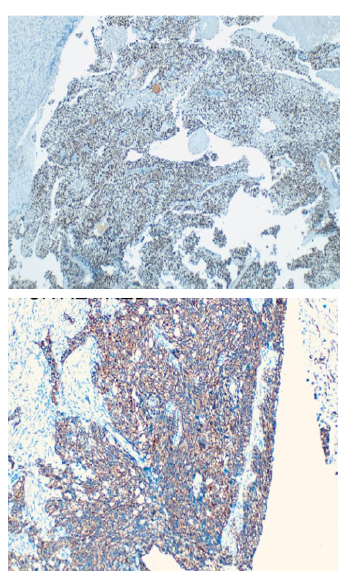
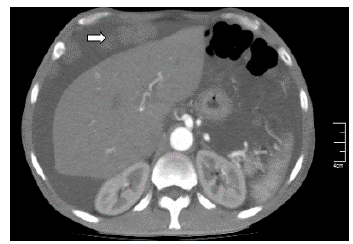
Se realizó paracentesis diagnóstica con líquido ascítico de aspecto hemático, citoquímico con leucocitos >500 células/mm3, <50 % polimorfonucleares, gradiente albúmina en plasma-líquido ascítico de 0,5 g/dL (GASA <1,1), baciloscopia negativa para bacilos ácido alcohol resistentes, reacción en cadena de polimerasa para Mycobacterium Tuberculosis (MTB) negativo, cultivo para gérmenes comunes negativo y citología negativa para células tumorales (ver Tabla 2). A pesar del reporte de citología, los hallazgos en el líquido ascítico ante la baja probabilidad de infección por MTB, sugerían carcinomatosis peritoneal, por lo que se realizó tomografía axial computarizada (TAC) de abdomen contrastada con documentación de múltiples lesiones peritoneales, lesiones líticas en huesos ilíacos de naturaleza metastásica, líquido libre en cavidad abdominal e hipertrofia prostática (ver Figura 1). Teniendo en cuenta los hallazgos imagenológicos y el grupo etario del paciente, se consideró imprescindible descartar CaP, complementándose el examen físico con tacto rectal con hallazgo de próstata fija, pétrea, recesos bilaterales comprometidos. Antígeno específico prostático con resultado total de 1090 ng/ mL. Por lo cual, se realizó diagnóstico clínico de CaP con más probable compromiso metastásico óseo; sin embargo, sin certeza de secundarismo peritoneal dado el comportamiento poco frecuente de diseminación peritoneal del CaP. Se complementó estudio con esofagogastroduodenoscopia y colonoscopia total dentro de la normalidad, decidiéndose realizar biopsia de lesiones peritoneales por laparoscopia, con hallazgos de múltiples siembras en grasa peritoneal sin adenopatías visibles, con reporte histopatológico que confirmó CP por adenocarcinoma pobremente diferenciado de origen prostático, T4N0M1, estadio IVb, Gleason X (Ver figura 2 a,b). Citología de líquido peritoneal de muestra obtenida durante procedimiento quirúrgico con hallazgo de grupos de células atípicas con núcleos hipercromáticos compatible con carcinoma metastásico. Dentro de los estudios de extensión se realizó gammagrafía ósea con hallazgo de múltiples focos de hipercaptación anormal en cráneo, escápula izquierda, arcos costales de manera difusa así como en T7 a T10, L1 a L3 y tercio proximal de fémur derecho. Se realizó bloqueo hormonal mediante orquiectomía bilateral paliativa ante estadificación tumoral, sin complicaciones. Servicio de urología oncológica dio egreso hospitalario con orden de cita prioritaria por su servicio con control sérico de PSA y testosterona total. A la fecha completa 24 meses vivo en controles por urología oncológica extrainstitucional, recibiendo radioterapia y bloqueo androgénico completo con inhibición de la señalización de los receptores androgénicos (enzalutamida).
Tabla 1 Paraclínicos de ingreso.
| Paraclínicos | Valores al ingreso | Valores de referencia | |
|---|---|---|---|
| Hemograma | Hemoglobina | 12,4 g/dL | 13-18 g/dL |
| Hematocrito | 38,9 % | 42-52 % | |
| VCM | 92,8 fL | 86-98 fL | |
| HCM | 29,6 pg | 27-32 pg | |
| CHCM | 31,9 g/dL | 33-37 g/dL | |
| Leucocitos | 9,690X103/uL | 5-10X103/uL | |
| Plaquetas | 465X103/uL | 150-450X103/uL | |
| Creatinina | 0,75 mg/dL | 0,67-1,17 mg/dL | |
| BUN | 8,7 mg/dL | 6-20 mg/dL | |
| ASAT | 37 U/L | 6-40 U/L | |
| ALAT | 25 U/L | 6-41 U/L | |
| TP | 12,3 s - INR 1,14 | 9,7-13,5 s | |
| TTP | 28,5 s | 22,5-30,5 s | |
| LDH | 155 U/L | 135-250 U/L | |
| Cloro sérico | 99,1 mmol/L | 98-107 mmol/L | |
| Sodio sérico | 137 mmol/L | 135-148 mmol/L | |
| Potasio sérico | 4,07 mmol/L | 3,5-4,5 mmol/L | |
| Calcio sérico | 8,8 mg/dL | 8,8-10,2 mg/dL | |
| Albúmina | 2,86 g/dL | 3,97-4,94 g/dL | |
| PSA | 1.090 ng/ml | 0-4,4 ng/ml | |
*VCM: Volumen Corpuscular Medio. *HCM: Hemoglobina Corpuscular Media. *CHCM: Concentración de Hemoglobina Corpuscular Media. *BUN: Nitrógeno Ureico en sangre. *ASAT: Transaminasa Oxalacetica. *ALAT: Transaminasa Pirúvica. *TP: Tiempo de protrombina. *TTP: Tiempo parcial de tromboplastina. *LDH: Deshidrogenasa Láctica. *PSA: Antígeno específico de próstata.
Fuente: autores
Tabla 2 Estudios en líquido peritoneal.
| Estudios Líquido Peritoneal | Valores al ingreso | |
|---|---|---|
| Citoquímico | Aspecto | Turbio |
| Hematíes | 40 000/mm3 | |
| Leucocitos | 810/mm3 | |
| PMN | 20 % | |
| Linfocitos | 73 % | |
| Monocitos | 6 % | |
| Albumina | 2,71 g/dL | |
| Frotis/Gram | 1-5 leucocitos - No bacterias | |
| Proteínas | 4,590 g/dL | |
| Glucosa | 121 mg/dL | |
| ADA | 5,13 U/L | |
| Baciloscopia | Negativo BAAR | |
| Levaduras | Negativo | |
| Citología Malignidad | Negativa | |
| Cultivo gérmenes comunes -Hongos | Negativo | |
| Cultivo Mycobacterium tuberculosis - 42 días incubación | Negativo | |
| PCR Mycobacterium | No detectado | |
*PMN: Polimorfonucleares. *ADA: Adenosin deaminasa. *PCR: Reacción en cadena de la polimerasa.
Fuente: autores
Fuente: autores.
Figura 1 TAC toracoabdominal con doble contraste oral/ intravenoso. Flecha señala en corte axial una de las múltiples lesiones peritoneales, compatibles con siembras por carcinomatosis peritoneal.
Discusión
La presencia de una diseminación tumoral en la cavidad peritoneal que puede provenir de un órgano intra o extraabdominal, se conoce como carcinomatosis peritoneal. Es una presentación metastásica infrecuente, cuya etiología puede ser primaria a partir de las células peritoneales, y secundaria, ante estadios avanzados de neoplasias ováricas, gástricas, pancreáticas, mamarias, hepáticas, entre otras; a resaltar de manera inusitada en CaP9,10. Se han postulado dos mecanismos distintos de invasión peritoneal en pacientes con adenocarcinoma prostático (CaP), uno es iatrogénico, luego de una cirugía laparoscópica con un CaP bien diferenciado, y el otro involucra siembras tumorales por diseminación linfática o hematológica de tumores de mal pronóstico con estadio avanzado, asociado a un alto puntaje de Gleason y/o diferenciación neuroendocrina11-13.
Las manifestaciones clínicas de la CP comprenden desde náuseas, anorexia, pérdida de peso, astenia; hasta obstrucción intestinal, dolor abdominal o lumbar, sensación de plenitud gástrica y ascitis, haciendo mención especial a estos tres últimos síntomas que estuvieron manifiestos en nuestro paciente, y que se erigen como los de mayor frecuencia en esta entidad acorde a lo reportado en la literatura8,9,14.
Se realizó una revisión en la literatura encontrándose 23 casos de CP por CaP con ascitis maligna secundaria; sin historia de prostatectomía abierta, laparoscópica o robótica, excluyendo así los casos relacionados a posible diseminación iatrogénica. La tabla 3 resume las principales características clínicas, estadio TNM, compromiso metastásico, tratamiento recibido y sobrevida de los pacientes reportados en la literatura, y se realiza una comparación con nuestro caso; a resaltar que solo otros 3 casos se han reportado con ascitis maligna al momento del diagnóstico del CaP (Catton15, Ji16, Kwok17). La mayoría de los casos reportados tiene un puntaje en la escala de Gleason ≥7 puntos, que se traduce en una pérdida del patrón glandular tumoral, dando unas características de alto riesgo, que pudieran relacionarse con mayor alteración genómica, concordante con el comportamiento agresivo y de diseminación tumoral evidenciado.
En el proceso de aproximación diagnóstica no invasiva de la CP el uso de imágenes médicas permite detectar sus hallazgos típicos: ascitis, infiltración omental y mesentérica, y nódulos peritoneales dispersos. La ecografía (US) suele ser el estudio inicial a realizar dado su accesibilidad; sin embargo, es inexacta para la estadificación, solo detecta 69 % de las metástasis peritoneales, el 32 % de las lesiones ganglionares y el 57 % de las metástasis parenquimatosas, con especial dificultad en la visualización de lesiones menores de 20 mm; por el contrario, a nivel subcapsular esplénico, hepático y en la serosa intestinal pudiera ser superior a la tomografía computarizada (TC) abdominal contrastada. En la ecografía, los implantes peritoneales se presentan como lesiones nodulares hipo a isoecoicas o en forma de placa con flujo Doppler color o como engrosamiento difuso del peritoneo. Por el contrario, la TC puede detectar lesiones peritoneales de hasta 10 mm con una sensibilidad del 79-86 % y una especificidad del 82-89 %, siendo la modalidad básica para la estadificación y el seguimiento10. Respecto a la resonancia magnética, es un método de segunda opción debido a su alto costo y su larga duración; así mismo, puede ser superior a la TC en detectar lesiones subcentimétricas (<10 mm), particularmente en el área subfrénica y en la serosa intestinal. Estos dos últimos métodos de imágenes pueden complementarse con PET (Positron Emission Tomography) que utiliza diferentes tipos de trazadores, con el potencial de detectar mínimos implantes peritoneales, favoreciendo la detección temprana, la estadificación y el seguimiento de la respuesta al tratamiento9,10; se resalta la PET-TC con 68Ga-PSMA que tiene una precisión, especificidad y sensibilidad mayor que las imágenes convencionales con TC para revelar metástasis en pacientes con CaP de alto riesgo; no obstante, en tumores sin expresión de PSMA (antígeno de membrana específico de la próstata) como en el CaP con diferenciación neuroendocrina, es una técnica ineficaz35.
En cuanto a los métodos diagnósticos invasivos se describe el uso de la paracentesis, permitiendo objetivar un líquido ascítico maligno, caracterizado por alto contenido de proteínas, un conteo de células blancas ≥500/mm3 con menos del 50 % de polimorfonucleares y un GASA <1,1; aunado a cultivos para gérmenes múltiples, incluyendo estudios microbiológicos y de biología molecular para descartar infección por Mycobacterium tuberculosis, uno de los principales diagnósticos diferenciales. En nuestro caso, el paciente no presentaba ninguna condición que favoreciera un estado de inmunosupresión (infección por virus de inmunodeficiencia humana, corticoterapia o inmunomoduladores, diabetes mellitus no controlada, u otros), y con los estudios histopatológicos realizados al líquido ascítico y a las biopsias peritoneales se descartaron otras entidades diferenciales como histoplasmosis peritoneal36-38. Si bien la primera citología del líquido ascítico fue negativa para malignidad, debe recordarse que la citología tiene una alta tasa de falsos negativos, como evidencia Allen et al en su estudio sobre ascitis maligna y carcinoma epitelial de ovario, en el cual encontraron una tasa inesperadamente alta de hasta un 33,9 %39. Uno de los retos de nuestro caso fue, que si bien la clínica, imágenes y estudios de líquido peritoneal sugerían una ascitis maligna más probablemente en relación al CaP, su infrecuencia aún mayor en el debut de un CaP hicieron imprescindible la confirmación histológica con biopsias de las lesiones peritoneales tomadas por laparoscopia, otro de los métodos para el diagnóstico de la CP, mínimamente invasivo, con una sensibilidad cercana al 100 %, y que permite paralelamente una estadificación tumoral, calcular el índice de carcinomatosis peritoneal e identificar un tumor irresecable9.
Tabla 3 Revisión de casos reportados en la literatura con carcinomatosis peritoneal por adenocarcinoma de próstata y ascitis maligna secundaria (Sin antecedente de prostatectomía abierta, laparoscópica o robótica)
| Autor | Año de publicación | Edad | Síntomas | Ascitis como debut CaP | Gleason Score | Estadio TNM Inicial | Metástasis | Terapia | Supervivencia |
|---|---|---|---|---|---|---|---|---|---|
| Appalaneni18 | 2004 | 60 | Distensión abdominal | No | 9 | NR | Omento, nódulos linfáticos, hueso | Mitoxantrone con esteroides | 1.5 meses |
| Benedict19 | 2010 | 67 | Distensión abdominal y dificultad para respirar | No | 8 | NR | Omento, peritoneo | Docetaxel con esteroides | NR |
| Brehmer20 | 2007 | 75 | NR | No | 9 | PT3N0 | Peritoneo | Bloqueo androgénico completo | Vivo a los 14 meses |
| Catton15 | 1992 | 63 | Distensión abdominal | Si | NR | NR | Peritoneo, pleura, nódulos linfáticos, hígado, bazo, páncreas, pulmones, epicardio, glándulas adrenales | Orquiectomía bilateral | 18 meses |
| Grabstald21 | 1995 | 72 | Dolor abdominal | No | NR | NR | Peritoneo | Bloqueo androgénico completo | Vivo a los 3 meses |
| Gungor22 | 2016 | 60 | Distensión abdominal | No | 8 | NR | Peritoneo | NR | NR |
| Jang23 | 2022 | 63 | Síntomas urinarios obstructivo, distensión abdominal, | No | 9 | NR | Omento, peritoneo | Inhibidor síntesis androgénica | NR |
| Ji16 | 2022 | 80 | Distensión abdominal | Si | 10 | NR | Peritoneo, Omento | NR | NR |
| Kehinde24 | 2012 | 76 | Síntomas urinarios obstructivos, dolor abdominal vago, distensión abdominal | No | 8 | T3NxMx | Peritoneo, Omento | Orquiectomía bilateral | Vivo a los 18 meses |
| Kwok17 | 2020 | 91 | Distensión abdominal, pérdida de peso y constipación. | Si | NR | NR | Peritoneo, Omento | Cuidado paliativo | NR |
| Labanaris25 | 2013 | 62 | Ninguno | No | 9 | CT2N0M0 | Peritoneo | LHRH agonista | Vivo a los 4 meses |
| Ladwa26 | 2017 | 74 | NR | No | NR | NR | Omento | Cabazitaxel | Vivo a los 10 meses |
| Lau27 | 2023 | 69 | Dolor y distensión abdominal | No | 9 | NR | Peritoneo, Omento | NR | NR |
| Madaan28 | 2007 | 75 | Distensión abdominal | No | 9 | NR | Peritoneo, Omento | Dietilestilbestrol | 4 meses |
| Petrakis14 | 2015 | 76 | Distensión abdominal, hematuria, constipación | No | NR | NR | Omento, hueso, nódulos linfáticos | Docetaxel, esteroides | Vivo a los 10 meses |
| Rizk29 | 2014 | 63 | NR | No | 8 | cT3NxMx | Peritoneo | Docetaxel | 33 meses |
| 60 | NR | No | 8 | cT4NxMx | Peritoneo, hueso | Docetaxel | 9 meses | ||
| Saif30 | 1999 | 70 | Distensión abdominal | No | 9 | NR | Peritoneo | Talidomida | NR |
| Saini31 | 2015 | 65 | Distensión abdominal | No | 7 | NR | Peritoneo, | Docetaxel | NR |
| Tareen8 | 2019 | 70 | Distensión abdominal, disminución gasto urinario, edema miembros inferiores y constipación | No | 7 | NR | Peritoneo, Omento, hígado | Bloqueo androgénico completo, Docetaxel, Cabazitaxel | NR |
| Van Roekel32 | 2018 | 65 | Dolor abdominal | No | 8 | cT3bNxMx | Uréter, hueso, peritoneo | Bloqueo androgénico completo, Docetaxel | 7 meses |
| Wynn33 | 2000 | 73 | Dolor y distensión abdominal | No | NR | NR | Omento, nódulos linfáticos | Colostomía paliativa | 1 mes |
| Zagouri34 | 2009 | 75 | NR | No | 9 | NR | Peritoneo, Omento | Docetaxel, esteroides | Vivo a los 8 meses |
| Caso presentado Gomez et al | 2024 | 71 | Dolor y distención abdominal, plenitud gástrica, edema miembros inferiores. | Si | NR | T4N0M1 | Peritoneo, hueso | Orquiectomía bilateral, Bloqueo androgénico completo | Vivo a los 24 meses |
*CaP: Adenocarcinoma de próstata *NR: No registro.
Fuente: autores.
Son múltiples los marcadores inmunohistoquímicos que pueden usarse como ayuda en el diagnóstico del CaP primario y/o metastásico con pobre diferenciación celular, partiendo de inmunomarcadores no específicos que orientan el linaje tumoral (CK/S100/vimentin/ LCA), en este caso adenocarcinoma/carcinoma, para después confirmarlo mediante inmunomarcadores específicos de tejido prostático epitelial como PSA, P501S, P504S y NKX3.1. En nuestro caso se utilizó un panel de marcadores que incluía a NKX3.1 (Figura 2 a), un gen supresor que se encuentra alterado en en el adenocarcinoma de próstata, especialmente en casos avanzados o de alto grado, con una sensibilidad superior a la del PSA, y que permite realizar diagnóstico diferencial con el carcinoma urotelial de alto grado40. En la tabla 4 se enumeran los principales anticuerpos utilizados en inmunohistoquímica del en el adenocarcinoma de próstata, resaltando su positividad acorde a lo reportado en la literatura; sin embargo, el comportamiento de cada anticuerpo puede variar según el grado de diferenciación tumoral, y la variante histológica41.
Tabla 4 Inmunomarcadores en Adenocarcinoma de Próstata.
| Anticuerpo | Literatura |
|---|---|
| P504S | + |
| p63 | |
| PSA | + |
| CK7 | |
| NKX3.1 | + |
| CK5/6 | |
| CAM 5.2 | + |
| AE1/AE3 | + |
| CK20 | |
| MUC1 | + |
*(+) Usualmente mas del 70 % de los casos son positivos. *(-) usualmente menos del 5 % de los casos son positivos.
Fuente: adaptado de Liu H, Lin F, Zhai Q. Prostate Gland. En: Lin F, Prichard JW, Liu H, Wilkerson ML, editor. Handbook of Practical Immunohistochemistry. 3 ed. Danville: Springer, Cham; 2022. p. 523-550.
Respecto al tratamiento del CaP metastásico sensible a hormonas (mHSCP), se requiere en primera medida una estadificación estricta, clasificando la enfermedad metastásica en volumen bajo o alto; este último, definido como mayor o igual a cuatro metástasis óseas con al menos una metástasis fuera de la columna/pelvis y/o la presencia de metástasis viscerales. En nuestro caso, el paciente tenía al momento del diagnóstico múltiples lesiones metastásicas óseas y carcinomatosis peritoneal; es decir, un CaP con un volumen metastásico alto de alto riesgo y con factores de mal pronóstico. El tratamiento que debe ofrecerse en este escenario es una terapia de deprivación androgénica (TDA) con agonistas o antagonistas de LHRH o castración quirúrgica, en combinación con inhibidores de la señalización del receptor de andrógenos (ISRA, abiraterona (ABI), enzalutamida (ENZ) o apalutamida (APA)), o quimioterapia (Docetaxel o Abazitaxel) más esteroide, dado que la terapia doble o triple ha mostrado un aumento en la sobrevida de los pacientes con mHSCP, con mejores tasas a lo descrito en la carcinomatosis peritoneal de primarios diferentes a la próstata. En nuestro caso se realizó bloqueo androgénico completo con castración quirúrgica sumado a inhibidor de la señalización del receptor de andrógenos tipo enzalutamida, con buena respuesta clínica8,35,42-45.
Es importante puntualizar que es imprescindible un seguimiento clínico, bioquímico e imagenológico estricto para detectar de forma temprana progresión tumoral a pesar de TDA y un nivel de castración de testosterona <50 ng/dL; entendiéndose como un aumento progresivo de los niveles séricos del antígeno prostático especifico (PSA), progresión o aparición de enfermedad radiográfica, y/o reaparición o aumento de síntomas, que le confieren el título de tumor resistente a la castración, y que plantea un reto terapéutico, mediante uso de taxanos si no han sido usados previamente, o el uso de un inhibidor de PARP o anticuerpos monoclonal que bloquea la actividad de la molécula PD-1, acorde a las pruebas genéticas somáticas y de línea germinal que identifican deficiencia en la reparación del ADN, y el estado de la inestabilidad de microsatélites. Así mismo, debe resaltarse que estas últimas terapias tienen poca trayectoria clínica en pacientes con CP por CaP, y que la experiencia radica en su mayoría en reportes de caso35,45.
Conclusión
La CP es una entidad poco frecuente y de mal pronóstico la cual debe tenerse en cuenta dentro de los diagnósticos diferenciales en pacientes con estadios avanzados de CaP, en especial aquellos pacientes con sintomatología de distensión abdominal secundaria a ascitis. Es imprescindible realizar un proceso diagnóstico secuencial estricto que, mediante métodos no invasivos e invasivos, permita una aproximación diagnóstica temprana y una adecuada estadificación, logrando de manera integral iniciar un tratamiento multimodal idóneo, que repercuta en la sobrevida del paciente.