Introducción
El linfoma B difuso de célula grande (LBDCG), el tipo histológico más común de los linfomas no Hodgkin, tiene gran heterogeneidad clínica y morfológica (1-4). Los pacientes con LBDCG no especificado (NOS) con sobreexpresión de las proteínas MYC (≥ 40 %) y BCL2 (≥ 50 %) en la inmunohistoquímica (IHQ) (5), sin tener mutación detectada por FISH (hibridación fluorescente in situ), se denominan LBDCG NOS doble expresor. Este grupo tiene peores desenlaces en comparación con los linfomas no doble expresor (supervivencia libre de progresión a 5 años: 39 % (95 % CI,19 %-59 %) versus 68 % (95 % CI, 52 %-85 %); p = 0,03 (6-8).
Los rasgos moleculares específicos evaluados por secuenciación de siguiente generación (NGS) o por FISH son el factor pronóstico independiente más importante en LBDCG (9); sin embargo, la mayoría de estudios moleculares no están ampliamente disponibles en Colombia. Dada esta situación, la inmunohistoquímica emerge como una técnica ampliamente disponible, rápida y menos costosa para estratificar el riesgo a través de la clasificación de la célula de origen por el algoritmo de Hans y la sobreexpresión de MYC y BCL2 (10).
En Colombia, en un grupo de 819 pacientes (11) se encontró que el linfoma no Hodgkin (88 %) fue más frecuente respecto al linfoma Hodgkin (12 %); dentro de los linfomas no Hodgkin el LBDCG NOS fue el de mayor aparición (40 %).
En el ámbito local, nacional (12) y latinoamericano son escasos los estudios sobre la epidemiología, las características clínicas y patológicas y el comportamiento clínico del LBDCG NOS doble expresor, por lo cual el objetivo de este estudio es determinar las características clínicas y patológicas y describir las tasas de respuesta de los pacientes con este tipo de linfoma diagnosticados en el Hospital de San José entre 2016 y 2019 y explorar su asociación con variables clínicas y patológicas de peor pronóstico.
Métodos
Se realizó un estudio observacional tipo cohorte retrospectiva, en el cual se incluyeron pacientes mayores de 18 años con diagnóstico de LBDCG NOS en el Hospital de San José entre los años 2016 y 2019. El diagnóstico debía ser confirmado mediante una revisión realizada por hematopatología, de acuerdo con los criterios de la Clasificación de los tumores de los tejidos linfoides y hematopoyéticos de la Organización Mundial de la Salud (OMS), edición del año 2017 (5).
Se excluyeron pacientes que tenían información incompleta sobre datos demográficos, estadificación pronóstica y respuesta alcanzada a la valoración intermedia y valoración final del tratamiento; casos en los que el material de patología (bloque de parafina, láminas histológicas y de inmunohistoquímica) no se encontraba disponible para su revisión; casos con material incompleto para terminar de categorizar el diagnóstico; y casos reclasificados como linfomas diferentes a LBDCG NOS luego de la revisión de patología. También se excluyeron los pacientes con diagnóstico de linfoma B difuso de célula grande doble/triple hit confirmado por la presencia de rearreglos en MYC, BCL2 o BCL6 por FISH para controlar el factor de confusión dado por la presencia de linfomas B de alto grado.
Se obtuvieron los casos seleccionados (bloques de parafina y láminas) del archivo de patología del Hospital de San José, se recolectaron 179 casos de los cuales 21 se encontraban duplicados y 91 fueron excluidos. En total, se seleccionaron 67 casos que fueron analizados por la hematopatóloga institucional y un residente de patología. Se determinó la morfología celular mediante microscopía de luz al observar el tamaño y estructura de la célula tumoral, y posteriormente se realizaron estudios de inmunohistoquímica (procedimiento bioquímico en el cual se utilizan anticuerpos para hacer visible, por inmunoreactividad cromogénica, la ubicación de proteínas y otros antígenos específicos en las células de los tejidos), como se observa en la Figura 1.
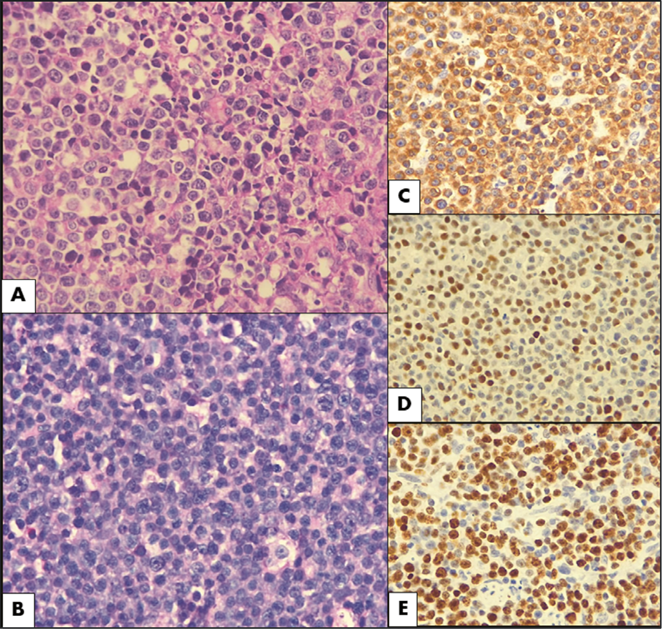
Fuente: propia
Figura 1 Análisis de hematoxilina y eosina (H&E) e inmunohistoquímica de LBDCG NOS doble expresor. (a) Morfología centroblástica caracterizada por células linfoides de tamaño mediano a grande con núcleos vesiculares ovalados de cromatina fina y 2 a 4 nucléolos unidos a la membrana nuclear. (b) Morfología de célula intermedia caracterizada por células linfoides de tamaño mediano acompañadas de macrófagos y cuerpos apoptóticos dando apariencia de cielo estrellado. (c) BCL2 (≥50 %). (d) MYC (≥40 %). (e) Alto índice de proliferación celular (Ki67 ≥ 70 %).
Los marcadores de inmunohistoquímica evaluados fueron MYC, BCL2, CD10, BCL6, MUM1 y Ki67. Se analizó la inmunoreactividad mediante el conteo visual de células neoplásicas positivas para cada marcador y se calculó el porcentaje que expresaba cada uno. Los casos con sobreexpresión de MYC (≥40 %) y BCL2 (≥50 %) fueron categorizados como LBDCG NOS doble expresor, de acuerdo con los criterios de la última edición de la Clasificación de los tumores de los tejidos linfoides y hematopoyéticos (5). Además, se analizaron los marcadores CD10, BCL6 y MUM1 (≥30 %), respectivamente, para evaluar el algoritmo de Hans (5), el cual permite clasificar la célula de origen del LBDCG en centro germinal y no centro germinal. Adicionalmente, en 13 casos se realizó FOXP1 para confirmar el tipo de célula de origen según el algoritmo de Choi (5).
La información de las características sociodemográficas, clínicas, pronósticas, terapéuticas y de respuesta alcanzada de los 67 pacientes analizados fue tomada de las historias clínicas. Tanto para los pacientes con LBDCG NOS doble expresor y no doble expresor se calcularon las tasas de respuesta parcial y completa según el Consenso de criterios de evaluación de respuesta en linfoma (RECIL) del 2017 (13) y las tasas de respuesta global, definida como la proporción de pacientes con respuesta parcial o completa al tratamiento, sin incluir pacientes con enfermedad estable (14).
Las variables cuantitativas fueron descritas con promedio y desviación estándar (DE), previa verificación de la normalidad de los datos por medio del estadístico Kolmogorov-Smirnov. Las variables cualitativas fueron descritas mediante frecuencias absolutas y relativas. Las variables cualitativas dicotómicas fueron asociadas en tablas cruzadas con el estadístico chi cuadrado (χ²) y se determinó el riesgo relativo (RR IC 95 %). La asociación de variables cualitativas con variables cuantitativas se realizó con el estadístico T Student para variables dicotómicas y análisis de varianza ANOVA para variables politómicas. Una p menor a 0,05 fue considerada estadísticamente significativa. El análisis estadístico se llevó a cabo con el software SPSS versión 21.0.
La ejecución de este proyecto de investigación tuvo en consideración las normas científicas, técnicas y administrativas para la investigación en salud que se dictan en la Declaración de Helsinki (2013), la Resolución 8430 de 1993 y la Ley Estatutaria 1581 de 2012. Al tratarse de un estudio de tipo cohorte retrospectiva de revisión de historia clínica, se consideró como un estudio sin riesgo.
Resultados
En una muestra de 67 pacientes con LBDCG NOS el 49,3 % fueron doble expresor (BCL2 >50 % y MYC >40 %) y la edad promedio en este grupo fue 60,8 años. Las principales comorbilidades en ambos grupos fueron las cardiovasculares, seguidas de la enfermedad renal crónica. En las Tablas 1 y 2 se describen las características demográficas, clínicas e histopatológicas de la cohorte de pacientes con LBDCG NOS y de aquellos doble expresor.
La mayoría correspondieron a linfomas de novo (94 %), seguida por linfomas transformados de linfoma folicular (3 %) y linfomas transformados de leucemia linfocítica crónica (1,5 %). El 13,4 % de los pacientes presentaron algún tipo de urgencia oncológica al momento del diagnóstico, siendo la más frecuente el síndrome de lisis tumoral (6 %), seguida por hipercalcemia maligna (3 %), síndrome biliar obstructivo (3 %) y síndrome de compresión medular (1,5 %).
Los linfomas doble expresor no mostraron diferencias para la edad, distribución por sexo, comorbilidades, presencia de síntomas B, compromiso bultoso, nivel de LDH, estado funcional evaluado por ECOG, estadios avanzados de la enfermedad (Ann Arbor III y IV), tipo de compromiso extranodal y en la distribución del índice pronóstico internacional (IPI) por grupos de riesgo, como se describe en la Tabla 1.
Tabla 1: Características demográficas, clínicas y terapéuticas
| Linfoma B difuso de célula Linfoma B difuso de célula grande doble Característica grande NOS N = 67 expresor N = 33 | ||
| (%n) | (%n) | |
| Promedio de edad en años | 61 | 60,8 |
| Rango | 27-93 | 27-86 |
| Sexo | ||
| Hombre | 40 (59,7) | 22 (66,7) |
| Mujer | 27 (40,3) | 11 (33,3) |
| Estadio Ann Arbor | ||
| I | 3 (4,5) | 1 (3) |
| II | 12 (17,9) | 7 (21,2) |
| III | 15 (22,4) | 11 (33,3) |
| IV | 37 (55,2) | 14 (42,4) |
| Síntomas B | ||
| Sí | 53 (79,1) | 26 (78,8) |
| Compromiso bultoso | ||
| Sí | 30 (44,8) | 14 (42,2) |
| LDH (deshidrogenasa láctica) | ||
| Elevada > 1 vez del límite superior | 47 (70,1) | 24 (72,7) |
| ECOG Estado funcional | ||
| 0 | 22 (32,8) | 11 (33,3) |
| 1 | 26 (38,8) | 11 (33,3) |
| 2 | 7 (10,4) | 4 (12,1) |
| 3 | 8 (11,9) | 5 (15,2) |
| 4 | 4 (6) | 2 (6,1) |
| IPI índice pronóstico internacional | ||
| 0 | 2 (3) | 2 (6,1) |
| 1 | 9 (13,4) | 3 (9,1) |
| 2 | 16 (23,9) | 7 (21,2) |
| 3 | 23 (34,3) | 12 (36,4) |
| 4 | 11 (16,4) | 5 (15,2) |
| 5 | 6 (9) | 4 (12,1) |
| Tipo de compromiso extranodal | ||
| Médula ósea | 10 (14,9) | 4 (12,1) |
| Tracto gastrointestinal | 11 (16,4) | 7 (21,2) |
| Sistema nervioso central | 6 (9) | 3 (9,1) |
| Renal / suprarrenal | 6 (9) | 2 (6,1) |
| Bazo | 13 (19,4) | 6 (18,2) |
| Otro* | 13 (19,4) | 4 (12,1) |
| Tratamiento de primera línea † | ||
| R CHOP 21 | 37 (55,2) | 18 (54,5) |
| R CVP | 6 (9) | 2 (6,1) |
| DA EPOCH R | 7 (10,4) | 5 (15,2) |
| R CHOEP | 2 (3) | 2 (6,1) |
| R mini CHOP | 3 (4,5) | 1 (3) |
| Otro esquema | 4 (6) | 1 (3) |
| Ninguno | 8 (11,9) | 5 (15,2) |
| Tratamiento de rescate † | ||
| R DHAP | 5(7,5) | 2 (6,1) |
| R ICE | 8(11,9) | 6 (18,2) |
| R ESHAP | 2 (3) | 1 (3) |
| R GDP | 6 (9) | 2 (6,1) |
| Otro | 5 (7,5) | 1(3) |
* Otro: pulmón, piel y tejidos blandos, testículos, anillo de Waldeyer, glándulas salivales, aparato genital femenino.
† R CHOP 21: rituximab, ciclofosfamida, doxorrubicina, vincristina, prednisona. R CVP: rituximab, ciclofosfamida, vincristina, prednisona. DA EPOCH R: dosis ajustadas de etopósido, prednisona, vincristina, ciclofosfamida, doxorrubicina, rituximab. R CHOEP: rituximab, ciclofosfamida, doxorrubicina, vincristina, prednisona, etopósido. R mini CHOP: rituximab, prednisona, dosis ajustadas de ciclofosfamida, doxorrubicina, vincristina. R DHAP: rituximab, dexametasona, cisplatino, citarabina. R ICE: rituximab, ifosfamida, carboplatino, etopósido. ESHAP: etopósido, metilprednisolona, cisplatino, altas dosis de citarabina. R GDP: rituximab, dexametasona, gemcitabina, cisplatino. Fuente: propia, datos del estudio
El análisis de MYC en los linfomas doble expresor (n = 33) se realizó en rangos. Se encontraron 16 casos en el rango del 40 % al 69 % y 17 casos en el rango ≥70 %. A los 67 pacientes con LBDCG NOS se les determinó la clasificación de célula de origen (COO) utilizando el algoritmo de Hans (5), encontrando frecuencias similares entre el tipo centro germinal y no centro germinal (33 y 34 casos respectivamente) como se describe en la Tabla 2; sin embargo, en el análisis discriminado por grupos, el origen que predominó en los LBDCG NOS doble expresor fue el no centro germinal en 21 de 33 casos (63,6 %).
El análisis del índice de proliferación celular Ki67 se realizó en rangos ≤50 %, 51 % al 89 % y ≥90 %, observando que en los LBDCG NOS doble expresor predominó el rango ≥90 % en 21 de 33 casos. En el presente estudio no fue posible establecer la correlación entre los hallazgos morfológicos de los LBDCG y la respuesta alcanzada a la valoración intermedia y final. Los 13 casos a los cuales se les determinó la COO por el algoritmo de Choi fueron concordantes con el algoritmo de Hans.
Tabla 2 Características histopatológicas
| Linfoma B difuso de célula Linfoma B difuso de célula grande Característica grande NOS N = 67 doble expresor N = 33 | ||
|---|---|---|
| (%n) | (%n) | |
| Clasificación célula de origen | ||
| Centro germinal | 33 (49,3) | 12 (36,4) |
| No centro germinal | 34 (50,7) | 21 (63,6) |
| Morfología celular | ||
| Centroblástica | 55 (82,1) | 22 (66,7) |
| Inmunoblástica | 1 (1,5) | 1 (3) |
| Anaplásica | 2 (3) | 2 (6,1) |
| Blastoide | 1 (1,5) | 1 (3) |
| Intermedia | 8 (11,9) | 7 (21,2) |
| Índice de proliferación celular Ki67 % | ||
| ≤50 | 8 (11,9) | 1 (3) |
| 51 al 89 | 34 (50,7) | 11 (33,3) |
| ≥90 | 25 (37,3) | 21 (63,6) |
Fuente: propia, datos del estudio
El 11,9 % de la cohorte no alcanzó a recibir el primer ciclo de quimioterapia principalmente por el fallecimiento previo al inicio de la terapia. El número de ciclos recibidos en promedio fue de 4,21 (0-7). La distribución porcentual con respecto al número de ciclos recibidos fue seis ciclos (57,1 %), un ciclo (13,4 %), cinco ciclos (7,5 %), cuatro ciclos (6,0 %), tres ciclos (4,5 %) y siete ciclos (1,6 %). El 9 % recibió radioterapia externa, el 16,4 % recibió profilaxis al sistema nervioso central con metotrexato sistémico a dosis altas.
El 58,2 % de los casos presentaron alguna complicación durante los ciclos de quimioterapia, siendo más frecuente neutropenia febril (16,4 %), infecciones no asociadas a neutropenia (7,5 %), toxicidad neurológica (7,5 %), toxicidad cardíaca -principalmente falla cardíaca y arritmias- (3 %), toxicidad renal (3 %), aplasia prolongada (1,5 %), toxicidad hepática (1,5 %) y enfermedad fúngica invasora documentada (1,5 %).
La Tabla 3 muestra las tasas de respuesta alcanzada a la revaloración intermedia y valoración final. La información sobre la revaloración intermedia y final se encontraba disponible en 41 pacientes de la cohorte de LBDCG NOS y en 19 pacientes del grupo de LBDCG NOS doble expresor. Las razones por las cuales no se disponía de la información requerida fueron el fallecimiento previo al inicio del tratamiento, pacientes que recibieron un primer ciclo intrahospitalario y continuaron los siguientes ciclos en otra institución o pacientes que fueron diagnosticados y posteriormente remitidos para continuar manejo en otra institución.
Tabla 3 Tasas de respuesta alcanzada
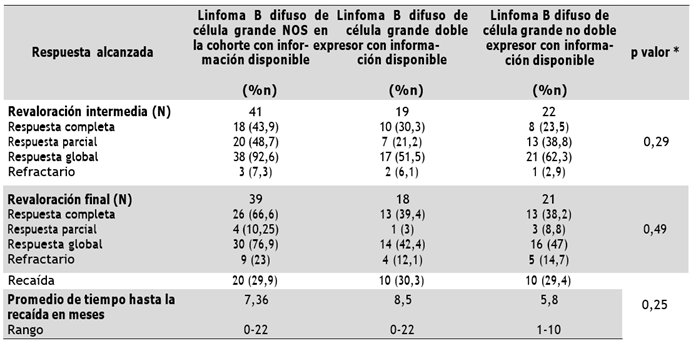
* p: nivel de significación asintótica bilateral por prueba de chi cuadrado de Pearson para asociación entre LBDCG expresor y no doble expresor con el tipo de respuesta alcanzada. Fuente: propia, datos del estudio
La recaída se presentó en el 30,3 % de los linfomas doble expresor y 29,4 % en los linfomas no doble expresor. De 58 pacientes con información disponible sobre trasplante de progenitores hematopoyéticos, 5,2 % recibieron trasplante autólogo; la mayor proporción correspondía a pacientes en su primera recaída, que recibieron el trasplante como esquema de consolidación luego de demostrar quimiosensibilidad con el esquema de rescate administrado.
No se encontraron diferencias estadísticamente significativas en la respuesta alcanzada a la revaloración intermedia (p = 0,29) y final (p = 0,49). Tampoco hubo diferencias estadísticamente significativas entre un MYC ≥70 % (p = 0,447), un Ki67 ≥ 90 % (p = 0,813) y célula de origen (p = 0,087) con la respuesta al tratamiento alcanzada; sin embargo, es necesario tener en cuenta los casos perdidos en la revaloración intermedia, que fueron del 38,8 %, y en la revaloración final del 41,8 %.
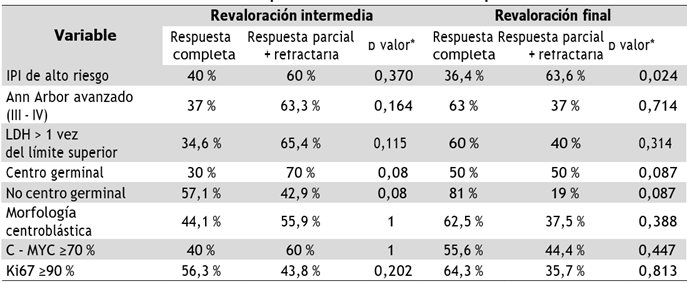
La Tabla 4 describe los factores pronósticos clínicos y patológicos de los linfomas doble expresor. Solo el IPI de alto riesgo mostró diferencias estadísticamente significativas para predecir peores respuestas en la revaloración final (p = 0,024), con mayor riesgo de tener una respuesta parcial o de presentar enfermedad refractaria (RR: 2,47 IC 1,10-5,55 p 0,02).
Discusión
En este estudio, con respecto a la estadificación inicial, el 79,7 % de los pacientes tenían un estadio avanzado de la enfermedad (AA III y IV), resultado que difiere parcialmente de los obtenidos por Combariza et al. en 2015, quienes encontraron que el 63,3 % de los pacientes con LBDCG se encontraban en un estadio avanzado (11).
La morfología centroblástica fue la más frecuente, lo cual concuerda con otras publicaciones (5,15) y hubo otras menos frecuentes como la anaplásica e inmunoblástica. La última edición de la Clasificación de los tumores de los tejidos linfoides y hematopoyéticos de la OMS recomienda incluir la característica morfológica dentro del análisis histopatológico, porque algunas de ellas, principalmente la morfología inmunoblástica, se han asociado con el impacto pronóstico adverso y con presentar la translocación de MYC (5); sin embargo, una de las mayores dificultades cuando se realiza el análisis morfológico celular es la deficiente reproducibilidad inter e intraobservador reportada en la literatura (16). Por lo tanto, los hallazgos morfológicos siempre deben ir correlacionados con los estudios de inmunohistoquímica para sugerir un LBDCG NOS agresivo o doble expresor.
Las frecuencias relativas del tipo de célula de origen pueden cambiar según la ubicación geográfica y poblacional (5). En el presente estudio se observaron frecuencias similares para el tipo centro germinal y no centro germinal, lo cual se correlaciona con otros estudios publicados (17). No obstante, para el grupo de LBDCG NOS doble expresor, el tipo de célula no centrogerminal es el más frecuente (5,6). A diferencia de otros estudios (17,18), no se demostró asociación entre la célula de origen y la respuesta alcanzada a la revaloración intermedia y final por las limitaciones previamente mencionadas.
Los diferentes porcentajes de la expresión de MYC se evaluaron según lo realizado por el grupo Italiano de Di Napoli et al., quienes sugieren que encontrar puntos calientes con un C-MYC ≥70 % tiene mayor probabilidad de hallar un rearreglo para MYC (19), lo cual permitiría identificar aquellos casos que deberían llevarse a un análisis molecular, para identificar pacientes que se beneficien de una terapia más agresiva y disminuir costos, considerando el contexto nacional.
En el presente estudio se logró determinar que el rango MYC ≥ 70 % correspondía a la mitad de los casos LBDCG NOS doble expresor; sin embargo, no se logró demostrar la utilidad de este rango MYC ≥ 70 % en relación a la respuesta alcanzada al tratamiento, debido a la pérdida de casos al momento de la recolección de información en la historia clínica, de ahí que sigue siendo indispensable categorizar los LBDCG NOS doble expresor como lo recomienda la OMS y usar herramientas moleculares tales como FISH que permitan comparar las variables estudiadas con el resultado final.
El índice de proliferación celular Ki67 en los LBDCG NOS generalmente es alto (>40 %) y en algunos casos >90 % (5). En este estudio se encontró la expresión del Ki67 del rango ≥90 % como la más frecuente para el grupo de LBDCG NOS doble expresor, lo cual sugiere una mayor agresividad, como es de esperarse por la biología tumoral. El grupo de pacientes con LBDCG NOS doble expresor presentó bajas tasas de respuesta global al tratamiento, comparado con el LBDCG NOS en general. Este hallazgo confirma el mal pronóstico dado por la sobreexpresión de MYC y BCL2 (20).
Las tasas de respuesta global fueron inferiores a las reportadas en los estudios pivotales del protocolo R-CHOP, como el estudio RICOVER-60 de Pfreundschuh et al., que mostró tasas de respuesta completa del 78 % (21), o el estudio del grupo francés GELA LNH 98-5 de Coiffier et al., que evidenció un 75 % de respuesta completa (22).
Las tasas de respuesta inferiores son atribuidas a que los estudios pivotales para R-CHOP se realizaron en condiciones ideales con mayores tasas de adherencia al protocolo, mientras que el presente estudio incluyó pacientes con condiciones socioeconómicas y administrativas diversas del régimen contributivo y subsidiado en el contexto real colombiano. Esto pudo haber influido en la densidad de dosis administrada y en las tasas de respuesta alcanzadas. De igual manera, se obtuvo una mayor proporción de linfomas de tipo doble expresor (49,3 %), comparado con el 20 % al 30 % reportado en otras series, disparidad que también pudo haber influenciado las tasas de respuesta alcanzadas (23).
Al analizar la asociación entre las características clínicas e histopatológicas con las tasas de respuesta alcanzadas, solo se encontró una asociación estadísticamente significativa entre la presencia de IPI de alto riesgo y menores tasas de respuesta completa a la valoración final, lo cual está en concordancia con el estudio inicial del proyecto internacional de factores pronósticos en linfomas no Hodgkin (24) que encontró menores tasas de respuesta completa en el grupo de riesgo alto por IPI (44 %) comparado con el grupo de riesgo bajo (87 %) (25, 26).
Como fortaleza del presente estudio se destaca la revisión central de patología, lo cual permitió controlar variables de confusión asociadas al diagnóstico histopatológico. Por otro lado, dentro de las limitaciones del estudio está la naturaleza retrospectiva del mismo y las pérdidas en el seguimiento de los pacientes en cuanto a la información relacionada con las tasas de respuesta debido a fallecimiento previo al inicio del tratamiento y la continuidad del tratamiento de quimioterapia en instituciones diferentes a la del estudio.
Para las futuras investigaciones, se recomienda plantear estudios prospectivos en cohortes más grandes de pacientes que permitan valorar las diferencias en supervivencia global entre los LBDCG doble expresor y no doble expresor, así como también ser la base para nuevas investigaciones en las que se pueda incluir el análisis molecular de los casos y de esta manera obtener datos más confiables y precisos.
Conclusión
En conclusión, en LBDCG NOS doble expresor con un puntaje IPI de alto riesgo se asocia con mayores tasas de respuesta parcial y enfermedad refractaria a la valoración final, es decir, no alcanzar una respuesta completa.
Es indispensable continuar categorizando los LBDCG NOS doble expresor para seleccionar los casos que deben llevarse a un análisis molecular. Se requieren estudios prospectivos con el fin de determinar si hay beneficio en intensificar la terapia en primera línea a fin de sobrepasar el pronóstico adverso dado por la sobreexpresión de MYC y BCL2.