1 Introducción
El Bosque seco Tropical (Bs-T) se caracteriza por una cobertura vegetal particular y única en el país, que presenta adaptaciones para sobrevivir a las presiones ambientales que el bioma ejerce, principalmente debido a su patrón de precipitación (entre 700 y 2000 mm anuales), cuya dinámica ha llevado a ciclos anuales con dos períodos de sequía muy marcados 1, su ubicación altitudinal (0-1000 m) (idem), y sus temperaturas elevadas, (max. 38° C) 2. El Bs-T se presenta como parches o fragmentos de bosque en toda de la región neotropical 2,3, esta zona de vida representa el 50% de zonas boscosas en Centroamérica y el 22 % en Sudamérica y es uno de los ecosistemas tropicales más afectados por actividades humanas, debido al pastoreo, la caza, los monocultivos como algodón, maíz, sorgo, arroz, la invasión de pastos exóticos, el fuego y la tala indiscriminada. Actualmente, estos bosques son considerados en general los ecosistemas más degradados, fragmentados y menos conocidos en Colombia 2; no obstante, sabemos que el Bs-T alberga un número importante de especies de aves, siendo importante en el mantenimiento y conservación de poblaciones tanto locales como migratorias en el neotrópico, sumado a que el Caribe presenta el más alto grado de endemismo de aves en los Bs-T de Colombia, lo que le confiere alto valor para la preservación de la fauna 4; ejemplo de especies endémicas del norte de Colombia son: Ortalis raficauda raficauda, Ortalis garrula y Myiarchus venezuelensis5,6, que a su vez muestran poblaciones en decrecimiento 7.
Colombia es reconocida como el país que presenta la mayor riqueza de aves en el mundo, con 1.937 especies registradas 8, esto se debe principalmente a las diferentes formaciones fitogeográficas y geológicas, junto con variadas condiciones ecológicas, además de su privilegiada posición geográfica en el extremo noroccidental de Sudamérica teniendo extensión en las costas del océano Pacífico y el mar Caribe 9. Todo lo anterior hace que presente una alta variedad biológica, por lo que es considerado el segundo país megadiverso del mundo, albergando cerca del 10% de biodiversidad del planeta 10. Las aves de Colombia se distribuyen sobre cinco eco-regiones: Andes, Caribe, Pacífica, Amazonia y Orinoquia. La región de los Andes es la que presenta la mayor riqueza de aves (812 especies), seguido de la región Amazónica y en tercer lugar encontramos la región Caribe con 710 especies 11.
Pese a la gran riqueza de aves en la región Caribe, se han realizado pocos estudios detallados, y los inventarios taxonómicos son deficientes y desactualizados 12. Dentro de la región Caribe se encuentra el departamento de Sucre, donde el ecosistema Bs-T es alterado principalmente por actividades antrópicas; a esta problemática se le suma que aún no existe información detallada sobre el estado de la avifauna presente en este ecosistema en particular 13 y en el departamento en general. En busca de estrategias de conservación efectivas para el Bs-T, se reconoce la importancia de los bosques de galería o bosques riparios, que permanecen como coberturas continuas a lo largo de los ríos y arroyos y pueden actuar como corredores 14, que pueden estar conectando los parches de bosque seco, aún presentes en el Caribe. En consecuencia, para valorar su papel conector, se necesita conocer la riqueza, composición, y abundancia de la avifauna que ellos albergan, además de conocer su aporte al mantenimiento de las poblaciones de aves residentes y migratorias de la región, en matrices cercanas a bosques secos, o sabanas antropizadas. El objetivo principal de esta investigación fue realizar una caracterización de la avifauna presente en un bosque de galería, inmerso en un matriz de paisaje modificado, originalmente dominado por bosque seco, en el corregimiento de San Antonio (Sucre-Colombia).
2 Materiales y métodos
El estudio se realizó en el corregimiento de San Antonio, específicamente en la finca La Alejandrina propiedad de Miguel Ángel Novoa (9° 16' 20,7´´N 75° 27´ 0,6´´W), que comprende una extensión de 70 Ha, con un gradiente altitudinal que va de 86 a 193 msnm; hace parte de la macrocuenca Sinú-Caribe, la cual cuenta con características favorables para la ocurrencia de muchas especies de aves, por su topografía heterogénea que permite el origen de una cadena montañosa y varios drenajes; la presencia de jagüeyes ha permitido que diversas especies de aves que dependen de esta zona puedan sobrevivir 13.
Dentro de la finca se realizaron 10 salidas de campo entre febrero y julio del 2016 (meses que corresponden a parte de los periodos de lluvia y sequía de la región), con una duración total de 20 días de muestreo. El área de muestreo fue de 615.200 m2 (Figura 1, recuadro rosa); en la cual se identificaron dos zonas con diferentes grados de perturbación, un bosque de galería (en adelante ‘Bosque’), considerado como el área de menor perturbación, que comprende una extensión de 38 hectáreas de vegetación secundaria formada por árboles de gran altura, lianas enredaderas, entre otras especies vegetales que la hacen atractiva para la alimentación, anidación y refugio de una gran diversidad de aves; este bosque se ubica a lo largo de un arroyo que atraviesa una matriz de paisaje modificado, dominada principalmente por potreros (en adelante ‘Potrero’) (Figura 1, áreas verdes) que contaban además con la presencia de cuatro fuentes de agua (jagüeyes) (Figura 1, círculos azules), rodeadas por cobertura vegetal de fácil acceso, en su mayoría arbustos de 1 metro de altura; aunque se observó arbustos hasta de 2 metros de alto, y árboles de gran altura, que se encuentran dispersos por toda la zona.

Figura 1 Ubicación geográfica del área de estudio, indicando las zonas de muestreo evaluadas en este trabajo (bosque de galería y potrero).
Para determinar las comunidades de aves presentes en la zona de estudio se siguió la metodología propuesta por 15, exceptuando la grabación de vocalizaciones. Se realizaron capturas con redes de niebla, utilizando 36 metros de red por día (esfuerzo total de 587 horas/red); las redes se instalaron a una distancia aproximada de 100 a 200 metros, en las dos zonas de estudio y se abrieron desde las 07:00 hasta las 17:00 horas, revisando cada 10 o 20 minutos, de acuerdo a las condiciones climáticas que se presentaran, debido a que en periodo de sequía las temperaturas pueden alcanzar los 37-40 °C, y el tiempo de revisión de las redes se debe acortar, para evitar que los individuos capturados en las redes puedan sufrir asfixia por las altas temperaturas. El muestreo se complementó con observaciones por transecto lineal de un kilómetro con búsqueda aleatoria intensiva 16; estos recorridos se realizaron desde las 09:00 hasta las 17:00 horas en cada zona de trabajo (esfuerzo total de 97 horas), ayudados por binoculares a una velocidad relativa de 0,7 km/h estableciendo puntos fijos de 15 min de duración por cada 30 min de recorrido. Se registraron las aves observadas, con el fin de obtener un muestreo más completo de la zona de estudio, ya que algunas especies de aves tienen un rango de vuelo muy alto, que evita su captura por redes de niebla.
Se realizaron registros fotográficos, a las especies para su posterior identificación siguiendo la Guía de aves de Colombia 17, y la guía de campo de las aves de Colombia 18. La nomenclatura de las especies registradas en este estudio a nivel de especie, familias, subfamilias, órdenes y subórdenes siguió “Una clasificación de las especies de aves de Sudamérica” de la Unión Americana de Ornitólogos, propuesta por 19. Para las especies de aves amenazadas a nivel nacional se consultó el libro rojo de aves de Colombia 20, y Bird Life International para las aves amenazadas a nivel global.
Para evaluar la representatividad del muestreo, se realizó una curva de acumulación de especies en el software EstimateS v9.1 21, para estimar el número de especies esperadas, mediante el índice no paramétrico Chao 1 22, a partir de las abundancias obtenidas en el muestreo de 20 días con redes de niebla. Mediante una prueba de χ2, aplicada en el programa PAST 3.02 23, se determinó el modelo de distribución que mejor describe los datos de abundancia y riqueza obtenidos por medio de los dos métodos de muestreo; para posteriormente construir curvas de rangos de abundancias. Con base en este análisis se clasificaron las especies como: Muy abundantes, abundantes y raras en los dos periodos. Además, se determinó la categoría de residencia como residentes o migratorias 6,11,24. En la plataforma R-project 3.1.3, se calcularon los índices de diversidad en términos de números de Hill 25, con base en los datos obtenidos por ambos métodos de muestreo, teniendo en cuenta que los números de Hill nos permiten medir la diversidad de cada zona para cada época muestreada, en términos de números de especies, con lo cual las correspondientes comparaciones serán siempre más ajustadas con la realidad y más sencillas de hacer. Para trazar los perfiles de diversidad, en las zonas de muestreo definidas de acuerdo con su grado de perturbación y en épocas de altas y bajas precipitaciones, se calculó la diversidad de orden 0 (0D), o riqueza de especies, la diversidad de orden 1 (1D), que es el exponencial de la entropía del índice Shannon y la diversidad de orden 2 (2D), que es el inverso del índice Simpson 22,25,26.
Finalmente, las especies identificadas se clasificaron en nueve gremios tróficos: frugívoros, nectarívoros, granívoros, insectívoros, omnívoros, carnívoros, frugívoro-insectívoro, frugívoro-granívoro, nectarívoro-insectívoro, con base en varios trabajos previos 6,27,28. Los datos sobre la dieta de las especies fue tomada principalmente de 17.
3 Resultados
3.1 Esfuerzo de muestreo, composición y estructura de aves
Se registraron 102 especies representadas en 793 individuos (Tabla 1), de los cuales 364, pertenecientes a 69 especies, se registraron mediante captura por redes de niebla y 429 se observaron durante las caminatas. Las especies registradas pertenecen a 17 órdenes y 39 familias; el orden que presentó mayor dominancia fue Passeriformes con 18 familias, mientras que la familia más dominante fue Tyranidae con 16 especies, seguida de Traupidae con 8 especies. Con base en el estimador Chao 1 se esperó un total de 83 especies para el área de estudio, con lo cual se evidenció una representatividad de muestreo del 83% en este trabajo (Figura 2), lo que al ser complementado con las caminatas, permite considerar el muestreo como efectivo para el área de estudio.
Tabla 1 Listado de especies registradas en la finca La Alejandrina, corregimiento de San Antonio, Sucre, Colombia. La taxonomía sigue al SACC [33]. E.C.= Estado de Conservación (34) y Bird Life International. Estado = Residente (R) o Migratoria (M). Gremio trófico = FG (frugívoro-granívoro); I (insectívoro); FI (frugívoro-insectívoro); F (frugívoro); C (carnívoro); O (omnívoro); G (granívoro); N (nectarívoro); NI (nectarívoro-insectívoro) 6,17 27,28.
| Orden | Familia | Especies | E.C. | Estado | Gremio trófico | Abundancia |
|---|---|---|---|---|---|---|
| Anseriformes | Anatidae | Dendrocygna autumnalis | LC | M | O | 22 |
| Anseriformes | Anatidae | Dendrocygna viduata | LC | R | O | 11 |
| Galliformes | Cracidae | Ortalis garrula | LC | R | FG | 10 |
| Podicipediformes | Podicipedidae | Tachybaptus dominicus | LC | R | O | 1 |
| Columbiformes | Columbidae | Columbina squammata | LC | R | FG | 2 |
| Columbiformes | Columbidae | Columbina minuta | LC | R | G | 1 |
| Columbiformes | Columbidae | Columbina talpacoti | LC | R | G | 79 |
| Columbiformes | Columbidae | Leptotila verreauxi | LC | R | G | 77 |
| Cuculiformes | Cuculidae | Crotophaga ani | LC | R | O | 35 |
| Cuculiformes | Cuculidae | Crotophaga major | LC | R | O | 5 |
| Cuculiformes | Cuculidae | Coccyzus americanus | LC | M | O | 5 |
| Cuculiformes | Cuculidae | Piaya cayana | LC | R | I | 5 |
| Cuculiformes | Cuculidae | Tapera naevia | LC | R | I | 1 |
| Caprimulgiformes | Caprimulgidae | Nyctidromus albicollis | LC | R | I | 3 |
| Apodiformes | Trochilidae | Amazilia saucerrottei | LC | R | N | 1 |
| Apodiformes | Trochilidae | Amazilia tzacatl | LC | R | NI | 8 |
| Apodiformes | Trochilidae | Glaucis hirsutus | LC | R | NI | 3 |
| Apodiformes | Trochilidae | Phaethornis anthophilus | LC | R | NI | 7 |
| Apodiformes | Trochilidae | Chlorostilbon gibsoni | LC | R | N | 1 |
| Gruiformes | Rallidae | Aramides cajanea | LC | R | O | 18 |
| Charadriiformes | Jacanidae | Jacana jacana | LC | R | O | 6 |
| Charadriiformes | Charadriidae | Vanellus chilensis | LC | R | O | 4 |
| Charadriiformes | Scolopacidae | Tringa solitaria | LC | M | O | 2 |
| Pelecaniformes | Ardeidae | Egretta thula | LC | M | O | 2 |
| Pelecaniformes | Ardeidae | Egretta caerulea | LC | M | O | 2 |
| Pelecaniformes | Ardeidae | Ardea alba | LC | M | O | 1 |
| Pelecaniformes | Ardeidae | Tigrisoma lineatum | LC | R | O | 2 |
| Cathartiformes | Cathartidae | Coragyps atratus | LC | R | C | 16 |
| Cathartiformes | Cathartidae | Cathartes aura | LC | R | C | 12 |
| Accipitriformes | Accipitridae | Rupornis magnirostris | LC | R | C | 3 |
| Accipitriformes | Accipitridae | Accipiter bicolor | LC | R | C | 1 |
| Accipitriformes | Accipitridae | Buteogallus meridionalis | LC | R | C | 2 |
| Coraciiformes | Momotidae | Momotus subrufescens | LC | R | O | 16 |
| Coraciiformes | Alcedinidae | Chloroceryle americana | LC | R | O | 3 |
| Galbuliformes | Galbulidae | Galbula ruficauda | LC | R | I | 27 |
| Piciformes | Picidae | Picumnus cinnamomeus | LC | R | I | 5 |
| Piciformes | Picidae | Campephilus melanoleucos | LC | R | I | 7 |
| Piciformes | Picidae | Melanerpes rubricapillus | LC | R | FI | 4 |
| Piciformes | Picidae | Dryocopus lineatus | LC | R | I | 2 |
| Piciformes | Ramphastidae | Ramphastos sulfuratus | LC | R | F | 6 |
| Falconiformes | Falconidae | Milvago chimachima | LC | R | C | 6 |
| Psittaciformes | Psittacidae | Eupsittula pertinax | LC | R | F | 2 |
| Psittaciformes | Psittacidae | Forpus sp. | LC | R | O | 3 |
| Passeriformes | Tyrannidae | Contopus cooperi | TN | M | F | 1 |
| Passeriformes | Tyrannidae | Poecilotriccus Sylvia | VU | R | I | 1 |
| Passeriformes | Tyrannidae | Cnemotriccus fuscatus | LC | R | I | 2 |
| Passeriformes | Tyrannidae | Myiarchus tuberculifer | LC | R | I | 12 |
| Passeriformes | Tyrannidae | Tyrannus melancholicus | LC | M | FI | 9 |
| Passeriformes | Tyrannidae | Myiozetetes cayanensis | LC | R | O | 1 |
| Passeriformes | Tyrannidae | Myiozetetes similis | LC | R | FI | 1 |
| Passeriformes | Tyrannidae | Capsiempis flaveola | LC | R | FI | 1 |
| Passeriformes | Tyrannidae | Elaenia flavogaster | LC | R | I | 10 |
| Passeriformes | Tyrannidae | Inezia caudata | LC | R | I | 2 |
| Passeriformes | Tyrannidae | Empidonax sp. | LC | R | I | 7 |
| Passeriformes | Tyrannidae | Tyrannus savana | LC | M | I | 1 |
| Passeriformes | Tyrannidae | Todirostrum nigriceps | LC | R | I | 3 |
| Passeriformes | Troglodytidae | Thryophilus sp. | LC | R | FI | 1 |
| Passeriformes | Tyrannidae | Pitangus sulphuratus | LC | R | O | 16 |
| Passeriformes | Pipromorphidae | Tolmomyias sulphurescens | LC | R | FI | 3 |
| Passeriformes | Pipromorphidae | Leptopogon amaurocephalus | LC | R | I | 4 |
| Passeriformes | Parulidae | Setophaga striata | LC | M | I | 1 |
| Passeriformes | Parulidae | Setophaga petechia | LC | M | I | 2 |
| Passeriformes | Parulidae | Geothlypis philadelphia | LC | M | I | 4 |
| Passeriformes | Parulidae | Setophaga fusca | LC | M | I | 3 |
| Passeriformes | Parulidae | Basileuterus sp. | LC | R | FI | 1 |
| Passeriformes | Thamnophilidae | Myrmeciza longipes | LC | R | I | 7 |
| Passeriformes | Thamnophilidae | Sakesphorus canadensis | LC | R | I | 4 |
| Passeriformes | Thamnophilidae | Thamnophilus sp. | LC | R | I | 3 |
| Passeriformes | Thamnophilidae | Formicivora grisea | LC | R | I | 3 |
| Passeriformes | Troglodytidae | Campylorhynchus nuchalis | LC | R | I | 1 |
| Passeriformes | Troglodytidae | Campylorhynchus griseus | LC | R | FI | 8 |
| Passeriformes | Troglodytidae | Cantorchilus leucoti | LC | R | I | 13 |
| Passeriformes | Vireonidae | Vireo olivaceus | LC | R | FI | 4 |
| Passeriformes | Vireonidae | Hylophilus flavipes | LC | R | FI | 10 |
| Passeriformes | Vireonidae | Cyclarhis gujanensis | LC | R | I | 5 |
| Passeriformes | Tityridae | Pachyramphus rufus | LC | R | I | 4 |
| Passeriformes | Tityridae | Pachyramphus polychopterus | LC | R | I | 2 |
| Passeriformes | Passerellidae | Arremon sp. | LC | R | FG | 1 |
| Passeriformes | Thraupidae | Volatinia jacariana | LC | R | G | 16 |
| Passeriformes | Thraupidae | Thraupis episcopus | LC | R | FI | 12 |
| Passeriformes | Thraupidae | Nemosia pileata | LC | R | F | 1 |
| Passeriformes | Thraupidae | Ramphocelus dimidiatus | LC | R | FG | 2 |
| Passeriformes | Thraupidae | Coereba flaveola | LC | R | NI | 7 |
| Passeriformes | Thraupidae | Saltator coerulescens | LC | R | FI | 2 |
| Passeriformes | Thraupidae | Conirostrum leucogenys | LC | R | F | 2 |
| Passeriformes | Thraupidae | Saltator striatipectus | LC | R | FI | 6 |
| Passeriformes | Hirundinidae | Stelgidopteryx ruficollis | LC | R | I | 1 |
| Passeriformes | Hirundinidae | Hirundo rustica | LC | M | I | 6 |
| Passeriformes | Dendrocolaptidae | Dendroplex picus | LC | R | I | 2 |
| Passeriformes | Turdidae | Catharus minimus | LC | M | FI | 3 |
| Passeriformes | Pipridae | Chiroxiphia lanceolata | LC | R | I | 14 |
| Passeriformes | Pipridae | Manacus manacus | LC | R | I | 2 |
| Passeriformes | Pipromorphidae | Atalotriccus pilaris | LC | R | I | 1 |
| Passeriformes | Cardinalidae | Piranga rubra | LC | M | FI | 1 |
| Passeriformes | Cardinalidae | Habia fuscicauda | LC | R | FI | 7 |
| Passeriformes | Emberizidae | Arremonops conirostris | LC | R | FI | 4 |
| Passeriformes | Emberizidae | Sicalis flaveola | LC | R | FG | 1 |
| Passeriformes | Furnariidae | Furnarius leucopus | LC | R | I | 56 |
| Passeriformes | Furnariidae | Synallaxis candei | LC | R | I | 6 |
| Passeriformes | Corvidae | Cyanocorax affinis | LC | R | FI | 41 |
| Passeriformes | Icteridae | Icterus nigrogularis | LC | R | FI | 7 |
| Passeriformes | Icteridae | Psarocolius decumanus | LC | R | FG | 3 |
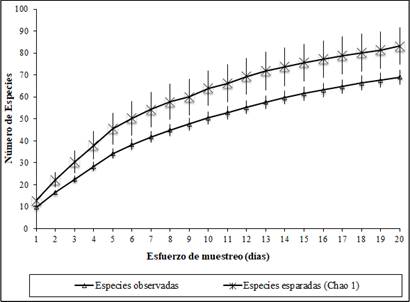
Figura 2 Curva de acumulación de especies capturadas en la Finca La Alejandrina, San Antonio, Sucre.
En cuanto a las épocas de muestreo, el mayor número de especies, con 93 (91% de las registradas en el estudio) se encontró en periodo de lluvias; 15% (14) de las especies observadas en esta época se consideran muy abundantes, entre las que destacan Columbina talpacoti y Leptotila verreauxi; el 38% son abundantes, siendo Momotus subrufescens, Geothlypis philadelpia y Tyranus melancholicus las más representativas de las 36 especies que se agruparon en esta categoría y el 47% de las especies son raras, con máximo 2 individuos registrados, encontrando 43 especies dentro de esta categoría (Figura 3). Durante la sequía, por su parte, se registraron 53 especies, que equivalen al 52% del total; dentro de estas 53, el 15% (8 especies) son muy abundantes, siendo L. verreauxi y C. talpacoti las más representativas; el 39,6% (21 especies) son abundantes, encontrando a Galbula ruficauda y Pitangus sulphuratus, con las mayores abundancias, mientras que el 47% (24 especies) son raras (Figura 3). En ambas épocas para la categoría muy abundantes, además de L. verreauxi y C. talpacoti, también se encontraron Furnarius leucopus , Crotophaga ani, Cyanocorax affinis y Dendrocygna autumnalis, mientras que en las especies raras se encontraron 5 especies para ambas épocas: Egretta thula, Egretta caurela, Thamnophilus sp., Todirostrum nigriceps y Nyctidromus albicollis.

Figura 3 Curvas de distribución de abundancia, mediante modelo logarítmico, de las especies durante periodos de lluvia y sequía, para reconocer la agrupación de la comunidad de aves.
Teniendo en cuenta las zonas muestreadas al interior del área de estudio, el potrero presentó el mayor número de especies con 83, siendo las de mayor abundancia C. talpacoti (60 individuos), seguida de F. leucopus (35 individuos) y L. verreauxi (31 individuos); mientras que en bosque se presentaron 57 especies, donde F. leucopus (46 individuos) fue la especie más abundante, seguida de Cyanocorax affinis (25 individuos). Así mismo, durante el periodo de lluvias la mayor riqueza (77 especies) se observó en el potrero, seguido del bosque con 44 especies; por el contrario en época de sequía fue menor la riqueza encontrada en general; en potrero se registraron 37 especies y en el bosque 33 especies. Las especies más abundante durante todo el estudio fueron C. talpacoti (79 individuos) y L. verreauxi (77 individuos).
3.2 Diversidad de la zona de estudio
El orden de diversidad 0D que representa la riqueza de especies, evidenció que el potrero durante las lluvias es la zona con mayor diversidad de especies efectivas (77), seguida del bosque, con 44 especies efectivas, mientras en la época de sequía el potrero mostró una diversidad de 37 especies efectivas y, finalmente, el bosque presentó la menor riqueza de especies efectivas durante la sequía con 33 especies. Para la diversidad de orden 1D, representada por las especies más frecuentes (especies típicas), el potrero en época de lluvias presentó nuevamente el mayor número de especies efectivas con 47,7, seguida de bosque con 28 especies; mientras que en la sequía el potrero presentó 23,9 especies efectivas, y nuevamente el bosque presentó la menor diversidad durante la sequía, con 21 especies. Finalmente, con la medida de orden 2D, que da peso a las especies dominantes, se observó la misma tendencia de los dos órdenes anteriores, donde potrero en lluvias presentó la mayor diversidad (30,5 especies efectivas), seguido por bosque (17,9 especies efectivas); durante la sequía el potrero y bosque arrojaron 16,4 y 15 especies efectivas, respectivamente. El trazado de los perfiles a partir de los tres órdenes de diversidad para las dos zonas de muestreo en dos épocas del año, se presenta en la Figura 4.

Figura 4 Perfiles de diversidad para la comunidad de aves registradas en dos zonas de muestreo (bosque y potrero) en la Finca La Alejandrina, San Antonio, Sucre, durante las épocas de sequía y lluvia. Se indica la diversidad de orden 0D (riqueza de especies), diversidad de orden 1D (exp H´) y diversidad de orden 2D (inverso de Simpson).
3.3 Gremios tróficos
Las 102 especies identificadas en los muestreos se clasificaron en 9 gremios tróficos (Tabla 1); el gremio más abundante fue insectívoro con 36 especies (35,29%), el segundo gremio fue frugívoro-insectívoro con 20 especies (19,61%), seguido de omnívoro con 18 especies (17,65%); los gremios frugívoro, carnívoro y frugívoro-granívoro presentaron 6 especies cada uno (5,88%); para el gremio granívoro se identificaron 4 especies (3,92%), mientras que para los gremios nectarívoro-insectívoro y nectarívoro se encontraron 3 especies, lo que corresponde a 2,94% del total.
3.4 Categoría de residencia
Se encontraron durante toda la investigación 14 especies migratorias: Cantharus minimus, Setophaga fusca, Setophaga striata, Setophaga petechia, Geothlypis philadelphia, Coccyzus americanus, Egretta caerulea, Egretta thula, Ardea alba, Tringa solitaria, Hirundo rustica, Tyrannus savana, Dendrocygna autumnalis y Piranga rubra, representando el 13,7% de las especies registradas en nuestro estudio. Las 87 especies restantes (86,3%) fueron consideradas residentes.
4 Discusión
Las especies registradas en el presente estudio corresponden al 5.26% de las 1.937 especies reportadas para Colombia 8. La curva de acumulación de especies en nuestro estudio no alcanzó la asíntota (Figura 2), lo que puede indicar que todavía existe una buena proporción de especies por fuera del inventario; sin embargo, los resultados obtenidos demuestran una alta representatividad del muestreo (83%) para especies capturadas con redes de niebla con base en el estimador Chao 1, lo que además fue complementado con las observaciones realizadas durante 97 horas de caminatas; resultados que se asemejan a esfuerzos logrados y recomendados para estudios en aves 6,15,29,30. Ante estos resultados podemos sugerir, similar a lo que han sugerido estudios pasados, la realización de muestreos con mayor duración en el tiempo y metros de red 9,30.
La riqueza obtenida en el presente estudio (102 especies) corresponde al 27,8% de las especies reportadas para el departamento de Sucre; sumado a ello, es similar al número de especies reportadas por otras investigaciones realizadas en fragmentos de bosque seco, como 31 con 134 especies en ecosistemas fragmentados y 32; esto permite indicar que el bosque de galería muestreado, y sus áreas aledañas, son un punto muy importante como hábitat de muchas especies de aves en el departamento. De manera específica, la zona que presentó la mayor riqueza fue el potrero, superando al bosque, lo que puede obedecer a la oferta de recursos de las áreas abiertas, donde particularmente insectos son abundantes durante las lluvias (35,29% de las especies son insectívoras). Por otra parte, para algunas especies propias del bosque, la presencia de otros cuerpos de agua fuera de él (como los jagüeyes), pueden ser una buena oportunidad de búsqueda de alimento; además, independientemente de que haya más especies en el potrero es de resaltar, que solo 6 especies se encontraron solo en esta zona, lo que implica que de manera similar a lo que reportan otros estudios, la presencia de cuerpos de agua continua como arroyos y la vegetación que los rodea, como es el caso de nuestro bosque de galería, son factores importantes que explican la composición y estructura de una comunidad de aves 33.
Las distribuciones de abundancias en los dos periodos (sequía y lluvia) presentaron pocas especies abundantes, muchas especies intermedias y especies raras (Figura 3). Según 34 el comportamiento de las distribuciones de abundancias puede indicarnos el estado de las comunidades de aves que puede albergar un ecosistema. Más del 38% son de abundancias intermedia y el 47% son especies raras y solo el 15% son muy abundantes. Una comunidad dominada por pocas especies podría ser el resultado de una fuerte selección por el ambiente, que solo permite que las especies que estén mejor adaptadas a este tengan una abundancia más alta 5. Teniendo en cuenta los resultados obtenidos a través de la curva de distribución de abundancia, podemos indicar un deterioro en la complejidad del hábitat, coincidiendo con 30, quien afirma que estos tipos de cambios en la complejidad son consecuencia de la pérdida de hábitat, con la consecuente pérdida de nicho y cambio en la composición de especies; todo esto lleva a que estas comunidades de aves tengan números elevados de especies generalistas, debido a la modificación de su entorno. A través de la distribución de abundancia logramos conocer la organización de la comunidad de aves que habitan este fragmento de bosque y además nos dio información de cómo están siendo repartidos los recursos en este ecosistema.
La diversidad de especies sigue la misma tendencia en las dos zonas (potrero y bosque), con referencia a las épocas de sequía y lluvia. El número de especies efectivas es mayor en el potrero seguido de bosque, en épocas de lluvias para los tres órdenes 0D, 1D y 2D (Figura 4), resaltando la fuerte correlación entre el número de especies efectivas y la precipitación, lo que sugiere que este factor puede explicar el ensamblaje de aves en el bosque de galería estudiado, coincidiendo con 5. Los índices de diversidad obtenidos sugieren que hay un alto desequilibrio en la comunidad de aves, debido a que el número efectivo de especies está muy por debajo del número total de especies reportado en este trabajo, en cada zona de estudio y en los periodos muestreados (0D); dado que estos índices tienen información de la distribución de abundancia, estas medidas representan el número de especies que tendría una comunidad si todas las especies estuvieran representadas por el mismo número de individuos 25. La gran diferencia entre la medida de diversidad de orden 0D (riqueza de especies) y el número de especies efectivas de las diversidades de orden 1D y 2D, indica que en este ecosistema las comunidades de aves presentan algunas especies abundantes y un gran número de especies raras, esta relación de cambio entre cada uno de estos índices permiten construir un perfil de diversidad, donde las comunidades más equilibradas (una alta equidad) presentan un reducido cambio entre cada orden (0D - 1D - 2D) de diversidad, encontrando todo lo contrario en nuestros resultados, lo que hace que pocas especies exploten un mayor número de recursos alimenticios. Estos resultados están relacionados con la pérdida de hábitat boscoso, disminuyendo la complejidad; 35 sugirió que el aumento en la complejidad del hábitat puede ser el factor principal involucrado en la generación de ensamblajes más equitativos.
Aunque en algunos ambientes neotropicales las especies de aves migratorias son capaces de producir cambios en la composición de la comunidad 36, en el área de estudio representaron el 16,5% de la avifauna registrada, influyendo muy poco en la riqueza observada en el lugar, lo que coincide con los trabajos de 37 y 27, quienes reportaron el 13% y 18%, respectivamente. La baja riqueza de especies migratorias en nuestro estudio, posiblemente se deba a que la zona muestreada no es exactamente un corredor de aves migrantes o los meses muestreados no son los meses más apropiados para registrar estas especies. Así mismo, las aves migratorias también han sido afectadas por las transformaciones del hábitat ya que esta problemática ha limitado la cantidad de hábitat natural disponible para estas especies. En los últimos 50 años se ha detectado la disminución poblacional de varias especies de aves migratorias neárticas neotropicales para Suramérica 38 y tanto la deforestación como el aumento de áreas abiertas han sido señaladas como las causas principales de que estas especies migrantes disminuyan 39,40.
Por otra parte, se ha documentado que el área y su grado de aislamiento son determinantes en el número de especies que un hábitat puede mantener; por ejemplo 41 reportan que hábitats conservados o nativos aislados, pequeños y cercanos a otros sistemas (potrero, sistema silvopastoril) pueden presentar una alta diversidad y densidad de aves, debido a que las especies utilizan los recursos de los hábitats nativos que los rodean; esto coincide con 31, quien reportó una alta riqueza de aves en diferentes sistemas de producción con predominio de áreas ganaderas y potreros de alta cobertura, cercanos a hábitat naturales; todo esto coincide con nuestros resultados, pocas especies típicas de ambientes poco alterados con poblaciones muy reducidas y un alto número de especies generalistas características de ambientes intervenidos. Aunque no es lo que proponemos para nuestros resultados, porque no evaluamos adaptaciones, cabe mencionar que para las dinámicas ecológicas expuestas, se han dado explicaciones evolutivas, como que la capacidad de utilizar estos hábitats probablemente se deba a adaptaciones obtenidas por presiones de selección ejercidas por las perturbaciones del hábitat 42. A pesar que la menor riqueza de especies se presentó en el bosque de galería, es importante mantener este ecosistema en óptimas condiciones, porque aquí queda demostrado que ofrece resguardo y percha para muchas especies de aves residentes en la zona y, eventualmente, es zona de alimentación para buen número de especies migratorias.
El bosque de galería estudiado presenta un área muy dinámica, donde las especies de los diferentes gremios tróficos se trasladan de una zona a otra en búsqueda de alimento; el gremio insectívoro fue el de mayor representación, seguido de frugívoro-insectívoro y omnívoro; esta distribución es parecida a otros bosques en el neotrópico 32,36,43; tenemos entonces que los insectos representan la principal fuente de alimento y mantenimiento de esta comunidad de aves, lo que no es sorprendente teniendo en cuenta que este es un grupo muy abundante de invertebrados capaces de habitar cualquier ambiente, facilitando su depredación por parte de muchas especies de aves, las cuales a su vez poseen una gran variedad de técnicas para consumirlos 44.
Finalmente, se pudo determinar que la composición y estructura de la comunidad de aves estudiada está fuertemente influenciada por el patrón climático y la transformación antropogénica; las áreas con el tiempo tuvieron una variación en su estructura, ofreciendo diferentes opciones de colonización por parte de las aves en los dos períodos, es así como áreas abiertas que se creían de poca importancia al momento de estudiar el ensamblaje, resultaron ser albergues de una alta diversidad de aves durante el periodo de lluvia; debido, probablemente, a que muchas aves prefieren salir a forrajear en el borde y áreas abiertas para evitar una alta competencia con otras especies al interior del bosque. Las aves cumplen un papel fundamental en la restauración de los hábitats (potrero y bosque), principalmente porque ayudan en la polinización y dispersión de semillas, siendo estas funciones ecológicas claves para el mantenimiento de la integridad de los ecosistemas. Es necesario continuar con el monitoreo de la comunidad de aves asociada a este bosque de galería, por cuanto se reconoce en el presente estudio su papel como resguardo de aves; así mismo, es necesario continuar con estudios que permitan evaluar la conectividad de esta comunidad con otras asociadas a los remanentes de bosque seco tropical del departamento de Sucre.














