Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Odontología Universidad de Antioquia
Print version ISSN 0121-246X
Rev Fac Odontol Univ Antioq vol.20 no.2 Medellín Jan./June 2009
ARTÍCULOS ORIGINALES DERIVADOS DE INVESTIGACIÓN
Comparación de los efectos de tres enjuagues en el manejo de la mucositis oral secundaria al tratamiento de leucemia linfoblástica aguda en niños
Comparison of the effects of three mouth rinses in the management of oral mucositis secondary to the treatment of acute lymphoblastic leukemia in children
Diana María Barbosa Liz1; Lucía Victoria Bernal de Jaramillo 2; Carolina Gallego González 3; Margarita E. Sierra Sánchez4
1 Odontóloga especialista en Estomatología Pediátrica de la Universidad Nacional de Bogotá, especialista en Odontología Integral del Adolescente y Ortodoncia, Universidad de Antioquia. Estudiante de Maestría en Educación y Desarrollo Humano en el Cinde, Universidad de Manizales. Docente asistente de Posgrado en la Facultad de Odontología de la Universidad de Antioquia. dimabarbosa@gmail.com
2 Odontóloga especialista en Odontología Integral del Niño. Universidad de Antioquia, docente asistente de Pregrado y Posgrado de la Facultad de Odontología de la Universidad de Antioquia. mariajllo@une.net.co
3 Odontóloga, Universidad de Antioquia. caroga83@hotmail.com
4 Médica general Universidad Pontificia Bolivariana. Médica Pediatra Universidad de Antioquia. Oncóloga de la Universidad París VII Instituto Gustave Roussy, Hospital Saint Louis de París. Coordinadora del Servicio de Hematooncología Infantil del HUSVP. mare@une.net.co
RESUMEN
INTRODUCCIÓN: el presente estudio se hizo con el propósito de comparar los efectos de tres enjuagues en el tratamiento de la mucositis oral secundaria al tratamiento de la leucemia linfoblástica aguda en niños en edades entre 3 y 15 años, que estaban hospitalizados en el Pabellón de Hematooncología Infantil del Hospital Universitario San Vicente de Paúl de Medellín.
MÉTODOS: se usaron tres enjuagues: triconjugado conformado por: lidocaína en gel al 2%, hidróxido de aluminio e hidróxido de magnesio con simeticona en suspensión (MylantaMR) e hidrocloruro de difenhidramina en jarabe (BenadrylMR); sucralfato constituido por sucralfato de sacarosa de aluminio en suspensión (Dip SucralfatoMR) y lidocaína en gel al 2%, y un tercer enjuague denominado control conformado por lidocaína en gel al 2%; a los tres enjuagues se les adicionó nistatina genérica (100.000 UI) en suspensión para prevenir la sobreinfección fúngica. La asignación de enjuagues fue al azar haciendo a cada paciente tres enjuagues diarios con el asignado; se hizo un registro diario de la severidad de la mucositis y la duración del episodio con el fin de establecer diferencias entre ellos. El tipo de estudio fue cuasi experimental de tipo comparativo y ciego, con una muestra de catorce casos (seis con triconjugado, cuatro con Sucralfato y cuatro de grupo control) recolectados en un periodo de 32 meses, entre abril de 2005 y noviembre de 2007.
RESULTADOS Y CONCLUSIONES: no se encontraron diferencias estadísticamente significativas en la duración ni en la severidad de la mucositis que presentaron los grupos de pacientes con la utilización de los enjuagues estudiados.
Palabras clave: mucositis oral, leucemia, quimioterapia, enjuague.
ABSTRACT
INTRODUCTION: the present study was conducted to compare the effects of three mouth rinses in the treatment of oral mucositis induced by chemotherapy in children between 3 and 15 years of age, with acute lymphoblastic leukemia and who were hospitalized at the Pediatric Hemato oncology Pavilion of the San Vicente de Paul University Hospital in the city of Medellin.
METHODS: three mouth rinses were compared: Triconjugate diphenhydramine, milk of magnesia (magnesium hydroxide) and lidocaine in gel; Sucralfate comprising sucralfate suspended and lidocaine in gel; and a third rinse, called Control consisting of lidocaine in gel; nistatin was added to the mouth rinses to avoid fungal infection. Each group had 3 daily rinses with the assigned mouth rinse and a daily log was made with information related to the severity of mucositis and duration of the episode. The type of study was a quasi-experimental comparative blind design, the sample had 14 cases (triconjugate with 6 cases, 4 in the sucralfate group and 4 in the control group) and collection of the sample was made over a period of 32 months between April 2005 and November 2007.
RESULTS AND CONCLUSION: no statistically significant differences were found in the severity nor on the length of mucositis among the rinses used by the patients.
Key words: oral mucositis, leukemia, chemotherapy, oral rinses.
INTRODUCCIÓN
La leucemia linfoblástica aguda (LLA) es la enfermedad maligna más encontrada en los niños; se le atribuye el 50% de todos los cánceres en este grupo de edad y corresponde al 75,2% de las leucemias en niños.1 Se presenta con más frecuencia en varones que en mujeres y puede ocurrir a cualquier edad, aunque tiene incidencia máxima entre los 2 y los 4 años.2 El principal tratamiento utilizado para este tipo de leucemias es la quimioterapia2-6 que busca atacar y destruir las células cancerosas que se reproducen rápidamente.4
En el Hospital Universitario San Vicente de Paúl de Medellín (HUSVP) se aplican diversos medicamentos quimioterapéuticos agrupados en diversos protocolos descritos por Nathan and Oski´s y por la Universidad de Cambridge7, 8, así:
-
Inducción de la remisión: busca destruir rápidamente las células leucémicas.
-
Intensificación o consolidación: disminuye el número de células residuales de la enfermedad.
-
Tratamiento del sistema nervioso central (SNC) o tratamiento de la leucemia subclínica del SNC: el objetivo de esta fase es hacer tratamiento al SNC para evitar recaídas en este sitio y tratarlo si el paciente ya tiene células malignas allí.
-
Reinducción o reintensificación (reconsolidación): usa medicamentos similares a los de las fases iniciales, con el fin de erradicar células leucémicas residuales.
-
Terapia de continuación: se hace para erradicar células leucémicas residuales y prevenir las recaídas medulares y extramedulares, sin inducir una aplasia y una inmunosupresión severa, y disminuir el riesgo de desarrollar resistencia; en el pasado se llamaba terapia de mantenimiento.
Sin embargo otros autores, describen diversas fases de tratamiento en otros protocolos, como Little, quien menciona tres fases en la quimioterapia: inducción, consolidación y remisión.9
Como efecto adverso de la quimioterapia, se afecta el crecimiento de las células normales y la capacidad de las mucosas para regenerarse,10-12 favoreciendo la aparición de mucositis. La mucositis oral aparece con frecuencia entre los 5 y 7 días después del inicio de la quimioterapia.2, 14, 15 Es una inflamación de la mucosa bucal caracterizada por dolor,3,15-17 úlceras, disfagia, odinofagia, disgeusia13, 15, 18, 19, eritema, descamación, sangrado y exudados.10, 20-23 La ulceración provocada por la mucositis puede favorecer en el paciente con depresión inmunológica15, 18, 19 la presencia de infecciones bacterianas, virales o fúngicas. 6, 11, 13-15, 22, 24-26 Afecta comúnmente superficies no queratinizadas como mucosa bucal, paladar blando, lengua y piso de boca.10, 23, 27.
Para el tratamiento de la mucositis oral se han utilizado diferentes compuestos, entre los que se destacan ungüentos, geles y enjuagues elaborados a partir de sustancias analgésicas, antihistamínicas, anestésicas, agentes antiinflamatorios, bicarbonato sódico, esteroides tópicos, orabase, camomila, clorhexidina, vitamina E, nitrato de plata y capsaicina,10, 15, 17, 19, 22, 23, 28, 29 entre otros. Sin embargo no se ha podido determinar cuál enjuague es más eficiente para el manejo de la mucositis, ni se ha establecido de manera concluyente cuál es el que modifica favorablemente la evolución de la enfermedad de manera significativa. 4, 6, 13, 16, 30-35
Es importante anotar que el tiempo de recambio celular normal de la mucosa oral, es de 4 a 14 días en la encía, de 41 a 57 días en la gingiva, y de 25 días en el carrillo.36 Esto puede tener un efecto significativo sobre las características clínicas de la mucositis y la capacidad de cicatrización del tejido,37 ya que los citostáticos utilizados tienen acción tóxica directa al interferir con la mitosis y reducir la habilidad de la mucosa para regenerarse, lo que lleva a la disminución en la capacidad de renovación del epitelio basal, con la consecuente atrofia de la mucosa, daño del colágeno y eventual ulceración. Además, estos agentes quimioterapéuticos producen también estomatoxicidad indirecta por sus efectos mielosupresores.10
El presente estudio se hizo con el propósito de comparar los efectos de tres enjuagues en el tratamiento de la mucositis oral inducida por quimioterapia en niños con LLA. Adicionalmente se buscó describir las características de edad, género y procedencia de la población objetivo; establecer la severidad de la mucositis en el momento de su detección y determinar la duración y evolución de esta, relacionándola con el tipo de enjuague utilizado.
MATERIALES Y MÉTODOS
Esta investigación tiene un abordaje cuanti- cualitativo. El estudio es de tipo clínico cuasi experimental y comparativo. Según el reporte del Instituto Nacional de Cancerología de 2001 se diagnosticaron 189 niños con cáncer en ese centro, de los cuales 113 presentaron leucemias; el 75,2% de ellas, es decir, 85 pacientes correspondían a LLA.1 Según el informe de la Directora del Servicio de Hematooncología Infantil del HUSVP de Medellín se diagnostican, en promedio, 100 leucemias anuales en niños (información sin publicar). No hay un consenso en cuanto al porcentaje de pacientes que presentan mucositis posterior al tratamiento de quimioterapia. Se reporta que entre el 24 y el 70% presentan la complicación de la mucositis oral;3, 6, 11, 34, 38 considerando esto, la determinación del tamaño muestral fue por conveniencia.
La población objeto de estudio fueron los pacientes con LLA entre los 3 y los 15 años que presentaron mucositis oral posterior al tratamiento de quimioterapia; aunque es objeto de otro artículo, se aclara que en esta investigación los pacientes se encontraban en las fases de inducción, consolidación, tratamiento al SNC y reinducción; ninguno de los pacientes estaba en terapia de continuación. Los criterios de selección de la muestra fueron los pacientes que cumplieron con los requisitos de la población y que estuvieran hospitalizados en el Pabellón de Hematooncología Infantil del HUSVP de Medellín, a quienes se les podía hacer el enjuague y un seguimiento estricto de la evolución de la mucositis.
La muestra fue de catorce casos y estuvo constituida por pacientes de ambos sexos (cuatro de grupo control y diez experimentales), y se recolectó en un periodo de 32 meses entre abril de 2005 y noviembre del 2007. En ese periodo se compararon tres enjuagues: Enjuague T (triconjugado), Enjuague S (sucralfato) y Enjuague C (grupo control). Diversos autores mencionan la preparación de los enjuagues en proporciones y concentraciones diferentes.7, 10 Por comodidad y estandarización de la preparación de los enjuagues se prepararon mezclando partes iguales de los siguientes medicamentos:
-
Enjuague T (triconjugado): lidocaína en gel al 2%, hidróxido de aluminio e hidróxido de magnesio con simeticona en suspensión (MylantaMR) e hidrocloruro de difenhidramina en jarabe (BenadrylMR).
-
Enjuague S (sucralfato): sucralfato de sacarosa de aluminio en suspensión (Dip SucralfatoMR) y lidocaína en gel al 2%.
-
Enjuague C (control): lidocaína en gel al 2%.
A todos los enjuagues se les añadió Nistatina genérica (100.000 UI) en suspensión, en igual cantidad a la utilizada con los medicamentos del enjuague, para evitar sobreinfecciones con Cándida albicans que pusieran en riesgo la salud de los pacientes; a pesar de que esta sustancia tiene un potencial cariogénico por el alto contenido de sacarosa (500 mg por m), se considera útil al evaluar el riesgo-beneficio. Para el manejo ético de la población objetivo se añadió
nistatina y lidocaína a todos los enjuagues, incluido el grupo control, y aunque lo ideal sería no haberlo intervenido, es imposible, desde lo ético, dejar a un grupo de estudio expuesto al dolor y a las posibles complicaciones fúngicas que comúnmente se presentan en estos pacientes y que han sido ampliamente reportadas e investigadas.11, 13, 14, 24, 26, 39 Por esto, el grupo C, el cual se denominó en el estudio como grupo control, recibió anestésico local y nistatina; por tanto, pudo ser utilizado como control ya que estos dos medicamentos están incluidos también en los otros grupos experimentales.Para esta investigación se escogieron enjuagues usualmente utilizados para el tratamiento de la mucositis oral como el Triconjugado, que se usa en la Unidad de Hematooncología Infantil del HUSVP y el Sucralfato, frecuentemente utilizado en la Unidad de Cirugía Maxilofacial del mismo hospital; estos medicamentos han sido usados en diversas investigaciones. 3, 10, 32 Una vez preparados, los enjuagues se refrigeraron y se almacenaron en frascos oscuros para protegerlos de la luz, siguiendo las recomendaciones dadas por farmaceuta del HUSVP. Se hizo una prueba piloto, para calibrar a los tres evaluadores (médicos tratantes del servicio de Hematooncología Infantil del HUSVP de Medellín) lo cual permitió estandarizar la clasificación del grado de mucositis que afectaba al paciente hasta lograr el 100% de concordancia.
Una vez diagnosticada la mucositis y que el paciente cumpliera los requisitos de inclusión, la asignación de enjuagues para cada paciente fue al azar, de tipo ciego y en orden consecutivo asignando al primer paciente el enjuague T, al segundo el enjuague C y al tercero el enjuague S y así sucesivamente. Siguiendo el protocolo descrito por Pereira et al.21 una vez incorporado a un grupo de enjuague, se le hizo a cada paciente, 30 min después de la ingesta de alimentos y posterior a la higiene oral, enjuagues de 4 cm de la mezcla asignada, sin deglución posterior de la misma, tres veces al día y durante un 1 min21,27 ya que el paciente no soportaba más de este tiempo el enjuague en boca.
Se registraron variables demográficas de los pacientes (edad, sexo, procedencia) y se evaluaron la variable severidad de la mucositis de acuerdo con los parámetros establecidos en la clasificación de mucositis de la OMS,10 que se muestran en la tabla 1 y la variable duración en días trascurridos desde la detección de la mucositis y su resolución. Se estableció para toda la población que la mucositis se detectó 8,5 días, en promedio, después de la última quimioterapia. La evaluación y registro de la información se realizó diariamente por el médico tratante; así mismo se verificó la aplicación correcta de los enjuagues por el departamento de enfermería del Hospital.
Adicionalmente, se recogió información relacionada con: el tipo de quimioterapia aplicada al paciente, el número de días transcurridos desde la última quimioterapia, el recuento de glóbulos blancos, la medicación antibiótica, presencia o no de fiebre, necesidad de analgesia endovenosa, identificación de microorganismos patógenos en boca (KOH, directo y cultivo), tipo de dentición, COP/CEO (cariados, obturados y perdidos) y el índice de higiene oral, con el fin de tener datos para futuras investigaciones (que no son objeto de este artículo). La información de las tres últimas variables fue recolectada por las investigadoras odontólogas, previa calibración.
Para el análisis estadístico se hizo un procesamiento electrónico de la información utilizando el S. P. S. S. versión 15.0 de propiedad de la Facultad de Odontología de la Universidad de Antioquia. Se usaron los indicadores básicos de resumen en las variables cuantitativas y las distribuciones porcentuales para las variables cualitativas; se hizo una descripción sobre el comportamiento de las variables estudiadas. Así mismo, para comparar la efectividad de los tratamientos en el manejo de la mucositis, se manejaron pruebas paramétricas (ANOVA de un factor) y no paramétricas para muestras independientes en momento inicial (Kruskal-Wallis), con una significancia del 5%. Los datos se distribuyeron de forma normal. Se usó el test de chi cuadrado para ver la asociación entre severidad de la mucositis y tipo de enjuague; y se aplicó la prueba de Fisher debido al tamaño pequeño de la muestra.
Para la realización del estudio, se tuvieron en cuenta las consideraciones éticas exigidas tanto por la Facultad de Odontología de la Universidad de Antioquia como por el HUSVP, que incluyen la información a los padres o acudientes de los objetivos de la investigación, la confidencialidad del manejo de la información y el anonimato de los pacientes, entre otros, con la firma de un consentimiento y autorización por parte de ellos acorde con el Acta 003 del 7 de diciembre de 2004 del Comité de Investigaciones y cumpliendo los requisitos establecidos en la Resolución 008430 de 1993.
RESULTADOS
características demográficas
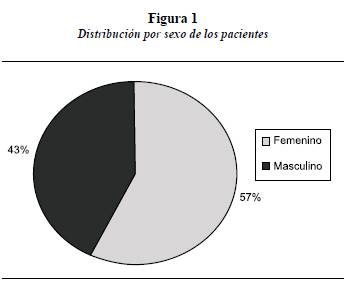
El estudio se llevó a cabo en catorce casos. En las figuras 1 y 2 se observa la distribución por sexos de la muestra y su procedencia. De los catorce casos investigados, diez eran provenientes de Antioquia y cuatro de departamentos vecinos (Chocó y Sucre). Como muestra la figura 3, las edades de los niños en el estudio oscilan entre los 3 y los 15 años, con un promedio aproximado de 9 años y desviación estándar de 3.
Terapia quimioterapéutica
Como se observa en la figura 4, se encontraron pacientes en diversas fases de tratamiento excepto en la fase de continuación. La mayoría de los pacientes que presentaron mucositis estaban en fase de consolidación.
Comportamiento de la mucositis con los enjuagues
Es importante mencionar que la detección de la mucositis en todos los pacientes se dio en promedio a los 8,5 días después de la aplicación de la última quimioterapia.
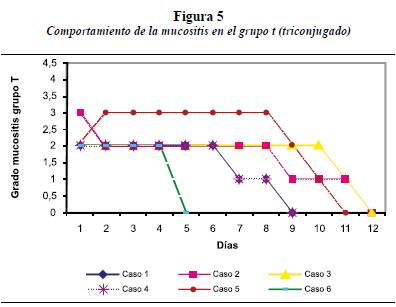
Aunque se pretendió tener grupos con el mismo número de casos, por razones ajenas a los investigadores, dos casos se perdieron: uno con enjuague de sucralfato y otro del grupo control. En las figuras 4 a 6 se observa el comportamiento de la mucositis con los tres grupos de enjuagues.
En la figura 5 se observa el comportamiento de la mucositis en el grupo con enjuague T (Triconjugado). En este grupo de enjuague ningún caso inició con mucositis grado 1 ni grado 4. Tres de estos pacientes estaban con protocolo de tratamiento al SNC, dos en protocolo de reinducción y uno en inducción. La resolución de la mucositis se dio entre los días 5 y 12, con promedio de 9,8 días.
En la figura 6, se observa que en el grupo con el enjuague S (Sucralfato), ningún paciente inició con mucositis grado 1; un paciente inició con grado 3 y otro paciente con grado 4. Estos pacientes estaban recibiendo protocolos de reinducción y de tratamiento al SNC respectivamente. Llama la atención que el caso que inició con mayor severidad no fue el que más se demoró en resolver la mucositis. El promedio de duración de la mucositis en el grupo que utilizó este enjuague fue de 10 días.
En la figura 7 se observa que de los 4 pacientes que recibieron el enjuague control, dos se detectaron cuando la mucositis estaba en grado 1 y los otros cuando estaba en grado 2. En uno de los casos que se detectó con grado 1, la mucositis se resolvió a los 3 días de uso del enjuague; en el otro caso se resolvió a los 6 días, al igual que en otro que se detectó con grado 2. Solo un paciente de grado 2 tuvo la resolución de su mucositis a los 9 días. El grado máximo de mucositis en los pacientes del grupo fue de 2 y su resolución promedio fue de 6 días, variando entre los 3 y los 9 días. Tres de estos pacientes estaban recibiendo protocolo al SNC y solo uno estaba en fase de consolidación.
La asignación al azar de la utilización del enjuague no permitió la estandarización del estado inicial del grado de mucositis. Al analizar si estas diferencias eran estadísticamente significativas, se aplicó la prueba no paramétrica de Kruskal-Wallis, debido a que la normalidad según el estadístico de Shapiro-Wilk, solo se presentó para el grupo C; el valor p para probar dichas diferencias fue 0,063; si se asume el tamaño pequeño de muestra, se puede considerar valor significativo a un nivel 0,1; al examinar entre cuáles tratamientos son las diferencias, se encontró que estas se daban principalmente entre el tratamiento con enjuague control y con sucralfato.
El primer abordaje estadístico intentó determinar diferencias al comparar los tres tipos de enjuague.
La tabla 2 muestra el comportamiento de la variable días de recuperación comparada en los tres diferentes enjuagues. Se observó que el tratamiento con enjuague en el grupo control parecía ser más corto y eficaz que con los otros enjuagues estudiados; sin embargo, al realizar las pruebas de comparación ANOVA se pudo ver que el p-valor 0,113 es mayor que el nivel de significancia considerado de 0,05, lo que conduce a concluir que no hay diferencias estadísticamente significativas entre el comportamiento de los tres enjuagues. Esta afirmación se puede verificar al hacer las pruebas de comparaciones múltiples post hoc. Sin embargo, solo la prueba LSD detecta una leve diferencia entre el Grupo T y el Grupo C, dado que el nivel de significancia es 0,043, menor que el nivel de comparación 0,05.
Para obtener los días de mucositis por paciente tabla 3 se consideró como numerador el número de días en severidad y enjuague dado, y como denominador el número de niños con dicha severidad y enjuague. Como se observa en la tabla 2, el comportamiento de los diferentes enjuagues no muestra tendencia clara: para la mucositis grado 1 el mejor fue el enjuague S, para la mucositis grado 2 no hay diferencias importantes entre los enjuagues S y C y, para la grado 3, el enjuague T se demoró más días en resolver la mucositis.
Lo anterior podría indicar diferencias significativas en la severidad, pero se considera que el tamaño muestral es pequeño y hace sensible la medición de cualquier dato extremo. Es importante aclarar que en grado de severidad 4 solo había un individuo con un enjuague, y no se pudo comparar con otros pacientes.
A estos datos se aplicaron pruebas de normalidad que arrojaron significancia de 0,637 para mucositis grado 1, 0 para grado 2 y 0,593 para grado 3. Aunque solo presentó valores para las severidades 1 y 3 se aplicó el análisis de varianza. El valor p obtenido en el ANOVA fue 0,524, lo que indica que no existen diferencias significativas en los días promedio con mucositis, según la severidad de esta. De forma similar se comparó la severidad y los días promedio por paciente en recuperarse y no se encontraron diferencias significativas en ningún grado de severidad. Es importante mencionar que este estudio se realizó en pacientes hospitalizados, algunos de los los diferentes enjuagues no muestra tendencia clara: para la mucositis grado 1 el mejor fue el enjuague S, para la mucositis grado 2 no hay diferencias importantes entre los enjuagues S y C y, para la grado 3, el enjuague T se demoró más días en resolver la mucositis. cuales ingresaron con mucositis en curso, por tanto no es posible detectar el día exacto de comienzo de la mucositis en todos los pacientes.
Para mirar la asociación entre el tipo de enjuague y la severidad de la mucositis se aplicó el test Chi-cuadrado. En este caso el valor p es mucho mayor que 0,05; por tanto, los enjuagues no tienen efecto significativo en la severidad de la mucositis. Debido al tamaño pequeño de la muestra se aplicó la prueba de Fisher y el valor p arrojado fue 0,1017; esto significa, igual que en las demás pruebas aplicadas, que no existe evidencia estadística de asociación entre el enjuague y la severidad de la mucositis en la población en estudio.
DISCUSIÓN
Bondi et al.6 mencionan la mucositis como la complicación oral más común en niños que reciben radioterapia y quimioterapia y, como lo mencionan algunos autores13, 17, 21, no hay un tratamiento efectivo que prevenga su aparición. Al igual que en los reportes de otros autores (Pereira et al.,21 Schmid et al.,13 Cheng, Molassiotis y Chang22), este estudio se llevó a cabo en niños que recibían tratamiento de quimioterapia y que presentaban mucositis oral, como efecto directo de las drogas citotóxicas en el epitelio y el tejido conectivo.
El porcentaje de pacientes en este estudio fue de 47% para sexo masculino y 53% para sexo femenino. Aunque la gran mayoría de los pacientes eran del departamento de Antioquia (71%), también había de otras regiones, ya que el HUSVP de Medellín es una institución de salud de tercer nivel y centro de referencia de pacientes de otros departamentos de Colombia. El promedio de edad de los pacientes investigados fue de 9 años, con rango entre los 3 y los 15 años; este rango de edad se seleccionó teniendo en cuenta que los pacientes tuvieran la capacidad de realizar los enjuagues.
Mucositis
Esta investigación recolectó muestras por un periodo de 32 meses durante los cuales se consiguieron catorce casos; inicialmente se proyectó recolectar la muestra durante un año, pero dado que el número de pacientes que cumplieron los requisitos establecidos para incluir en el estudio era muy pequeño, se extendió la recolección y aun así solo se consiguieron catorce casos. Otros autores también utilizaron muestras pequeñas como la investigación de Rutkauskas11 que reportó 13 casos, evaluando los efectos de los enjuagues con clorhexidina. Cheng22 reporta una muestra de 14 pacientes en quimioterapia, entre 6 y 17 años con diagnósticos de leucemia, linfoma o tumores sólidos pediátricos. En el presente estudio se buscó ser más estrictos en el criterio de selección de los pacientes, y solo se tuvo en cuenta a los diagnosticados con LLA, que presentaran mucositis y que estuvieran hospitalizados en el HUSVP, siendo esta una de las razones por las cuales la muestra resultó pequeña.
Como se pudo observar en las figuras 4, 5 y 6, y a pesar de ser estrictos en asignar al azar los enjuagues a los pacientes, no se pudo lograr la estandarización en la variable grado de severidad de la mucositis al inicio del tratamiento, para los tres grupos, mostrando diferencias significativas entre ellos. Por tanto, no es fácil comparar los efectos del enjuague en cada uno de los grupos, ya que los pacientes iniciaron con cuadros clínicos diferentes y se podría esperar que la evolución y resolución de la mucositis se diera, también, de forma diferente. Esta limitación para estandarizar muestras pequeñas, con diversos grados de mucositis se ha encontrado en otras investigaciones similares, como en el estudio de Laprinzi et al., realizado con sucralfato en 1997, en el cual tampoco se logró igualdad en el grado de mucositis inicial de la muestra.32 En el estudio de Cheng, el promedio de mucositis oral inicial en el grupo control fue mayor que el de mucositis oral en el grupo tratado, pero esta diferencia no fue estadísticamente significativa.2
Enjuagues
El presente estudio comparó los efectos de tres enjuagues, para el tratamiento de la mucositis oral. El primer enjuague empleado fue el Triconjugado, el cual ha sido muy utilizado para el tratamiento de la mucositis.12 Dodd et al.3 realizaron una investigación en la cual se aplicaron tres enjuagues bucales, entre ellos al Magic mouthwash (triconjugado) sin encontrar diferencias significativas entre ellos. Por su parte otros autores utilizan Nistatina como medicamento profiláctico contra las infecciones fúngicas31 generando controversia ya que el alto contenido de azúcar puede favorecer la colonización fúngica.3 Bondi et al.6, compararon los efectos del triconjugado más clorhexidina, con los efectos de una mezcla de anfotericina B, polimixina E, tobramicin y clorhexidina, encontrando que estadísticamente se disminuyó la severidad y duración de la mucositis, más en el grupo de medicamentos mezclados, que en el grupo con triconjugado. Epstein,40 en 2007, menciona que la difenhidramina, uno de los componentes del triconjugado, es un enjuague analgésico tópico, efectivo en el tratamiento de la mucositis, al igual que el hidróxido de aluminio, que actúa como agente protector de la mucosa. En la presente investigación, el comportamiento del triconjugado fue similar al de los demás enjuagues.
El otro enjuague estudiado fue el Sucralfato que también ha sido reportado como un medicamento exitoso en el tratamiento de la mucositis oral.4 Loprinzi32 evaluó a 131 pacientes, de los cuales 50 desarrollaron mucositis; 27 de estos fueron tratados con sucralfate y 23 con placebo y encontró que este podría ser benéfico en el tratamiento de la mucositis, ya que el 95% de los pacientes tratados mostraron mejoría en los signos y síntomas de las lesiones. Dichos hallazgos fueron también encontrados en un estudio de Barker et al.,17 que recomendó el sucralfato para el tratamiento de la mucositis oral, por la reducción de la sintomatología dolorosa. Como se mencionó anteriormente, tampoco se evidenciaron diferencias significativas entre el uso del sucralfato y los demás enjuagues.
Existen intentos por establecer protocolos específicos de manejo de la mucositis según el grado que se presente al momento de la detección. Puyal y colaboradores en 200320 establecen protocolos de manejo con múltiples medicamentos que incluyen el agua bicarbonatada y nistatina, clorhexidina, fluconazol, aciclovir, acetonido de fluocinolona, acetonido de triamcinolona e hidrocortisona, entre otros, e incluyen el cambio en el tiempo de aplicación de los medicamentos según el grado de mucositis del paciente. Ellos le dan gran importancia al estado de mucositis inicial para establecer el protocolo de manejo.
Aunque con los enjuagues estudiados (grupos T, S y C) se produjeron resultados similares en los pacientes, evidenciados por disminución de la sintomatología dolorosa y de las lesiones orales (según la clasificación de la OMS), y no hubo diferencias significativas entre los enguajes, sí es importante saber que con cualquiera de ellos, pueden mejorarse los síntomas de los pacientes que presentan mucositis, teniendo la posibilidad de elegir el que en un momento determinado presente mayor disponibilidad.
CONCLUSIONES
-
Ninguno de los enjuagues presentó mejores resultados que el otro. Por tanto, se puede utilizar cualquiera de ellos para el manejo de la mucositis oral.
-
Existen grandes limitaciones en la elaboración de investigaciones con patologías específicas como la LLA y tratamientos quimioterapéuticos estandarizados debido a la limitación en obtener una muestra amplia que permita inferir resultados concluyentes.
RECOMENDACIONES
-
Aumentar la muestra y compararla, con el fin de evaluar posibles diferencias entre los enjuagues utilizados. Se podría hacer incluyendo pacientes con diagnósticos clínicos diferentes como leucemia mieloide, linfomas, histiocitosis y otros.
-
Comparar en esta misma muestra, las otras variables cualitativas recolectadas, como tipo de quimioterapia recibida, índice de higiene oral, recuento leucocitario, entre otros.
-
Utilizar enjuagues diferentes, nuevos en el medio, tales como la vitamina E, el noni, la camomila, clorhexidina, etc.
-
Iniciar el estudio en pacientes con el mismo grado de mucositis para poder comparar la evolución de la misma.
-
Detectar la mucositis en todos los pacientes en el grado I.
REFERENCIAS BIBLIOGRÁFICAS
1. Piñeros MP, Pardo C, Cantor LF, Hernández G, Martínez T, Pérez N et al. Registro institucional de cáncer del Instituto Nacional de Cancerología, empresa social del Estado. Principales resultados, año 2001. Rev Col Cancerol 2002; 6(3): 4-49. [ Links ]
2. Little JW, Falace DA, Millar CS, Rhodus N L. Tratamiento odontológico del paciente bajo tratamiento médico. 5. a ed Madrid: Harcourt Brace; 1998. [ Links ]
3. Dodd MJ, Dibble SL, Miaskowski C, MacPhail L, Greenspan D, Paul SM et al. Randomized clinical trial of the effectiveness of 3 commonly used mouthwashes to treat chemotherapy-induced mucositis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000; 90(1): 39-47. [ Links ]
4. Caribé F, Chimenos E, López J, Finestres F, Guix B. Manejo odontológico de las complicaciones de la radioterapia y quimioterapia en el cáncer oral. Med Oral 2003; 8(3): 178-187. [ Links ]
5. Ferretti GA, Raybould TP, Brown AT, McDonald JS, Greenwood M, Maruyama Y et al. Chlorhexidine prophylaxis for chemotheraphy and radiotheraphy induced stomatitis: a randomized double-blind trial. Oral Surg Oral Med Oral Pathol 1990; 69(3): 331-338. [ Links ]
6. Bondi E, Baroni C, Prete A, Gatti M, Carrassi A, Lodi G, et al. Local antimicrobial therapy of oral mucositis in paediatric patients undergoing bone marrow transplantation. Oral Oncol 1997; 33(5): 322-326. [ Links ]
7. Nathan and Oski´s. Hematology of Infancy and Childhood. 6.a ed USA: Saunders; 2003. [ Links ]
8. Pui CH, Crist W. Acute lymphoblastic leukemia. En: Pui CH. Childhood leukemias. USA: Cambridge University Pres; 1999. p. 288-303. [ Links ]
9. Little JW. Discrasias sanguíneas. En: Little JW. Tratamiento odontológico del paciente bajo tratamiento medico. 5.a ed. España: Harcourt Brace; 1998. p. 495-515. [ Links ]
10. Ávila A, Cardona AF, Perea AH. Fisiopatología, prevención y tratamiento de la mucositis oral inducida por quimioterapia y radioterapia. Rev Col Cancerol 2000; 4 (1): 36-51. [ Links ]
11. Rutkauskas JS, Davis JW. Effects of chlorhexidine during immunosuppressive chemotherapy. Oral Surg Oral Med Oral Pathol 1993; 76(4): 441-448. [ Links ]
12. Quinn B, Stone R, Uhlenhopp M, McCann S, Blijlevens N. Ensuring accurate oral mucositis assessment in the European group for blood and marrow transplantation prospective oral mucositis audit. Eur J Oncol Nurs 2007; 11 Suppl 1: S10-18. [ Links ]
13. Schmid I, Schmitt M, Streiter M, Meilbeck R, Albert M, Reihardt D, Stachel D. Parenteral nutrition is not superior to replacement fluid therapy for the supportive treatment of chemotherapy induced oral mucositis in children. Eur J Cancer 2006; 42(2):205-211. [ Links ]
14. Napeñas JJ, Brennan MT, Mougeot FK, Fox PC, Lockhart PB. Relationship between mucositis and changes in oral microflora during cancer chemotherapy. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007; 103(1): 48-59. [ Links ]
15. Fayle SA, Curzon M. Oral complications in pediatric oncology patients. Pediatric Dent 1991; 13(5): 289-295. [ Links ]
16. Barach A, Peterson DE. Risk factors for ulcerative oral mucositis in cancer patients: unanswered questions. Oral oncol 2003; 39(2): 91-100. [ Links ]
17. Barker G, Loftus L, Luddy P, Barrer B. The effects of sucralfato suspension and diphenhidramine syrup plus kaolin-pectin on radiotheraphy-induced mucositis. Oral Surg Oral Med Oral Pathol 1991; 71(3): 288-293. [ Links ]
18. Solabarrieta MA, Villanueva SM. Cuidados de la mucositis. Pacientes con quimioterapia. Rev Rol Enferm 2002; 25(5):69-74. [ Links ]
19. Nelson L, Pliskin ME. Consideraciones odontológicas en niños con leucemia. Compend Edu Cont de Odontología. Edición en español para Latinoamérica. 1985; 1(7): 15-21. [ Links ]
20. Puyal M, Jiménez C, Chimenos E, López J, Juliá A. Protocolo de estudio y tratamiento de la mucositis bucal en los pacientes con hemopatías malignas. Med Oral 2003; 8(1):10-18. [ Links ]
21. Pereira Pinto L, de Souza LB, Gordon-Núñez MA, Soares RC, de Brito Costa EM, de Aquino AR, Fernandes MZ. Prevention of oral lesions in children with acute lymphoblastic leucemia. Int J Pediatr Otorhinolaryngol 2006; 70(11): 1847-1851. [ Links ]
22. Cheng KKF, Molassiotis A, Chang AM. An oral care protocol intervention to prevent chemotherapy-induced oral mucositis in paediatric cancer patients: a pilot study. Eur J Oncol Nurs 2002; 6(2): 66-73. [ Links ]
23. Ikebe T, Seki K, Nakamura S, Takenoshita Y, Nakayahma H, Shinohara M et al. Severity of oral mucositis correlates with the response of oral cancer to preoperative radiochemotherapy. Int J Oral Maxillofac Surg 2005; 34(6): 642-645. [ Links ]
24. Mata de Hening M. Factores determinantes de patogenicidad en relación a la ecología de Cándida albicans en cavidad oral. Acta Odontol Venez 2001; 39(2): 55-59. [ Links ]
25. Eilers J, Million R. Prevention and management of oral mucositis in patients with cancer. Semin Oncol Nurs 2007;23(3): 201-212. [ Links ]
26. Alberth M, Majoros L, Kovalecz G, Borbás E, Szegedi I, Marton I, Kiss C. Significance of oral candida infections in children with cancer. Pathol Oncol Res 2006; 12 (4): 237-241. [ Links ]
27. Sardella A, Uglietti D, Demarosi F, Lodi G, Bez C, Carrassi A. Benzydamine hydrochloride oral rinses in management of burning mouth syndrome. Oral Surg Oral Med Oral Pathol Radiol Endod 1999; 88(6): 683-686. [ Links ]
28. T erezhalmy GT, Whitmyer CC, Marckman M. Cancer chemotherapeutic agents. Dent Clin Nort Am 1996; 40(3):709-726. [ Links ]
29. Flaitz CM, Baker KA. Treatment approaches to common symptomatic oral lesions in children. Dent Clin North Am 2000; 44(3): 671-696. [ Links ]
30. Wahlin YB. Effects of chlorhexidine mouthrinse on oral health in patients with acute leukemia. Oral Surg Oral Med Oral Pathol 1989; 68 (3): 279-287. [ Links ]
31. Epstein JB, Vickars L, Spinelli J, Reece D. Efficacy of chlorhexidine and nystatin rinses in prevention of oral complications in leukemia and bone marrow transplantation. Oral Surg Oral Med Oral Pathol 1992; 73(6): 682-689. [ Links ]
32. Loprinzi CL, Ghosh C, Camoriano J, Sloan J, Steen PD, Michalak JC et al. Phase III controlled evaluation of sucralfato to alleviate stomatitis in patients receiving fluoracil-based chemotherapy. J Clin Oncol 1997; 15(3): 1235-1238. [ Links ]
33. Wadleigh RG, Redman RS, Graham ML, Krasnow SH, Anderson A, Cohen MH. Vitamin E in the treatment of chemotherapy-induced mucositis. Am J Med 1992; 92(5): 481-484. [ Links ]
34. Sonis ST. Mucositis as a biolical process: a new hypothesis for the development of chemotherapy- induced stomatotoxicity. Oral Oncol 1998;34(1): 39-43. [ Links ]
35. Hernández GA, Olivar A, Torres MH. Guías de manejo en estomatología pediátrica. Bogotá: ECOE editores; 1998. [ Links ]
36. T en cate´s AN. Oral Mucosa. En: Oral hystology, Development, structure and function. 7.a ed. Canada: Mosby; 2008. p. 319-357. [ Links ]
37. Carl W. Tratamiento de las manifestaciones orales en la terapia del cáncer, parte II: quimioterapia. Artículo 7: de educación continua. 1989; V(5): 37-45. [ Links ]
38. Ramírez-Amador V, Esquivel-Pedraza L, Mohar A, Reynoso- Gómez E, Volkow-Fernández P, Guarner J, Sánchez- Mejorada G. Chemotherapy-associated oral mucosal lesions in patients with leukaemia or lymphoma. Eur J Cancer Oral Oncol 1996; 32B (5):322-327. [ Links ]
39. Epstein JB, Ransier A, Lunn R, Chin E, Jacobson J, Reece D, Arbor A. Prophylaxis of candidiasis in patients with leukaemia and bone marrow transplants. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1996;81(3):291-296. [ Links ]
40. Epstein JB. Mucositis in the cancer patient and immunosuppressed host. Infect Dis Clin North Am 2007;21(2): 503-522. [ Links ]
RECIBIDO: FEBRERO 26/2008 - ACEPTADO: ABRIL 21/2009
Cómo citar este artículo:
Barbosa DM, Bernal LV, Gallego C, Sierra ME. Comparación de los efectos de tres enjuagues en el manejo de la mucositis oral secundaria al tratamiento de leucemia linfoblástica aguda en niños. Rev Fac Odontol Univ Antioq 2009; 20(2): 179-190.
Barbosa DM, Bernal LV, Gallego C, Sierra ME. Comparison of the effects of three mouth rinses in the management of oral mucositis secondary to the treatment of acute lymphoblastic leukemia in children. Rev Fac Odontol Univ Antioq 2009; 20(2): 179-190.