Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad de Odontología Universidad de Antioquia
Print version ISSN 0121-246X
Rev Fac Odontol Univ Antioq vol.21 no.2 Medellín Jan./June 2010
ARTÍCULOS ORIGINALES DERIVADOS DE INVESTIGACIÓN
Estudio comparativo de implantes de superficie lisa y rugosa. Resultados a 36 meses1
Machined versus rough surface implants, a clinical study. 36-month follow-up
Jorge Alberto Arismendi2; Ana Lucía Mesa3; Luz Piedad García4; Juan Fernando Salgado5; Catalina Castaño6; Richard Mejía7
1 Trabajo de grado presentado como requisito para optar al título de especialistas en Odontología Integral del Adulto, énfasis en Prostodoncia y Periodoncia. Facultad de Odontología, Universidad de Antioquia. 2009. Este trabajo contó con financiación parcial de Lifecore Biomedical Inc. Con la donación de los implantes y elementos protésicos
2 Director de grado. Especialista en Odontología Integral del Adulto, Facultad de Odontología, Universidad de Antioquia. Profesor Asociado, Vicedecano, Facultad de Odontología, Universidad de Antioquia, Medellín, Colombia. Correo electrónico: jorgearismendi@une.net.co
3 Odontóloga, especialista en Odontología Integral del Adulto. Facultad de Odontología, Universidad de Antioquia. Práctica privada en periodoncia e implantes, Medellín, Colombia
4 Odontóloga, estudiante de VI semestre del posgrado Odontología Integral del Adulto, énfasis en Prostodoncia, Facultad de Odontología, Universidad de Antioquia
5 Odontólogo, estudiante de VI semestre del posgrado Odontología Integral del Adulto, énfasis en Periodoncia, Facultad de Odontología, Universidad de Antioquia
6 Odontóloga, especialista en Odontología Integral del Adulto, énfasis en Periodoncia. Profesora asistente, pre- y posgrado. Facultad de Odontología, Universidad de Antioquia
7 Odontólogo, especialista en Odontología Integral del Adulto, énfasis en Prostodoncia. Profesor asistente, pre- y posgrado. Facultad de Odontología, Universidad de Antioquia
RESUMEN
INTRODUCCIÓN: la estabilidad primaria es esencial para una oseointegración ideal y depende de las características micro- y macroscópicas del implante. Las características superficiales de un implante influyen de manera importante en la respuesta clínica en términos de oseointegración y sus resultados deben evaluarse a largo plazo. En la literatura se discute sobre los beneficios de utilizar implantes de superficie rugosa para mejorar la oseointegración. El objetivo de este estudio fue evaluar la oseointegración de dos grupos de implantes, uno de superficie lisa o maquinada y otro de superficie rugosa o modificada.
MÉTODOS: se efectuó seguimiento clínico y radiográfico a 12, 24 y 36 meses a dos grupos de implantes de conexión externa, tipo tornillo, de la casa comercial Lifecore®, uno con 30 implantes de superficie lisa (SuperCAT®) y otro con 30 implantes de superficie rugosa (RBM®). Las mediciones a 12, 24 y 36 meses de función fueron comparadas entre sí para determinar el comportamiento de la cresta ósea marginal utilizando la plataforma del implante como referencia.
RESULTADOS: en los implantes de superficie lisa a los 24 y 36 meses, la pérdida promedio de altura de la cresta ósea fue 1,5mm. En los implantes de superficie rugosa a los 24 meses la pérdida ósea promedio fue 1,4mm, y a los 36 meses fue 1,5mm en promedio.
CONCLUSIONES: el seguimiento clínico y radiográfico de dos grupos de implantes con superficies diferentes no presentó diferencias estadísticamente significativas en cuanto a las variables evaluadas, para casos de restauración de diente único sobre implantes.
Palabras clave: oseointegración, implantes, titanio.
ABSTRACT
INTRODUCTION: the implant surface affects the clinical response in terms of osseointegration and should be evaluated in the long term. In the last years, literature has strongly recommended the use of modified surface implants, in order to improve osseointegration. The primary stability is essential to obtain osseointegration and it depends on the micro and macro characteristics of the implant and bone structure. The usage of active surfaces is an advantage, but it does not modify the bone density. The aim of this study is to undertake a clinical and radiographic evaluation between two different groups of implants, machined versus modified surfaces.
METHODS: a 24 to 36 months clinical and radiographic follow-up was done to two groups of Lifecore® implants, one group with 30 machined implants (Super CAT®), and the other one with 30 modified surface (RBM®) external hex connection and screw type implants. Measurements were taken to determine the bone crest behavior using the implant platform as reference at 24-36 months of function and were compared with the 12 months measurements.
RESULTS: in machined implants at 24-36 months, the average marginal bone loss was 1.5 mm. In modified surface implants at 24 months, the average marginal bone loss was 1.4 mm, and at 36 months, the loss was 1.5 mm.
CONCLUSIONS: there are no statistical significant differences between the two groups of machined and modified implant surface, for single tooth restoration, as it relates to clinical and radiographic follow up.
Key words: osseointegration, implants, titanium.
INTRODUCCIÓN
Cada paciente que recibe un tratamiento tiene el derecho de conocer los beneficios y riesgos potenciales del procedimiento así como una predicción del servicio útil del implante1
El medio ambiente médico y social de hoy requiere que nuestras decisiones estén basadas no solo en el reconocimiento de los problemas del paciente y la experiencia y preferencias del clínico, sino también en los datos válidos de la investigación actual.2 Las decisiones basadas en la evidencia han hecho énfasis en que los resultados proporcionados por la investigación no son suficientes para tomar una conducta clínica. Esta evidencia por sí misma no provee herramientas para definir lo que se debe hacer en una situación individual, pero sí suministra información útil que facilita la toma de decisiones con mayor criterio.2
El uso clínico de los implantes de titanio en pacientes totalmente edéntulos, parcialmente edéntulos y para el reemplazo de diente único ha sido bien documentado. Existen estudios3-5 que reportan alta tasa de éxito a largo plazo; sin embargo, estos estudios no cuentan con muestras significativas y, dado que este tipo de dispositivos son considerados una terapia de largo plazo, su eficacia debe ser evaluada en períodos de tiempo suficientes para poder determinar los resultados de esta terapéutica. Por lo anterior se requiere un soporte científico razonable que respalde las decisiones clínicas acerca de la pertinencia del uso de los diferentes sistemas de implantes presentes actualmente en el mercado; en concordancia con esta afirmación la tendencia es realizar estudios clínicos aleatorios a largo plazo con muestras significativas, minimizando los errores sistemáticos.
La topografía superficial del implante es uno de los parámetros que se debe evaluar en el seguimiento a largo plazo y que influye de manera importante sobre la respuesta clínica en términos de oseointegración. En los últimos años ha cobrado gran fuerza en la literatura la discusión sobre los beneficios de utilizar implantes de superficie rugosa para lograr mejor oseointegración. La superficie rugosa permite mayor superficie de contacto e histológicamente representa mayor estímulo para la osteogénesis alrededor del implante. Los estudios histológicos6 han reportado mayor porcentaje de contacto óseo alrededor de implantes rugosos comparados con implantes de superficie lisa y se recomienda la utilización de estos en situaciones de baja calidad y cantidad de reborde óseo.
La estabilidad primaria es esencial para lograr oseointegración ideal y depende de las características micro- y macroscópicas del implante, así como de la estructura ósea. Los implantes con superficie modificada muestran mayor anclaje inicial en hueso y mayor porcentaje de contacto óseo que los implantes de superficie maquinada.6 Reportes con microscopía de luz muestran el contacto directo hueso-implante y la evaluación cuantitativa demuestra diferencias en la cantidad de hueso en la interfase, de acuerdo con las modificaciones de las superficies de los implantes.7 El uso de una superficie activa es ciertamente una ventaja pero no modifica la densidad del hueso, por lo que se debería esperar alta tasa de fracaso con cualquier tipo de implante colocado en hueso de muy baja densidad.6
Los diferentes tratamientos sobre los implantes alteran las características superficiales (composición, rugosidad y energía) y pueden tener implicaciones en la actividad clínica. Los estudios deben evaluar el efecto de estas diferencias sobre las interacciones biológicas.8 Considerando las variaciones en el patrón de fracaso que presentan diversos sistemas de implantes con superficies modificadas en el tiempo, es probable que las características de superficie de los implantes tengan importancia en el resultado final.9 Aunque son importantes y necesarios todos estos estudios para la evaluación ultraestructural de la interfase hueso-implante, ellos ofrecen poca ayuda para el juicio clínico de éxito en la oseointegración. 10
La Asociación Dental Americana (ADA) sugiere un reporte de mínimo dos estudios clínicos independientes con duración de 5 años, tasa de éxito de 85% y tamaño de muestra de 50 pacientes. Para una aceptación provisional la misma entidad exige datos clínicos de dos estudios independientes con seguimiento a tres años.1, 11-13 La conveniencia de los estudios independientes está basada en los cuestionamientos manifestados por el Consejo de Asuntos Científicos de la ADA acerca de la falta de estandarización entre los fabricantes de implantes en asuntos referentes a materiales, terminado de la superficie, tratamiento de la superficie, porosidad, técnicas quirúrgicas y otros factores que influyen en su desempeño clínico.13
El objetivo de este estudio fue hacer una comparación entre dos tipos de implantes, superficie lisa y superficie rugosa, para evaluar su comportamiento clínico y radiográfico a tres años, y determinar si existen diferencias estadísticamente significativas.
MÉTODOS
Se realizó un estudio de tipo experimental, comparativo y prospectivo. Los pacientes que hicieron parte de este proyecto de investigación participaron en la investigación “Evaluación clínica y radiográfica de implantes oseointegrados de superficie lisa y rugosa. Estudio prospectivo”.14 La muestra de la investigación fue intencional y comprendió 60 implantes que fueron instalados en pacientes con necesidad de restauración de diente único. Posteriormente se efectuaron revisiones a los 12, 24 y 36 meses después de la colocación de la restauración protésica.
Se tomaron radiografías periapicales con técnica paralela utilizando un posicionador Rinn® (XCP® Instruments, Elgin, IL) junto con la guía acrílica de cada paciente empleada para la evaluación inicial a 12 meses. Las radiografías fueron tomadas por el mismo operador con un equipo de rayos X Trophy CCX Digital® (f = 3, 70 kV, 8 mA), la película que se utilizó fue la Ektachrome Asa 100 y fue procesada en un equipo de revelado automático Air Techniques®. Posteriormente las radiografías fueron digitalizadas mediante el sistema de escáner Nikon (Coolscan IV ED®) y transferidas al programa Axiovisión 3.1 para el análisis de los cambios posicionales de la cresta ósea mesial (CM) y distal (CD) respecto a la plataforma del implante. El operador que tomó las radiografías y realizó las mediciones desconocía el tipo de superficie que estaba evaluando, buscando con ello configurar doble ciego en el estudio.
Teniendo en cuenta que los cambios posicionales de las crestas óseas mesial y distal se evaluaron a 12, 24 y 36 meses, se adoptaron las siguientes convenciones con el fin de diferenciar el comportamiento de cada una de las crestas óseas según el periodo de tiempo así:
-
CM1: cresta ósea mesial a 12 meses.
-
CM2: cresta ósea mesial a 24 meses.
-
CM3: cresta ósea mesial a 36 meses.
-
CD1: cresta ósea distal a 12 meses.
-
CD2: cresta ósea distal a 24 meses.
-
CD3: cresta ósea distal a 36 meses.
Cada implante fue llevado a una de las siguientes categorías: no contados (implantes que no se han revisado por cualquier razón), fracaso (implantes que han sido removidos) y sobrevivientes. Posteriormente se realizó un análisis cuantitativo de los resultados utilizando una tabla de cuatro campos, con la cual se determinó la tasa de éxito, de acuerdo con lo propuesto por Roos y colaboradores (1997).15 Para cumplir con los objetivos, inicialmente se evaluó si las variables cuantitativas (CM1, CM2, CM3, CD1, CD2 y CD3), cumplían los supuestos de normalidad y homocedasticidad (homogeneidad de varianzas), pruebas de Shapiro-Wilks y Levine, respectivamente. Como no fue así, se utilizó inicialmente la prueba no paramétrica de Friedman y luego la Prueba de Wilcoxon para estimar si existían diferencias estadísticamente significativas entre los diferentes periodos en cada una de las variables. Para verificar si existían diferencias por sexo y por tipo de superficie se utilizó la prueba U de Mann-Whitney. Se trabajó con el nivel de significancia a=0,05.
RESULTADOS
El presente estudio reporta el comportamiento clínico y radiográfico a los 12, 24 y 36 meses de seguimiento, de las crestas óseas mesial y distal de 60 implantes de superficie lisa y rugosa, correspondientes a 49 pacientes. Los datos iniciales utilizados para establecer la comparación se obtuvieron de la investigación “Evidencia de cambios clínicos y radiográficos en implantes óseointegrados de superficie maquinada y modificada, 3-12 meses de seguimiento” publicada anteriormente.14 En dicha investigación se instalaron 60 implantes que correspondieron a 49 pacientes, 27 de ellos mujeres (55,1%) con promedio de edad 38,5 años, y 22 hombres (44,9%) con edad promedio de 41,5 años (tabla 1).
Las evaluaciones radiográficas de control se hicieron de la siguiente manera:
-
A los 12 meses se evaluaron los 60 implantes.
-
A los 24 meses se evaluaron 57 implantes. Los 3 restantes corresponden a pacientes que no fue posible localizar, con implantes de superficie rugosa (tabla 2).
-
A los 36 meses se evaluaron 51 implantes. Los 9 restantes que no fueron evaluados se relacionan así: 1 implante de superficie lisa perdido en accidente de tránsito, 1 implante de superficie lisa retirado por pérdida de oseointegración, 1 implante de superficie lisa en paciente en estado de embarazo y 6 pacientes con implantes de su perficie rugosa que no fue posible localizar (estos incluyen los 3 pacientes que no fueron evaluados en el período de 24 meses) (tabla 3).
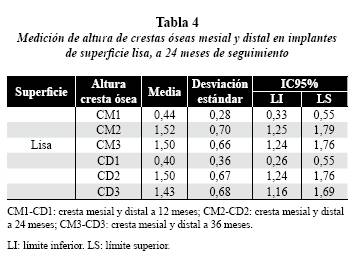
En los implantes de superficie lisa, en la evaluación a los 24 meses la distancia de la cresta ósea a la plataforma se ubicó en promedio a 1,5 mm en la cresta ósea mesial (CM2) (IC95%: 1,25-1,79) y 1,5 mm en la cresta ósea distal (CD2) (IC95%: 1,24-1,76) y, a los 36 meses (figuras 1A y B), la cresta ósea mesial (CM3) se conservó estable, ubicándose a una distancia promedio de 1,5 mm (IC95%: 1,24–1,76); la cresta ósea distal (CD3) se situó a una media de 1,4 mm (IC95%: 1,16–1,69). (tabla 4).
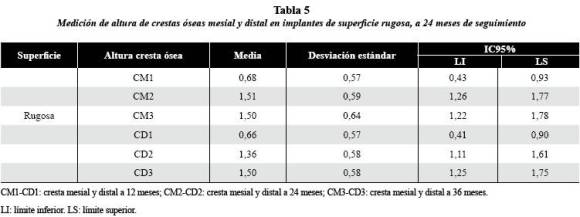
Referente a los implantes de superficie rugosa, los resultados a los 24 meses, establecieron un promedio de 1,5 mm en la cresta ósea mesial (CM2) (IC95%: 1,26-1,77) y 1,3 mm en la cresta ósea distal (CD2) (IC95%: 1,11-1,61). A 36 meses (figuras 1B y C), la cresta ósea mesial (CM3) conservó media de 1,5 mm (IC95%: 1,22-1,78); y la cresta ósea distal (CD3) se ubicó a 1,5 mm en promedio (IC95%: 1,25-1,75) (tabla 5).
El gráfico 1 permite ver el comportamiento de la cresta ósea mesial en los implantes de superficie lisa y rugosa en los distintos períodos evaluados. Hubo incremento estadísticamente significativo (p < 0,05) entre los períodos CM1-CM2 y CM1- CM3; en el período CM2-CM3 el nivel de la cresta ósea se mantuvo estable, sin representar diferencia estadísticamente significativa. Con respecto al tipo de superficie, no hubo diferencia estadísticamente significativa (p > 0,05) en ninguno de los períodos.
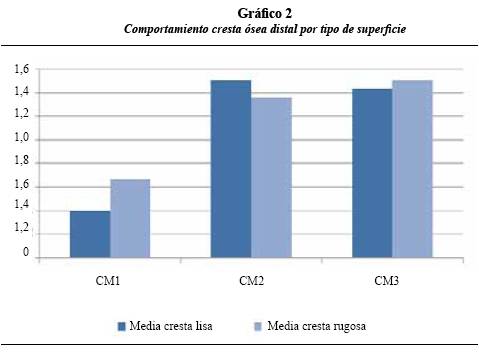
El gráfico 2 permite apreciar el comportamiento de la cresta ósea distal en los implantes de superficie lisa y rugosa, con incremento estadísticamente significativo (p < 0,05) entre los períodos CD1- CD2 y CD1-CD3; entre CD2 y CD3 el nivel de la cresta ósea se mantuvo estable, sin representar diferencia estadísticamente significativa. Con respecto al tipo de superficie, no hubo diferencia estadísticamente significativa (p > 0,05) en ninguno de los períodos.
Debido a que las variables cuantitativas CM1, CM2, CM3, CD1, CD2 y CD3 no cumplían con el supuesto de normalidad, se efectuaron pruebas no paramétricas con el propósito de establecer si existían diferencias al comparar las variables entre los diferentes periodos de seguimiento. La prueba U de Mann-Whitney no mostró diferencias estadísticamente significativas entre las medias de las diferentes variables por tipo de superficie (lisa y rugosa), valores p > 0,05 (tabla 6).
La prueba de Friedman mostró que existía diferencia estadísticamente significativa en la media de la variables entre los períodos de observación de las crestas óseas, valor p = 0,000. La prueba de Wilcoxon indicó que estas diferencias se presentaban entre las medias de: CM 2-CM 1 (valor p = 0,000), CM3-CM 1 (valor p = 0,000); CD 2-CD 1 (valor p = 0,000) y CD3-CD 1 (valor p = 0,000) (tablas 7 y 8).
Clínicamente no se reportaron eventos adversos en ninguno de los implantes en ambos grupos durante las revisiones realizadas.
DISCUSIÓN
Uno de los criterios para evaluar el éxito del tratamiento con implantes ha sido la pérdida ósea radiográfica. Basados en este parámetro, varios autores han propuesto un límite de 1,5 mm de pérdida ósea alrededor de implantes oseointegrados exitosamente durante el primer año de carga y un límite para los siguientes años de 0,2 mm.14, 15, 16 Recientemente la Conferencia Consenso del Congreso Internacional de Implantólogos Orales17 aprobó cuatro categorías clínicas que definen las condiciones de éxito, supervivencia y fracaso de los implantes dentales; en dicho consenso se estableció que un implante se clasifica en grupo de éxito cuando cumple las siguientes condiciones: ausencia de dolor a la palpación, percusión o función, sin movilidad clínica en cualquier dirección, ausencia de exudado y pérdida ósea marginal radiográfica menor de 2 mm.
En este sentido se puede considerar que los implantes de superficie lisa y rugosa evaluados en este trabajo se clasifican en la categoría de éxito. A los 12 meses los implantes de superficie lisa con carga funcional presentaron pérdida ósea promedio de 0,4 mm; mientras que a los 24 y 36 meses la pérdida promedio de altura de la cresta ósea fue de 1,5 mm, es decir, que se presentó incremento en la pérdida de altura de la cresta ósea entre los 12 y 24 meses, con estabilización de la altura de la cresta ósea entre los dos últimos períodos. Igualmente los implantes de superficie rugosa con carga funcional a los 12 meses demostraron pérdida ósea promedio de 0,6 mm. A los 24 meses dicha pérdida incrementó en promedio 1,4 mm, y a los 36 meses se aumentó ligeramente a 1,5 mm en promedio.
Los resultados sobre la pérdida ósea ocurrida en trece estudios18 que evalúan el comportamiento de implantes del sistema Brånemark después del primer año de carga funcional muestran que la pérdida ósea se encuentra entre 0,4 y 1,6 mm con promedio de 0,93 mm. Los resultados obtenidos en esta investigación en cuanto a pérdida de altura de la cresta ósea en implantes dentales de superficie lisa y rugosa, se ubican en el intervalo anterior y permiten determinar que no hay diferencias estadísticamente significativas entre los dos grupos luego de 24 y 36 meses de seguimiento. Este comportamiento corrobora lo que la literatura ha reportado como el límite de adaptación biomecánica del tejido óseo marginal.19 Es importante anotar que la referencia de implante de superficie modificada por medio de arenado con un medio reabsorbible (RBM®) utilizado en este estudio presenta en su diseño una superficie maquinada en las tres primeras roscas del implante.
Los sistemas de implantes dentales disponibles actualmente presentan diferentes tipos de tratamiento de superficie para maximizar el contacto huesoimplante. Los estudios demuestran que la principal ventaja de los tratamientos de superficie radica en una fase de cicatrización más rápida y una migración selectiva de las células hacia la superficie del implante, cuando se comparan con la maquinada.20, 21 Reportes histológicos22 han descrito que a los dos meses el porcentaje de contacto hueso-implante con superficie de grabado ácido incrementa 39,14%, mientras que el contacto hueso-implante en superficie lisa disminuye 44,7% lo que indica pérdida de contacto hueso-implante en los primeros dos meses; se aclara que en los implantes de superficie rugosa el hueso se encuentra entre las roscas con características de hueso reticular delgado, mientras que en los implantes de superficie lisa el hueso se halla contactando las puntas de la roscas. Otro punto de vista histológico indica que aunque los implantes de superficie rugosa demostraron una respuesta ósea significativamente mayor que los implantes de superficie lisa, la significancia clínica en este sentido requiere evaluación en estudios prospectivos a largo plazo.23 En este mismo sentido, un análisis histométrico24 del contacto hueso-implante mostró diferencias entre superficie lisa y rugosa a favor de esta última en ausencia de carga, lo que sugirió que el crecimiento óseo sobre la superficie lisa es más lento comparado con la superficie rugosa; sin embargo, en presencia de carga no se encontraron diferencias significativas entre ambos tipos de superficie. El autor fue enfático al afirmar que las células responden a la microtopografía de la superficie de forma mecánico-dependiente, esto quiere decir que la carga controlada adecuadamente acelera la oseointegración, atenuando de esta forma la influencia de la microtopografía superficial. Otros estudios coinciden con la anterior afirmación al manifestar que la carga del implante no afecta la formación ósea en ausencia de superficie rugosa, sin desconocer el efecto estimulante que representa la superficie rugosa cuando se carga el implante.25, 26
Una revisión de literatura27 recopila los resultados de los estudios de cinco tipos de superficies de implantes dentales. En esta publicación las investigaciones evaluaron implantes de superficie TiUnite, SLA, Osseotite, Frialit-2, Tioblast y Osseospeed y se comparó su sobrevivencia con la de los implantes maquinados. La evaluación en un reporte clínico a dieciocho meses con la superficie TiUnite (oxidación anódica electroquímica) muestra una tasa de sobrevivencia del 99,1%. Cuando se compara TiUnite con implantes maquinados se observa una tasa de supervivencia de 95,5 85,5%, respectivamente, en un período de un año. El seguimiento clínico a tres años para evaluar la superficie SLA (arenado y grabado ácido) reporta tasa de éxito del 99% en 104 implantes. En un estudio comparativo entre 68 implantes de superficie SLA con 68 implantes de superficie TPS (rociado con plasma de titanio) cargados a 6 meses no se observan diferencia en cuanto a la sobrevivencia. Para analizar el comportamiento de implantes de superficie Osseotite (grabado con ácido sulfúrico y ácido clorhídrico) se reportan tasas de sobrevivencia y de éxito entre el 95 y 99% en un período de seis años. Por otra parte, al evaluar la tasa se sobrevivencia de implantes de superficie Frialit-2 (arenado y grabado ácido) a cinco años se observa del 96 al 97%. Finalmente, en esta revisión se observó que durante un seguimiento a diez años con 199 implantes de la superficie Tioblast y Osseospeed (lisa y rugosa con rocío de plasma de titanio) la tasa de sobrevivencia fue del 96,9%. Con esta revisión los autores pretenden confirmar la estabilidad de los implantes dentales de superficies alteradas evaluando la tasa de sobrevivencia. Sin embargo si se compara con implantes maquinados no es posible obtener diferencias estadísticamente significativas que demuestren la superioridad de una superficie frente a la otra.
Una revisión sistemática con estudios clínicos en humanos con diferentes superficies de implantes dentales muestra en sus resultados que los implantes de superficies modificadas ofrecen ventajas significativas comparados con aquellos de superficies maquinadas, especialmente en hueso de poca calidad.28 Al observar los resultados obtenidos en este estudio se puede afirmar que durante el seguimiento efectuado a 24 y 36 meses el comportamiento clínico y radiográfico es similar al comparar ambas superficies. Un reporte parcial a dos años de un estudio cuyo objetivo era documentar las diferencias entre superficie maquinada y rugosa respecto a tasas de supervivencia y pérdida ósea marginal encontró una tasa acumulada de éxito del 97,7% y promedio de pérdida ósea de 0,14 mm en el maxilar y 0.29 mm en la mandíbula sin considerar el tipo de implante. Aunque no se pudieron establecer diferencias estadísticamente significativas respecto a la pérdida ósea marginal o supervivencia de los implantes entre ambos tipos de superficie, los autores expresaron que la superficie rugosa puede ofrecer algunas ventajas relacionadas con el torque reverso y el mayor contacto hueso-implante, cualidades que pueden ser benéficas en casos de pacientes con cantidad y calidad ósea reducida.29
Una comparación de dos sistemas de implantes con diferentes superficies en un modelo de boca dividida, con dos años de seguimiento, no halló diferencias significativas en el nivel óseo marginal. La tasa de supervivencia fue del 100% para los implantes de superficie rugosa y del 97,7% para los implantes de superficie lisa sin diferencias estadísticamente significativas. Los autores no cuestionaron las ventajas de la superficie rugosa, pero manifestaron preocupación cuando estos implantes son expuestos a la cavidad oral porque acumulan más placa bacteriana, con la posibilidad de mayor inflamación gingival y daño óseo marginal.30
En un estudio clínico aleatorizado controlado, a cinco años, se demostró que la pérdida ósea durante el primer año en función, así como los siguientes años, fue pequeña y no varió al comparar implantes con superficie lisa y rugosa. El 78% de los implantes de superficie lisa y el 73% de los implantes con superficie rugosa tuvieron menos de 1 mm de pérdida ósea como reporte final.31
La literatura sobre implantes dentales es clara cuando afirma que el factor local más importante para el éxito en el tratamiento es la cantidad y calidad de hueso en el sitio del implante. De este modo, si la topografía superficial de los implantes pudiera ser un factor que supere las deficiencias en la cantidad y la calidad ósea en casos individuales, esta característica podría ser crítica en el momento de seleccionarlo.32 Lo anterior puede respaldar la hipótesis que en casos de calidad ósea favorable, el tipo de superficie del implante tiene un papel secundario,27, 33 y a pesar del efecto positivo que tiene la superficie rugosa en los huesos de mala calidad, todavía falta por demostrar la prueba fundamental de este efecto.34 Sin embargo se requiere seguimiento a mediano y largo plazo para soportar los datos que se presentan en la literatura y que se plantean en esta discusión. Aunque es ampliamente reconocido que los estudios clínicos controlados aleatorizados son esenciales para la toma de decisiones basados en la evidencia, tales estudios son difíciles de diseñar, toman tiempo y son costosos.
Una revisión sistemática reciente se originó de la hipótesis nula de que “no hay diferencia en el comportamiento clínico entre varios tipos de implantes dentales oseointegrados con forma radicular”. Se hizo la búsqueda de todos los estudios controlados que compararan implantes oseointegrados con diferentes materiales, formas y características superficiales con seguimiento de al menos un año. Los resultados, después de trabajar con dieciséis (16) estudios clínicos aleatorizados, 771 pacientes y dieciocho tipos diferentes de implantes, con seguimientos entre uno y cinco años, determinaron que no hay evidencia de que alguno de los sistemas de implantes evaluados fuera superior a otro.35 Un estudio clínico evaluó a largo plazo las diferencias entre implantes de titanio moderadamente rugoso e implantes maquinados con respecto a pérdida ósea marginal y tejidos blandos periimplantares en el mismo paciente, con seguimiento a doce años. Se concluyó que no se pudieron encontrar diferencias entre los implantes maquinados y con superficie rugosa para los parámetros de tejidos blandos y óseos.36
En conclusión, bajo las condiciones del protocolo convencional de colocación de implantes y restauración en dos fases quirúrgicas, no se encontraron diferencias estadísticamente significativas entre los dos grupos de implantes, superficie lisa y superficie rugosa, para las variables de oseointegración y cambios en el nivel óseo.
REFERENCIAS
1. Smith DE, Zarb GA. Criteria for success of osseointegrated endosseous implants. J Prosthet Dent 1989; 62: 567-572. [ Links ]
2. Jaeschke R, Schünemann HJ, Devereaux PJ, Gordon H. Evidence-based health care as a model for decision making. J Evid Base Dent Pract 2004; 4: 4-7. [ Links ]
3. De Leonardis D, Garg AK, Pecora GE. Osseointegration of rough acid-etched titanium implants: 5-Year Follow-up of 100 Minimatic Implants. Int J Oral Maxillofac Implants 1994; 14: 384-391. [ Links ]
4. Schropp L, Kostopoulos L, Wenzel A, Isidor F. Clinical and radiographic performance of delayed-immediate single-tooth implant placement associated with peri-implant bone defects. A 2-year prospective, controlled, randomized follow-up report. J Clin Periodontol 2005; 32: 480-487. [ Links ]
5. Wennström JL, Ekestubbe A, Gröndahl K, Karlsson S, Lindhe J. Implant-supported single-tooth restorations: a 5-year prospective study. J Clin Periodontol 2005; 32: 567-574. [ Links ]
6. Trisi P, Rao W, Rebaudi A. A Histometric Comparison of smooth and rough titanium implants in human low-density jawbone. Int J Oral Maxillofac Implants 1999; 14: 689-698. [ Links ]
7. Masuda T, Yliheikkila P, Felton D, Cooper L. Generalizations regarding the process and phenomenon of osseointegration. Part I. In vivo studies. Int J Oral Maxillofac Implants 1998; 13: 17-29. [ Links ]
8. Kilpadi D, Lemons J, Liu J, Raikar G, Weimer J, Vohra Y. Cleaning and heat treatment effects on unalloyed titanium implant surfaces. Int J Oral Maxillofac Implants 1999; 14: 689-698. [ Links ]
9. Esposito M, Hirsch J, Lekholm U, Thomsen P. Biological factors contributing to failures of osseointegrated oral implants. (II) Etiopathogenesis. Eur J Oral Sci 1998; 106: 721-764. [ Links ]
10. Sykaras N, Iacopino M, Marker V, Triplett R, Woody R. Implant materials, designs, and surface topographies: their effect on osseointegration. A literature review. Int J Oral Maxillofac Implants 2000; 15: 675-690. [ Links ]
11. Wozniak WK. Dental implants and ADA acceptance. J Am Dent Assoc 1986; 113(6): 879. [ Links ]
12. Eckert SE. Food and drug administration requirements for dental implants. J Prosthet Dent 1995; 74: 162-168. [ Links ]
13. ADA Council on scientific affairs. Dental endosseous implants: an update. J Am Dent Assoc 1996; 127: 1238-1239. [ Links ]
14. Arismendi JA, Castaño AC, Mejia RM, Mesa AL, Castañeda DA, Tobón SI. Evidencia de cambios clínicos y radiográficos en implantes oseointegrados de superficie maquinada y modificada, 3-12 meses de seguimiento. Rev Fac Odontol Univ Antioq 2006; 18(1): 6-16. [ Links ]
15. Roos J, Sennerby L, Lekholm U, Jemt T, Gröndahl K, Albrektsson T. A qualitative and quantitative method for evaluating implant success: a 5-year retrospective analysis of the Brånemark Implant. Int J Oral Maxillofac Implants 1997; 12: 504-514. [ Links ]
16. Albrektsson T, Zarb G, Worthington P, Eriksson A. The long-term efficacy of currently used dental implants: a review and proposed criteria of success. Int J Oral Maxillofac Implants 1986; 1: 11-25. [ Links ]
17. Misch CE, Perel ML, Wang HL, Sammartino G, Galindo- Moreno P, Trisi P et al. Implant success, survival, and failure: the International Congress of Oral Implantologists (ICOI) Pisa Consensus Conference. Implant Dent 2008; 17(1): 5-15. [ Links ]
18. Goodacre CJ, Kan JYK, Rungcharassaeng K. Clinical complications of osseointegrated implants. J Prosthet Dent 1999; 81: 537-552. [ Links ]
19. Kitamura E, Stegaroiu R, Nomura S, Miyakawa O. Biomechanical aspects of marginal bone resorption around osseointegrated implants: considerations bases on a threedimensional finite element analysis. Clin Oral Impl Res 2004; 15: 401-412. [ Links ]
20. Park JY, Gemmell CH, Davies JE. Platelet interactions with titanium: modulation of platelet activity by surface topography. Biomaterials 2001; 22: 2671-2682. [ Links ]
21. Kanagaraja S, Wennerberg A, Eriksson C, Nygren H. Cellular reactions and bone apposition to titanium surface with different surface roughness and oxide thickness cleaned by oxidation. Biomaterials 2001; 22: 1809-1818. [ Links ]
22. Trisi P, Lazzara R, Rebaudi A, Rao W, Testori T, Porter S. Bone-Implant contact on machined and dual acid-etched surfaces after two months of healing in the human maxilla. J Periodontol 2003; 74(7): 945-956. [ Links ]
23. Ivanoff CJ, Widmark G, Johansson C, Wennerberg A. Histologic evaluation of bone response to oxidized and turned titanium micro-implants in human jawbone. Int J Oral Maxillofac Implants 2003; 18(3): 341-348. [ Links ]
24. Vandamme K, Naert I, Vander Sloten J, Puers R, Duyck J. Effect of implant surface roughness and loading on periimplant bone formation. J Periodontol 2008; 79(1): 150-157. [ Links ]
25. Duyck J, Slaets E, Sasaguri K, Vandamme K, Naert I. Effect of intermittent loading and surface roughness on peri-implant bone formation in a bone chamber model. J Clin Periodontol 2007; 34(11): 998-1006. [ Links ]
26. Vandamme K, Naert I, Geris L, Sloten JV, Puers R, Duyck J. Histodynamics of bone tissue formation around immediately loaded cylindrical implants in the rabbit. Clin Oral Implants Res 2007; 18(4): 471-480. [ Links ]
27. Albrektsson T, Wennerberg A. Oral implant surfaces: part 2-review focusing on clinical knowledge of different surfaces. Int J Prosthodont 2004; 17: 544-564. [ Links ]
28. Cochran DL. A comparison of endosseous dental implant surfaces. J Periodontol 1999; 79: 1523-1539. [ Links ]
29. Karlsson U, Gotfredsen K, Olsson C. A 2-year report on maxillary and mandibular fixed partial dentures supported by Astra Tech dental implants. A comparison of 2 implants with different surface textures. Clin Oral Impl Res 1998; 9: 235-242. [ Links ]
30. Van Steenberghe D, De Mars G, Quirynen M, Jacobs R, Naert I. A prospective split-mouth comparative study of two screw-shaped self-tapping pure titanium implant systems. Clin Oral Impl Res 2000; 11: 202-209. [ Links ]
31. Wennström JL, Ekestubbe A, Gröndahl K, Karlsson S, Lindhe J. Oral rehabilitation with implant-supported fixed partial dentures in periodontitis-susceptible subjects. J Clin Periodontol 2004; 31: 713-724. [ Links ]
32. Allen EP, Brodine AH, Cronin RJ, Donovan TE, Rouse JS, Summitt JB. Annual review of selected dental literature: report of the committee on scientific investigation of the American Academy of Restorative Dentistry. J Prosthet Dent 2005; 94(2): 146-176. [ Links ]
33. Stach RM, Kohles SS. A meta-analysis examining the clinical survivability of machined-surfaced and osseotite implants in poor-quality bone. Implant Dent 2003; 12: 87-96. [ Links ]
34. Al-Nawas B, Hangen U, Duschner H, Krummenauer F, Wagner W. Turned, machined versus double-etched dental implants in vivo. Clin Implant Dent Relat Res 2007; 9(2): 71-78. [ Links ]
35. Esposito M, Grusovin MG, Coulthard P, Thomsen P, Worthington HV. A 5-year follow-up comparative analysis of the efficacy of various osseointegrated dental implant systems: a systematic review of randomized controlled clinical trials. Int J Oral Maxillofac Implants 2005; 20: 557-568. [ Links ]
36. Vroom MG, Sipos P, de Lange GL, Gründemann LJ, Timmerman MF, Loos BG et al. Effect of surface topography of screw-shaped titanium implants in humans on clinical and radiographic parameters: a 12-year prospective study. Clin Oral Implants Res 2009; 20(11): 1231-1239. [ Links ]
RECIBIDO: SEPTIEMBRE 9/2009 - ACEPTADO: ENERO 26/2010
CORRESPONDENCIA
Jorge A. Arismendi Echavarría
Facultad de Odontología
Universidad de Antioquia
Correo electrónico: jorgearismendi@une.net.co
Cómo citar este artículo:
Arismendi JA, Mesa AL, García LP, Salgado JF, Castaño C, Mejía R. Estudio comparativo de implantes de superficie lisa y rugosa. Resultados a 36 meses. Rev Fac Odontol Univ Antioq 2010; 21(2): 159-169.
Arismendi JA, Mesa AL, García LP, Salgado JF, Castaño C, Mejía R. Machined versus rough surface implants, a clinical study. 36-month follow-up. Rev Fac Odontol Univ Antioq 2010; 21(2): 159-169.