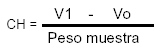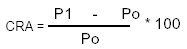Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.13 no.2 Medellín July/Dec. 2006
CARACTERIZACIÓN FISICOQUÍMICA Y FUNCIONAL DE TRES CONCENTRADOS COMERCIALES DE FIBRA DIETARIA
PHYSICALCHEMICAL AND FUNCTIONAL CHARACTERIZATION OF THREE COMMERCIAL CONCENTRATES FROM DIETARY FIBER
Francia E. VALENCIA G.1* y María O. ROMÁN M. 1
1 Departamento de Alimentos, Facultad de Química Farmacéutica, Universidad de Antioquia. Calle 67 No 53-108, Bloque 2. Medellín, Colombia.
* Autor a quien se debe dirigir la correspondencia: francia.valencia@gmail.com
Recibido: Junio 17 de 2006 Aceptado: Octubre 31 de 2006
RESUMEN
En Colombia se han realizado pocos estudios sobre la funcionalidad de extractos comerciales de fibra dietaria micropulverizada, lo que motiva a desarrollar un estudio experimental para establecer metodologías adecuadas en su evaluación, para el desarrollo de nuevos productos alimenticios que promuevan efectos fisiológicos benéficos. El presente estudio busca caracterizar dos extractos comerciales de fibra dietaria micropulverizada de trigo (375) y avena (528) y uno de manzana (659). La composición proximal, el contenido de fibra dietaria total (FDT), soluble (FDS) e insoluble (FDI), además de la viscosidad (η), tamaño de partícula, capacidad de retención de agua (CRA), capacidad de hinchamiento (CH), capacidad de adsorción de moléculas orgánicas (CAMO), capacidad de intercambio catiónico (CIC) y capacidad fermentativa in vitro (CF), presentaron diferencias significativas. Aquellos con mayor contenido de fibra insoluble (375 y 528), muestran valores más bajos de CRA (3,8 y 3,9 g de H20/g de materia seca MS) y mayores valores de CAMO (11,7 y 10,9 g de aceite/g de MS); la fibra 375 muestra la mayor CH (7,1 g de H20/g de MS). En general la CF es baja, lo que se evidencia por la baja cantidad y proporción molar de ácidos grasos acético, propiónico y butírico.
Palabras Clave: fibra dietaria, propiedades funcionales, efectos fisiológicos benéficos, capacidad fermentativa.
ABSTRACT
In Colombia there have been few studies done on the functionality of commercial extracts of micropulverized dietary fiber, this motivated the development of an experimental study that evaluated the functional properties, for the purpose of establishing adequate manipulation methodologies by including them in the development of new alimentary products that promote beneficial physiological effects. The present study aims to characterize two commercial extracts of micro- pulverized dietary fiber from wheat (375) and oat (528) and one from apple (659). The proximal composition, the total content of dietary fiber (FD), soluble (FDS), insoluble (FDI), in addition to viscosity (η), particle size, water retention capacity (CRW), swelling capacity (CS), organic molecule adsorption capacity (CAMO), and catatonic interchange capacity (CIC); indicated specific characteristics of the three concentrated fibers in the study. The fiber concentrates present significant differences among the physicalchemical and functional properties. Those with a major content of soluble fiber (375 and 528), showed lower values of CRW (3,8 and 3,9 from H2O/g from dry matter MD) and mayor values from CAMO (11,7 and 10,9 from oil/g from MD); the 375 fiber showed the most CS (7,1 g and H2O/g from MD).
Keywords: dietary fiber, functional properties, beneficial physiological effects, fermentative capacity.
INTRODUCCIÓN
Las normas de etiquetado establecidas en los diferentes países, el nivel de educación y el conocimiento de los consumidores sobre los estilos de vida saludable, han impulsado a los productores de alimentos a mejorar la calidad de sus productos y a ofrecer alimentos que realmente cumplan las expectativas de los consumidores (1, 2, 3), lo que ha incrementado en las empresas productoras de alimentos la demanda por materias primas de alta calidad que les permita controlar las características finales de sus productos alimenticios.
Así pues, se requiere establecer metodologías adecuadas que permitan evaluar las propiedades funcionales, con el fin de controlar el aporte nutricional y las propiedades sensoriales en la formulación de productos de óptima calidad en los cuales se puede incrementar la cantidad de fibra para prevenir enfermedades crónicas (1, 2, 4, 5, 6, 7 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18).
Las propiedades funcionales de la fibra son las responsables de los efectos fisiológicos que desarrolla y están influenciadas por la matriz estructural de la fibra, la relación fibra dietaria insoluble/fibra dietaria soluble (FDI/FDS), el tamaño de la partícula, la fuente, así como por el grado y el tipo de procesamiento llevado a cabo (1, 19, 20, 21).
Estas propiedades se determinan por lo general in vitro y sirven para darnos una idea de su comportamiento in vivo, ya que en este medio están sometidas a un entorno fisiológico muy complejo y a una serie de mecanismos que pueden modificarla. Cuando las fibras son utilizadas en la elaboración de alimentos, las propiedades fisicoquímicas influyen también en las características físicas de éstos, especialmente cuando se usan como agentes gelificantes, espesantes y/o estabilizantes (19, 20, 22, 23, 24, 25, 26).
El objetivo del trabajo fue caracterizar fisicoquímica y funcionalmente tres concentrados comerciales de fibra dietaria, para establecer parámetros de calidad en las materias primas y realizar control de procesos que genere mayor confianza por parte de los consumidores.
MATERIALES Y MÉTODOS
Fuentes de fibra dietaria
Dos extractos comerciales de fibra dietaria micropulverizada de trigo (375) y avena (528) y uno de manzana (659), suministrados por una empresa productora de galletas. Las muestras fueron homogenizadas y separadas aleatoriamente en fracciones, almacenadas a temperatura ambiente en bolsas de polietileno con cierre hermético, rotuladas y marcadas hasta su evaluación analítica.
Caracterización de las fuentes de fibra. Para la determinación de humedad se usó como referencia el método gravimétrico 966.02 de la Association of Official Analytical Chemist (AOAC). Las cenizas se determinaron según el método directo AOAC 923.03. El extracto etéreo se determinó siguiendo el método Soxhlet 920.39 del AOAC. La proteína bruta se obtuvo multiplicando el contenido de nitrógeno determinado por el procedimiento Kjeldahl, según el método 920.87 del AOAC, por el factor de transformación en proteína 6.25. El análisis de fibra dietarIa total (FDT) se realizó siguiendo el método enzimático-gravimétrico 985.29 del AOAC (Sigma TDF-100A). Para la determinación de la fibra dietaría insoluble se aplicó el mismo método obviando la precipitación de la fibra soluble en alcohol según el método 991.43G del AOAC (27).
Propiedades funcionales
En el laboratorio de Análisis de Alimentos y Bromatología de la Facultad de Química Farmacéutica de la Universidad de Antioquia se evaluaron las propiedades de hidratación, la capacidad de adsorción de moléculas orgánicas (CAMO) y la capacidad de intercambio catiónico (CIC), y en el Laboratorio de Química de Coloides de la Facultad de Ciencias Exactas y Naturales de la Universidad de Antioquia se determinaron la viscosidad (η) y el tamaño de partícula de las fibras en estudio. En el laboratorio de Biotecnología Ruminal BIORUM de la Facultad de Ciencias Agropecuarias de la Universidad Nacional, Sede Medellín, se realizaron las fermentaciones in vitro de las muestras.
Viscosidad (η): De cada una de las muestras se pesaron 6g y se les adiciono agua destilada hasta completar 100 ml. Se midió la viscosidad con un viscosímetro Haake Typ 002-7028, utilizando una aguja MVBD, a temperaturas de 20°C y de 80°C. Los resultados obtenidos se expresaron en milipascales (mps).
Capacidad de hinchamiento (CH): Se pesaron 2 g de cada muestra en una probeta graduada de 25 ml y se midió el volumen ocupado por las fibras (Vo) (mL); se adicionaron 10 ml de agua destilada y se agitó manualmente durante 5 min. Se dejó en caracterización fisicoquímica y funcional de tres concentrados comerciales de fibra dietaria reposo durante 24 horas a temperatura ambiente. Posteriormente se midió el volumen final de las muestras (V1)(mL) (28, 29, 30).
La capacidad de hinchamiento (mL/g) se calculó mediante la siguiente fórmula:
Capacidad de retención de agua (CRA): En tubos de centrífuga (Centrífuga Universal Rotofix HETT), se pesaron 0,5g de cada muestra (Po) (g), se adicionaron 10 ml de agua destilada y se agitaron manualmente durante 10 minutos; se dejó durante 24 horas a temperatura ambiente; se centrifugó a 3000 r.p.m durante 10 minutos, inmediatamente se retiró el sobrenadante y se pesó el sedimento (P1) (g) (28).
La CRA (%) se calculó mediante la siguiente fórmula:
Capacidad de adsorción de moléculas orgánicas (CAMO): En tubos de centrífuga (Centrífuga Universal Rotofix HETT), se pesaron 0,5g de cada muestra (Po)(g), se adicionaron 10 ml de aceite de girasol comercial y se agitó manualmente durante 10 minutos, luego se dejó en reposo durante 24 horas a temperatura ambiente y se centrifugó a 3000 r.p.m durante 10 minutos, inmediatamente se retiró el sobrenadante y se pesó el sedimento (P1) (g) (28).La CAMO (mL/g) se calcula mediante la siguiente fórmula:
Capacidad de intercambio catiónico (CIC): En beaker de 50 mL se colocaron 2 g de muestra en un exceso de ácido clorhídrico 2N, durante 24 horas, a temperatura ambiente; el ácido clorhídrico se eliminó, se colocó la muestra en una solución saturada de cloruro de sodio y se lavó con agua destilada. Los iones H+ captados por la muestra se determinaron por titulación, reportándose el resultado en miliequivalentes de H+/g.
Tamaño de partícula: Se determinó en un equipo Mastesizer (2000) de MALVERN, con el accesorio Scirocco 2000 (A) (Rawle).
Fermentación in vitro: La evaluación de la capacidad fermentativa de cada fibra se realizó como se muestra en la figura 1 (31).
Análisis de datos
Las determinaciones fisicoquímicas se realizaron por triplicado y los valores presentados corresponden al promedio. Los resultados de las pruebas funcionales fueron analizados mediante análisis de los estadísticos descriptivos y el test univariado de análisis de varianza. En la evaluación de la CF, las variables dependientes pH, desaparición de sustrato, porcentaje mol de ácido acético AA, porcentaje mol de ácido propiónico AP y porcentaje mol de ácido butírico AB, se analizaron mediante la técnica del análisis de varianza de medidas repetidas y se tuvieron en cuenta los efectos: tiempo, tipo de fibra, tipo de paciente e interacción entre ellos. El análisis se realizó mediante el paquete estadístico S.A.S (Stadistical Analysis System).
RESULTADOS
En la tabla 1 se presentan los resultados de la composición proximal y del contenido de FDT, FDS y FDI de los concentrados de fibra.
En la figura 2 se presentan los valores medios con los intervalos LDS (95%) de la capacidad de retención de agua de los concentrados de fibra (% P/P).
En la figura 3 se presentan los valores medios con los intervalos LDS (95%) de la capacidad de hinchamiento (mL de agua/g de MS).
En la figura 4 se presentan los valores medios con intervalos LSD (95%) de la CAMO (%).
En la figura 5 se presentan los valores medios con intervalos LSD (95%) de la capacidad de intercambio catiónico.
En la tabla 2 se presentan los resultados del análisis de varianza multivariado de medidas repetidas para las distintas variables en la evaluación in vitro de la capacidad fermentativa de las fibras, mediante la prueba traza de Pillai, para la comparación de los vectores de medias de los distintos grupos.
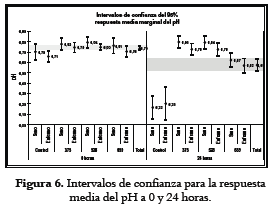
En la figura 6 se presentan los resultados obtenidos para la respuesta media del PH a 0 y 24 horas.
Análisis de resultados
Los concentrados presentaron más del 55 % de FDT en base seca lo que hace de estos productos buenas fuentes de fibra. La fibra 375 y 528 a base de cereales aportan mayor contenido de fibra total e insoluble que la fibra 659 a base de frutas. La fibra 659 presentó mayor contenido en humedad, proteína y FDS.
En la figura 2 se observa que los concentrados de fibra 375, 528 y 659 presentan valores de CRA de 3.8, 3.9 y 4.1 g de H2O/g MS respectivamente y no se establecieron diferencias significativas entre los resultados. Lo anterior indica que estas fibras tienen similar susceptibilidad al estrés debido a la fuerza centrífuga (4, 19, 30, 32 ,33).
En la figura 3, la CH de la fibra 375 (7,1 g de H2O/g MS) es superior a la que demostraron las fibras 528 (2,3 g de H2O/g MS) y 659 (3,4 g de H2O/g MS); la CH presenta diferencias altamente significativas; esto significa que la fibra 375 tiene mayor capacidad de aumentar su volumen en un exceso de agua, por lo que podría provocar mayor saciedad y un aumento del bolo fecal (10, 19, 30). Las diferencias en la CH pueden tener explicación por la composición química y por los tratamientos realizados para la extracción de las fibras (19, 34).
En la figura 4 se observa que los concentrados de fibra 375 y 528 (11,2 y 10,8 g de aceite/ g de MS) se comportaron como un grupo homogéneo, mostrando valores superiores que los del concentrado de fibra 659 (6,3 g de aceite/ g de MS). La CAMO presenta diferencias significativas. Dichos resultados indican que los concentrados de fibra 375 y 528, que presentan mayor contenido de FDI, contienen además mayores valores de adsorción de moléculas orgánicas que las fibras con mayor contenido de fibra dietaria soluble. Esta propiedad podría relacionarse con el comportamiento en el intestino, en el cual las fibras 375 y 528 posiblemente ligan sales biliares, colesterol, drogas, compuestos tóxicos y carcinogénicos permitiendo su excreción por las heces (10, 28, 35).
En la figura 5 se observa que la CIC del concentrado de fibra 659 (8,9 meq [H+]/g de MS) es aproximadamente dos veces mayor que el de los concentrados de las fibras 375 y 528 (4,4 y 4,3 meq [H+]/g de MS) que se comportaron como un grupo homogéneo. La CIC presenta diferencias significativas. Lo anterior indica que el contenido de grupos carboxilos libres e hidroxilos en los residuos de azúcar, así como el contenido de pectina, es mayor en el concentrado de fibra 659 (10, 28).
En la medición de la viscosidad a temperatura de 20°C y a 80°C para los concentrados de fibra 375, 528 y 659, los valores obtenidos fueron muy bajos y no varían.
Con respecto al tamaño de partícula, se encontró que para la fibra 375 el mayor volumen en porcentaje se encuentra distribuido entre 10.000 y 120.000 µm, con un d(0,5) = 39,095 µm. Para la fibra 528 el mayor volumen en porcentaje se encuentra distribuido entre 8.710 y 120.000 µm, con un d(0,5) = 37,744 µm. Para la fibra 659 el mayor volumen en porcentaje se encuentra distribuido entre 11.482 y 480.000 µm, con un d(0,5) = 108,054 µm. Los resultados muestran que la distribución de tamaño de partícula de las fibras en estudio presentaron un amplio rango de dispersión (36, 37).
En la tabla 2 se observa que el pH muestra diferencias significativas en el cambio de las 0 a las 24 horas (h); este cambio también se observa por el tipo de fibra, pero no por donante. Esta variación indica que las bacterias tuvieron mayor actividad sobre el sustrato 659. En el análisis del % mol de ácido acético, % mol de ácido propiónico y % mol de ácido butírico, se observan diferencias significativas a las 0 y 24 horas; sin embargo, ni dentro de los grupos, ni entre los diferentes estados del donante se observan diferencias. Los resultados de la fermentación de las fibras en estudio reflejan que la fermentabilidad es baja, al igual que la cantidad y la proporción molar de los ácidos grasos volátiles cuantificados (acético, propiónico y butírico), posiblemente por algunas variaciones realizadas a las condiciones del método (obtención del inóculo, inóculos fecales usados individualmente o mezclados, la concentración de las diferentes sales, la forma de agitación, área de contacto entre las partículas de fibra y las bacterias), que pudieron propiciar cambios en las condiciones ambientales y, a su vez, alteraciones en las rutas metabólicas.
En la figura 6 se observa que el pH en los concentrados de fibra 375 y 528 a las 0 y 24 horas difiere muy poco, esto es debido posiblemente al alto contenido en celulosa que presentan estos compuestos. Sin embargo, es importante anotar que la mayor variación de pH se presentó en el concentrado de fibra 659, debido a su mayor contenido en polisacáridos solubles, lo cual es un factor determinante para la fermentabilidad de los sustratos ricos en fibra.
CONCLUSIONES
Cada concentrado de fibra presenta características fisicoquímicas y funcionales propias, cuyo conocimiento, permite hacer recomendaciones para su empleo en el desarrollo de productos alimenticios que puedan ser una opción para incrementar la ingesta de fibra dietaria.
AGRADECIMIENTOS
Agradecemos el respaldo dado por la Compañía de Galletas NOEL S.A. y por la Universidad de Antioquia (Programa de Gestión Tecnológica), que contribuyeron a la realización de este trabajo. Al Doctor Gustavo Ernesto Botero M., Director Técnico , al Doctor Santiago Hoyos Sierra, Director de Gestión Tecnológica, a la Doctora Adriana Deossa Vélez, Coordinadora de Desarrollo de Productos, todos de la Compañía de Galletas NOEL S. A. Al Ingeniero Luis Jaime Osorio, Ejecutivo del Programa de Gestión Tecnológica de la Universidad de Antioquia y al Doctor Herley Casanova Yepes, Coordinador del Laboratorio de Química de Coloides de la Facultad de Ciencias Exactas y Naturales de la Universidad de Antioquia.
REFERENCIAS BIBLIOGRÁFICAS 1. Saura FD, Goñi I, Martín C, Ferrer R. Fibra dietética en cerveza: contenido, composición y evaluación nutricional. Cerveza y Malta 2003;(XI 2),158: 51-60.
[ Links ] 2. Valencia FE, Román MO. La fibra dietaria como alimento funcional. Vitae 2004;11(2):12-7.
[ Links ] 3. Skeaff CM, Thomas C, Mann J, Chisholm A, Williams S, Richmond K. Isocaloric substitution of plant sterol-enriched fat spread for carbohydrate-rich foods in a low-fat, fibre-rich diet decreases plasma low-density lipoprotein cholesterol and increases highdensity lipoprotein concentrations. Nutrition, Metabolism & Cardiovascular Disease. 2005;(15):337-44.
[ Links ] 4. Goñi I, Martin N. In vitro fermentation and hydration properties of commercial dietary fiber-rich supplements. Nutrition Research, 1998;18(6):1077-89.
[ Links ] 5. O’sullivan KR. Fibre and its role in health and disease. International Journal of Food Sciences and Nutrition. 1998;S9-S12. caracterización fisicoquímica y funcional de tres concentrados comerciales de fibra dietaria
6. Rieckhoff D, Trautwein EA, Mälkki Y, Erbersdobler HF. Effects of different cereal fibers on cholesterol and bile acid metabolism in the syrian golden hamster. Cereal Chem 1999;76(5):788-95.
[ Links ] 7. Verschuren P. Functional foods - Scientific and global perspectives. Organised by the ILSI Europe Functional Food Task Force. Summary report of an international symposium held in October. Paris, France. 2001.
[ Links ] 8. Adam A, Levrat-Verny M, Lopez HW, Leuillet M, Demigne C, Reme C. Whole wheat and triticale flours with differing viscosities stimulate cecal fermentations and lower plasma and hepatic lipids in rats. Journal Nutrition 2001;(131):1770-6.
[ Links ] 9. López AP. La investigación y el diseño de los alimentos funcionales. La colaboración de las Universidades y los centros de investigación con las empresas. Alimentación, Equipos y Tecnología 2002 Octubre:101-12.
[ Links ] 10. Villarroel M, Acevedo C, Yánez E, Biolley E. Propiedades funcionales de la fibra del musgo Sphagnum magellanicum y su utilización en la formulación de productos de panadería. Archivos Latinoamericanos de Nutrición 2003 Diciembre;53(4):1-15.
[ Links ] 11. Bornet FRJ, Brouns F. Immune-stimulating and gut healthpromoting properties of short-chain fructo-oligosaccharides. Nutrition Reviews 2002;60(11):326-34.
[ Links ] 12. García P. Metabolismo colónico de la fibra. Nutricion Hospitalaria 2002;XVII(Sup. 2):11-6.
[ Links ] 13. Roberfroid MB. Prebiotics and probiotics: are they functional foods. Am. J. Clin. Nutr. 2000;71(suppl):1682S-7S.
[ Links ] 14. Ziegler TR, Evans ME, Fernández-Estívariz C, Jones DP. Trophic and cytoprotective nutrition for intestinal adaptation, mucosal repair and barrier function. Annu. Nutr 2003;23:229-61.
[ Links ] 15. Lenoir-Wijnkoop I, Hopkins M. The intestinal microflora. Understanding the symbiosis. Montrouge, France: John Libbey Eurotext. 2003.
[ Links ] 16. Montagne L, Pluske JR, Hampson DJ. A review of interactions between dietary fibre and the intestinal mucosa and their consequences on digestive health in young non-ruminant animals. Animal Feed Science and Technology 2003;(108):95-117.
[ Links ] 17. Rombeau JL. Investigations of short-chain fatty acids in humans. Clinical Nutrition Supplements 2004;(1):19-23.
[ Links ] 18. De Leeuw JA, Zonderland JJ, Altena H, Spoolder HAM, Jongbloed AW, Verstegen MWA. Effects of levels and sources of dietary fermentable non-starch polysaccharides on blood glucose stability and behaviour of group-housed pregnant gilts. Applied Animal Behaviour Science 2005;(94):15-29.
[ Links ] 19. Guillon, F, Champ M. Structural and physical properties of dietary fibres, and consequences of processing on human physiology. [citado 2000 mayo 2] Disponible en URL: http//www.uib.es/depart/dque/asignaturas/7/52.pdf
20. Figuerola F, Hurtado M, Estevez AM, Chiffelle I. Fibre concentrates from apple pomace and citrus peel as potential fibre sources for food enrichment. Food Chemistry 2005;(91):395-401.
[ Links ] 21. Drzikova B, Dongowski G, Gebhardt E, Habel A. The composition of dietary fibre-rich extrudates from oat affects bile acid binding and fermentation in vitro. Food Chemistry 2005;(90):181-92.
[ Links ] 22. Olds SB. Physical and chemical properties, methods of analysis, and physiological effects. Foods technology 1986 February;104-110.
[ Links ] 23. Femenia A, Lefebvre AC, Thebaudin JY, Robertson JA, Bourgeois CM. Physical and sensory properties of model foods supplemented with cauliflower fiber. Journal of Food Science 1997;62(4):635-39.
[ Links ] 24. Ha MA, Jarvis MC, Mann JI. A definition for dietary fibre. European Journal of Clinical Nutrition 2000;54:861-64.
[ Links ] 25. McCleary BV, Prosky L. Advanced dietary fiber technology. Iowa: Blackwell Science 2001. p. 534.
[ Links ] 26. Roman MO, Florez O, Gutiérrez EL, Martínez O L, Medina G. Desarrollo de una forma de dosificación sólida con fibra dietaria. Vitae 2004;11(2):6-11.
[ Links ] 27. AOAC Official Methodos of Analisis. 16 edición. Association of Official Analitical Chemist 1996.
[ Links ] 28. Lajolo SA, Wensel DN. Temas en tecnología de alimentos. Fibra dietaria. México DF: Instituto Politécnico Nacional 1998;2. p 29-42.
[ Links ] 29. AACC, Report. All dietary fiber is fundamentally functional. Cereal Foods World. 2003 May-June;48(3):128-9.
[ Links ] 30. Raghavendra SN, Ramachandra SR, Rastogi NK, Raghavarao KSMS, Kumar S, Tharanathan RN. Grinding characteristics and hydration properties of coconut residue: A source of dietary fiber. Journal of Food Engineering 2006;72:281-6.
[ Links ] 31. Valencia FE. Evaluación de la capacidad fermentativa de diferentes fuentes de fibra dietaria. [Tesis de Maestría]. Medellín: Universidad de Antioquia; 2006.
[ Links ] 32. Robertson JA, De Monredon FD, Dysseler P, Guillon F, Amado R, Thibault JF. Hydration properties of dietary fibre and resistant starch: a European collaborative study. Lebensm. Wiss U. Technol 2000;(33):72-9.
[ Links ] 33. Chaplin MF. Fibre and water binding. Proceedings of the Nutrition Society 2003;62:223-7.
[ Links ] 34. Nawirska A, Kwasniewska M. Dietary fiber fractions from fruit and vegetable processing waste. Food Chemistry 2005;91:221-5. [ Links ] 35. Khattak, MMAK. Physiological effects of dietary complex carbohydrates and its metabolites role in certain diseases. Pakistan Journal of Nutrition 2002;1(4):161-8.
[ Links ] 36. Jenkins D, Kendall C, Vuskan V, Agustin L, Li YM, Lee B et al.. The effect of wheat bran particle size on laxation and colonia fermentation. Journal of the American College of Nutrition 1999;18(4):339-45.
[ Links ] 37. Aura AM, Härkönen H, Fabritius M, Poutanen KX. Development of an in vitro enzymatic digestion method for removal of starch and protein and assessment of its performance using rye and wheat breads. Journal Cereal Science 1999;(29):139-52. [ Links ]