Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.14 no.2 Medellín July/Dec. 2007
CAMBIOS FISIOLÓGICOS, TEXTURALES, FISICOQUÍMICOS Y MICROESTRUCTURALES DEL TOMATE DE ÁRBOL (Cyphomandra betacea S.) EN POSCOSECHA
CHANGES PHYSIOLOGICAL, TEXTURAL, PHYSICOCHEMICAL AND MICROESTRUCTURAL OF THE TREE TOMATO (Cyphomandra betacea S.) AT POSTHARVEST
Carlos Julio MÁRQUEZ C.1*; Claudia Margarita OTERO E.1; Misael CORTÉS R.1
1Facultad de Ciencias Agropecuarias, Departamento de Ingeniería Agrícola y de Alimentos, Universidad Nacional de Colombia, Sede Medellín, A.A. 568.
RESUMEN
Son evaluados diariamente tomates de árbol en grado de madurez de cosecha con el fin de determinar la evolución de diferentes características poscosecha. El comportamiento de la tasa respiratoria permite confirmar al fruto como un producto no climatérico, con un tiempo óptimo de maduración y consumo alrededor de los 10 días de poscosecha, alcanzando en este estado pérdidas de peso por transpiración entre el 8 y 10%. Las características físicas y químicas presentan un incremento de los sólidos solubles totales, disminución en el porcentaje de acidez y en la firmeza. El color de la epidermis y la pulpa presentan un incremento de la cromaticidad amarilla y roja, resultando una tonalidad anaranjada del fruto, que se hizo más acentuada con la maduración.
Palabras clave: Tomate de árbol (Cyphomandra betacea S.), respiración, poscosecha, firmeza, color, microestructura.
ABSTRACT
Tree Tomatoes harvest ripening degree are evaluated each day in order to determine the evolution of different postharvest characteristics. Respiratory rate behavior allows the identification of the fruit as a no climacteric product, with an optimum ripening time and consumption of 10 days after harvest. The fruit shows a mass loss for transpiration between 8 and 10% when the optimum ripening stage was reached. Chemical and physical characteristics present a total soluble solids increase, a decrease of the acidity values, a decrease of firmness. The color of the epidermis and pulp shows an increase of the yellow and red chromaticity, which combination exhibit an orange like color, being this effect greater with the ripening development.
Keywords: Tree tomato (Cyphomandra betacea S.), respiration, posharvest, firmness, colour, microstructure.
INTRODUCCIÓN
El tomate de árbol (Cyphomandra betacea S.) conocido como Tamarillo, es un fruto tropical que se encuentra dentro del grupo de alimentos que por su valor nutricional y comercial son apetecidos en el mercado nacional e internacional(1). Desde el punto de vista nutricional, el fruto es una excelente fuente de vitaminas A, B6, C y, E, y minerales como el hierro; además tiene un contenido bajo en carbohidratos y menos de 40 calorías por cada
100 g (2). Los posibles centros de origen de este fruto han sido identificados en Filipinas y América Latina, especialmente en Ecuador, Colombia y Perú (3).
Colombia presenta un área cultivada en tomate de árbol aproximadamente de 6.500 Ha., con una producción correspondiente a 120.000 ton/año (www.minagricultura.gov.co, fecha de consulta: agosto 22 de 2006), en su mayoría para consumo nacional. El cultivo del tomate de árbol presenta buena resistencia a las plagas y enfermedades, especialmente virales, y requiere suelos fértiles y bien drenados y ambientes cálidos y húmedos (4).
Investigaciones recientes sugieren que el tomate de árbol necesita suelos muy ricos en materia orgánica (3 a 5%) (5) y un control efectivo de enfermedades como la antracnosis, causada por el hongo Colletotrichum gloeosporioides, que causa pérdidas hasta de un 100% (6). Otras pérdidas se dan durante el almacenamiento, debido principalmente al desarrollo de hongos (7).
El tomate de árbol, como sistema biológico respira, transpira y libera etileno, y una vez cosechado manifiesta una serie de cambios a todo nivel; se destacan los fisicoquímicos, sensoriales, bioquímicos, entre otros (1, 8, 9). Las condiciones más favorables para su almacenamiento se dan a temperaturas entre 3,0 y 4,5°C y humedades relativas entre 90-95% (7). En Colombia, el Instituto Colombiano de Normas Técnicas ha establecido algunos criterios de maduración para esta fruta, de acuerdo a características físicas de color, forma y tamaño (10).
Saber las propiedades reológicasresulta de gran importancia en las frutas, ya que permite un conocimiento de su estructura, un mejor control durante su transformación, diseñar procesos de transformación y, además, porque están directamente relacionadas con la aceptación por parte de los consumidores (11, 12).
El objetivo de este trabajo fue evaluar, durante el periodo de desarrollo poscosecha del tomate de árbol la evolución de los parámetros fisiológicos, texturales, físicoquímicos, y micro-estructurales que permiten definir las condiciones óptimas de cosecha, consumo y mejor calidad de la fruta.
MATERIALES Y MÉTODOS
Materia prima
Como material vegetal se utilizaron tomates de árbol (Cyphomandra betacea S.) comunes, conocido como tomate de árbol anaranjado, cultivados en elmunicipio de Entrerríos, Antioquia, ubicado a 2.300 m.s.n.m. con una temperatura promedio de 16°C.Los tomates fueron recolectados con grado de madurez del 0%, de acuerdo a la Norma Técnica Colombiana, NTC 41O5. Los frutos fueron cosechados 16 semanas luego de la floración e inmediatamente transportados al laboratorio de experimentación, presentando características homogéneas en color y tamaños entre 8 y 9 cm de longitud, 5-6 cm de diámetro ecuatorial y 80-100 g de peso.
Cambios fisiológicos
El índice de respiración (mg CO2/h · kg) se determinó a partir de una modificación del método químico de Petenkoffer (13). Se pesaron seis tomates de árbol y se introdujeron en un recipiente hermético; posteriormente el producto de su respiración (CO2) fue neutralizado con una solución de NaOH (0,1 N). La cantidad de H2CO3 producido se determinó a partir de la diferencia de concentraciones de la solución de NaOH inicial (0,1N) y la concentración de NaOH parcialmente neutralizada. A partir del H2CO3, por estequiometría, se obtuvo la cantidad de CO2. Para la determinación del índice de respiración y de transpiración del fruto, se cuantificaron las pérdidas de peso por gravimetría (1), utilizando una balanza analítica Ohaus ± 0,01g. La figura 1 ilustra el montaje del respirómetro utilizado en laboratorio.
Figura 1. Respirómetro de laboratorio, adaptado de Lagos y Kairus, 1990 (13).
Caracterización fisicoquímica
Se evaluó el rendimiento de la fruta en pulpa expresado en % peso/peso (g/g x 100), por el método gravimétrico, utilizando una balanza analítica Ohaus con precisión de 0,01g (14). Los sólidos solubles totales (SST) en % (g ssol/ g fase líquida x 100) se determinaron en un refractómetro Leica auto ABBE (escala de 0-32%). El pH se determinó con unpotenciómetro Schott CG840B y el % de acidez (g ácido cítrico/100 g muestra x 100) se efectuó por el método químico de titulación potenciométrica (15).
Caracterización de la textura
La firmeza del fruto se determinó a partir de ensayos de punción, utilizando un analizador de textura TA.XT2i (Stable Micro Systems) y el Sofware Texture Expert Excced, Versión 2,64. Se utilizó una sonda metálica de 5 mm de diámetro, a una velocidad de penetración de 2 mm/s y una distancia de penetración de 20 mm (16).
Caracterización del color
La medida del color se realizó diariamente sobre la superficie o epidermis del fruto(6 lecturas/muestra, 3 longitudinales y 3 ecuatoriales) utilizando el espectrofotómetroX-RITE, modelo SP60. A partir del espectro de reflexión de las muestras, se obtuvieron las coordenadas de color CIE-L*a*b*, donde L* es un indicador de la luminosidad, a* indica la cromaticidad en el eje verde (-) a rojo (+), y b* la cromaticidad en el eje azul (-) a amarillo (+).
Caracterización de la microestructura
El análisis de la microestructura celular se llevó a cabo durante toda la poscosecha por microscopia electrónica de barrido (SEM) (17), mediante un microscopio JEOLJSM 5910 LV, a 25 Pa de vacío, previo tratamiento de las muestras por inmersión durante30 segundos en N2 líquido. Las micrografías fueron realizadas entre 90 y 120 aumentos.
Diseño experimental
Las pruebas de respiración e índice de pérdida de peso o transpiración, se evaluaron a diario en 2 grupos independientes, de 6 muestras cada uno. Las pruebas fisicoquímicas (pH, % acidez y % SST), texturales (firmeza), y microestructurales, se realizaron en 6 frutos/día durante 14 días continuos, según el flujograma ilustrado en la figura 2. Los frutos para cada determinación fueron tomados al azar, siendo la unidad experimental total de 192 muestras de tomates de árbol. Para el análisis de las variables de respuesta se aplicaron pruebas estadísticas a partir de ANOVAS, utilizándose el método LSD (mínimas diferencias significativas) como método de comparaciones múltiples, con un nivel de confianza del 95% (a = 0,05). El análisis de varianza se realizó con el paquete estadístico STATGRAPHICS plus versión 5.1.
Figura 2. Flujograma para la determinación de las variables estudiadas durante el almacenamiento poscosecha del tomate de árbol.
RESULTADOS Y DISCUSIÓN
Cambios fisiológicos
Los resultados de la respiración del tomate de árbol aparecen en la figura 3. Se observa que el comportamiento de la respiración se asemeja más al de un fruto con características no climatéricas (1,7), donde se identifican tres etapas:
La primera etapa donde se están empezando a desarrollar algunas de sus características organolépticas con producción de CO2 creciente, alcanzando un máximo en el día 5.
La segunda etapa, donde la producción de CO2 es decreciente hasta un valor de producción constante (día 10), donde se considera que se logran las características fisicoquímicas y sensoriales ideales para el consumo.
La tercera etapa, en la cual el comportamiento del índice de madurez es asintótico, corresponde a los días de sobremaduración, donde los atributos de consumo empiezan a afectarse, tipificada por el arrugamiento de la epidermis, que se inicia en los sectores aledaños al pedúnculo.
Figura 3. Comportamiento respiratorio del tomate de árbol en términos de CO2 durante el período de maduración
La figura 4 presenta el % de pérdida de peso en el tiempo, para las condiciones sicrométricas promedio de la experimentación (23ºC, 65% HR). La cinética se ajustó a una ecuación de orden cero con un parámetro de regresión R2 del 98,5%. Las pérdidas de peso son atribuidas a la transpiración del vapor de agua y de los compuestos volátiles, alcanzando el día 14 una disminución cercana al 12 % con relación al inicio del experimento, momento en el que se observó un notable deterioro de las bayas en la epidermis, y disminución de la calidad comercial.
Figura 4. Pérdida de peso (%) del tomate de árbol durante los días poscosecha
Cambios fisicoquímicos
La figura 5 presenta los valores medios con intervalos LSD (95%) de los parámetros fisicoquímicos (% rendimiento, % SST, pH y % de acidez) durante los días poscosecha. El rendimiento presentó diferencias estadísticas altamente significativas, con una tendencia de aumento desde valores iniciales del 52% en la madurez de cosecha hasta valores alrededor del67% en la madurez de consumo, lo cual está de acuerdo con Gutiérrez y López, 1999 (18). Esto permite establecer que, para el procesamiento, el fruto debe estar en el grado de madurez ideal o de consumo, lo cual se logra en el día 10 para las condiciones de experimentación aplicadas (14).
El % SST presentó diferencias estadísticas significativas durante el proceso de maduración con 5 grupos homogéneos, atribuibles a la variabilidad de las muestras(9,5-12% SST). Se observa una tendencia ligeramente creciente hasta el día 5, y posteriormente, en la etapa de maduración y sobremaduración, el comportamiento puede considerarse constante pero con alta variabilidad. Esto puede atribuirse a la hidrólisis de los almidones, que se desdoblan en disacáridos y monosacáridos más simples como sacarosa, fructuosa y glucosa (19, 20, 21).
Los factores pH y % de acidez, durante el periodo en que se alcanza la maduración de consumo, presentaron una correspondencia en su comportamiento (< % de acidez, > pH), sin embargo el ANOVA no presentó diferencias significativas para el pH y sí para la acidez. Se observaque para ambos factores existe un grupo homogéneo correspondiente a los primeros 10 días, y de ahí en adelante, a medida que la concentración de ácidos disminuye, el pH presenta una ligera tendencia al aumento. Esta situación podría relacionarse con la disminución de hidrogeniones libres presentes en la pulpa de fruta, posiblemente debido a que muchos de los ácidos orgánicos participan durante ésta etapa en la formación de sustancias volátiles aromáticas (22), lo cual podría favorecer aspectos organolépticos.
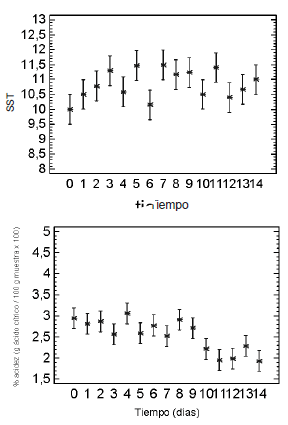
Figura 5. Evolución del % de rendimiento, % de sólidos solubles totales (SST), pH y el % de acidez durante los días poscosecha
Cambios en la texturaLa figura 6 presenta los valores medios con intervalos LSD (95%) de la fuerza máxima de penetración del tomate de árbol durante los días poscosecha evaluados. El ANOVA presentó diferencias estadísticas, con una tendencia decreciente a lo largo del tiempo en los valores medios de firmeza. Esto tiene correspondencia con el comportamiento del índice de respiración y con la misma maduración del fruto, evidenciándose una disminución de la resistencia del material vegetal (22). Los niveles de la fuerza máxima de penetración en el grado de madurez de consumo están alrededor de 40 Newton (N). Restrepo 2005 (23) considera que para algunos frutos una carga correspondiente al 70% de la máxima no presenta afectación en el almacenamiento; por lo tanto, para frutos de tomate de árbol en estado de madurez de consumo, cargas de 28 N pueden ser soportadas sin que se vean afectados físicamente. Esta disminución de la fuerza máxima de penetración puede atribuirse a los cambios propios en las paredes celulares de la pulpa durante el proceso de maduración, producto de la degradación por hidrólisis del componente péctico, que a la vez desagregan otros compuestos, como celulosa y hemicelulosa (21). Por otro lado, las células de la epidermis presentan un comportamiento ligeramente elástico a medida que pasan los días de poscosecha, lo cual se origina principalmente en la formación de ácidos pécticos solubles, y genera una mayor flexibilidad en el material.
Figura 6. Evolución de la firmeza del tomate de árbol durante los días poscosecha
Cambios en el color
La figura 7 presenta los valores medios con intervalos LSD (95%) de la luminosidad (L*), cromaticidad a* y cromaticidad b* en la epidermis o cáscara (subíndice c) y en la pulpa (subíndice p) durante los días poscosecha.
Figura 7. Evolución de los parámetros de color en la epidermis (subíndice c) y en la pulpa (subíndice p) durante los días poscosecha.
El análisis de luminosidad en la epidermis (Lc*) presentó diferencias estadísticas altamente significativas, con una tendencia creciente, lo cual corresponde a la pérdida de tonalidades oscuras desde el mismo inicio del tiempo poscosecha (24). Las cromaticidades ac* y bc* presentaron diferencias altamente significativas, con una tendencia creciente en los tonos rojo y amarillo respectivamente, lo cual da como resultado una tonalidad anaranjada, que se acentúa con la maduración y la sobremaduración del fruto. Esto puede atribuirse al aumento en la concentración de pigmentos carotenoides, que sumados a la presencia de antocianinas, genera el color natural del tomate de árbol en la epidermis durante su maduración (25).
El análisis de luminosidad en la pulpa (Lp*), no presentó diferencias estadísticas, a pesar de encontrarse variabilidad en la lectura de las muestras, lo que indica que los cambios de color que se observan en el desarrollo de la maduración en la pulpa, no están influenciadospor el valor de Lp*. La cromaticidad ap* presentó durante los primeros 8 días una tonalidad roja constante, la cual fue disminuyendo a medida que avanza hacia la sobremaduración,debido posiblemente a que a partir de este día hubo un enmascaramiento de los pigmentos antocianos, responsables de la aparición de tonos fuertes, y un afloramiento de los pigmentos carotenoides (25); mientras que la cromaticidad bp* refleja diferencias estadísticas significativas, acentuando el color amarillo con los días poscosecha. La tonalidad anaranjada resultante en la pulpa, presentó una menor intensidad que la alcanzada en la epidermis del tomate de árbol.
Cambios microestructurales
La figura 8 presenta la microestructura de los tejidos internos de la pulpa en el fruto tomate de árbol, para los estados de madurez 0% (A) y 100% (B), correspondientes a estados de la fruta verde y madura respectivamente. Las micrografías permiten apreciar la arquitectura celular del tejido verde (A), donde las paredes celulares están bien definidas, y en la micrografía B, el interior de las células tiene apariencia dendrítica, propia de los artefactos resultantes en el proceso de sublimación del agua contenida en las células.
(A) (B)
Figura 8. Micrografías de la pulpa del tomate de árbol en grado de madurez del 0% ó verde (A) y 100% ó maduro (B)
En la pulpa madura, el tejido internopresenta una degradación de la arquitectura celular, en la cual una mayor cantidad de líquido nativo se ubica especialmente en los espacios intercelulares, como producto de las reacciones enzimáticas propias del proceso y de la degradación de la celulosa, la hemicelulosa y el componente péctico de las paredes celulares (14).
CONCLUSIONES
El comportamiento observado de la respiración del fruto, permitió confirmar al tomate de árbol como unfruto no climatérico, con un tiempo óptimo de maduración de 10 días de poscosecha, para las condiciones de experimentación de 23°C y 65% de HR, alcanzando un nivel de pérdidas de peso por transpiración entre 8 y 10%. Los cambios fisicoquímicos presentaron un ligero aumento en el contenido de azúcares, de 10 a 11% SST, en el pH de 3,7 a 4,7, y una leve disminución del % de acidez de 2,9 a 2,0.La firmeza del fruto fue el parámetro que presentó mayor variación durante los 14 días de almacenamiento poscosecha, disminuyendo de 44 N hasta 27 N en los frutos sobremadurados. La carga permitida en la maduración de consumo, está en el orden de28 N, sin que el fruto se vea afectado físicamente. La evaluación instrumental del color en la epidermis y en la pulpa, permitió evidenciar incremento de la cromaticidad roja (> a*, < pigmentos clorofílicos) y amarilla (> b*, > pigmentos carotenos) en los días poscosecha y esto condujo a revalidar la tonalidad anaranjada observada, la cual se hace más acentuada con la maduración. La microscopía electrónica de barrido (SEM) permitió observar la degradación de la pared celular en los tejidos de la pulpa de frutos maduros con relación a los tejidos de los frutos verdes.
La valoración de los parámetros estudiados durante el almacenamiento poscosecha del fruto del tomate de árbol, permite establecer factores de calidad; no obstante, por lo complejo de losprocesos y reacciones que están ocurriendo simultáneamente dentro del fruto durante la maduración, se deben considerar de manera integral para mejorar su manejo poscosecha con fines de prolongar la vida útil.
AGRADECIMIENTOS
A los Laboratorios de Frutas y Hortalizas y de Procesos Agrícolas de la Universidad Nacional de Colombia, Sede Medellín, y al Ingeniero Agrónomo Diego Tamayo, de la Finca La Guairá, del Municipio de Entrerríos, Antioquia.
REFERENCIAS BIBLIOGRÁFICAS
1. Villamizar F. Manejo tecnológico poscosecha de frutas y hortalizas. Manual de prácticas. Bogotá: Universidad Nacional de Colombia; 2001. [ Links ]
2. Ordóñez RM, Vattuone MA, Isla MI. Changes in carbohydrate content and related enzyme activity during Cyphomandra betacea (Cav.) Sendtn. fruit maturation. Postharvest Biology and Technology. 2004; (35): 293-301. [ Links ]
3. Velástegui J, Cherrez R. Manual del cultivo del tomate de árbol. Ambato Ecuador:Sena; 1992. [ Links ]
4. Reyes Chilpa R, Sanabria D. Etnobotánica. Bogotá: Universidad Nacional de Colombia;1993. [ Links ]
5. Soria Hidrovo N. Cultivo de tomate de árbol. Servicio de información agropecuaria del Ministerio de Agricultura y Ganadería del Ecuador; 2006. [ Links ]
6. Lobo M. Tomate de árbol (Cyphomandra betacea Sendt), frutal promisorio para la diversificación del agro andino. Medellín: Corpoica; 2004. [ Links ]
7. Portela SI. Postharvest physiology and handling of tamarillos (Cyphomandra betacea).Avances en Horticultura. 2001; 4(1): 40-50. [ Links ]
8. Azcón-Bieto J,Talón M. Fundamentos de fisiología vegetal. España: McGraw Hill; 2003. [ Links ]
9. Pantastico E. Posharvest physiology handling and utilizations of tropical and subtropical fruits and vegetables. Westport: Avi; 1981. [ Links ]
10. Instituto Colombiano de Normas Técnicas. Norma Técnica Colombiana (NTC-4105); 1997. [ Links ]
11. Sharma S, Mulvaney S,Risvi, S. Ingeniería de alimentos. México: Limusa Wiley; 2003. [ Links ]
12. Muller GH. Introducción a la reología de los alimentos. Zaragoza: Acribia;1973. [ Links ]
13. Lagos Roa E, Kairuz de Civetta L. Análisis de crecimiento del fruto y determinación del momento óptimo de cosecha para las variedades de mango Tommy Atkins y Kent y su comportamiento en maduración controlada. Bogotá: Universidad Nacional de Colombia; 1990. [ Links ]
14. Camacho G, Romero G. Obtención y conservación de pulpas: Mora, guanábana, lulo y mango. Bogotá. ICTA - Universidad Nacional de Colombia; 1996. [ Links ]
15. Bernal de Ramírez I. Análisis de alimentos. Bogotá: Guadalupe; 1993. [ Links ]
16. Ciro H, Vahos D, Márquez C. Estudio experimental de la fuerza de fractura en frutas tropicales: El tomate de árbol (Cyphomandra betacea Sendtl). DYNA. 2004; (146): 55-64. [ Links ]
17. Hernando I, Pérez M, Lluch M. Microstructural characterization of Burgos cheese using different microscopy techniques. Food Sci. Tech. Int. 2000; 6(2):151-157. [ Links ]
18. Gutiérrez Vásquez A, López Millán M. Manejo poscosecha y comercialización del tomate de árbol. Armenia: Fudesco;1999. [ Links ]
19. Budde CO, Polenta G, Lucangeli CD, Murria RE. Air and immersion heat treatments affect ethylene production and organoleptic quality of Dixiland' peaches. Postharvest Biology and Technology. 2006; (41): 32-37. [ Links ]
20. Gallo F. Manual de fisiología, patología poscosecha y control de calidad en frutas y hortalizas. Armenia, Colombia: NRI, SENA, DFID; 1997. [ Links ]
21. Fennema O. Química de alimentos. Zaragoza: Acribia; 1993. [ Links ]
22. Park YS, Jung ST, Gorinstein S. Ethylene treatment of Hayward' kiwifruits (Actinidia deliciosa) during ripening and its influence on ethylene biosintesis and antioxidant activity. Scientia horticolturae. 2006; (108): 22-28. [ Links ]
23. Restrepo JC. Caracterización y normalización de los recipientes de cosecha y empaques de comercialización de frutas en Colombia. Chinchiná: Cenicafé; 2005. [ Links ]
24. Coelho de Lima M, Elesbao Alves R, Cunha Filgueiras H, Eneas Filho J. Comportamento respiratório e qulidade pós-colheta de graviola (Annona muricata L.) morada sob temperatura ambiente. Rev. Bras. Frutic. 2003; 25(1):1-10. [ Links ]
25. Charley H. Tecnología de alimentos. México:Limusa; 1991. [ Links ]
Recibido: Mayo 15 de 2007 Aceptado: Septiembre 10 de 2007
*Autor a quien se debe dirigir la correspondencia: cjmarque@unalmed.edu.co






















