Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.15 no.2 Medellín July/Dec. 2008
FARMACOLOGÍA Y TOXICOLOGÍA
SÍNTESIS Y ACTIVIDADES LEISHMANICIDA Y CITOTÓXICA in vitro DE ANÁLOGOS 2-ARILQUINOLINAS
SYNTHESIS AND in vitro LEISHMANICIDAL AND CYTOTOXIC ACTIVITIES OF 2-STYRYLQUINOLINES ANALOGS
Ana M. MESA V.1; Paula A. MOLANO M.2; Blandine SEON.3; Bruno FIGADERE.3; Sara M. ROBLEDO.4; Diana L. MUÑOZ.1; Jairo A. SÁEZ V. 1*
1 Grupo Química de Plantas Colombianas, Instituto de Química, Universidad de Antioquia. A.A. 1226. Medellín, Colombia.
2 Departamento de Química, Universidad de Córdoba, Cra 6 Nº 76-103, Montería, Colombia
3 Laboratoire de Pharmacognosie, Associé au CNRS (BIOCIS), Université de Paris-Sud, F-92296, Chatenay-Malabry, France.
4 Programa de Estudio y Control de Enfermedades Tropicales PECET, Universidad de Antioquia. A.A. 1226. Medellín, Colombia.
RESUMEN
Actualmente la quimioterapia de la leishmaniasis es promisoria, sin embargo aun no se dispone de un medicamento adecuado. Varias quinolinas sustituidas han presentado actividad in vitro contra agentes causales de leishmaniasis cutánea, leishmaniasis visceral, tripanosomiasis africana y enfermedad de Chagas. En este trabajo se sintetizan seis 2-arilquinolinas derivadas de la galipeina mediante condensación de Perkin a partir de quinaldina y aldehídos aromáticos. La actividad leishmanicida se evalúa en amastigotes axénicos y la actividad citotóxica en células U-937. Todos los compuestos muestran ser activos contra leishmania panamensis pero también contra células mamíferas. Los compuestos estirilquinolinas 2-[(E)-2-(2,5-dimetoxifenil)etenil]quinolina (1), 2-[(E)-2-(2,3-dimetoxifenil)etenil]quinolina (2) y N-{4-[(E)-2-quinolin-2-iletenil]fenil}acetamida (3) son mas activos sobre amastigotes axénicos (CE50 = 3,7; 4,5 y 19,1μg/mL) e intracelulares (CE50 = 1,4; 1,8 y 1,7μg/mL), en comparación con los derivados hidrogenados 2-[2-(2,5-dimetoxifenil)etil]quinolina (1a), 2-[2-(2,3-dimetoxifenil)etil]quinolina (2a) y N-[4-(2-quinolin-2-iletil)fenil]acetamida (3a) (CE50= 31,1; 23,6 y 59,3μg/mL). Todos los compuestos muestran también actividad contra células U-937 con CE50 de 3,7; 6,2 y 4,5μg/mL para las estirilquinolinas 1, 2 y 3, respectivamente y CE50 de 16,0; 12,9 y 20,2μg/mL para los derivados hidrogenados 1a, 2a y 3a, respectivamente. Aunque el proceso de hidrogenación produjo una disminución tanto de la actividad leishmanicida como de la actividad citotóxica, la actividad leishmanicida mostrada por los compuestos de tipo 2-estirilquinolinas les confiere un potencial como moléculas candidatas para el desarrollo de compuestos anti-leishmania.
Palabras clave: Actividad leishmanicida, estirilquinolinas, citotocixidad, amastigotes axénicos.
ABSTRACT
The search of new treatments for leishmaniasis is an active task nowadays, since there is a lack of non-toxic, cheap and non-resistant medication. In the literature several quinolines have shown in vitro activity against agents of cutaneous leishmaniasis, visceral leishmaniasis, African trypanosomiasis and Chagas diseases. Six 2-styrylquinolines derived from galipeine were synthesized by Perkin condensation of quinaldine with aromatic aldehydes. Leishmanicidal activity was estimated for leishmania panamensis at the amastigote form and cytotoxic activity against U-937 cells. All compounds showed activity against both L. panamensis and U-937 cells. (E)-2-(2,5-dimethoxyphenyl)ethenyl)quinoline (1), (E)-2-(2,3-dimethoxyphenyl)ethenyl)quinoline (2) and (E)-N-[4-(2-quinolin-2-yl-ethenyl)phenyl]acetamide (3) were more active against axenic (EC50= 3.7, 4.5 and 19.1μg/mL) and intracellular amastigotes (EC50= 1.4, 1.8 and 1.7μg/ml, respectively), in comparison with hydrogenated derivatives 2-[2-(2,5-dimethoxyphenyl)ethyl]quinoline (1a), 2-[2-(2,3-dimethoxyphenyl)ethyl]quinoline (2a) and N-[4-(2-quinolin-2-ylethyl)phenyl]acetamide (3a) (CE50= 31.1, 23.6 and 59.3μg/mL, respectively). All compounds were also active against the U-937 cells. Styrylquinolines 1, 2 and 3 showed a LC50 of 3.7, 6.2 and 4.5μg/mL, respectively and the hydrogenated derivatives 1a, 2a and 3a showed a LC50 of 16.0. 12.9 and 20.2μg/mL, respectively. Although hydrogenation reduced the leishmanicidal and cytotoxic activities, the activity showed against leishmania parasites suggests this compound series has potential as drug candidates for the treatment of leishmaniasis.
Key words: Leishmanicidal activity, 2-styrylquinolines, cytotoxicity, axenic amastigotes, intracellular amastigotes.
INTRODUCCIÓN
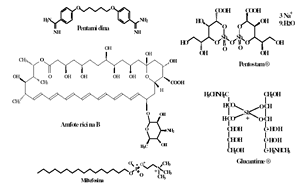
Las enfermedades protozoarias como la leishmaniosis, la malaria y la enfermedad de Chagas, tienen un impacto significativo en el desarrollo de los países que se encuentran en las regiones tropicales y subtropicales del planeta, principalmente en Asia, África y Latinoamérica. La leishmaniosis es endémica en 88 países y se estima que 12 millones de personas son infectadas y 350 millones se encuentran en zonas de riesgo de infección (1, 2). En Colombia, la enfermedad se encuentra en el 91% de todo el territorio ubicado bajo los 1.750 msnm (3). Esta enfermedad es causada por cerca de 20 especies de parásitos del género leishmania, que en el nuevo mundo es transmitido por insectos dípteros del género Lutzomyia. Sus reservorios son animales domésticos y silvestres como el perro, el perezoso, la zarigüeya-chucha, la zorra y pequeños mamíferos. En el hombre esta enfermedad afecta la piel, las mucosas y los órganos del sistema mononuclear fagocítico, causando así los cuadros clínicos de leishmaniosis cutánea, mucosa y visceral, respectivamente (1, 3). Los tratamientos usados para esta enfermedad se basan en antimonio pentavalente SbV como el Pentostam® y el Glucantime ®, los cuales inhiben enzimas glicolíticas, la oxidación de ácidos grasos (1, 4, 5) y la acción de la topoisomerasa I de leishmania, afectándose así procesos como el superenrollamiento y desenrollamiento del ADN necesarios en el proceso de duplicación del ADN (6). Estos medicamentos son utilizados desde hace 50 años. Sin embargo, actualmente presentan varios inconvenientes como eficacia y toxicidad variable, esquemas de tratamiento prolongados de administración parenteral y resistencia del parásito al medicamento. Como alternativas terapéuticas se han venido utilizando la pentamidina y la anfotericina B ( Vease figura 1); aunque efectivos, su uso es limitado debido a que son igual o más tóxicos que los antimoniales, requieren mayor supervisión y son aún más costosos (1, 2). Actualmente se esta evaluando el uso de la Miltefosina (Véase figura 1), un medicamento de administración oral, inicialmente desarrollado como agente antitumoral y que ha demostrado ser muy eficaz para el tratamiento de la leishmaniasis visceral en la India (7). La principal limitación de la Miltefosina es su teratogenicidad por lo que está contraindicado su uso en mujeres embarazadas (7, 8, 9). Aunque la situación de la quimioterapia de la leishmaniasis es promisoria, aun no se dispone de un medicamento adecuado, por lo que es necesario buscar nuevos medicamentos que aporten al control de la enfermedad.
Figura 1. Medicamentos utilizados en el tratamiento de la Leishmaniasis
El núcleo quinolínico se encuentra en muchos agentes farmacológicamente activos como leishmanicidas, antimaláricos, antibacteriales, antiinflamatorios, antiasmáticos, antihipertensivos, agentes inhibidores de la tirosinquinasa, y antitripanosoma entre otros (10-14). Varias quinolinas sustituidas presentan actividad in vitro contra agentes causales de leishmaniasis cutánea, leishmaniasis visceral, tripanosomiasis africana, enfermedad de Chagas y contra el virus HTLV-1 (15-19).
Estudios etnofarmacológicos sobre uso de plantas contra la leishmania, particularmente de la planta Galipea longiflora (Rutaceae) utilizada por los indígenas de Bolivia para tratar la leishmaniasis (20), han permitido identificar quinolinas sustituidas en el carbono-2 como activas contra leishmania amazonensis y Trypanosoma cruzi pero también contra Plasmodium vinckei petteri (19, 21, 22). Así mismo, análogos 2-arilquinolinicos con grupos carboxilos, son potentes inhibidores in vitro del virus de inmunodeficiencia humana del tipo-1 (HIV-1) (23).
En este trabajo se evalua la actividad leishmanicida y citotóxica de 2-arilquinolinas sintetizadas por reacción tipo Perkin entre quinaldina y los aldehídos aromáticos 2,5-dimetoxibenzaldehido, 2,3-dimetoxibenzaldehido y 4-acetamidobenzaldehido en presencia de anhídrido acético, luego reducidos por hidrogenación catalítica con carbón sobre paladio, con la finalidad de buscar nuevas y mas eficaces alternativas en la terapia de la leishmaniosis.
MATERIALES Y MÉTODOS
Los reactivos para la síntesis de las estirilquinolinas 2-[(E)-2-(2,5-dimetoxifenil)etenil]quinolina (1), 2-[(E)-2-(2,3-dimetoxifenil)etenil]quinolina (2) y N-{4-[(E)-2-quinolin-2-iletenil]fenil}acetamida (3), y las dihidroestirilquinolinas 2-[2-(2,5-dimetoxifenil)etil]quinolina (1a), 2-[2-(2,3-dimetoxifenil)etil]quinolina (2a) y N-[4-(2-quinolin-2-iletil)fenil]acetamida (3a) fueron obtenidos de Sigma-Aldrich: quinaldina, 2,5-dimetoxibenzaldehído, 2,3-dimetoxibenzaldehído, 4-acetamido-benzaldehído y anhídrido acético.
Las reacciones se monitorean por cromatografía de capa fina sobre placas de silica gel (Merck Kiesegel 60 F254), utilizando como revelador el reactivo de Dragendorff. Las separaciones se realizaron por cromatografía instantánea, empleando silica gel 60 (0,063-0,200 mm) Merck como fase estacionaria. Los disolventes que se utilizan como eluentes para las cromatografías son éter de petróleo, diclorometano, acetato de etilo, y hexano grado comercial los cuales se destilaron antes de su uso.
Los espectros infrarrojo (IR) se obtuvieron en un equipo Perkin-Elmer RX/FT-IR system; donde sólo se reportan las absorbancias características. Para el análisis espectroscópico se utilizaron dos espectrómetros Bruker de 300 y 250 MHz para 1H y de 75 MHz para 13C utilizando cloroformo deuterado (CDCl3) como disolvente. Los desplazamientos químicos (δ) están expresados en partes por millón (ppm) tomando como referencia el TMS y las constantes de acoplamiento (J) en Herzios (Hz). El equipo de espectrometría de masas empleado fue un Nermag-Sidar R-10-10C.
Las dihidroestrilquinolinas 2-[2-(2,5-dimetoxifenil)etil]quinolina (1a), 2-[2-(2,3-dimetoxifenil)etil]quinolina (2a) y N-[4-(2-quinolin-2-iletil)fenil]acetamida (3a) fueron obtenidas por hidrogenación de los compuestos de síntesis 2-[(E)-2-(2,5-dimetoxifenil)etenil]quinolina (1), 2-[(E)-2-(2,3-dimetoxifenil)etenil]quinolina (2) y N-{4-[(E)-2-quinolin-2-iletenil]fenil}acetamida (3), respectivamente (Véanse figura 2 y figura 3).
Síntesis de estirilquinolinas 1-3
A una solución de quinaldina (30 mmol) en 50 mL de anhídrido acético se le adicionaron 40 milimoles del aldehído apropiado y la mezcla se sometió a reflujo durante 12 horas. Después de dejar enfriar a temperatura ambiente, la solución se neutralizó con NaHCO3 y se extrajo (2x50 mL) con la mezcla hexano: acetato de etilo (1:2); la solución orgánica se secó sobre sulfato de sodio anhidro, se filtró y se evaporó a presión reducida. El extracto crudo se purificó por cromatografía flash utilizando como eluente hexano: acetato de etilo (9:1), obteniéndose de esta manera las estirilquinolinas 2-[(E)-2-(2,5-dimetoxifenil)etenil]quinolina (1), 2-[(E)-2-(2,3-dimetoxifenil)etenil]quinolina (2) y N-{4-[(E)-2-quinolin-2-iletenil]fenil}acetamida (3) (Véase figura 2) (13, 24 , 25).
Figura 2. Preparación de Estirilquinolinas.

Reducción de las estirilquinolinas 1-3
A una solución de estirilquinolina (500 mg) en etanol (10 mL), se le adicionaron 30 mg de carbón sobre paladio al 10% bajo atmósfera de hidrógeno a 20 ºC y se dejó en agitación durante 12 horas. El catalizador se removió por filtración a través de silica gel y esta fue lavada con porciones de CH2Cl2. El filtrado se concentró a vacío obteniéndose los compuestos hidrogenados dihidroestrilquinolinas 1a - 3a en forma cuantitativa (Véase figura 3).
Figura 3. Reducción de las estirilquinolinas

Evaluación in vitro de la actividad Leishmanicida y Citotóxica de las estirilquinolinas 1-3 y las dihidroestrilquinolinas 1a - 3a
A los compuestos 1, 2, 3, y sus derivados hidrogenados 1a, 2a, 3a se les evaluó in vitro la actividad leishmanicida en amastigotes axénicos de L. (V.) panamensis (Cepa M/HOM/87/UA140GFP) así como la actividad citotóxica sobre la línea celular promonocítica humana U937 (CRL-1593.2™ de ATCC). La Anfotericina B se utilizó como medicamento control de citoxicidad y efectividad. Se utilizaron como control de viabilidad celular parásitos cultivados en ausencia de los compuestos pero mantenidos bajo las mismas condiciones. Para cada compuesto se evaluaron seis concentraciones (diluciones dobles a partir de 125 µg/mL hasta 3,5 µg/mL en dimetil sulfóxido, DMSO). Cada concentración de los compuestos sintetizados, la Anfotericina B así como el control de células sin tratamiento y el control de DMSO se evaluó por triplicado en dos experimentos independientes. Los resultados se expresan como la concentración Letal 50 (CL50) para citotoxicidad y como concentración efectiva 50 (CE50) para actividad leishmanicida. Tanto la CL50 como la CE50 se calcularon por el método Probit. El índice de selectividad (IS) se calculó dividiendo la actividad citotóxica entre la actividad leishmanicida (IS = CL50 / CE50).
La actividad leishmanicida se evaluó en amastigotes axénicos empleando el micrométodo enzimático MTT [bromuro 3-(4,5dimetiltiazol-2il)-2,5-difenil tetrazolio]. Los parásitos se cultivaron a una concentración de 1x106 parásitos/mL (100,000 parásitos/pozo) en medio Scheneider, pH 5.2 suplementado con 20% de SFB y luego de 72 horas de incubación a 32oC en presencia o ausencia de los compuestos, se determinó la actividad leishmanicida midiendo la actividad de la deshidrogenasa mitocondrial de los parásitos, adicionando 20µL/pozo de MTT e incubando a 32°C durante 4 horas. La reacción enzimática se interrumpió adicionando 100µL/pozo de una solución al 50% de isopropanol y 10% de SDS. La producción de formazán se midió a 570 nm en un espectrofotómetro (ELISA reader Bio-Rad).
La actividad citotóxica de los productos en las células U937 se evaluó también por el método MTT siguiendo la metodología descrita previamente por Weniger y col (2001) (26). Las células U937 se dispensaron en platos para cultivo celular de 96 pozos a una concentración de 100,000 células/mL (10,000 células/pozo) en medio RPMI-1640 suplementado con 10% de suero fetal bovino (SFB) y la correspondiente concentración de los compuestos. Las células se incubaron a 37oC con 5% CO2 durante 72 horas y se determinó el efecto citotóxico midiendo la actividad de la deshidrogenasa mitocondrial de las células, adicionando 10µL/pozo de MTT e incubando a 37°C durante 3 horas. La reacción enzimática se interrumpió con la adicion de 100µL/pozo de isopropanol-SDS, y la producción de formazán se midió a 570 nm, como se describió previamente. Células U937 cultivadas en ausencia del los productos pero mantenidas bajo las mismas condiciones se utilizaron como control de viabilidad.
La actividad leishmanicida de las estirilquinolinas 1-3 se confirmó en amastigotes intracelulares de L. (V) panamensis por citometría de flujo. Las células U937 se dispensaron en platos de 24 pozos para cultivo celular a una concentración de 10,000 células/pozo. Las células se trataron con 1 µM de acetato de forbol miristato (PMA) (Sigma) durante 48 h a 37°C con el fin de permitir su diferenciación a macrófagos y luego se infectaron con promastigotes de L. panamensis expresando GFP a una proporción de 1:35 parásito: célula. Luego de 2 horas de incubación a 34°C en 5% CO2, los promastigotes extracelulares se retiraron mediante dos lavados con solución salina tamponada con fosfatos (PBS) y se incubaron de nuevo a 34°C, 5% de CO2 a fin de permitir la transformación de los promastigotes internalizados en amastigotes y la multiplicación de estos al interior de los macrófagos. Después de 24 horas de incubación se adicionaron los compuestos a las correspondientes concentraciones y se mantuvieron a 34°C, 5% CO2 durante 96 horas, haciendo cambio de medio a las 48 horas de incubacion. A las 96 horas, las células infectadas y tratadas, al igual que las células no infectadas, se desprendieron con una solución de 0.25% tripsina/1mM EDTA (Gibco), se levaron dos veces con PBS centrifugando 5 minutos a 1300 rpm. Las células se tiñeron con 5 µL de anti-CD33 conjugado a phycoeritrin (PE) (Pharmingen) y se fijaron con 0.5% paraformaldeido (PHA) (Sigma) en PBS. Las células infectadas al igual que las células no infectadas se analizaron según la intensidad de fluorescencia relativa de GFP (fluorescencia verde) y PE (fluorescencia roja) en un citómetro de flujo Beckman-coulter Epics XL con laser de argón (488 nm: excitación y 525 nm: emisión). Se evaluaron 10.000 eventos y los datos se procesaron utilizando el programa WinMDI.
RESULTADOS Y DISCUSIÓN
Los compuestos 2-[(E)-2-(2,5-dimetoxifenil)etenil]quinolina (1), 2-[(E)-2-(2,3-dimetoxifenil)etenil]quinolina (2) y N-{4-[(E)-2-quinolin-2-iletenil]fenil}acetamida (3), se obtuvieron por calentamiento entre la quinaldina y los aldehídos 2,5-dimetoxibenzaldehído, 2,3-dimetoxibenzaldehído, 4-acetamidobenzaldehído respectivamente en presencia de anhídrido acético. Los derivados reducidos 2-[2-(2,5-dimetoxifenil)etil]quinolina (1a), 2-[2-(2,3-dimetoxifenil)etil]quinolina (2a) y N-[4-(2-quinolin-2-iletil)fenil]acetamida (3a) , se obtuvieron por hidrogenación catalítica con carbón sobre paladio, los cuales fueron caracterizados por técnicas espectroscópicas (IR, RMN-1H, RMN-13C, J-MOD).
Datos espectroscópicos de las 2-arilquinolinas
2-[(E)-2-(2,5-dimetoxifenil)etenil]quinolina (1): C19H17NO2, TOF ESI 314 (M++Na), PM: 291,1. IR υ (cm-1) 3000; 3056; 2942; 2833; 2362, 2253; 1632; 1613-1496; 904; 723. RMN-1H δ (ppm) 7.47 (d, J= 8.05, 1H, H-3); 8.11 (d, J= 8.60 Hz, 1H, H-4); 8.08 (d, J= 8.60Hz, 1H, H-5); 7.48 (t, J=8.05 Hz, 1H, H-6); 7.69 (t, J= 8.41 Hz, 1H, H-7); 7.78 (d, J= 8.67 Hz, 1H, H-8); 7.44 (d, J= 16.59 Hz, 1H, H-1’ ); 7.99 (d, 16.63 Hz, 1H, H-2’); 6.87 (d, J= 1.68 Hz, 1H, H-3’’); 7.27 (d, J=8.02 Hz, 1H, H-4’’ ); 6.86 (d, J= 1.68 Hz, 1H, H-6’’ ); 3.88 (s, 3H); 3.83 (s, 3H); RMN-13C (ppm) 156.57 (C2); 118.82 (C3); 136.18 (C4); 127.26 (C4a); 126.06 (C5, C6); 129.10 (C7, C8); 148.14 (C8a); 127.44 (C1’); 129.63 (C2’); 151.91 (C2’’); 115.78 (C3’’); 112.44 (C4’’); 153.73 (C5’’); 111.35 (C6’’); 56.23 (OCH3); 55.79 (OCH3).
2-[(E)-2-(2,3-dimetoxifenil)etenil]quinolina (2): C19H17NO2, TOF ESI 314 (M++Na), P.M 291,1. IR υ (cm-1) 3058; 3003; 2937 ; 2835; 2360-2207; 1632; 1614-1504; 1832; 906; 725. RMN-1H δ (ppm) 7.46 (d, J= 7.85 Hz, 1H, H-3); 8.11 (d, J= 8.56Hz, 1H, H-4); 8.08 (d, J= 8.56Hz, 1H, H-5); 7.48 (t, J= 8.11 Hz, 1H, H-6); 7.69 (t, J= 8.40 Hz, 1H, H-7); 7.77 (d, J= 8.52 Hz, 1H, H-8); 7.97 (d, J= 16.60 Hz, 1H, H-1’); 7.45 (d, J= 16.70 Hz, 1H, H-2’); 6.89 (d, J= 8.12 Hz, 1H, H-4’’ ); 7.09 (t, J= 8.04 Hz, 1H, H-5’’); 7.37 (d, J= 7.98 Hz, 1H, H-6’’); 3.88 (s, 3H); 3.91 (s, 3H); RMN-13C (ppm) 156.82 (C2); 118.78 (C3); 136.62 (C4); 127.71 (C4a); 129.16 (C5); 126.55 (C6); 130.06 (C7); 129.60 (C8); 147.91 (C8a); 127.87 (C1’); 130.93 (C2’); 131.10 (C1’’); 153.45 (C2’’); 148.68 (C3’’); 112.750 (C4’’); 124.62 (C5’’); 119.28 (C6’’); 56.23 (OCH3); 61.69 (OCH3).
N-{4-[(E)-2-quinolin-2-iletenil]fenil} acetamida (3): C19H16N2O, TOF ESI 311 (M++Na), P.M 288,1. IR υ (cm-1) 3393; 3039; 2362; 2252; 1704; 1637; 1426; 1367; 1614; 909; 1240; 728. RMN-1H δ (ppm) 7.46 (d, J= 8.77 Hz, 1H, H-3); 8.11 (d, J= 8.56 Hz, 1H, H-4); 8.08 (d, J= 8.56 Hz, 1H, H-5); 7.48 (t, J= 8.11 Hz, 1H, H-6); 7.69 (t, J= 8.40 Hz, 1H, H-7); 7.78 (d, J= 8.09 Hz, 1H, H-8); 7.42 (d, J= 16.60 Hz, 1H, H-1’); 7.70 (d, J= 16.70 Hz, 1H, H-2’); 7.65 (d, J= 8.64 Hz, 1H, H-2’’, H-6’’); 7.71 (d, J= 8.64 Hz, 1H, H-3’’, H-5’’); 2.31 (s, 3H). RMN-13C (ppm) 155.45 (C2); 119.39 (C3); 132.88 (C4); 129.14 (C4a); 126.43 (C5); 128.50 (C6); 130.51 (C7); 129.90 (C8); 148.24 (C8a); 136.52 (C1’); 129.25 (C2’); 137.28 (C1’’); 129.25 (C2’’, C6’’); 128.50 (C3’’, C5’’) 139.30 (C4’’); 26.99 (CH3); 172.95 (C=O).
2-[2-(2,5-dimetoxifenil)etil]quinolina (1a): C19H19NO2, TOF ESI 316 (M++Na), P.M 293,3 u.m.a. IR υ (cm-1) 2948; 2835; 2361, 2341, 2252, 1601-1502; 1159; 904, 724. RMN-1H δ (ppm) 7.07 (d, J= 8.41 Hz, 1H, H-3); 7.90 (d, J= 8.47 Hz, 1H, H-4); 7.83 (d, J= 8.44 Hz, 1H, H-5).7.28 (t, J= 7.48, 1H, H-6); 7.49 (t, J= 7.64 Hz, 1H, H-7); 7.56 (d, 8.07 Hz, 1H, H-8); 2.94 (ddd, J= 6.35, 10.24, 15.45 Hz, 2H, H-1’); 3.08 (ddd, J= 6.35, 10.24, 15.45 Hz, 2H, H-2’); 6.58 (d, 1H, J= 8.61 Hz, H-3’’); 6.51(dd, 1H, J= 2.86, 8.85 Hz, H-4”); 6.60 (d, 1H, J= 2.85 Hz, H-6”); 3.51 (s, 3H); 3.58 (s, 3H). RMN-13C (ppm) 162.39 (C2); 121.66 (C3); 136.13 (C4); 126.81 (C4a); 127.52 (C5); 125.73 (C6); 128.82 (C7); 129.34 (C8); 147.90 (C8a); 39.28 (C1’); 30.77 (C2’); 131.010 (C1’’); 151.80 (C2’’); 111.18 (C3’’); 111.51 (C4’’); 153.42 (C5’’); 116.21(C6’’); 55.65 (OCH3); 55.87 (OCH3).
2-[2-(2,3-dimetoxifenil)etil]quinolina (2a): C19H19NO2, TOF ESI 316 (M++Na), P.M 293,3 u.m.a. IR υ (cm-1) 2937; 2837; 2360; 1619-1505; 1117; 904, 723. RMN-1H δ (ppm) 7.27 (d, J= 8.42 Hz, 1H, H-3); 8.10 (d, J= 8.48 Hz, 1H, H-4 ); 8.04 (d, J= 8.45 Hz, 1H, H-5); 7.49 (t, J= 8.02 Hz, 1H, H-6); 7.70 (t, J= 8.40 Hz, 1H, H-7); 7.77 (d, J= 8.81 Hz, 1H, H-8); 3.20 (ddd, J= 4.33, 8.45, 10.63 Hz, 2H, H-1’); 3.29 (ddd, J= 4.33, 8.45, 10.63 Hz, 2H, H-2’); 6.80 (dd, J= 8.17, 1.45 Hz, 2H, H-4”);. 6.97 (d, J= 7.88 Hz, 1H , H-5’’); 6.84 (dd, J= 8.04, 1.30 Hz, 2H, H-6’’ ); 3.87 (s, 3H); 3.87 (s, 3H). RMN-13C (ppm) 162.20 (C2); 121.65 (C3); 136.19 (C4); 126.82 (C4a); 127.55 (C5); 125.74 (C6); 128.88 (C7); 129.34 (C8); 147.23 (C8a); 30.09 (C1’); 40.00 (C2’); 135.34 (C1’’); 147.95 (C2’’); 152.76 (C3’’);110.47 (C4’’); 122.01 (C5’’); 123.86 (C6’’); 55.70 (OCH3); 60.69 (OCH3).
N-[4-(2-quinolin-2-iletil)fenil]acetamida (3a): C19H18N2O, TOF ESI 314 (M++Na), P.M 290,1 u.m.a. IR υ (cm-1) 2361, 2253; 1706; 1426; 1369; 1601; 1246; 905; 969. RMN-1H δ (ppm) 7.18 (d, J= 8.43 Hz, 1H, H-3); 8.01 (d, J= 8.27 Hz, 1H, H-4); 7.99 (d, J= 8.27 Hz, 1H, H-5). 7.44 (t, J= 7.40 Hz, 1H, H-6); 7.64 (t, J= 8.24 Hz, 1H, H-7); 7.72 (d, J= 8.03 Hz, 1H, H-8); 3.24 (ddd, J= 3.66, 9.52, 14.84 Hz, 2H, H-1’); 3.16 (ddd, J= 3.66, 9.52, 14.84, 2H, H-2’); 6.98 (d, J= 8.20 Hz, 2H, H-2’’, H-6’’); 7.27 (d, J= 8.18 Hz, 2H, H-3’’, H-5’’); 2.22 (s, 3H); 5.21 (s, 1H, N-H). RMN-13C (ppm) 161.29 (C2); 121.52 (C3); 136.6 (C4); 126.81 (C4a); 127.58 (C5); 125.92 (C6); 128.78 (C7); 129.50 (C8); 147.92 (C8a); 40.53 (C1’); 35.36 (C2’); 142.40 (C1’’); 129.91 (C2’’, C6’’); 128.55 (C3’’, C5’’); 137.28 (C4’’); 26.94 (CH3); 173.09 (C=O).
Los resultados de la actividad leishmanicida in vitro, la citotoxicidad de las estirilquinolinas 1, 2, 3, los derivados hidrogenados 1a, 2a, 3a y el control anfotericina B son presentados en la tabla 1.
Todos los compuestos presentaron actividad contra L. panamensis, disminuyendo ésta con los derivados hidrogenados. Los compuestos 1, 2 y 3 presentan una alta actividad contra amastigotes axénicos de L. panamensis, con valores de CE50 de 3,7; 4,5 y 19,1 μg/mL respectivamente (tabla 1). La actividad de las 2-arilquinolinas 1, 2 y 3 se confirmó en amastigotes intracelulares, encontrándose CE50 de 1,4 + 0,1; 1,8 + 0,1 y 1,7 + 0,08 µg/mL, respectivamente. Las dihidroestirilquinolinas 1a, 2a y 3a presentaron CE50 de 31,1; 23,6 y 59,3 μg/mL, respectivamente. Aunque la actividad de los derivados hidrogenados fue menor que la mostrada por los compuestos 2-arilquinolinas, se consideran compuestos activos como leishmanicidas (27). Estos resultados sugieren que la presencia del doble enlace en los carbonos C1’- C2’ es indispensable para la actividad ya que la reducción del doble enlace etilénico la disminuye, como puede observarse en la tabla1.
Mecanismos de acción postulados para varias moléculas activas contra este tipo de parásitos sugieren una interacción de tipo π-π con las quinolinas que les confieren una alta actividad biológica como en el caso de la anfotericina B (28); sin embargo, estos compuestos mostraron ser tóxicos sobre las líneas celulares U-937. Puesto que todos los compuestos, pero especialmente las dihidroestirilquinolinas 1 y 2 mostraron niveles similares de actividad contra el parásito y contra la célula hospedera, es necesario determinar si la actividad leishmanicida observada está asociada a la actividad citotóxica o si son mecanismos independientes. Sin embargo, el hecho de que estos compuestos mostraran una buena actividad leishmanicida, les confiere potencial como moléculas candidatas para el desarrollo de medicamentos anti-leishmania. Dada su facilidad de síntesis, se pueden emplear como plantillas estructurales para realizar estudios de relación estructura-actividad y ensayos biodirigidos, desarrollar moléculas activas contra el parásito y con una baja toxicidad contra las células hospederas.
TABLA 1. Citotoxicidad y actividad leishmanicida en amastigotes de estirilquinolinas
REFERENCIAS BIBLIOGRÁFICAS
1. Mishra J, Saxena A, Singh S. Chemotherapy of leishmaniasis: past, present and future. Curr. Med. Chem. 2007; 14(10):1153-1169 [ Links ]
2. Report of the Scientific Working Group on Leishmaniasis, 2004. TDR/SWG/04. [ Links ]
3. Vélez ID, Hendrickx E, Robledo SM, Agudelo SP. Leishmaniosis cutánea en Colombia y género. Cad. Saude Pública 2001; 17:171-180. [ Links ]
4. Berman JD, Gallalee JV, Best JM, Hill T. Uptake, distribution, and oxidation of fatty acids by leishmania mexicana amastigotes. J. Parasitol. 1987; 73(3): 555-560. [ Links ]
5. Berman JD. Chemotherapy for leishmaniasis: biochemical mechanisms, clinical efficacy, and future strategies. Rev. Infect. Dis. 1988; 10(3): 560-586. [ Links ]
6. Lucumi A, Robledo S, Gama V, Saravia NG. Sensitivity of leishmania viannia panamensis to pentavalent antimony is correlated with the formation of cleavable DNA-protein complexes. Antimicrob. Agents Chemother. 1998; 42(8):1990-1995. [ Links ]
7. Croft S, Coombs G. Leishmaniasis-current chemotherapy and recent advances in the search for novel drugs. Trends Parasitol. 2003; 19 (11):502-508. [ Links ]
8. Croft SL, Seifert K, Duchene M. Antiprotozoal activities of phospholipid analogues. Mol. Biochem. Parasitol. 2003; 126(2):165-172. [ Links ]
9. Sundar S, Jha TK, Thakur CP, Engel J, Sindermann H, Fischer C, et al. Oral miltefosine for Indian visceral leishmaniasis. N. Engl. J. Med. 2002; 347(22):1739-1746. [ Links ]
10. Franck X, Fournet A, Prina E, Mahieux R, Hocquemiller R, Figadere B. Biological evaluation of substituted quinolines. Bioorg. Med. Chem. Lett. 2004; 14(14):3635-3638 [ Links ]
11. Chen Y, Fang K, Shew J, Hsu S, Tzeng C. Synthesis and antibacterial evaluation of certain quinoline derivates. J. Med. Chem. 2001; 44 (14): 2374-2377. [ Links ]
12. Martínez G, Giménez C, Gómez A, Franck X, Fournet A, Hocquemiller R, et al. Nematocidal and trichomonacidal activities of 2-substituted quinolines. Fármaco 2005; 60(3): 219-224. [ Links ]
13. Fakhfakh MA, Fournet A, Prina E, Mouscadet J, Franck X, Hocquemiller R, et al. Synthesis and biological evaluation of substituted quinolines: potencial treatment of protozoal and retroviral co-infections. Bioorg. Med. Chem. 2003; 11(23): 5013-5023. [ Links ]
14. Larsen RD, Corley EG, King AO, Carrol JD, Davis PV, Verhoeven T, et al. Practical route to a new class of LTD4 receptor antagonists. J. Org. Chem. 1996; 61(10):3398. [ Links ]
15. Mekouar K, Mouscadet J, Desmaële D, Subra F, Leh H, Savouré D, et al. Styrylquinoline derivatives: a new class of potent HIV-1 integrase inhibitors that block HIV-1 replication in CEM cells. J.J. Med. Chem. 1998; 41(15): 2846-2857. [ Links ]
16. Fournet A, Mahieux R, Fakhfakh MA, Franck X, Hocquemiller R, Figadère B. Substituted Quinolines Induce Inhibition of Proliferation of HTLV-1 Infected Cells. Bioorg. Med. Chem. Lett. 2003; 13(5): 892-894. [ Links ]
17. Madrid P, Sherrill J, Liou A, Weisman J, Derisi J, Kiplin R. Synthesis of ring - substituted 4-aminoquinolines and evaluation of their antimalarial activities. Bioorg. Med. Chem. Lett. 2005; 15(4): 1015-1018. [ Links ]
18. Vaitilingam B, Nayyar A, Palde PB, Monga V, Jain R, Kaur S, et al. Synthesis and antimycobacterial activities of ring-substituted quinolinecarboxylic acid/ester analogues. Bioorg. Med. Chem. 2004; 12(9): 4179-4188. [ Links ]
19. Normand-Bayle M, Benard C, Zouhiri F, Mouscadet J, Leh H, Thomas C, et al. New HIV-1 replication inhibitors of the styryquinoline class bearing aroyl/acyl groups at the C-7 Position: synthesis and biological activity. Bioorganic & Medicinal Chemistry Letters 2005; 15: 4019-4022. [ Links ]
20. Fournet A, Barrios A, Muñoz V, Hocquemiller R, Roblot F, Cavé A, et al. Antiprotozoal activity of quinoline alkaloids isolated from Galipea longiflora, a Bolivian plant used as a treatment for cutaneous leishmaniasis. Phytotherapy Research 1993 8(3): 174 - 178. [ Links ]
21. Fournet A, Ferreira ME, Rojas de Arias A, Torres De Ortiz S, Fuentes S, Nakayama H, et al. In vivo efficacy of oral and intralesional administration of 2-substituted quinolines in experimental treatment of new world cutaneous leishmaniasis caused by leishmania amazonensis. Antimicrob. Agents Chemother. 1996; 40(11): 2447-2451 [ Links ]
22. Gantier JC, Fournet A, Munos MH, Hocquemiller R. The effect of some 2-substituted quinolines isolated from Galipea longiflora on Plasmodium vinckei petteri infected mice. Planta Med. 1996; 62(3):285-286 [ Links ]
23. Normand-Bayle M, Bénard C, Zouhiri F, Mouscadet J, Leh H, Thomas C, et al. New HIV-1 replication inhibitors of the styryquinoline class bearing aroyl/acyl groups at the C-7 position: Synthesis and biological activity. Bioorganic & Medicinal Chemistry Letters 2005; 15(18): 4019-4022. [ Links ]
24. Fakhfakh MA, Franck X, Fournet A, Hocquemiller R, Figadère B. Preparation of quinolines substituted at the 2 or 3 position by an alquenyl o alkynyl chain. Sinthetic Communications 2002; 32: 2863-2875. [ Links ]
25. Fakhfakh MA, Franck X, Fournet A, Hocquemiller R, Figadere B. Expeditious preparation of 2-substituted quinolines. Tetrahedron Lett. 2001; 42(23): 3847-3850. [ Links ]
26. Weniger, B, Robledo S, Arango GJ, Deharo E, Aragón, R, Muñoz V, et al 2001. Antiprotozoal activities of Colombian plants. J.Ethnopharmacol. 78(2-3):193-200. [ Links ]
27. Muñoz D, Cardona P, Cardona A, Carrillo L, Quiñones, W, Echeverri, F, et al. Efecto de hidrazonas sobre amastigotes intracelulares de leishmania panamensis y una proteasa de cisteína parasitaria. Vitae. 2006; 13 (2). [ Links ]
28. Sedlák M, Pravda M, Staud F, Kubicová L, Týcová K, Ventura K. Synthesis of pH-sensitive amphotericin B-poly(ethylene glycol) conjugates and study of their controlled release in vitro Bioorg. Med. Chem. 2007; 15(12):4069-4076. [ Links ]
AGRADECIMIENTOS
Los autores agradecen a la Universidad de Antioquia, ECOS-NORD, ICFES, COLCIENCIAS, ICETEX y PLANEACIÓN NACIONAL por la ayuda financiera en la realización de este trabajo.
Recibido: Abril 1 de 2008; Aceptado: Julio 8 de 2008
* Autor a quien se debe dirigir la correspondencia: jaisav@matematicas.udea.edu.co















