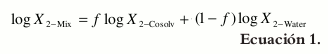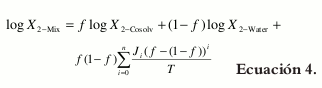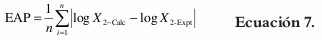Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.16 no.3 Medellín Sept./Dec. 2009
INDUSTRIAL FARMACÉUTICA
DESEMPEÑO DE LOS MODELOS DE YALKOWSKY & ROSEMAN Y JOUYBAN & ACREE EN LA ESTIMACIÓN DE LA SOLUBILIDAD DEL KETOPROFENO EN MEZCLAS COSOLVENTES ETANOL + AGUA
PERFORMANCE OF THE YALKOWSKY & ROSEMAN AND JOUYBAN & ACREE MODELS ESTIMATING THE SOLUBILITY OF KETOPROFEN IN ETHANOL + WATER COSOLVENT MIXTURES
Mauricio GANTIVA1; Alicia YURQUINA2; Fleming MARTÍNEZ1*
1 Grupo de Investigaciones Farmacéutico-Fisicoquímicas. Departamento de Farmacia. Facultad de Ciencias. Universidad Nacional de Colombia. A.A. 14490. Bogotá, Colombia.
2 Departamento de Química Inorgánica. Facultad de Bioquímica, Química y Farmacia. Universidad Nacional de Tucumán. San Miguel de Tucumán. Argentina.
RESUMEN
El ketoprofeno (KTP) es un antiinflamatorio de amplio uso terapéutico. En este trabajo se evalúa la validez de una adaptación puntual del modelo de Jouyban-Acree (J & A), en comparación con la utilidad de la ecuación de solubilidad logarítmica-lineal propuesta por Yalkowsky y Roseman (Y & R), para la estimación de la solubilidad del KTP en mezclas cosolventes etanol + agua, en función de la composición cosolvente y de la temperatura, en el intervalo entre 20,0 y 40,0°C. Los modelos de J & A y Y & R requieren únicamente de los valores experimentales de solubilidad de los fármacos en los solventes puros en función de la temperatura. Se encuentra que los valores obtenidos con los dos modelos presentan halgunas desviaciones notorias respecto a los valores experimentales.
Palabras clave:ketoprofeno, mezclas cosolventes etanol + agua, ecuación de Jouyban-Acree, ecuación de Yalkowsky-Roseman.
ABSTRACT
Ketoprofen (KTP) is a widely used anti-inflammatory drug. In this paper the validity of a trained version of the Jouyban-Acree (J & A) model is evaluated to predict the solubility of KTP in ethanol + water cosolvent mixtures. The usefulness of the solubility log-linear equation proposed by Yalkowsky and Roseman (Y & R) is also evaluated for the same drug in this cosolvent system. The solubility estimation is studied as a function of temperature and cosolvent composition. The J & A and Y & R models require only the experimental solubility values in the pure solvents at all the temperatures evaluated. The calculated values by using both models deviate notoriously from experimental values in several cases.
Key words: ketoprofen, ethanol + water cosolvent mixtures, Jouyban-Acree equation, Yalkowsky-Roseman equation.
INTRODUCCIÓN
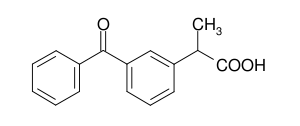
El ketoprofeno (KTP) es un derivado químico del ácido propiónico (Véase figura 1). Farmacológicamente, tiene acción analgésica y está clasificado como antiinflamatorio no esteroidal (AINE). Por sus propiedades es ampliamente utilizado en la terapéutica actual para el tratamiento de diversos procesos agudos o crónicos relacionados con dolor e inflamación (1).
Figura 1. Estructura molecular del ketoprofeno.
Por otra parte, es bien sabido que las formulaciones líquidas inyectables se caracterizan por suministrar altas dosis de fármaco en pequeños volúmenes de producto; por lo tanto, algunas propiedades fisicoquímicas, tales como la solubilidad de los principios activos y de los otros componentes presentes en la solución, son muy importantes para el diseñador farmacéutico, ya que el adecuado conocimiento de estas propiedades, y de ser posible su predicción, facilita enormemente el desarrollo de medicamentos (2).
Por lo anteriormente expuesto, y específicamente en lo relacionado con la predicción de propiedades fisicoquímicas de sistemas líquidos, en este trabajo se desafió el modelo de solubilidad propuesto por Jouyban y Acree (J & A) (3) frente a los valores experimentales de solubilidad del KTP en el sistema cosolvente etanol + agua (EtOH + W). Los resultados obtenidos con el modelo J & A también se compararon con los obtenidos con la ecuación de solubilidad logarítmica-lineal, propuesta originalmente por Yalkowsky y Roseman (Y & R) (4). Se encontró que los valores obtenidos con los dos modelos presentan algunas desviaciones notorias respecto a los valores experimentales.
El sistema EtOH + W es uno de los más ampliamente usados en el diseño de formulaciones líquidas destinadas a la administración parenteral (5), y además, ha sido bien estudiado desde el punto de vista fisicoquímico; en particular, respecto a los volúmenes molares parciales y de exceso (6, 7) y algunas propiedades reológicas (8). En estudios previos se han evaluado los aspectos termodinámicos del proceso de disolución de fármacos como acetaminofeno (9, 10), ibuprofeno (11) y naproxeno (12) en este sistema cosolvente. Igualmente, se ha estudiado la utilidad del método extendido de solubilidad de Hildebrand en la predicción de la solubilidad de dos de los fármacos previamente mencionados (13, 14). Así mismo se han desafiado los modelos de J & A y Y & R para la estimación de la solubilidad del ibuprofeno y naproxeno en algunos sistemas cosolventes (15, 16). La información generada en tales investigaciones permitió realizar el análisis e interpretación de resultados para los sistemas tomados como objeto de estudio.
ASPECTOS TEÓRICOS
En la literatura farmacéutica y química se han descrito diferentes métodos para la estimación de la solubilidad de varias clases de solutos en mezclas cosolventes, algunos de los cuales han sido ampliamente desafiados recientemente frente a la solubilidad experimental de ciertos fármacos (17, 18).
Como se ha indicado previamente (19), uno de los modelos más simples para estimar esta propiedad en mezclas cosolvente-agua está basado en la regla de la mezcla algebraica, la cual, para el caso de fármacos no polares en una mezcla binaria, adquiere la forma:
Donde X2-Mix es la solubilidad calculada en la mezcla cosolvente considerada, X2-Cosolv es la solubilidad en el cosolvente puro, X2-Water es la solubilidad en agua pura, y f es la fracción volumétrica del cosolvente en la mezcla libre de soluto, la cual, a su vez, es calculada asumiendo aditividad de volúmenes como:
en la que, VCosolv y VWater son los respectivos volúmenes de cosolvente y agua, respectivamente (20). La ecuación 1 es una forma práctica del modelo logarítmico-lineal desarrollado por Yalkowsky y Roseman (4), y que tiene la forma:
Donde S2-Mix y S2-Water son las solubilidades (expresadas en molaridad o fracción molar) en la mezcla cosolvente y en el agua, respectivamente, y v es el factor de potencia cosolvente-solubilizante (disolvente) del respectivo sistema soluto-solvente. El término σ de la ecuación 3 ha sido correlacionado con diferentes índices de polaridad de los solventes, tales como el coeficiente de reparto octanol-agua, el parámetro de solubilidad de Hildebrand, y las tensiones interfaciales, entre otros (21). La ecuación 3 ha sido ampliamente utilizada en el estudio de diversos solutos de interés farmacéutico (4, 22, 23).
Sin embargo, se ha encontrado que el comportamiento experimental de diferentes solutos lipofílicos se desvía notoriamente de esta sencilla regla aditiva, en particular si los cosolventes son anfipróticos. Específicamente, en el caso del sistema propilenoglicol + agua (PG + W), Rubino y Obeng, (24) estudiando la solubilidad de algunas series homólogas de p-hidroxibenzoatos y p-aminobenzoatos de alquilo, encontraron desviaciones negativas a la ecuación 1 en mezclas ricas en agua, esto es, a bajas fracciones volumétricas de PG, y desviaciones positivas en las mezclas ricas de cosolvente. Puesto que estos investigadores encontraron cierta similaridad en las desviaciones encontradas por los diferentes solutos, sugirieron que las interacciones cosolvente-agua son las principales responsables de estos comportamientos. Fue así como plantearon que los cosolventes pueden interactuar con el agua, principalmente mediante dos mecanismos: (a) La naturaleza orgánica de los cosolventes conduce a un tipo particular de interacción con el agua, la cual ha sido descrita como la formación de "témpanos" de agua alrededor de las porciones apolares del cosolvente, esto es, el efecto de la hidratación hidrofóbica. Puesto que dicho fenómeno depende de la capacidad del agua de formar uniones cohesivas con otras moléculas de agua, es de esperar que este tipo de interacción sea predominante a bajas concentraciones de cosolvente, en las cuales se tiene presente un exceso de moléculas de agua. Este fenómeno ha sido descrito por Kimura et al.(25) en el estudio de las entalpías de transferencia de la 1-metil-2-pirrolidinona desde el agua hasta algunos alcoholes de cadena corta. (b) En adición a los efectos hidrofóbicos, los grupos hidroxilo del PG pueden interactuar con el agua mediante enlaces de hidrógeno, por lo que se ha sugerido que a bajas concentraciones de los alcoholes de cadena corta, estos pueden aumentar la estructuración del agua a través de enlaces de hidrógeno, en adición a lo conseguido por el efecto hidrofóbico. Por lo tanto, los dos tipos de interacciones mencionadas anteriormente, que llevan a un aumento en la estructuración de agua, conducen, a su vez, a una disminución en las interacciones soluto-solvente, según se ha demostrado mediante estudios del calor de disolución en estos sistemas (25). De otro lado, cuando la fracción de PG es alta, los enlaces de hidrógeno entre el cosolvente y el agua siguen estando presentes, pero la estructuración del agua ha disminuido significativamente o ha desaparecido.
En un intento de considerar estas desviaciones no tenidas en cuenta por el modelo de Y & R, Jouyban y Acree (17) propusieron la ecuación 4 como extensión de la ecuación 4.
Donde T es la temperatura absoluta, y Ji son los respectivos coeficientes con un significado teórico importante, puesto que son función de las energías de interacción entre dos y tres cuerpos que describen las atracciones entre las diferentes moléculas en solución. La ecuación 4 es asimismo, una derivación de la ecuación originalmente propuesta por Redlich y Kister (26), y su desarrollo, así como su significado, han sido descritos previamente en la literatura (27, 28).
Recientemente, Jouyban y Acree (3), mediante análisis de regresión, procesaron los valores de solubilidad hallados en la literatura para diferentes fármacos (expresados en fracción molar) frente a la ecuación 4, obteniendo la ecuación 5, en la cual se evalúa el significado de las constantes del modelo mediante la prueba t de Student, siendo estas constantes estadísticamente significativas con p < 0,05.
Donde el Factor de Jouyban-Acree está definido de acuerdo con la siguiente expresión:
PARTE EXPERIMENTAL
Materiales
Ketoprofeno USP (29); etanol absoluto R.A. Merck (EtOH); agua destilada (W), conductividad < 2 µS cm-1; tamiz molecular Merck (números 3 y 4); unidades de filtración Swinnex®-13 Millipore Corp.
Preparación de las mezclas cosolventes
Todas las mezclas etanol + agua se prepararon por pesada en cantidades cercanas a 40,00 g; en una balanza analítica Ohaus Pioneer TM PA214 (sensibilidad ± 0,1 mg), en concentraciones desde 10% m/m hasta 90% m/m, variando en 10% m/m, con lo cual se estudiaron nueve mezclas binarias y los dos solventes puros.
Determinación de la solubilidad
Se adicionó un exceso de KTP a 20 cm3 de cada mezcla cosolvente, en frascos ámbar con tapa rosca. Las mezclas sólido-líquido se colocaron en un baño de ultrasonido (Elmasonic E 60 H) durante 15 minutos, y posteriormente en un baño termostático con agitación (Julabo SW23) ajustado a 313,15 ± 0,05 K, durante al menos cinco días, hasta alcanzar la saturación. Este tiempo se estableció determinando la concentración del fármaco hasta obtener valor constante. Transcurrido este tiempo se filtraron las soluciones a temperatura constante para remover partículas no disueltas antes de tomar alícuotas. Después de realizar las diluciones requeridas se determinaron las concentraciones de fármaco mediante espectrofotometría UV (UV/VIS BioMate 3 Thermo Electron Company spectrophotometer). Posteriormente la temperatura se disminuyó en 5,0 K; para estabilizarla en 308,15 K durante al menos dos días, con el fin de permitir la precipitación del exceso de fármaco, a lo que siguió la cuantificación del activo en saturación. Este procedimiento se repitió hasta alcanzar los 293,15 K. Para permitir la interconversión entre expresiones de concentración, gravimétricas y volumétricas, se determinó la densidad de las soluciones saturadas utilizando un densímetro digital (DMA 45 Anton Paar) conectado a un baño termostático de recirculación (Neslab RTE 10 Digital One Thermo Electron Company). Todos los procedimientos fueron realizados por triplicado.
Cálculo de errores
Como medida de comparación entre los valores individuales experimentales y calculados mediante los modelos Y & R y J & A (3), se calcularon los errores absolutos (EA), sobre la base de la solubilidad logarítmica, según la ecuación 6:
Así mismo, como medida general de la validez de los dos modelos (3), se calcularon los errores absolutos promedio según la ecuación 7, en la cual n es el número de puntos de composición cosolvente considerados:
RESULTADOS Y DISCUSIÓN
Puesto que las expresiones volumétricas de concentración en mezclas cosolventes son dependientes de la temperatura, ya que dependen de los coeficientes de expansión térmica-volumétrica (α) de los componentes, previamente se ha evaluado la variación de f con la temperatura en el sistema EtOH + W, encontrando que esta es relativamente pequeña, en todos los casos menor del 0,60 %. Además, el promedio obtenido a las cinco temperaturas es prácticamente el correspondiente al valor de f obtenido a 30,0°C (16). Por esta razón, en el desafío de las ecuaciones 1 y 5 se utilizaron las fracciones volumétricas calculadas a esta temperatura, de la misma forma que se ha realizado en otras investigaciones (15, 16).
A continuación se presentan los valores experimentales de solubilidad en equilibrio del fármaco, en forma de logaritmo decimal de las fracciones molares, con sus respectivas incertidumbres (Véase tabla 1). Los valores utilizados como entrada en las ecuaciones 1 y 5 fueron los obtenidos en los solventes puros, correspondientes a las fracciones volumétricas 0,00 y 1,00 de EtOH.
Además, se presentan los valores de solubilidad logarítmica calculados mediante los modelos Y & R y J & A en función de la composición cosolvente y la temperatura para el KTP, con los respectivos errores absolutos, respecto a los valores experimentales (Véase tabla 2). Esta información se puede observar gráficamente para datos de solubilidad referidos a 25,0°C (Véase figura 2).
Figura 2. Solubilidad logarítmica calculada del KTP usando el Modelo de Jouyban-Acree (○) y el Modelo de Yalkowsky-Roseman (□), en función de la solubilidad logarítmica experimental del fármaco (△) a 25,0 °C.
Comparando globalmente los resultados obtenidos para el fármaco con los dos modelos teóricos se observa que no son muy diferentes entre sí, dados los valores EAP totales obtenidos, esto es, 0,28 (± 0,17) y 0,37 (± 0,22) para Y & R y J & A, respectivamente, lo cual, aparentemente, demostraría que en el caso bajo estudio, el modelo de Jouyban-Acree no presenta ventajas prácticas sobre el modelo de Yalkowsky-Roseman, ya que los dos métodos arrojan resultados similares. Por otro lado, debe considerarse que el modelo J-A implica cálculos más complejos. Así mismo, se puede observar que las desviaciones obtenidas respecto a los valores experimentales presentados en la tabla 1 son muy superiores a las respectivas incertidumbres experimentales.
Para ilustrar estos efectos se grafican las diferencias logarítmicas decimales obtenidas entre las solubilidades experimentales y las calculadas mediante el modelo log-lineal de Y & R, y así mismo, entre las obtenidas mediante el modelo J & A y el modelo Y & R para el fármaco a 25,0 °C (Véase figura 3).
Figura 3. Diferencia logarítmica de solubilidades [valor experimental - valor según el modelo Y &R] para el KTP (□), y diferencia logarítmica de solubilidades calculadas [valor J & A - valor Y & R] (○) en función de la proporción de EtOH a 25,0 &176;C.
En esta figura se observa que las diferencias obtenidas entre los dos modelos y los valores experimentales son dependientes de la composición cosolvente. Esto es, en fracciones volumétricas de EtOH inferiores a 0,50, el modelo J & A arroja resultados más distantes comparado con el modelo Y & R, mientras que a fracciones superiores a 0,70 las desviaciones obtenidas en los dos modelos son muy similares; solo que el modelo Y & R predice valores inferiores mientras que el modelo J & A predice valores superiores a los experimentales. También puede observarse claramente que alrededor de f = 0,50 el valor estimado mediante el modelo Y & R es casi coincidente con el experimental.
Dado que la ecuación 5 (modelo J & A) es una extensión de la ecuación 1 (modelo Y & R), en la figura 3 se puede observar el denominado factor de exceso de Jouyban-Acree (Factor JA), equivalente a la diferencia logarítmica entre las solubilidades calculadas, esto es, el valor J & A menos el valor Y & R.
De otro lado, el perfil obtenido para la solubilidad experimental (Véase figura 3) es similar al adoptado por las desviaciones encontradas por Rubino y Obeng (24) en el estudio de la solubilidad de series homólogas de p-hidroxibenzoatos y p-aminobenzoatos de alquilo en mezclas PG + W, las cuales fueron negativas respecto a la ecuación 1 en las mezclas ricas en agua, esto es, a bajas fracciones volumétricas de PG, y positivas en las mezclas ricas en cosolvente.
Una explicación posible para las desviaciones negativas encontradas a bajas proporciones de cosolvente en nuestros sistemas en estudio podría hallarse en el trabajo de Kimura et al (25), quienes basados en la similitud de los calores de disolución de 1-metil-2-pirrolidinona en mezclas alcohol-agua a bajas concentraciones de cosolvente, interpretaron que el agua retiene su habilidad para formar estructuras ordenadas.
Como es bien sabido, los cosolventes poseen grupos polares y no polares en su estructura molecular y, por lo tanto, se espera que la hidratación hidrofóbica ocurra alrededor de las partes no polares del compuesto, mientras que los enlaces de hidrógeno se forman entre los grupos polares y el agua. Aunque los alcoholes de pequeña masa molar generalmente han sido considerados como compuestos polares, Matsumoto et al (30) han presentado evidencia de la influencia del grupo metilo terminal de estos cosolventes sobre la estructuración del agua, basados en estudios de las entalpías molares de exceso. Estas interacciones existentes entre los alcoholes y el agua podrían reducir la interacción entre el agua y los fármacos estudiados. Así, a bajas proporciones del cosolvente, las solubilidades obtenidas, según las ecuaciones 1 y 5, resultan inferiores a las esperadas.
De otro lado, en la literatura se ha ofrecido evidencia de tipo termodinámico para explicar el comportamiento de la solubilidad del acetaminofeno (9, 10) y el naproxeno (12) en el mismo sistema cosolvente estudiado en este trabajo, encontrándose una conducción entrópica en las mezclas pobres en EtOH (ricas en agua) y una conducción entálpica en concentraciones mayores del cosolvente. Estos resultados fueron atribuidos a la pérdida de estructura del agua presente alrededor de los grupos no polares de los fármacos, la cual se encontraba inicialmente asociada por el efecto de hidratación hidrofóbica. Tal desestructuración se ve incrementada a medida que se reemplaza el agua por cosolvente.
La solubilidad favorecida de KTP observada a altas f de EtOH era de esperarse, ya que a medida que aumenta la composición de EtOH va disminuyendo la polaridad del medio solvente, estimada a través de los valores de permitividad y parámetro de solubilidad de la mezcla. Ambas propiedades son descriptores de la polaridad del medio, varían de 78,5 a 24,5 y de 47,05 a 26,59 MPa1/2, respectivamente, cuando se pasa de agua a etanol, y fueron usadas en trabajos previos como criterio en la selección de solventes para otros fármacos (31, 32).
CONCLUSIONES
De todo lo discutido se desprende que los sistemas KTP en mezlas binarias EtOH + W presentan desviaciones negativas frente al modelo de JouybanAcree en todo el intervalo de composición cosolvente, y desviaciones negativas y positivas frente al modelo de Yalkowsky-Roseman, siendo ambos altamente dependientes de la composición cosolvente. En el último modelo, las desviaciones observadas pueden, en principio, atribuirse a efectos de interacción solvente-solvente en las mezclas solventes, así como a las diferencias en la hidratación hidrofóbica del compuesto. Por lo anterior, para nuestros sistemas en estudio, no resultaría muy práctico el uso de estos dos modelos para estimar la solubilidad de KTP. Resultados similares se obtuvieron en el caso de la estimación de la solubilidad de ibuprofeno y naproxeno en otros sistemas cosolventes (15, 16).
Del conjunto de resultados y análisis expuestos en este trabajo así como de aquellos de la literatura se llega a la necesidad de determinar experimentalmente la solubilidad de los fármacos en función de la temperatura, en todas aquellas mezclas cosolventes que puedan ser útiles durante el proceso de diseño de formulaciones líquidas homogéneas.
AGRADECIMIENTOS
Muy formalmente agradecemos a la DIB de la Universidad Nacional de Colombia por el apoyo financiero, y al Departamento de Farmacia de la misma universidad por facilitar los equipos e instalaciones requeridos para el desarrollo de los experimentos. Así mismo agradecemos al Profesor A. Jouyban, de Tabriz University of Medical Sciences (Irán), por la donación del material bibliográfico requerido para llevar adelante esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Roberts II LJ, Morrow JD. Analgesic-antipiretic and anti-inflammatory agents and drugs employed in the treatment of gout. En: Hardman JG, Limbird LE, Gilman AG, Editores. Goodman & Gilman's The Pharmacological Basis of Therapeutics. 10 ed. New York: McGraw-Hill; 2001. pp. 703-705. [ Links ]
2. Jiménez F, Martínez F. Una estrategia para la selección sistemática de vehículos en el diseño de formas farmacéuticas líquidas homogéneas. Rev Colomb Cienc Quim Farm. 1995; 24 (1): 19-23. [ Links ]
3. Jouyban A, Acree Jr WE. In silico prediction of drug solubility in water-ethanol mixtures using Jouyban-Acree model. J Pharm Pharmaceut Sci. 2006; 9 (2): 262-269. [ Links ]
4. Yalkowsky SH, Roseman TJ. Solubilization of drugs by cosolvents. En: Yalkowsky SH, Editor. Techniques of Solubilization of Drugs. New York: Marcel Dekker; 1981. pp. 91-134. [ Links ]
5. Rubino JT. Cosolvents and Cosolvency. En: Swarbrick J, Boylan JC, Editores. Encyclopedia of Pharmaceutical Technology, Vol. 3. New York: Marcel Dekker; 1988. pp. 375-398. [ Links ]
6. Jiménez J, Manrique J, Martínez F. Effect of temperature on some volumetric properties for ethanol + water mixtures. Rev Colomb Cienc Quím Farm. 2004; 33 (2): 145-155. [ Links ]
7. Resa JM, González C, Goenaga JM, Iglesias M. Temperature dependence of excess molar volumes of ethanol + water + ethyl acetate. J Solution Chem. 2004; 33 (2): 169-198. [ Links ]
8. Belda R, Herraez JV, Díez O. Rheological study and thermodynamic analysis of the binary system (water/ethanol): Influence of concentration. Phys Chem Liquids. 2004; 42 (5): 467-476. [ Links ]
9. Bustamante P, Romero S, Reillo A. Thermodynamics of paracetamol in amphiprotic and amphiprotic-aprotic solvent mixtures. Pharm Sci. 1995; 1 (1): 505-507. [ Links ]
10. Jiménez JA, Martínez F. Thermodynamic magnitudes of mixing and solvation of acetaminophen in ethanol + water cosolvent mixtures. Rev Acad Colomb Cienc. 2006; 30 (114): 87-99. [ Links ]
11. Manrique J, Martínez F. Solubility of ibuprofen in some ethanol + water cosolvent mixtures at several temperatures. Lat Am J Pharm. 2007; 26 (3): 344-354. [ Links ]
12. Pacheco DP, Martínez F. Thermodynamic analysis of the solubility of naproxen in ethanol + water cosolvent mixtures. Phys Chem Liquids. 2007; 45 (5): 581-595. [ Links ]
13. Romero S, Reillo A, Escalera B, Bustamante P. The behavior of paracetamol in mixtures of amphiprotic and amphiprotic-aprotic solvents: Relationship of solubility curves to specific and nonspecific interactions. Chem Pharm Bull. 1996; 44 (5): 1061-1064. [ Links ]
14. Aragón DM, Pacheco DP, Ruidiaz MA, Sosnik AD, Martínez F. Método extendido de Hildebrand en la predicción de la solubilidad de naproxeno en mezclas cosolventes etanol + agua. Vitae. 2008; 15 (1): 113-122. [ Links ]
15. Vargas EF, Barbosa H, Martínez F. Utilidad del modelo de Jouyban-Acree para la estimación de la solubilidad del ibuprofeno y el naproxeno en algunas mezclas cosolventes. Rev Ing Invest. 2008; 28 (2): 30-36. [ Links ]
16. Vargas E, Sosnik A, Martínez F. Aplicación del modelo de Jouyban-Acree para la estimación de la solubilidad del naproxeno en mezclas cosolventes etanol + agua. Lat Am J Pharm. 2008; 27 (5): 654-660. [ Links ]
17. Jouyban-Gharamaleki A, Valaee L, Barzegar-Jalali M, Clark BJ, Acree Jr WE. Comparison of various cosolvency models for calculating solute solubility in water-cosolvent mixtures. Int J Pharm. 1999; 177 (1): 93-101. [ Links ]
18. Nokhodchi A, Shokri J, Barzegar-Jalali M, Ghafourian T. Prediction of benzodiazepines solubility using different cosolvency models. Farmaco. 2002; 57 (7): 555-557. [ Links ]
19. Vargas EF, Manrique YJ, Pacheco DP, Torres NS, Martínez F. Desviaciones al modelo logarítmico-lineal en la solubilidad de ibuprofén y naproxén en mezclas cosolventes propilenoglicolagua. Quím Nova. 2007; 30 (8): 1945-1950. [ Links ]
20. Connors KA. Thermodynamics of Pharmaceutical Systems: An Introduction for Students of Pharmacy. Hoboken NJ: WileyInterscience; 2002. pp. 61-66. [ Links ]
21. Rubino JT, Yalkowsky SH. Cosolvency and cosolvent polarity. Pharm Res. 1987; 4 (3): 220-230. [ Links ]
22. Yalkowsky SH. Solubility and Solubilization in Aqueous Media. New York: American Chemical Society and Oxford University Press; 1999. pp. 180-235. [ Links ]
23. Millard JW, Álvarez-Nuñez FA, Yalkowsky SH. Solubilization by cosolvents: Establishing useful constants for the log-linear model. Int J Pharm. 2002; 245 (1): 153-166. [ Links ]
24. Rubino JT, Obeng EK. Influence of solute structure on deviations from the log-linear solubility equation in propylene glycol: water mixtures. J Pharm Sci. 1991; 80 (5): 479-483. [ Links ]
25. Kimura F, Murakami S, Fujishiro R. Thermodynamics of aqueous solutions of nonelectrolytes. II. Enthalpies of transfer of 1-methyl-2-pyrrolidinone from water to many aqueous alcohols. J Solution Chem. 1975; 4 (3): 241-247. [ Links ]
26. Redlich O, Kister AT. Algebraic representation of thermodynamic properties and the classification of solutions. Ind Eng Chem. 1948; 40 (2): 345-348. [ Links ]
27. Acree Jr WE. Mathematical representation of thermodynamic properties. Part 2. Derivation of the combined nearly ideal binary solvent (NIBS)/Redlich-Kister mathematical representation from a two-body and three-body interactional mixing mode. Thermochim Acta. 1992: 198 (1): 71-79. [ Links ]
28. Jouyban A, Chew NYK, Chan HK, Khoubnasabjafari M, Acree Jr WE. Solubility prediction of salicylic acid in water-ethanolpropylene glycol mixtures using Jouyban-Acree model. Pharmazie. 2006; 61 (4): 318-331. [ Links ]
29. US Pharmacopeia. 28 ed. United States Pharmacopeial Convention, Rockville, MD. 2004. pp. 1099-1100. [ Links ]
30. Matsumoto Y, Touhara H, Nakanishi K, Watanabe N. Molar excess enthalpies for water + ethanediol, + 1,2-propanediol, and + 1,3-propanediol at 298.15 K. J Chem Thermodyn. 1977; 9 (8): 801-805. [ Links ]
31. Yurquina A, Manzur ME, Molina MAA, Manzo R. Requerimiento dieléctrico y parámetros de solubilidad de nipagin y nipasol en el sistema agua-etanol. Acta Farm Bonaerense. 2000; 19 (1): 49-52. [ Links ]
32. Yurquina A, Manzur ME, Manzo R, Molina MAA. Physicochemical studies of acetaminophen in water-peg 400 systems. J Mol Liquids. 2007; 133 (1-3): 47-53. [ Links ]
Recibido: Marzo 25 de 2009; Aceptado: Septiembre 29 de 2009
* Autor a quien debe dirigir la correspondencia: fmartinezr@unal.edu.co