Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.23 no.1 Medellín Jan./Apr. 2016
https://doi.org/10.17533/udea.vitae.v23n1a04
DOI: 10.17533/udea.vitae.v23n1a04
PHARMACEUTICAL INDUSTRY
BÚSQUEDA DE BACTERIAS MARINAS COMO FUENTE DE INHIBIDORES DE QUORUM SENSING (IQS): PRIMER ESTUDIO QUIMICO DE Oceanobacillus profundus(RKHC-62B)
SCREENING OF MARINE BACTERIAL STRAINS AS SOURCE OF QUORUM SENSING INHIBITORS (QSI): FIRST CHEMICAL STUDY OF Oceanobacillus profundus (RKHC-62B)
Diana MARTÍNEZ-MATAMOROS1 MsC, Melisa LAITON FONSECA1, PhD, Carmenza DUQUE1 PhD, Freddy A. RAMOS1, * PhD, Leonardo CASTELLANOS1 Ph.D.
1 Laboratorio de Productos Naturales Marinos, Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia. Carrera 30 N° 45-03, 111321, Bogotá - Colombia.
Corresponding author: faramosr@unal.edu.co
Recibido: Noviembre 23 de 2015. Aceptado: Febrero 03 de 2016
RESUMEN
Antecedentes: Los productos naturales aislados de microorganismos marinos han demostrado tener un amplio rango de actividades biológicas incluyendo inhibidores de quorum sensing. Objetivos: Estudiamos quince cepas bacterianas del phylum Firmicutes aisladas del coral blando Antillogorgia elisabethae que fueron evaluadas como una nueva fuente sostenible de compuestos inhibidores de quorum sensing (IQS). Métodos: Se prepararon cultivos en cuatro medios diferentes y extraídos usando una resina no iónica. Todos los extractos fueron probados con el fin de establecer su actividad inhibitoria de quorum sensing (IQS) usando Chromobacterium violaceum ATCC 31532 como biosensor. Los extractos activos fueron fraccionados mediante cartuchos RP-18. Cada fracción fue evaluada mediante bioensayo y analizada por HPLC. Resultados: Las fracciones metanólicas de Jeotgalicoccus halophilus y Oceanobacillus profundus fueron las más activas, lo cual sugiere que los compuestos no polares pueden ser los responsables de esta actividad. Conclusiones: El estudio químico del extracto orgánico de O. profundus cultivado en medio LBS permitió aislar los compuestos tirosol (1) y acetato de tirosol (2) como los responsables de la actividad IQS.
Palabras clave: Productos naturales marinos, Microorganismos marinos, Jeotgalicoccus halophilus, Oceanobacillus profundus, Compuestos inhibidores de quorum sensing.
ABSTRACT
Background:Natural products isolated from marine microorganisms have demonstrated a wide range of biological activities included quorum sensing inhibitors. Objectives: We study fifteen marine Firmicutes bacterial strains isolated from the Caribbean soft coral Antillogorgia elisabethae that were evaluated as a novel and sustainable source of quorum sensing inhibitor compounds. Methods: Cultures were made in four different culture media and further extracted using a non-ionic resin. All these extracts were tested in order to establish its quorum sensing inhibition (QSI) activity using Chromobacterium violaceum ATCC 31532. The active extracts were fractionated by RP-18 cartridge. Each fraction was tested and evaluated for its composition by HPLC-PDA. Results: Methanol fractions of Jeotgalicoccus halophilus and Oceanobacillus profundus were the most active ones, suggesting that non-polar compounds could be the responsible for the QSI activity of the bacterial extracts here tested. Conclusions:The chemical study of the organic extract of Oceanobacillus profundus cultured in LBS, yielded the compounds tyrosol (1) and tyrosol acetate (2) as responsible of QSI activity showed by the organic extract.
Keywords: Marine natural products, Marine microorganisms, Jeotgalicoccus halophilus, Oceanobacillus profundus, Quorum sensing inhibitor compounds.
INTRODUCCIÓN
La aparición de cepas de bacterias resistentes al uso de antibióticos, como consecuencia del uso indiscriminado de estos, representa un enorme reto para industrias como la agropecuaria y la industria mÉdica, pues las consecuencias sobre la salud pueden ser muy graves (1-5). El quorum sensing (QS) es un mecanismo en el cual las bacterias regulan o sincronizan cambios en su expresión genética en función de su densidad poblacional, como por ejemplo la producción de antibióticos, toxinas, pigmentos, exopolisacáridos (formación de biopéliculas), motilidad y otros factores de virulencia (6). En este marco, los inhibidores del quorum sensing (IQS) han emergido como una estrategia novedosa para controlar infecciones, y evitar el desarrollo de mecanismos de resistencia causados por el uso de los antimicrobianos (7), lo anterior debido a que muchos de los factores de virulencia son regulados por quorum sensing (QS), el cual además está involucrado en la resistencia a antibióticos por parte de las cepas bacterianas (2,3). También, se ha logrado establecer que el uso de compuestos IQS permite que las cepas bacterianas causantes de infecciones se tornen nuevamente susceptibles a los agentes antimicrobianos, lo cual, acompañado de la activación innata del sistema inmune del hospedero permite el control de la infección (8).
Para el caso del ambiente marino los IQS han encontrado otras aplicaciones, particularmente en la industria de los recubrimientos o antifoulants; pues, las superficies naturales y artificiales son rápidamente colonizadas por micro- y macroorganismos en un proceso conocido como biofouling, que genera grandes pérdidas económicas por el rápido deterioro de las superficies inmersas (9). Este proceso de colonización es muy complejo, pero es sabido que si se impide la formación de biopelículas por parte de los microorganismos, se podría retrasar e incluso impedir la llegada de macroorganismos, disminuyendo el fouling de gran manera. Lo anterior sin generar daños al ecosistema, por lo que la identificación de compuestos de origen natural con actividad IQS parece ser una de las aproximaciones más promisorias para el desarrollo de antifoulants industriales (10-12).
De otro lado, los compuestos IQS han sido obtenidos tradicionalmente a partir de plantas, y más recientemente a partir de organismos marinos (11). No obstante los microorganismos también son una fuente de este tipo de compuestos, sobre todo teniendo en cuenta que la vida de las bacterias en comunidad las obliga a desarrollar relaciones inter e intraespecies, permitiéndoles generar diferentes mecanismos para interferir en los sistemas de QS de los otros miembros de la comunidad bacteriana (11,13). Como resultado de estas investigaciones, se ha establecido que bacterias Gram positivas como Actinobacterias y Firmicutes producen moléculas inhibidoras del quorum sensing. Un ejemplo de esto es la dicetopiperazina ciclo-L-prolina-L-tirosina y la N-(2'-feniletil)-isobutiramida, aisladas de cepas de Bacillus cereus y Halobacillus salinus, respectivamente (13). Adicionalmente, los microorganismos representan una fuente sostenible de moléculas, resolviendo así el problema del suministro de materia prima con miras a una posible aplicación industrial (14).
Así, y como parte de nuestra búsqueda de compuestos IQS a partir de diferentes fuentes de origen natural (15), en este trabajo se estableció una metodología rápida para el cultivo, extracción y evaluación de la actividad IQS de extractos de cultivos de bacterias marinas. Para esto, 15 aislamientos de bacterias pertenecientes al phylum Firmicutes, obtenidas del octocoral Antillogorgia elisabethae (anteriormente conocido como Pseudopeterogorgia elisabethae) (16), se cultivaron en cuatro medios diferentes; posteriormente el sobrenadante fue extraído y los extractos obtenidos fueron evaluados en búsqueda de actividad IQS, usando el ensayo de inhibición de la expresión de violaceína en Chromobacterium violaceum ATCC 31532. Los extractos más activos se analizaron por HPLC-DAD y RMN, para escoger el más promisorio y llevar acabo su estudio químico.
MATERIALES Y MÉTODOS
Área de estudio
Individuos del octocoral Antillogorgia elisabethae fueron recolectados en El planchon (13°24'0'N y 81°23'0'W'), Isla de Providencia (Caribe Sur-Ocdadcidental, Colombiano), mediante buceo autónomo SCUBA a una profundidad entre 20 y 30 m, e identificados por la Profesora Dra. Mónica Puyana, de la Universidad Jorge Tadeo Lozano, el voucher del espécimen se codifico como INV CNI 1612-1614, y fue despositado en la colección de invertebrados del Museo de Historia Natural Marina Colombiana (MHNMC) en el Instituto de Investigaciones Marinas de Punta BetÍn (INVEMAR).(17)
Materiales y Equipos Generales
Las cepas bacterianas fueron cultivadas en agar marino preparado con sales calidad R.A. (Merck) y agar bacteriológico (OXOID). El agua empleada para los medios de cultivo fue destilada, y desionizada a través de un equipo Simplicity (MILLIPORE). Para los ensayos de actividad IQS se empleó como medio de cultivo tripticasa de soya (SCHARLAU) para microbiología, y agar bacteriológico (OXOID). Todos los medios e instrumentos empleados en microbiología fueron esterilizados con vapor de agua en un autoclave AllAmerican 75X de 32 L a 20 psi y 120°C durante 30 min. Los inóculos fueron preparados en cabina de flujo laminar AVE-402 (ESCO). Para el cultivo a mayor escala de Oceanobacillus profundus se empleó el medio LB suplementado con sales (LBS, vide supra).
La incubación de las cepas de estudio en caja de Petri se llevó a cabo en una incubadora (MEMMERT) a 28°C. Los cultivos en medio líquido de las cepas se agitaron en un shaker orbital HD-3000 (DIMAQ) a temperatura ambiente (19°C) a 100 rpm. La biomasa fue separada por centrifugación a 5000 rpm y eliminada por filtración al vacío empleando membranas estériles de nitrato de celulosa de tamaño de poro 0.80, 0.65 y 0.45 µm (SARTORIUS).
La extracción de los cultivos en medio líquido se llevó a cabo empleando la resina no iónica Diaion ® HP-20 (Supelco), y para el fraccionamiento fueron empleados cartuchos de extracción en fase sólida Hypersep RP-18 de 200 mg (Thermo) y un equipo de extracción en fase sólida con vacío de 16 puestos (TeknoKroma). Los solventes empleados para las extracciones y procesos cromatográficos fueron calidad R.A. (Panreac y Merck).
Los análisis por HPLC-DAD fueron realizados en un equipo Merck-Hitachi equipado con detector DAD L-4250 y UV L-4200, bomba L-6000A, auto muestreador 6200A, y una columna LichroCart Merck RP-18 (125x4 mm, 5 µm). La detección en el UV fue a 210 y 270 nm. Se empleó acetonitrilo grado cromatográfico (Honeywell) y agua desionizada a través de un equipo Simplicity Millipore.
Los espectros RMN 1H y 13C fueron registrados en un espectrómetro Bruker Avance 400 (400 MHz para RMN 1H y 100 MHz RMN 13C) empleando como solvente cloroformo-d1 (Merck) grado de deuteracón 99.8% y metanol-d4 (Merck) grado de deuteración 99.8%.
Con el ánimo de evaluar el efecto del medio de cultivo sobre el potencial de producir compuestos inhibidores del quorum sensing a partir de cepas aisladas de ambientes marinos, se realizaron los cultivos de 15 cepas de Firmicutes (3x10 mL) en cuatro medios de cultivo. Dos de estos son considerados medios ricos en nutrientes (LBS y TAK), los cuales emplean como fuente de carbono el extracto de levadura (LBS) y almidón y dextrosa (TAK) y como fuente de nitrógeno la triptona (LBS) y peptona (TAK). Los otros dos medios son considerados medios ricos en sales y deficientes en nutrientes BM y MM; el medio BM emplea como fuente de carbono los ácidos benzoico y cítrico, y como fuente de nitrógeno NaNH4HPO4; mientras el medio MM emplea como fuente de carbono y nitrógeno al glutamato de sodio. Los cultivos fueron realizados a temperatura ambiente y con agitación (100 rpm). Adicionalmente, se hicieron los respectivos controles de los medios sin inocular. Cada uno de los experimentos fue extraído con resina Diaion® HP-20, la cual fue lavada con agua hasta fin de cloruros para remover la mayor cantidad posible de compuestos del medio de cultivo, y posteriormente eluída con MeOH y AcOEt para obtener el extracto HP-20, que se espera sea enriquecido en compuestos orgánicos producidos por las bacterias. Estos extractos fueron evaluados en cuanto a su actividad IQS a concentraciones de 1 y 2 mg/disco, y en cuanto a su rendimiento. Es importante notar que la resina empleada al ser una resina no iónica, tiene la capacidad de retener compuestos de naturaleza orgánica desde polares hasta no polares, y permite eliminar sales y otros compuestos altamente hidrofílicos (ejemplo azúcares, aminoácidos, etc.), de esta manera se puede obtener un extracto enriquecido en una gran diversidad de compuestos orgánicos a partir de disoluciones acuosas ricas en electrolitos (18) como es el caso de los medios de cultivo de microorganismos.
Ensayo de Inhibición de quorum sensing (IQS)
Para la evaluación de la actividad inhibitoria del quorum sensing se empleó el biosensor Cromobacterium violaceum ATCC 31532 utilizando la técnica de difusión en agar con sensidiscos juzgando como resultado positivo la inhibición de la producción de violaceína, sin efectos bactericidas (15). El biosensor C. violaceum fue cultivado en caldo tripticasa de soya (CTS) a 27 °C durante toda la noche, hasta alcanzar una densidad óptica (OD) cercana al patrón 0.5 McFarland. Posteriormente, se realizó un sembrado masivo con 400 µL de inóculo sobre cajas de agar tripticasa de soya (ATS). En las cajas de Petri se colocaron por duplicado los sensidiscos de prueba previamente impregnados con los extractos (1.0 y 2.0 mg/disco) y fracciones a ensayar (0.3 mg/disco). Finalmente, las cajas con los sensidiscos fueron incubadas a 27° C, y los halos de inhibición de la producción de violaceína fueron medidos visualmente con la ayuda de un calibrador a las 24 h y 48 h. Los halos se reportan en mm sin restar el diámetro de disco (4.7 mm). Adicionalmente, se observó si hubo o no inhibición del crecimiento del biosensor, en caso de que se diese la inhibición del crecimiento de C. violaceum ATCC 31532, el extracto o fracción se clasificó como inhibidor de crecimiento y no como inhibidor de quorum sensing. Así, la actividad IQS fue detectada cuando hubo inhibición en la producción de violaceína sin que hubiera inhibición del crecimiento bacteriano. Como controles positivos se emplearon: a) ácido kójico (90 µg/disco) b) un extracto de Cecropia pachystachya (10 µg/disco) (19). Como controles negativos se emplearon los sensidiscos impregnados con los disolventes en que se aplicaron las muestras, es decir MeOH y DCM, y su posterior evaporación. Los extractos de los medios de cultivo sin inocular fueron evaluados en las mismas condiciones que los extractos de los cultivos de cada cepa.
Cepas Bacterianas
Las 15 cepas bacterianas marinas objeto de este estudio fueron obtenidas del holobionte del octocoral Antillogorgia elisabethae, utilizando métodos tradicionales de cultivo (17). Las bacterias fueron caracterizadas e identificadas usando tanto sus características morfológicas como métodos moleculares (secuenciación del gen 16S rRNA) (17). A continuación se presenta la lista de las cepas bacterianas usadas en este trabajo: Paenibacillus glucanolyticus (RKHC-8), Bacillus cereus (RKHC-9), Bacillus horti (RKHC-13), cepa no identificada RKHC-15, Bacillus licheniformis (RKHC-21), Bacillus mojavensis (RKHC-37), Bacillus pumillus (RKHC-57A), Bacillus horneckiae (RKHC-68A), Bacillus anthracis (RKHC-69A), Oceanobacillus profundus (RKHC-62B), Oceanobacillus iheyensis (RKHC-82A), Jeotgalicoccus halophilus (RKHC-28), Staphylococcus auricularis (RKHC-48), Staphylococcus equorum (RKHC-54), y Staphylococcus warneri (RKHC-78B).
Condiciones de crecimiento
Los 15 aislamientos bacterianos se preservaron en medio marino Difco® 2216 semisólido a 4 °C hasta que fueron utilizados para su cultivo. Cada una de las cepas fue cultivada en volúmenes de 10 mL por triplicado, durante 96 h, a temperatura ambiente y con una agitación de 100 rpm, en cuatro medios diferentes, que son descritos a continuación: LB con sales (Medio Luria Bertani modificado por nosotros con la adición de sales de medio marino, LBS) cantidades por litro de agua: NaCl 20.8 g, KCl 0.56 g, MgCl2 4.00 g, MgSO4·7H2O 4.80 g, Tris 0.36 g, sal marina Rila® 1.5 g, extracto de levadura 5 g y triptona 10.0 g. Medio Marino Mínimo (MM) cantidades por litro de agua: Glutamato de sodio 2.0 g, NaCl 20.0 g, MgSO4·7H2O 7.0 g, MgCl2 5.3 g, CaCl2 1.25 g, K2HPO4 0.075 g, FeSO4 0.025 g, CuSO4 0.005 g y Tris 6.1 g (20). Benzoato mínimo (BM) cantidades por litro de agua: Benzoato de sodio 2.5 g, MgSO4·7H2O 0.2 g, K2HPO4 10.0 g, NaNH4HPO4 3.5 g, ácido cítrico 0.2 g, y sal marina Rila® 18.0 g (21). Takahashi (TAK) cantidades por litro de agua: Almidón 30.0 g, dextrosa 5.0 g, peptona 10.0 g, MgSO4·7H2O 0.5 g, Na2HPO4·12H2O 0.5 g, y KH2PO4 0.2 g (22).
Extracción
Culminado el tiempo de crecimiento, las tres réplicas del cultivo fueron reunidas y centrifugadas a 5000 rpm durante 10 min, con el fin de eliminar la biomasa. Posteriormente, el sobrenadante fue filtrado secuencialmente a través de tres membranas con diferente tamaño de poro: 0.80, 0.65 y 0.45 µm, para así obtener el medio de cultivo agotado para cada cepa en cada medio. Estos fueron sometidos a dos técnicas de extracción: Extracción con resina no iónica Diaion® HP-20 en relación resina/medio del cultivo agotado (1/10) y empleando como eluyentes 100 mL MeOH y 100 mL de AcOEt. Los dos eluídos fueron reunidos en un solo extracto que se denominó extracto HP-20; la otra metodología de extracciÓn fue Líquido-Líquido y se describe a continuación.
Las cepas J. halophilus (RKHC-28) y O. profundus (RKHC-62B) fueron cultivadas en los medios LBS, TAK y BM, en volúmenes de 100 mL con 10 réplicas por cada medio de cultivo, a temperatura ambiente, y con agitación de 100 rpm durante 96 h. Los sobrenadantes de estos cultivos se extrajeron por medio de extracción líquido-líquido continua usando diclorometano. Se extrajeron 500 mL del medio de cultivo agotado con 500 mL de DCM, por duplicado. Este extracto se denominó DCM. La fase acuosa residual se extrajo con resina Diaion ® HP-20 (relación 1:10 resina:medio agotado extraído), eluyéndola con metanol para obtener el extracto acuoso residual (EAR). Posteriormente, cada uno de los tres extractos resultantes (HP-20, DCM, EAR) fue evaluado en el ensayo de IQS (vide infra). Como blancos fueron empleados los extractos de los medios de cultivo sin inocular obtenidos por extracción con la resina Diaion® HP-20.
Fraccionamiento
Los extractos que resultaron activos en el ensayo de IQS fueron fraccionados por cromatografía en columna RP-18 (200 mg), en cantidades que oscilaron entre 2 y 50 mg de extracto dependiendo de la cantidad de extracto obtenida. Para esto se usaron mezclas de MeOH-H2O (1:9) y (1:1), y MeOH (100%). Cada una de estas fracciones fue concentrada, y posteriormente evaluada en el ensayo de IQS.
Análisis por HPLC
Para el análisis por HPLC-DAD de extractos y fracciones se empleó el equipo Merck-Hitachi antes descrito y con el siguiente gradiente de solventes: ACN-H2O 1:9 0-10 min; ACN-H2O de 1:9 a ACN 100 % de 10 a 30 min; ACN 100% de 30 a 40 min; y de ACN 100 % a ACN-H2O 1:9 de 40 a 50 min a un flujo de 1 mL/min. La detección se hizo a 210 nm, mientras el detector DAD registró entre 210 a 650 nm con el fin de tener el espectro UV de cada pico eluído. Se inyectaron 50 µL de cada solución a una concentración de 1.0 mg de extracto por mL. Adicionalmente, los extractos activos (Fracción DCM del cultivo de J. halophilus y O. profundus) fueron analizados por RMN-1H.
Estudio químico de Oceanobacillus profundus
La cepa bioactiva Oceanobacillus profundus fue cultivada durante 96 h en medio LBS. Para esto se usaron fiolas de 500mL, con un volumen de 100 mL, por 114 veces para completar un volumen total de 11,4 L. Posteriormente, el medio se centrifugó a 5000 rpm y el sobrenadante se sometió a extracción líquido-líquido continua con DCM destilado. La fracción orgánica se concentró para obtener 850 mg de extracto crudo. El extracto se sometió a purificación por cromatografía en columna sobre sílica gel, usando un gradiente discotinuo de hexano, acetato de etilo y metanol, para obtener 12 fracciones F1-F12. Todas las fracciones fueron ensayadas contra C. violaceum a 100, 200 y 300 µg/sensidisco. Las fracciones activas F5 (10 mg), y F7 (19 mg), eluidas con hexano:acetato de etilo (1:1) y acetato de etilo, respectivamente, fueron purificadas por CC sobre sephadex LH-20 usando metanol como eluente, para rendir los compuestos 1 y 2. Estos compuestos puros fueron ensayados contra C. violaceum a 100, 200 y 300 µg/sensidisco, observándose actividad IQS en todos los ensayos.
Compuesto 1: (-)-ESI-EM: 137 [M-H]-. RMN (300 MHz, CDCl3) 7,06 (d, J= 9,0 Hz, 2H); 6,77 (d, J=9,0 Hz, 2H); 3,82 (t, J=6,0 Hz, 2H); y 2,77 (t, J=6,0 Hz, 2H) ppm
Compuesto 2: (-)-ESI-EM: 179 [M-H]-. RMN (300 MHz, CDCl3) 7,09 (d, J= 8,0 Hz, 2H); 6,78 (d, J=8,0 Hz, 2H); 4,24 (t, J=2,7 Hz, 2H); 2.87 (t, J=2,7 Hz, 2H), y 2,06 (s, 3H) ppm
RESULTADOS
Evaluación de la producción de extractos inhibidores del quorum sensing
Las cepas bacterianas más promisorias como fuente de compuestos IQS se resumen en la tabla 1, y corresponden a: O. profundus, cuyos cuatro extractos fueron activos; seguido de B. licheniformis, B. horneckiae y J. halophilus, en cuyos casos tres de los cuatros extractos resultaron activos (cultivos en LBS, BM y TAK); y con actividad moderada los extractos de las cepas S. warneri (BM y TAK), B. anthracis (BM, MM), B. horti (TAK y MM) y B. mojavensis (BM, TAK y MM) que resultaron activos en dos de los cuatro medios ensayados.
Fraccionamiento de los extractos activos
Los extractos obtenidos de las cepas O. profundus, B. licheniformis, B. horneckiae y J. halophilus, las cuales mostraron la mayor actividad, fueron fraccionados a través de cartuchos para extracción en fase sólida (EFS) RP-18, eluyendo con tres mezclas de solventes: MeOH:H2O (1:9), MeOH:H2O (1:1) y MeOH (100%), para así obtener fracciones orgánicas de polaridad alta, media y baja, respectivamente. Luego, cada una de estas fracciones fue evaluada en el ensayo de actividad IQS (tabla 1s, material suplementario) con el fin de establecer en cuál de ellas se tienen los compuestos bioactivos.
En todos los casos la actividad IQS se encontró únicamente en la fracción de menor polaridad: la metanólica, mientras las fracciones más polares (eluídas con MeOH:H2O 1:9) no presentaron dicha actividad, sugiriendo que los compuestos responsables de la actividad inhibitoria del QS son de polaridad moderada o baja. Las fracciones más activas fueron las de B. licheniformis (cultivada en LBS), J. halophilus (cultivada en BM) y O. profundus (cultivada en MM); mientras que las fracciones de J. halophilus (cultivada en MM) y B. horneckiae (cultivada en BM) presentaron actividad moderada; y finalmente J. halophilus (cultivada en LBS) presentó baja actividad (tabla 1s, material suplementario).
Análisis cromatográfico de los extractos activos
Los extractos HP-20 de las cuatro cepas bioactivas preseleccionadas (O. profundus, B. licheniformis, B. horneckiae y J. halophilus) cultivadas en medio TAK, MM, BM y LBS, y sus respectivos blancos de medio fueron analizados por HPLC-DAD. Los cromatogramas, aunque muestran la presencia de compuestos diferentes al medio de cultivo, presentaron poca resolución cromatográfica (Figuras 1s, 2s, 3s y 4s, material suplementario) haciendo evidente la necesidad de incluir estrategias de limpieza de los extractos para facilitar el análisis, aislamiento y elucidación estructural de los compuestos responsables de la actividad. El análisis por HPLC de las fracciones metanólicas no fue posible dado el bajo rendimiento de estas aunque fueron las que presentaron la mayor actividad (tabla 1s, material suplementario). Las cepas B. horneckiae y B. licheniformis fueron descartadas para esta parte del estudio, ya que aunque sus extractos presentan una buena actividad IQS, en la literatura se encuentran múltiples> reportes de su composición química (23,24). Mientras que para J. halophilus y O. profundus no hay reportes de los compuestos producidos por ellas por lo que se continuó con su estudio.
Con lo anterior resulta claro que las cepas J. halophilus y O. profundus, cultivadas en los medios LBS, BM y TAK, tienen compuestos activos como IQS de baja a mediana polaridad, por lo que se decidió obtener extractos enriquecidos en compuestos de estas polaridades usando una extracción líquido-líquido continua (L-L) con diclorometano (48 horas). Posteriormente, la fase acuosa remanente fue extraída empleando resina Diaion® HP-20 para obtener el extracto acuoso residual (EAR) con el fin de recuperar los compuestos de polaridad mayor que no fueron extraídos con el DCM. Los resultados en cuanto al rendimiento de los extractos DCM y EAR, así como el de actividad IQS evaluada por el método de difusiÓn en agar se muestran en la tabla 2.
La tabla 2 muestra que la actividad IQS para J. halophilus cultivado en los tres medios de cultivo se concentró en el extracto DCM, logrando inhibiciones mayores a las presentadas por los fraccionamientos sobre RP-18 (tabla 1). Es de notar, que para el caso de O. profundus cultivado en LBS mostró que la actividad IQS se centraba en el extracto DCM (compuestos de baja polaridad), mientras que cuando se cultivaba en el medio TAK la actividad estaba en EAR (compuestos de alta polaridad), evidenciado la gran influencia que tiene el medio de cultivo en la producción de compuestos IQS para esta cepa. De otro lado el extracto DCM de O. profundus cultivado en BM resultó estar enriquecido con el ácido benzoico propio del medio de cultivo, por lo cual no se realizÓ el bioensayo.
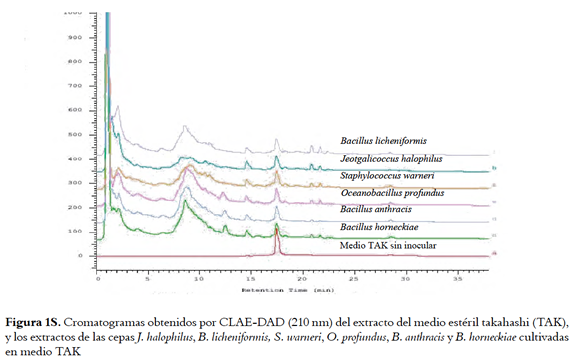
Para conocer la complejidad de los extractos activos obtenidos por extracción L-L, estos se analizaron por HPLC-DAD comparándolos con los perfiles obtenidos para los extractos de los medios sin inocular (Figuras 1, 5S y 6S, material suplementario), donde se muestra que con la extracción L-L se obtienen perfiles cromatográficos más sencillos que los obtenidos para los extractos HP-20 correspondientes, lo cual facilitaría la recuperación de los compuestos activos.
En la figura 1 se pueden observar los perfiles cromatográficos para los extractos DCM de los medios agotados de J. halophilus y O. profundus cultivados en LBS, además del perfil del medio sin inocular. Para J. halophilus se observan un pico intenso entre 15 y 16 min, que si bien presenta un tiempo de retención similar al pico mayoritario del medio LBS sin inocular (blanco), los espectros UV de estos picos (ver recuadros de la figura 1) muestran que se tratan de compuestos diferentes a los presentes en el medio de cultivo. Las absorciones en λ = 244, 262 y 300 nm para el pico mayoritario de J. halophilus son característicos de compuestos indúlicos(28). De manera similar, el extracto de O. profundus presentó picos cromatográficos en diferentes tiempos de retención, al compararlo con el medio de cultivo sin inocular, sin embargo, el espectro UV del pico que aparece en un tiempo de retención de 15 min es idéntico al mismo pico en el perfil del medio de cultivo, por lo cual podemos afirmar que O. profundus produce compuestos de otra naturaleza. Lo anterior permitió evidenciar la producción de compuestos por parte de las bacterias, haciendo uso de un sistema de HPLC-UV y un proceso de extracción más selectivo.
Este mismo análisis se realizó para los extractos de J. halophilus y O. profundus en los medios BM y TAK encontrando diferencias importantes entre los extractos DCM de los medios agotados y extractos DCM de los blancos (Figuras 5S y 6S, material suplementario). Estos resultados evidenciaron que esta técnica de extracción facilitó la recuperación de los compuestos bioactivos.
Identificación de los compuestos responsables de la actividad IQS
Por último, se registraron los espectros de RMN 1H (CDCl3) del extracto DCM del cultivo agotado de las cepas J. halophilus y O. profundus en medio LBS, y del extracto del mismo sin inocular (figuras 2A, 2B y 2C ). Esto con el fin de identificar señales en los extractos DCM de las cepas, diferentes a las del extracto DCM del medio sin inocular. Así, para el caso de J. halophilus se observó la presencia de compuestos tipo aldehído a juzgar por la aparición de señales entre δH 9,5 y δH 10,0, así mismo se observa la aparición de nuevas señales de protones aromáticos (δH 6,8 y 8,5) características de anillos indólicos, confirmando lo previamente visto en los espectros UV; además, se presentan diferencias en la zona de los metilos alifáticos y entre δH 3,5 y δH 4,0 que sugiere la producción de péptidos. Las señales más representativas en el extracto de J. halophilus que no están presentes en el medio de cultivo se pueden observar en la figura 7S de la información de soporte, donde se presenta la resta de los espectros.
En el caso de O. profundus las diferencias son menos evidentes (figuras 2B y 2C), aunque es posible observar la aparición de señales anchas entre δH 6,7 y δH 7,3, indicando la producción de compuestos aromáticos; así mismo se observan señales alrededor de δH 2,1 indicando la producción de compuestos acetilados. La resta de los espectros se presentan en la figuras 9S, y muestra además de lo antes dicho señales entorno de δH 3,5 y en la región de metilos.
Para continuar se seleccionó la cepa O. profundus, que fue descrita originalmente en 2007 a partir de sedimentos de alta mar (2247 m) (25), y que no presenta ningún estudio químico. La cepa fue cultivada en LBS, centrifugada, y el sobrenadante extraído con DCM. El extracto orgánico del cultivo fue separado por cromatograía sobre sílica gel de manera bioguiada usando el biosensor C. violaceum. De esta manera a partir de las fracciones bioactivas figuras 5S y figuras 7S se aislaron los compuestos 1 y 2, respectivamente, por medio de CC sobre Sephadex® LH-20. Los espectros de RMN 1H del compuesto 1 muestra la presencia de una anillo aromático para disustituido (δH 7,06 (d, J= 9,0 Hz, 2H); 6,77 (d, J=9,0 Hz, 2H)) y un residuo hidroxietilo (δH 3,82 (t, J=6,0 Hz, 2H); y 2,77 (t, J=6,0 Hz, 2H)). En ESI(-) se observa un ion en m/z 137 [M-H]- es congruente con la formula molecular C8H10O2. El análisis anterior y una búsqueda en la literatura permitió identificar a 1 como 4-(2-hidroxietil) fenol (26), también conocido como tirosol (figuras 3). El espectro de RMN 1H de 2 es similar al de 1, teniendo una señal adicional para un grupo acetilo (δH 2,06, s, 3H) que es congruente con el ion en m/z 179 en ESI(-) (Fórmula molecular C10H12O3), lo que permitió su identificación como acetato de 4-hidroxifenetilo (acetato de tirosol) de acuerdo a lo reportado (27) (figuras 3). Ambos compuestos mostraron actividad inhibitoria de quorum sensing aún a la mínima cantidad ensayada (100 mg/sensidisco), presentado una actividad similar al ácido kójico un compuesto reconocido como IQS empleado como patrón positivo (28).
DISCUSIÓN
La importancia de esta propuesta radica en la capacidad de evaluar el potencial de una colección de microorganismos como productores de compuestos y realizar una selección bioguiada, en nuestro caso actividad IQS. Por otra parte una de las limitantes es el empleo de un solo bioensayo, pues aunque un extracto no presentara actividad en el ensayo escogido podría tener otra, por lo que además de varios métodos de extracción podrían evaluarse diferentes tipo de bioactividad (antibiótica, antifúngica, citotóxica, etc.), en la práctica siguiendo este esquema el investigador tiene la libertad de probar simultáneamente diferentes técnicas dependiendo de sus objetivos.
Los microorganismos marinos han sido reconocidos como una fuente novedosa de compuestos con actividad biológica (14), dentro de las cuales la búsqueda de inhibidores de quorum sensing es un campo de investigación nuevo (11, 28). Actualmente, es ampliamente aceptado que un buen número de los compuestos obtenidos de los extractos de invertebrados marinos, particularmente los de organismos sésiles, son en realidad producidos por microorganismos asociados al invertebrado (29). Uno de los ejemplos más relevantes por su importancia biomédica y económica es la producción de la cianosafracina B por parte de la bacteria Pseudomonas fluorescens, simbionte del tunicado Ecteinascidia turbinata, el cual se emplea como precursor en la obtención de la ecteinascidina 743 (E-743), medicamento usado para el tratamiento del cáncer y que fue inicialmente obtenido a partir del extracto del tunicado (30). Actualmente es comercializado por Pharmamar con el nombre comercial de Yondelis ® (14). En la bibliografía especializada, también se encuentran ejemplos de compuestos aislados de microorganismos cultivados, sin contraparte en invertebrados, y con aplicación farmacológica. Este es el caso de la salinosporamida A producida por actinomicetes del género Salinospora, la cual actualmente se encuentra en la primera fase de estudios clínicos por su actividad citotóxica como inhibidor de proteosoma en células cancerosas. En general, las bacterias de género Salinospora producen en condiciones in vitro compuestos con estructuras novedosas y potente actividad citotóxica (31).
El metabolismo y la producción de compuestos de un microorganismo están condicionados por el medio donde se cultiva; así como por otros parámetros como la agitaciÓn, pH, aireación, etc. No obstante, estos medios del cultivo, por su complejidad, generan matrices que dificultan la separación e identificación de los metabolitos producidos por el microorganismo. Así, la selección del medio y de la metodología de extracción tiene un gran impacto en el éxito del estudio de los productos naturales a partir de microorganismos (32). Lo anterior hace necesario tener apuestas metodológicas que minimicen estas dificultades, y que permitan tomar decisiones en cuanto a la cepa a estudiar y las condiciones de cultivo. Estas metodologías deben ser fácilmente automatizables.
En la tabla 2s (ver material suplementario) se presentan los resultados de la evaluación IQS de los extractos HP-20 obtenidos del cultivo de las 15 cepas y del rendimiento de la extracción. En esta tabla se puede ver que el medio deficiente en nutrientes BM estimuló la producción de compuestos IQS en la mayoría de las cepas (87 %); sin embargo, el rendimiento de los extractos también fue muy bajo en la mayoría de los casos. En el medio rico en nutrientes LBS el 26 % de los extractos de los cultivos de las cepas mostraron actividad a todas las dosis empleadas, lo cual podría indicar que produce compuestos con potente actividad IQS o en alta concentración. En el medio rico en nutrientes TAK el 80 % de las cepas presentaron una actividad, al igual que en el medio LBS, donde además los extractos presentaron un buen rendimiento. Finalmente, el medio deficiente en nutrientes MM permitió obtener cerca del 33 % de los extractos con buena actividad, pero con rendimientos más bajos que los obtenidos incluso en BM. Con todo lo anterior los medios TAK y LBS fueron seleccionados como los mejores medios para la obtención de extractos inhibidores del QS. Sin embargo, es claro que un buen rendimiento en el extracto no significa, necesariamente, una alta producción de metabolitos, pues la resina puede retener también componentes del medio de cultivo dando extractos de matrices muy complejas, que en los pasos posteriores de purificación serían descartados por esta razón.
En todos los casos se observó que la cantidad de extracto obtenido del cultivo de las cepas es mayor al extracto del medio sin inocular correspondiente. Así mismo, en general los extractos obtenidos a partir de los medios mínimos tienen rendimientos más bajos que los obtenidos en los medios enriquecidos; no obstante, algunos de los extractos obtenidos a partir del cultivo en los medios mínimos (BM y MM) presentan actividad IQS superior a la obtenida para los cultivos en los medios enriquecidos LBS y TAK (tabla 1). Este hecho puede verse como una ventaja pues los medios mínimos representan una matriz menos compleja, esperando que los compuestos IQS se encuentren en una mayor concentración en estos extractos o que sean más fáciles de separar de la matriz.
A partir de la respuesta del biosensor C. violaceum ATCC 31532 frente a los extractos (tabla 2s, material suplementario) también se pudo observar actividad inhibitoria de crecimiento de los extractos de S. equorum (cultivada en BM y TAK), S. auricularis, (cultivadas en BM, TAK y MM), y de la cepa no identificada RKHC-15 (cultivada en LBS), lo cual sugiere que estas cepas podrían ser fuentes de compuestos con actividad antimicrobiana. Adicionalmente, se pudo establecer que en los extractos de algunas cepas como O. iheyensis en el medio LBS producen inductores del quorum sensing al inducir la producción de la violaceína en el biosensor (tabla 2s, material suplementario). Esta inducción no parecería deberse a la producción de homoserinlactonas, autoinductores del biosensor, porque las bacterias gram positivas como O. iheyensis no producen esta clase de compuestos (13). Este efecto inductor podría sugerir que en este extracto se encuentran compuestos IQS, o antibióticos, pero en cantidades subinhibitorias lo cual desencadena -como mecanismo de defensa- la producción de moléculas señalizadoras en el biosensor e inducción la expresión de los genes responsables de la producción de violaceína (33).
Los compuestos 1 y 2 han sido obtenidos de múltiple fuentes incluyendo una cepa marina de Streptomyces sp. KMM210; la levadura marina Pichia membranifaciens, especies de hongos del género Fusarium spp. PSU-F14 y PSU-F135, y Nigrospora sphaerica (34-36). Múltiples actividades biológicas se les han atribuido incluyendo antioxidante e inhibidores de citoquinina (37-39). El tirosol es una molécula de comunicación utilizada por el hongo Candida albicans favoreciendo por medio de QS el inicio de la filamentación (40-42) pero no se había descrito actividad inhibitoria del quorum sensing en bacterias aunque si su producción, como es el caso de Bacillus subtilis KMM 3427 (43), aunque compuestos similares (orto-dihidroxilados) han sido patentados recientemente con este fin (44). Lo que pone de manifiesto el potencial de esta especie como biocontrolador o como fuente de compuestos con actividad IQS.
CONCLUSIONES
En este trabajo se estudiaron 15 cepas bacterianas pertenecientes al phylum Firmicutes aisladas del coral blando Antillogorgia elisabethae como fuente de compuestos con actividad IQS. Las bacterias fueron cultivadas en los medios LBS, TAK, BM y MM. Los extractos realizados con la resina Diaion® HP-20 permitieron seleccionar a las cepas J. halophilus, O. profundus, B. horneckiae y B. licheniformis como productoras de los extractos más activos. Estas cepas bacterianas representan una fuente novedosa de inhibidores del QS. Por medio de análisis HPLC-DAD se determinó una alta complejidad de los extractos, incluso luego de un fraccionamiento cromatográfico en fase reversa sobre cartuchos reutilizables. Por otra parte, y gracias a que la actividad IQS se centró en la fracción menos polar del fraccionamiento cromatográfico, se pudo proponer que el uso de extracciones L-L con solventes de media polaridad (Ej. DCM) debería permitir la recuperaciÓn de los compuestos bioactivos con menor contaminación del medio de cultivo. Así, se obtuvieron extractos más activos y menos complejos, para las cepas J. halophilus y O. profundus, mostrando las ventajas de esta extracción enfocada hacia los compuestos bioactivos. La caracterización preliminar de estos extractos por CLAE y RMN 1H, permitió observar la producción de compuestos diferentes a los medios de cultivo, identificando núccleos tipo indol así como la presencia de grupos formilo en las moléculas producidas por J. halophilus, mientras que para O. profundus se lograron aislar el tirosol (1) y su acetato (2), para los que no se había reportado actividad QSI.
AGRADECIMIENTOS
Este trabajo fue financiado por Colciencias, la Universidad Nacional de Colombia y la International Foundation for Science IFS Uppsala - Suecia (Grant F/5023-1). El Ministerio de Ambiente, Vivienda y Desarrollo Territorial otorgó el Permiso (Permiso No. 4 of 10/02/2010, contrato de acceso a recurso genético No 107 y 108) para la recolección de las muestras y la investigación en Antillogorgia elisabethae en el archipiélago de San Andrés y Providencia, en el Caribe colombiano.
Los autores declaran que no existe conflicto de intereses con los resultados del presente trabajo.
REFERENCIAS
1. CIOFU O, GIWERCMAN B, HØIBY N, PEDERSEN SS. Development of antibiotic resistance in Pseudomonas aeruginosa during two decades of antipseudomonal treatment at the Danish CF Center. APMIS [Internet]. Blackwell Publishing Ltd; 1994;102(7-12):674â80. [ Links ]
2. Rumbaugh KP, Griswold J a, Iglewski BH, Hamood a N. Contribution of quorum sensing to the virulence of Pseudomonas aeruginosa in burn wound infections. Infect Immun [Internet]. 1999 Nov;67(11):5854-62. [ Links ]
3. Collier DN, Anderson L, McKnight SL, Noah TL, Knowles M, Boucher R, et al. A bacterial cell to cell signal in the lungs of cystic fibrosis patients. FEMS Microbiol Lett [Internet]. 2002 Sep 24;215(1):41-6. [ Links ]
4. Schultz MP, Bendick J a, Holm ER, Hertel WM. Economic impact of biofouling on a naval surface ship. Biofouling [Internet]. 2011 Jan;27(1):87-98. [ Links ]
5. Skandamis PN, Nychas G-JE. Quorum sensing in the context of food microbiology. Appl Environ Microbiol [Internet]. 2012 Aug;78(16):5473-82. [ Links ]
6. Fuqua C, Parsek MR, Greenberg EP. R EGULATION OF G ENE E XPRESSION BY CELL - TO -CELL COMMUNICATION : Acyl-Homoserine Lactone Quorum Sensing. Annu Rev Genet. 2001;35:439-68. [ Links ]
7. Bhardwaj AK, Vinothkumar K, Rajpara N. Bacterial quorum sensing inhibitors: attractive alternatives for control of infectious pathogens showing multiple drug resistance. Recent Pat Antiinfect Drug Discov [Internet]. 2013 Apr;8(1):68-83. [ Links ]
8. Bjarnsholt T, Jensen PØ, Rasmussen TB, Christophersen L, Calum H, Hentzer M, et al. Garlic blocks quorum sensing and promotes rapid clearing of pulmonary Pseudomonas aeruginosa infections. Microbiology [Internet]. 2005 Dec;151(Pt 12):3873-80. [ Links ]
9. Fusetani N. Antifouling marine natural products. Nat Prod Rep [Internet]. The Royal Society of Chemistry; 2011;28(2):400-10. [ Links ]
10. Dobretsov S, Teplitski M, Paul V. Mini-review: quorum sensing in the marine environment and its relationship to biofouling. Biofouling [Internet]. 2009 Jan;25(5):413-27. [ Links ]
11. Kalia VC. Quorum sensing inhibitors: an overview. Biotechnol Adv [Internet]. Elsevier Inc.; 2012;31(2):224-45.5(5):413-27. [ Links ]
12. Qian P-Y, Xu Y, Fusetani N. Natural products as antifouling compounds: recent progress and future perspectives. Biofouling [Internet]. 2010 Jan;26(2):223-34. [ Links ]
13. Teasdale ME, Donovan K a, Forschner-Dancause SR, Rowley DC. Gram-positive marine bacteria as a potential resource for the discovery of quorum sensing inhibitors. Mar Biotechnol (NY) [Internet]. 2011 Aug;13(4):722-32. [ Links ]
14. Gerwick WH, Moore BS. Lessons from the past and charting the future of marine natural products drug discovery and chemical biology. Chem Biol [Internet]. Elsevier Ltd; 2012 Jan 27;19(1):85-98. [ Links ]
15. Tello E, Castellanos L, Duque C. Synthesis of cembranoid analogues and evaluation of their potential as quorum sensing inhibitors. Bioorg Med Chem [Internet]. Elsevier Ltd; 2013 Jan 1;21(1):242-56. [ Links ]
16. Williams GC, Chen J. Resurrection of the octocorallian genus Antillogorgia for Caribbean species previously assigned to Pseudopterogorgia, and a taxonomic assessment of the relationship of these genera with Leptogorgia (Cnidaria, Anthozoa, Gorgoniidae). 2012;52:5326. [ Links ]
17. Correa H, Haltli B, Duque C, Kerr R. Bacterial Communities of the Gorgonian Octocoral Pseudopterogorgia elisabethae. Microb Ecol [Internet]. Springer US; 2013;66(4):972-85. [ Links ]
18. Li J, Chase H a. Development of adsorptive (non-ionic) macroporous resins and their uses in the purification of pharmacologically-active natural products from plant sources. Nat Prod Rep [Internet]. 2010 Oct;27(10):1493-510. [ Links ]
19. Brango-Vanegas J, Costa GM, Ortmann CF, Schenkel EP, Reginatto FH, Ramos FA, et al. Glycosylflavonoids from Cecropia pachystachya Trécul are quorum sensing inhibitors [Internet]. Phytomedicine : international journal of phytotherapy and phytopharmacology. Urban & Fischer Verlag; 2014. p. 670-5. [ Links ]
20. Hasan F, Khan S, Shah AALI, Hameed A. Production of antibacterial compounds by free and immobilized Bacillus pumilus SAF1. Pak J Bot. 2009;41(3):1499-510. [ Links ]
21. Al-zereini W, Schuhmann I, Laatsch H, Helmke E. New Aromatic Nitro Compounds from Salegentibacter sp . T436 , an Arctic Sea Ice Bacterium : Taxonomy , Fermentation , Isolation and Biological Activities. J Antibiot (Tokyo). 2007;60(5):301-8. [ Links ]
22. Sugiura K. Note Isolation of Tunicamycin Produced by Bacillus cereus K-279 Takashi Kamogashira , Setsuko Takegata. 1988;52(3):859-61. [ Links ]
23. Gutiérrez-Mañero FJ, Ramos-Solano B, Probanza A, Mehouachi J, R. Tadeo F, Talon M, et al. The plant-growth-promoting rhizobacteria Bacillus pumilus and Bacillus licheniformis produce high amounts of physiologically active gibberellins. Physiol Plant [Internet]. Munksgaard International Publishers; 2001;111(2):206-11. [ Links ]
24. Hamdache A, Lamarti A, Aleu J, Collado IG. Non-peptide metabolites from the genus Bacillus. J Nat Prod [Internet]. 2011 Apr 25;74(4):893-9. [ Links ]
25. Nam JH, Bae W, Lee DH. Oceanobacillus caeni sp. nov., isolated from a Bacillus-dominated wastewater treatment system in Korea. Int J Syst Evol Microbiol. 2008;58(5):1109-13. [ Links ]
26. Rukachaisirikul V, Khamthong N, Sukpondma Y, Phongpaichit S, Hutadilok-Towatana N, Graidist P, et al. Cyclohexene, diketopiperazine, lactone and phenol derivatives from the sea fan-derived fungi nigrospora sp. PSU-F11 and PSU-F12. Arch Pharm Res. 2010;33(3):375-80. [ Links ]
27. Aissa I, Bouaziz M, Ghamgui H, Kamoun A, Miled N, Sayadi S, et al. Optimization of lipase-catalyzed synthesis of acetylated tyrosol by response surface methodology. J Agric Food Chem. 2007;55(25):10298-305. [ Links ]
28. Dobretsov S, Teplitski M, Bayer M, Gunasekera S, Proksch P, Paul VJ. Inhibition of marine biofouling by bacterial quorum sensing inhibitors. Biofouling [Internet]. 2011 Sep;27(8):893-905. [ Links ]
29. Bhatnagar I, Kim S-K. Immense essence of excellence: marine microbial bioactive compounds. Mar Drugs [Internet]. 2010 Jan;8(10):2673-701. [ Links ]
30. Cuevas C, Pérez M, Martín MJ, Chicharro JL, Fernández-Rivas C, Flores M, et al. Synthesis of Ecteinascidin ET-743 and Phthalascidin Pt-650 from Cyanosafracin B. Org Lett [Internet]. American Chemical Society; 2000 Jul 19;2(16):2545-8. [ Links ]
31. Feling RH, Buchanan GO, Mincer TJ, Kauffman CA, Jensen PR, Fenical W, et al. A Cytotoxic Proteasome Inhibitor 10. 2003;355-7. [ Links ]
32. Knight V, Sanglier J-J, DiTullio D, Braccili S, Bonner P, Waters J, et al. Diversifying microbial natural products for drug discovery. Appl Microbiol Biotechnol [Internet]. 2003 Oct;62(5-6):446-58. [ Links ]
33. Romero D, Traxler MF, López D, Kolter R. Antibiotics as signal molecules. Chem Rev [Internet]. 2011 Sep 14;111(9):5492-505. [ Links ]
34. Sobolevskaya MP, Denisenko VA, Moiseenko AS, Shevchenko LS, Menzorova NI, Sibirtsev YT, et al. Bioactive metabolites of the marine actinobacterium. Russ Chem Bull. 2007;56(4):838-40. [ Links ]
35. Elbandy M, Shinde PB, Dang HT, Hong J, Bae KS, Jung JH. Furan metabolites from the sponge-derived yeast Pichia membranifaciens. J Nat Prod. 2008;71(5):869-72. [ Links ]
36. Trisuwan K, Khamthong N, Rukachaisirikul V, Phongpaichit S, Preedanon S, Sakayaroj J. Anthraquinone, cyclopentanone, and naphthoquinone derivatives from the sea fan-derived fungi Fusarium spp. PSU-F14 and PSU-F135. J Nat Prod. 2010;73(9):1507-11. [ Links ]
37. Serdyuk OP, Smolygina LD, Muzafarov EN, Adanin VM, Arinbasarov MU. 4-Hydroxyphenethyl alcohol a new cytokynin-like subtance from the phototropic purple bacterium Rhodospirillum rubrum 1R. FEBS Lett. 2000;365(1995):10-2. [ Links ]
38. Hung CY, Tsai YC, Li KY. Phenolic antioxidants isolated from the flowers of Osmanthus fragrans. Molecules. 2012;17(9):10724-37. [ Links ]
39. Zhang Q-H, Tian L, Zhou L-D, Zhang Y, Li Z-F, Hua H-M, et al. Two new compounds from the marine Nigrospora sphaerica. J Asian Nat Prod Res. 2009;11(11):962-6. [ Links ]
40. Kalia VC. Quorum Sensing vs Quorum Quenching : A Battle with No End in Sight. New Delhi. Springer; 2015. 383 p. [ Links ]
41. Alem M a S, Oteef MDY, Flowers TH, Douglas LJ. Production of tyrosol by Candida albicans biofilms and its role in quorum sensing and biofilm development. Eukaryot Cell. 2006;5(10):1770-9. [ Links ]
42. ALBUQUERQUE P, CASADEVALL A. Quorum sensing in fungi - a review. Med Mycol. 2012;29(6):997-1003. [ Links ]
43. Ivanova EP, Kuznetsova T a, Mikhailov V V. Antifungal compounds produced by bacterial populations of the sea sponge Verongia sp. Biol Morya (Vladivostok, Russ Fed). 2000;26(2):116-8. [ Links ]
44. Auñon CD, Allende PA, Fábragas CJ, Gómez-Acebo GE. Use of hydroxytirosol and derivatives thereof as quorum quenchers [Internet]. World Intellectual Property Organization International Bureau; PCT/EP2013/071845, 2014. [ Links ]