1 Introducción
Los primeros tintes usados fueron de origen natural, como el hollín, óxido de manganeso, hematita y ocre, para pintar desde historias en cuevas hasta pieles y ropas de uso común. Los tintes naturales de uso textil fueron obtenidos de plantas, insectos, hongos y líquenes. Desde 1856, cuando Perkin obtuvo los primeros colorantes sintéticos, miles de estos tintes sintéticos se han producido hoy en día, considerando que la producción mundial anual total de tinte de uso textil se estima alrededor de 70,000 toneladas/año, con más de 100,000 colorantes disponibles en el mercado. Teniendo en cuenta que el mayor consumidor de estos tintes es la industria textil [1].
Los tintes o colorantes pueden definirse como sustancias que, al ser aplicadas a un sustrato, imparte color a dicho sustrato mediante procesos que de manera temporal destruyen cualquier estructura cristalina de las sustancias coloreadas. Estas se adhieren a superficies compatibles por adsorción física, retención mecánica, formación de enlaces covalentes o de complejos con sales o metales, entre otros [2]. El color de los tintes depende de su capacidad de absorber la luz en el rango visible de la radiación electromagnética (400-700 nm). Considerando la teoría de Witt, un colorante debe estar formado de dos grupos, un cromóforo y un auxocromo. Los cromóforos dan color al tinte, porque son capaces de absorber luz en la región visible (por ejemplo, grupos nitro, azo, quinoides), mientras que los auxócromos se encargan de profundizar el color, cuando se introduce una molécula de color. La teoría de Witt, ha sido reemplazada por la teoría electrónica moderna, la misma en la cual el color es causado por la excitación de los electrones de valencia n, por la luz visible [3].
El uso de colorantes para la tinción de diferentes productos es de gran demanda y uso a escala mundial, ya que además del aporte visual que puede generar a un producto, mejorar notablemente su apariencia, también potencia estrategias de marketing de promoción de venta de estos, por ello, varias industrias utilizan diversos tipos de colorantes; industrias como la alimenticia, del papel, la textil, entre otras. Por ello, uno de los problemas que ocasiona el proceso de teñido es la cantidad de aguas coloreadas producidas. La presencia de colorantes en efluentes es una de las principales causas de afectaciones al medio ambiente. Estos pueden ser fácilmente detectados aún en cantidades muy pequeñas (menos de 1 ppm para ciertos colorantes). Los colorantes además de afectar la transparencia del agua alteran su absorción y el reflejo de la luz solar, interfiriendo con la vida acuática en lagos, ríos y otros cuerpos de agua. Además afecta la demanda química de oxígeno (DQO), y muchos de estos colorantes sintéticos son tóxicos, mutagénicos y cancerígenos [4]. Dado este problema, la descarga de colorantes a nivel mundial está regulada [5-7].
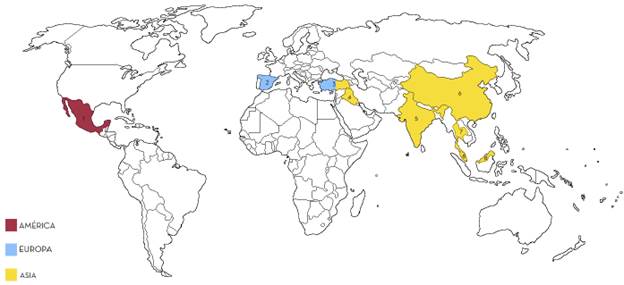
Los estudios realizados sobre la presencia de colorantes en aguas residuales y en matrices ambientales son escasos, del 2010 al 2020 se encontraron 20 estudios [8]-[25]. Como se ve en la figura 1, Asia es el continente donde más se ha estudiado este tema con 12 estudios distribuidos en India (6), Malasia (4), Irak (3), Turquía (2), China (1), Tailandia (1), ver tabla SI.1. En América solo se encontró un estudio en México. En Europa se encontraron dos estudios, uno en España y otro en Italia. En estas investigaciones, todas las aguas estudiadas fueron residuales industriales. En las investigaciones revisadas, el país donde se encontró la más baja concentración fue Irak al encontrar como mínimo 50 mg Pt-Co/L, mientras que la máxima concentración, 2200 mg Pt-Co/L, fue encontrada en Turquía, seguido de este, el valor subsecuente con respecto a niveles máximos fue encontrado en 2105 mg Pt-Co/L en Tailandia, estos países, pertenecientes al continente asiático poseen los valores más altos con respecto a coloración del agua residual ya que sobre pasaron los 1000 mg Pt-Co/L.
No existen estudios en el Ecuador, sin embargo, son diversas las actividades en las que los colorantes son usados, contaminando los efluentes que luego son liberados directamente al ambiente o enviados a las plantas de tratamiento de aguas que no están diseñadas para su tratamiento. Un ejemplo de esto se observa en los procesos productivos artesanales. Dentro de la amplia gama de artesanías producidas en el Ecuador, principalmente en las provincias de Manabí y Azuay, destaca notablemente la fabricación del sombrero de paja toquilla, mismo que en el 2012 fue declarado Patrimonio Cultural Inmaterial de la Humanidad [26, 27]. A pesar de que esta actividad se ha venido realizando desde hace varios años, los procesos de cultivo, recolección de la fibra, transporte hasta la elaboración de sombreros y otras artesanías no se han innovado y se siguen realizando con las técnicas que se han pasado como conocimiento entre generaciones.
Tradicionalmente los productos elaborados de paja toquilla se han concentrado en el tejido de la misma; sin embargo, actualmente se han extendido a una gama más amplia de productos, sobre todo la incorporación de procesos de teñido para ampliar la gama de colores ofertados. Los procesos de tinción se realizan también de forma artesanal, se coloca la paja en cocción con agua caliente, limón o sal, y generalmente colorantes sintéticos que comercialmente se venden bajo el nombre de anilinas [28]. Las anilinas son obtenidas con la reacción entre anilina y ácido crómico, conocido como mauveína o púrpura de anilina [29].
Debido a la naturaleza artesanal de la fabricación de productos de paja toquilla, los efluentes coloreados generalmente son descargados a ríos, quebradas o redes de alcantarillado público, donde afectan al ecosistema por su alta carga de DQO y materia orgánica [29]. A causa de esto, en algunas comunidades se han prohibido las técnicas de tinturado para evitar la contaminación, lo que ha afectado a la economía de las familias que tienen esta actividad como sustento.
Una alternativa para el tratamiento de estos efluentes son los procesos de Oxidación avanzada que se caracterizan por aprovechar la alta reactividad del radical hidroxilo (OH) como agente oxidante para oxidar materia orgánica hasta su mineralización. En la tabla 1 se muestran algunas investigaciones realizadas empleando el proceso de oxidación avanzada Fenton para la remoción de colorantes comunes.
Esta investigación propone el estudio de un proceso Fenton como una alternativa que permita la remoción del color en efluentes generados en la elaboración de productos de paja toquilla teñidos con anilinas. La ecotoxicidad del agua tratada se evaluó a través de pruebas agudas con Dapnia Magna.
2 Metodología
2.1 Aplicación de diseño experimental para determinar la relación [Fe]/[H2O2] en la reacción Fenton
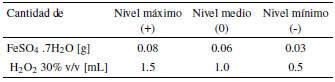
Para la determinación de las mejores condiciones de experimentación se realizó un diseño factorial completo de dos factores con tres niveles (32). Los factores fueron el catalizador y la cantidad de peróxido (ver tabla 2). Cada prueba se realizó por duplicado. La respuesta fue el tiempo para llegar a la decoloración del colorante. Como colorante modelo se trabajó con una solución de 100 ppm de azul de metileno en agua. El análisis de datos fue realizado por el software estadístico R versión 4.1.2 y con la interfaz R.Studio. Se realizó un ANOVA considerando la interacción. Además, se analizaron los efectos principales e interacciones con el paquete FrF2. Se comprobaron los supuestos de normalidad y homocedasticidad del modelo con las pruebas de Shapiro y de Bartlett.
2.2 Aplicación del proceso Fenton homogéneo para la degradación de colorantes empleados en el teñido de paja toquilla
En esta investigación se trabajó con 3 colorantes comercialmente muy usados a nivel local para el teñido de la paja toquilla, conocidos como: anilina azul, anilina roja y anilina negra. Se prepararon soluciones sintéticas en los rangos de 100, 250, 500 y, solamente para la anilina negra 1000 ppm, debido a la alta velocidad de reacción. En todos los casos se trabajó con un volumen de reacción de 100 mL, se ajustó el pH a 3 (pHmetro portátil, Combo, pH & EC), con una solución de ácido clorhídrico 2 N, se mantuvo las muestras en continua agitación a 400 rpm (plancha de agitación, MTOPS, HS 180). Se adicionó a cada muestra sulfato de hierro II hep-tahidratado (Merk, pureza 99.5%) y peróxido de hidrógeno (Freire Mejía, 30% v/v), respectivamente, según la relación optimizada [Fe]/[H2O2] obtenida con el diseño experimental. El seguimiento de la reacción se realizó por espectrofotometría (Espectrofotómetro Thermoscientific, Genesys 180), en el rango visible a la longitud de onda de absorbancia máxima de cada uno de los colorantes (615 nm - anilina Azul, 554 nm - anilina Roja y 616 nm -anilina Negra). Finalmente, se determinó el porcentaje de decoloración alcanzado. Cada prueba se realizó por duplicado.
2.3 Determinación de la cinética de decoloración con la aplicación del proceso Fenton homogéneo
Se realizó el seguimiento de cada reacción por espectrofotometría Visible, se registró la absorbancia cada 20 segundos hasta no observar un cambio significativo en la concentración de colorante. La cinética de decoloración se obtuvo mediante métodos integrales para los ajustes lineales de órdenes de reacción 0, 1 y 2. Se determinaron el R2 y las constantes cinéticas.
2.4 Prueba de ecotoxicidad sobre las soluciones decoloradas
Las pruebas de ecotoxicidad se realizaron en Daphnia Magna (D.M.) según la norma brasileña ABNT NBR 12713 [38]. Las D.M., antes de la prueba, se conservaron en una pecera con agua potable declorada a 20 °C, en un fotoperiodo de 12 horas de luz y 12 de oscuridad. Las D.M. fueron alimentadas tres veces por semana después de un cambio de agua del cincuenta por ciento. Los cladóceros fueron alimentados con un concentrado de espirulina 30 ppm y levadura 10 ppm. Se realizaron pruebas de sensibilidad con soluciones de dicromato de potasio, para ello 10 neonatos < 24 h, se colocaron con soluciones de dicromato de potasio con diferentes concentraciones según la norma chilena NCh 2083 [39]. Las concentraciones utilizadas fueron: 0.3, 0.8, 1.5 y 2 ppm. Una vez comprobada la sensibilidad de las Daphinas, 10 neonatos de menos de 24 h de nacidos fueron colocados en cada una de las aguas tratadas y neutralizadas. Cada prueba se hizo por triplicado, al cabo de 48 h se contabilizaron la cantidad de Daphnias inmovilizadas.
3 Resultados y discusión
3.1 Determinación de la relación [Fe]/[H2O2] para la aplicación del proceso Fenton homogéneo
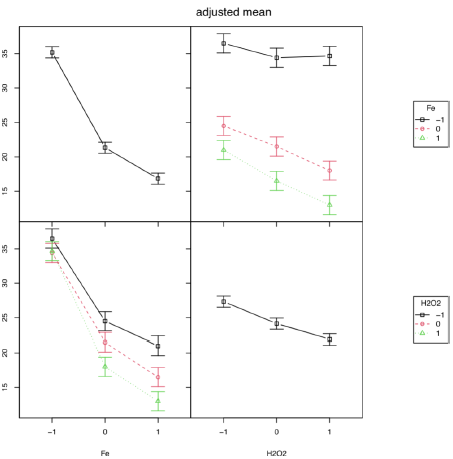
Se encontró que los factores cantidad de hierro y peróxido de hidrógeno son estadísticamente significativos, p < 0.001; sin embargo, su interacción no resultó estadísticamente significativa, al nivel de significancia del 5%. En la figura de efectos (figura 2) se observa que el hierro produce un mayor cambio en la respuesta en comparación del peróxido de hidrógeno; es decir, a mayor nivel de hierro menos tiempo para obtener la decoloración. La cantidad de peróxido no afecta prácticamente la velocidad de decoloración. En la figura b, se verificaron que no existe interacción entre catalizador y cantidad de peróxido. Las gráficas c y d comprueban que una mayor cantidad de catalizador disminuye el tiempo de decoloración y que una mayor cantidad de peróxido de hidrógeno también disminuye el tiempo de reacción, sin embargo, la diferencia entre el resultado obtenido con el nivel medio y alto de peróxido no es tan acusado como si comparamos con el nivel mínimo. Debido a los resultados se fijaron los valores de H2O2 al nivel medio y de sulfato de hierro al nivel alto.
3.2 Degradación de colorantes empleados en el teñido de paja toquilla
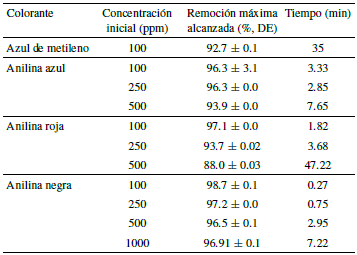
Los porcentajes de remoción de colorante alcanzados con las concentraciones optimizadas de Fe2+ y H2O2 se muestran en la tabla 3; para el azul de metileno, colorante que sirvió de base para diseñar el proceso, y para tres colorantes comúnmente usados en el teñido artesanal de paja toquilla.
Los porcentajes de remoción de color alcanzados en todos los casos fueron mayores al 90%, a excepción de la anilina roja con una concentración inicial de 500 ppm, resultados similares a los reportados por otros autores [29, 30, 35, 37] que han empleado procesos Fenton homogéneos para la remoción de colorantes similares. Paulino, Araujo y Salgado [37] señalan que su estudio alcanzó una remoción de azul de metileno del 96.2%, superior a la reportada en este estudio, lo que se debe a que la relación Fe2+/H2O2 empleada es mayor en el mencionado estudio, la mayor presencia de estos dos componentes está directamente relacionada con los porcentajes de remoción que se pueden alcanzar. Además, un segundo factor a considerar es el tiempo de reacción que en el caso de [37] fue de 60 minutos; tiempos más largos de tratamiento pueden incrementar la remoción de colorantes, en la figura 4 es posible ver el decrecimiento de la concentración de colorante respecto al tiempo. A excepción de la anilina negra que mantuvo una ligera coloración, al final del proceso no se percibía color en las muestras.
En la tabla 3 se puede observar que decrece el porcentaje de remoción a medida que se incrementa la concentración inicial de colorante; es decir, mientras mayor es la concentración inicial de colorante menor es el porcentaje de remoción alcanzado. Otros estudios han encontrado dependencia entre la concentración de salida y la remoción [40]. Esto está ligado a la cantidad de radicales disponibles para la oxidación que son dependientes de la cantidad de peróxido empleado, sin embargo, en todos los casos, se observó que la cantidad de Fe2+ y H2O2 usados permitieron un alto porcentaje de decoloración. Los tiempos de reacción se incrementaron con la concentración de colorante. Lo que se relaciona con la cinética de decoloración. De manera general, se demostró, que el proceso Fenton planteado en este estudio con las cantidades de Fe2+ y H2O2 determinadas permitió la remoción de coloración, es decir todos los colorantes estudiados son afines a la oxidación por radicales.
Los diferentes tiempos de remoción del colorante, demuestran la diferente afinidad que existe entre los colorantes y el proceso, diferencias que también se han encontrado en el estudio de [37] donde se aplicó el mismo tratamiento a azul de metileno y Rodamina, logrando mayor decoloración para el primero.
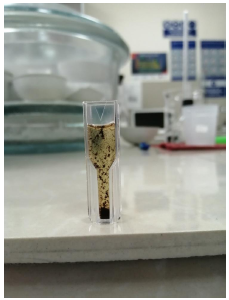
Durante la aplicación del proceso Fenton a la anilina negra se pudo observar la formación de precipitados, ver figura 3, especialmente en las concentraciones más altas de colorante, estas formaciones causaron fluctuaciones en las mediciones en el espectrofotómetro. Estos flóculos se deben a la necesidad de una mayor cantidad de peróxido. Sin embargo, estos pueden ser fácilmente removidos por filtración.
4 Cinética de decoloración con la aplicación del proceso Fenton homogéneo
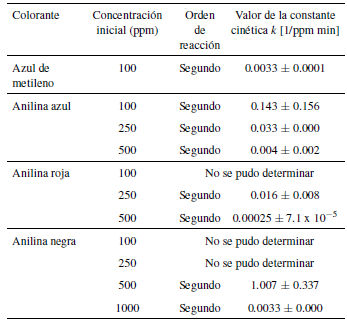
A partir de los datos de concentración remanente de colorante versus tiempo, mostrados en la figura 4, se determinó el orden de reacción y la constante cinética para la decoloración de cada una de las soluciones sintéticas de estudio, los resultados se observan en la tabla 4.
Los resultados para todos los colorantes empleados presentaron el mejor ajuste para una cinética de decoloración de segundo orden, diferente a resultados alcanzados con otros colorantes donde se ha encontrado un seudoprimer orden [35]. El orden encontrado en este estudio indica que la velocidad de reacción depende de la concentración de colorante presente en la mezcla, esto se puede observar en la figura 4, donde el descenso de concentración del máximo es muy rápido y luego toma más tiempo el bajar la concentración, presentando un perfil casi asintótico. En la mayoría de los casos el valor de coeficiente de regresión lineal fue mayor a 0.9, a excepción de la anilina negra (ver información suplementaria IS.2).

Figura 4 Curvas de decoloración para a) azul de metileno, b) anilina azul, c) anilina roja y d) anilina negra.
Si bien todos los colorantes muestran ajustarse a una cinética de segundo orden, tal y como se observa en la tabla 3 y en la tabla 4, el comportamiento de decoloración fue diferente para cada colorante. El tratamiento de la anilina negra presentó los valores más bajos de tiempo de remoción del colorante y por ello no fue posible determinar su constante de reacción a las dos concentraciones más bajas.
5 Resultados de ecotoxicidad sobre las soluciones decoloradas
Los resultados de las pruebas de inmovilidad aguda practicadas con D. M. en las aguas finales y neutralizadas. También se realizó esta prueba con las aguas contaminadas con anilinas con las concentraciones iniciales empleadas en las pruebas de remoción, en estos casos, se obtuvo un 100 % de inmovilización (muerte) de las D. M. No se presentaron D. M. inmovilizadas en ninguno de los casos después de tratamiento, pese a que en algunas aguas mantuvieron una ligera coloración esto no afectó a las Daphnias. Esto indica que a través de este proceso se pudo recuperar la calidad del agua y por tanto puede ser descargada al ambiente.
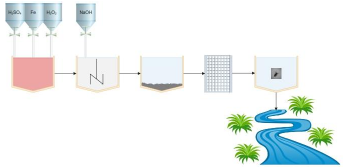
En la figura 5 se presenta una representación esquemática del proceso planteado en este estudio para la remoción de color de anilinas ampliamente usadas en el teñido de paja Toquilla. El proceso inicia con la regulación del pH, este es un parámetro variable en el proceso dependiendo de la anilina o mezcla de anilinas que se vaya a emplear, en todos los casos deberá ajustarse a 3. El hierro se adiciona como FeSO4.7H2O, de tal forma que se asegure una concentración de 800 ppm. Se adiciona H2O2 al 30 % hasta una concentración de 10 ppm. Una vez finalizado el proceso de decoloración el efluente se neutraliza con la finalidad de que el hierro precipite. La solución filtrada fue colocada en contacto con Daphnias para asegurar que el efluente no es tóxico y pudiera ser enviado a las redes de tratamiento de aguas municipales.
6 Conclusiones
El proceso de oxidación avanzada Fenton permitió la eficiente remoción de color de soluciones de colorantes tipo anilina azul, roja y negra, usando la relación optimizada entre Fe2+ y H2O2 correspondiente a un nivel máximo y medio, respectivamente. Los porcentajes de remoción alcanzaron valores superiores al 90% con diferentes tiempos de tratamiento que varían desde menos de 10 minutos para las anilinas azul y negra, hasta 47 minutos para la anilina roja. En todos los casos la cinética de decoloración fue de segundo orden. Finalmente, se encontró que, una vez neutralizadas, las aguas resultantes del proceso Fenton no presentan ecotoxicidad en la Daphnia magna.