INTRODUCCIÓN
El cultivo de camarón Penaeus vannamei en Latinoamérica, y particularmente en México, se basa en la utilización de postlarvas y juveniles producidas en condiciones de laboratorios comerciales 1. En laboratorios el rendimiento del cultivo de las larvas de los camarones peneidos está relacionado con las condiciones controladas y una adecuada alimentación, cantidad y calidad del alimento en cada etapa del desarrollo, para el éxito de los diversos cambios morfológicos que presentan desde la etapa de nauplio hasta postlarva 2,3.
Existe una gran variedad dietas balanceadas comerciales como alternativas para sustituir al alimento vivo en larvas de camarón 4; sin embargo, por sus características en su composición nutricional acorde a la especie objeto de cultivo, presentación, flotabilidad, aprensión, digestibilidad y eficiencia de asimilación, no han sido del todo satisfactorias al emplearse como sustitutos del alimento vivo 5). Además, tampoco se han obtenido resultados favorables para resolver el problema de la demanda constante del alimento vivo y por tanto los laboratorios productores de larvas continúan requiriendo de microalgas en la fase de zoea, complementada en la etapa de mysis con nauplios de artemia durante el desarrollo temprano de P. vannamei6,7.
Las diatomeas del género Thalassiosira son frecuentemente utilizadas como alimento vivo de larvas de camarón en la región del noroeste de México 8, debido a su tamaño, densidad celular, tasa de crecimiento y composición bioquímica 9.
Por otra parte, aunado a los costos y la gran demanda por los quistes de Artemia empleados rutinariamente en la larvicultura de los camarones peneidos, se podría presentar un déficit en el abastecimiento de los requerimientos de quistes por los laboratorios comerciales de producción de postlarvas, lo cual sería un problema en la alimentación de las larvas en la camaronicultura.
Por lo tanto, una alternativa confiable de alimento vivo necesaria y urgente para larvas de camarón es la utilización de copépodos 10,11 y rotíferos 12,13 a manera de sustituir a los nauplios de Artemia.
Los rotíferos son ampliamente utilizados en la alimentación de larvas de camarones y peces debido a que presentan un alto valor nutricional, pequeño tamaño y su constante movimiento natural en el agua estimula el comportamiento predador de las larvas 14,15. Asimismo, se ha sugerido que las especies de Brachionus plicatilis y Brachionus rotundiformis son presas potenciales para las etapas iniciales de las larvas de camarón, en particular al estadio de mysis de P. vannamei12,16, así como alevines de peces 14, para lo cual, se han descrito técnicas de producción en condiciones masivas 13,14. No obstante, para cualquier especie acuática cultivada de importancia comercial, existen factores fisicoquímicos de mantenimiento de interés como salinidad, temperatura, entre otros, así como también el tipo de alimento y su disposición (calidad y cantidad), mismos que pueden alterar el desarrollo y supervivencia en los organismos acuáticos 3.
Aunque es preciso proponer nuevas alternativas efectivas para reducir los costos producción de alimento vivo y que puedan sustituir el uso de nauplios de Artemia (e.g. rotíferos) 13, también es importante determinar la influencia que tienen estas dietas sobre la supervivencia, así como en el desarrollo y el crecimiento de las larvas cultivadas.
Existen algunos estudios donde se analizó reemplazar los nauplios de Artemia por el rotífero B. plicatilis en larvas de camarón blanco 2,16. No obstante, no se ha explorado el uso del rotífero B. rotundiformis (tamaño menor a 200 μm) como alimento en larvas de P. vannamei, particularmente durante las etapas de zoea, que es cuando empiezan ingerir alimento exógeno y por lo tanto requieren de alimento acorde al tamaño de su boca. Más aún, hasta el momento se desconocen estudios del suministro de este rotífero en comparación con los nauplios de Artemia (dieta tradicional) sobre el crecimiento y el desarrollo de las larvas del camarón blanco. Por lo tanto, en este trabajo se analizó el crecimiento, desarrollo y supervivencia de larvas de camarón blanco P. vannamei alimentadas con diferentes dietas vivas: microalgas, nauplios de Artemia y rotíferos.
MATERIALES Y MÉTODOS
Cultivo de microalgas, rotíferos y nauplios de Artemia. La especie de microalga utilizada en este trabajo fue Thalassiosira weissflogii mientras que, en lo que respecta a las presas vivas se utilizó al rotífero Brachionus rotundiformis y a los nauplios de Artemia franciscana.
Los cultivos de T. weissflogii se realizaron en recipientes circulares de plástico transparente con volumen útil de 16 L y una capacidad máxima de 20 L (dimensiones: radio = 13.5 cm y altura = 35 cm). El agua de mar que se utilizó fue filtrada hasta a 1 um y desinfectada con 1 mL/L de hipoclorito de sodio comercial al 5% por al menos 24 h. La microalga se cultivó en medio f de Guillard, con aireación constante (filtrado a 10 μm), iluminación de 250-260 μmol/m2/s, salinidad de 35 ups, temperatura de 22 a 25°C, pH de 7.010.0 9. La densidad de los cultivos se determinó mediante conteos directos al microscopio con la ayuda de una cámara de Neubauer de 0.1 mm de profundidad (Optik Labor).
Los rotíferos se cultivaron de acuerdo a un estudio previo 13; estos se realizaron en recipientes circulares de plástico transparentes con un volumen útil de 12 L y una capacidad máxima de 17 L (dimensiones: radio = 13.5 cm y altura = 30 cm) de agua de mar filtrada hasta 1 um, con aire filtrado a 10 um (superior a 4 mg/L), salinidad de 34-36 ups, temperatura de 28±1.5°C mantenida con calentadores termoregulados (FINNEX, HMO-50) y sin iluminación para evitar incrementos en el pH a 8.0±1.0 ocasionados por la actividad fotosintética de la microalga que se utilizó como alimento (2.50±0.29x105 células/mL). Este alimento fue suministrado en tres raciones diarias, con un volumen total aproximado de 3 L, con lo cual, se remplazaba el volumen cosechado (25%) de los contenedores de los rotíferos usados para alimentar a las larvas de camarón durante la experimentación. Bajo estas condiciones se cosecharon diariamente una biomasa de 154.35±10.46 rotíferos/mL, la cual fue estimada mediante conteos directos en estereoscopio con la ayuda de una cámara de recuento Sedgwick-Rafter de 1 mL de capacidad.
Para la obtención de los nauplios de Artemia, primeramente, los quistes fueron hidratados con agua durante 30 min y luego descapsulados usando hipoclorito de sodio. Una vez descapsulados, los quistes se transfirieron a recipientes cónicos de paredes transparentes con un volumen útil de 15 L de agua de mar (35 ups) para su eclosión. El agua de mar fue filtrada hasta 1 um, y la temperatura se mantuvo a 28°C mediante el uso de un calentador y un termorregulador (FINNEX, HMO-50). Además, se mantuvo con burbujeo intenso desde el fondo el recipiente, con la finalidad de mantener suspendidos los quistes 17. Al cabo de 18 h de incubación de los quistes; los nauplios fueron cosechados e inmediatamente se inactivaron con agua dulce a 60°C, y finalmente fueron conservados -20°C para su posterior utilización como alimento, el cual tuvo un tiempo no mayor a 72 h 3.
Obtención de organismos experimentales. Las larvas de camarón P. vannamei usadas en el presente estudio correspondieron a un mismo lote que se encontraba en la fase de nauplio IV. Estas larvas fueron donadas por el laboratorio de producción comercial "FITMAR" ubicado en el sur de Sinaloa, México (22°54'28''N y 106°05'44''W), por lo que las larvas tuvieron que ser transportadas hasta las instalaciones experimentales de la Facultad de Ciencias del Mar en Mazatlán, Sinaloa, México. El transporte tuvo una duración aproximada de 2 h, y se realizó en bolsas de plástico transparentes y llenadas con agua de mar a saturación de oxígeno y a temperatura de 28-29°C. Una vez en las instalaciones experimentales, las larvas se transfirieron a un tanque de plástico de 450 L, el cual fue llenado con agua de mar (35 ups) filtrada hasta 1 um a una temperatura de 30°C y aireación constante.
Diseño experimental. El experimento comenzó cuando el 100% de las larvas alcanzaron la etapa de nauplio V. Se evaluó el efecto de tres dietas: una tradicional (Thalassiosira weissflogii y nauplios de Artemia) y dos no tradicionales (microalgas y rotífero B. rotundiformis). Las dietas A y B consistieron en suministrar solo microalgas en la etapa de zoea, y posteriormente para mysis con una combinación de microalgas y nauplios de Artemia (dieta tradicional: A) y microalgas y rotíferos (dieta no tradicional B) de acuerdo con las cantidades señaladas en un estudio previo (3), mientras que la dieta no tradicional (C), consistió en el suministro combinado de microalgas y B. rotundiformis desde de zoea I. Cabe señalar que las dietas empleadas fueron diseñadas en base a los pesos orgánicos tanto de la microalga como de los nauplios de Artemia y de los rotíferos (Tabla 1). Los experimentos culminaron cuando los tratamientos (dietas) registraron más del 50% de los camarones en el estadio de PL1. Cada tratamiento (dieta) constó de 16 réplicas, con un total de 48 unidades experimentales (acuarios). Para esto se utilizaron recipientes circulares de plástico con paredes transparentes (dimensiones: radio = 13.5 cm y altura = 30 cm) con un volumen útil de 12 L de agua de mar y aireación constante, ambos filtrados hasta 1 um. La salinidad en los cultivos fue de 35 ups. La densidad inicial fue de 200 larvas/L. Las larvas en cada unidad experimental fueron alimentadas con tres dietas en una ración diaria. La temperatura se mantuvo a 30°C mediante un calentador y un termorregulador (FINNEX, HMO-50).
Tabla 1 Dietas usadas para la alimentación de las larvas de P. vannamei: microalgas y nauplios de Artemia a partir de mysis (A), microalgas y rotíferos (B), microalgas y rotíferos desde zoea I a mysis III (C), y valores promedio (desviación estándar) de peso orgánico PO de los organismos utilizados como alimentos en las dietas.
| Estadio | Microalgas | A | B | C |
|---|---|---|---|---|
| Células/ mL | Nauplios/ larva | Rotíferos/ larva | Rotíferos/ larva | |
| Zoea I | 10000 | 10 | ||
| Zoea II | 12000 | 30 | ||
| Zoea III | 15000 | 90 | ||
| Mysis I | 5000 | 30 | 270 | 270 |
| Mysis II | 5000 | 40 | 360 | 360 |
| Mysis III | 5000 | 50 | 450 | 450 |
| PO | ||||
| Microalga | (pg/célula) 274.26 (33.39) | (μg/organismo) | ||
| Rotífero | 0.32 (0.58) | |||
| Nauplio | 2.85 (0.68) | |||
Todos los días y antes de cada suministro de alimento de las dietas, se realizó un recambio de agua en los tratamientos del 30%, así como la eliminación de los biodepósitos (heces y alimento sobrante) en las unidades experimentales mediante el sifoneo del fondo. Posteriormente, se ajustó el volumen de los tratamientos a 12 L, haciendo la reposición con agua de mar filtrada hasta 1 um y ambientada a la misma temperatura de los cultivos.
La supervivencia (S) de las larvas en los tratamientos se evaluó cada 24 horas, mediante conteos de los organismos vivos en muestras de 500 mL. El cálculo de los organismos supervivientes mediante la mediante la ecuación: S=(Nf/Ni)x100. En donde, S indica el porcentaje de la supervivencia, Nf representa la cantidad de larvas restantes y Ni es el número inicial de organismos 15.
Adicionalmente, cada 24 horas se evaluó el índice de desarrollo (ID), con muestras de 2530 larvas de cada tratamiento que se revisaron in vivo en un estereoscopio (LEICA, ZOOM-2000) para determinar la etapa del desarrollo, posteriormente las larvas se regresaron a los tratamientos correspondientes para reducir la mortandad por muestreo. El ID se calculó con la ecuación: ID=(Σini)/N, donde i es el valor asignado a cada fase de desarrollo larval (nauplio V=0; zoea I-III : 1-3; mysis I-III : 4-6; PL1=7), ni es la cantidad de larvas de la etapa i, y N es el cantidad total de organismos analizados en la muestra 3.
Para determinar el efecto de las dietas sobre el crecimiento de los organismos, primeramente, se tomaron dos muestras de las larvas en la etapa de nauplio V: una de 15 y otra de 1000 individuos para medir la longitud total (LT) y el peso orgánico (PO) inicial, respectivamente. Asimismo, al término del experimento se tomaron muestras de 12-15 larvas de cada tratamiento para evaluar la LT final. Las mediciones de LT se realizaron de acuerdo a las recomendaciones 6,7. En relación al PO final, se seleccionaron de manera aleatoria 400 organismos de cada tratamiento y fueron concentrados en filtros de fibra de vidrio Whatman GF-C de 25 mm de diámetro. Los valores iniciales de LT y PO en los nauplios V fueron de 0.92±0.01 mm y de 4.46±0.48 μg/larva, respectivamente. Adicionalmente, se estimó el PO individual de las microalgas, los rotíferos y de los nauplios de Artemia de acuerdo a estudios previos 2,18; para esto, se concentraron por separado en filtros de fibra de vidrio Whatman GF-C de 47 mm (microalga) y de 25 mm (resto de los organismos).
Análisis estadístico. Para verificar que los datos obtenidos en relación a la supervivencia (transformados a arcoseno), el índice de desarrollo, la longitud y el peso de larvas tuvieran una distribución normal y que sus varianzas fueran homogéneas, se les practicó la prueba de normalidad (Lillieford) y de homoscedasticidad (Bartlett). Posteriormente, se aplicó un análisis de varianza de una vía (ANOVA). Cuando ANOVA mostró diferencias significativas se realizaron las pruebas de comparaciones múltiples de Tukey, para detectar dichas diferencias. En todos los casos se utilizó un nivel de significancia (α) de 0.05 19.
RESULTADOS
Se obtuvieron las tasas de supervivencia de más del 25% con las dietas ensayadas. En general, los porcentajes de supervivencia de las larvas durante todo el período experimental fueron más altos cuando fueron alimentadas con microalgas en la etapa de zoea y complementadas con rotíferos o nauplios de Artemia a partir de mysis I (Figura 1). El mayor porcentaje de supervivencia al final del experimento se obtuvo con la dieta alternativa B (30.4%), seguido de la dieta tradicional A (28.5%) y posteriormente con la dieta C no tradicional (microalgas y rotíferos a partir de zoea I). Sin embargo, estas diferencias observadas no resultaron estadísticamente significativas (p>0.05) entre las dietas evaluadas, lo cual reveló que las supervivencias de las larvas de camarón blanco al final del experimento (PL1) no dependieron del alimento con el cual fueron alimentadas (Tabla 2).
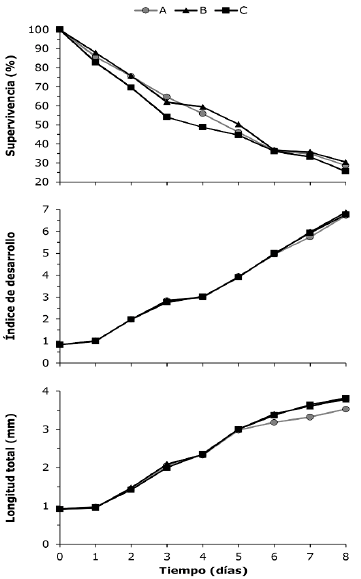
Figura 1 Supervivencia (%), índice de desarrollo (ID) y longitud total (LT en mm) promedio de las larvas de P. vannamei, alimentadas con microalgas y (A) Artemia a partir de mysis, (B) rotíferos, a partir de mysis I y (C) rotíferos a partir de zoea I. El símbolo (*) indica diferencias estadísticas.
Tabla 2 Valores finales promedio y (desviación estándar) de supervivencia, índice de desarrollo ID de larvas Penaeus vannamei alimentadas con microalgas y (A) nauplios de Artemia a partir de mysis I, (B) rotíferos, a partir de mysis I y (C) rotíferos a partir de zoea I.
| Dieta | Supervivencia (%) | ID | Etapa larval |
|---|---|---|---|
| A | 28.50 (10.78)a | 6.71 (0.12)a | PL1 |
| B | 30.36 (10.04)a | 6.86 (0.11)b | PL1 |
| C | 25.70 (11.14)a | 6.76 (0.06)ab | PL1 |
Letras distintas indican diferencias significativas (ANAVA de una vía).
Los cambios morfológicos en el desarrollo de las larvas de nauplio V hasta PL1 fueron mejores con las dietas no tradicionales B y C (compuestas por rotíferos). En el octavo día, el tratamiento con la dieta B registró el valor más alto del ID (6.86), seguido de un ID de 6.76 con la dieta C. Aunque, el valor más bajo de ID se presentó con la dieta tradicional A con nauplios de Artemia. La comparación de la progresión del ID durante los días de cultivo con las diferentes dietas tradicionales y no tradicionales se presentan en la figura 1. El aumento registrado en el ID durante los tres primeros días fue similar en todas las dietas evaluadas, sin embargo, a partir de los días cuatro y seis el incremento en el ID fue mayor con la dieta no tradicional C, seguido de la dieta tradicional A y la no tradicional B. Sin embargo, durante el periodo del día 7 hasta la terminación del experimento, el ID fue mayor en las dietas alternativas no tradicionales que en la dieta tradicional.
Los resultados de las pruebas estadísticas entre los tratamientos del ID, indicaron que en el octavo día de cultivo (PL1), se presentaron diferencias significativas entre las dietas A y B, aunque al compararlas con el tratamiento C (Tabla 2), no resultaron diferencias en el desarrollo larval (p>0.05). Con estos resultados de ID, se demuestra que B. rotundiformis como alimento a partir de mysis tiene mejores resultados que los nauplios de Artemia y además el uso anticipado en zoea presenta los mismos resultados que la dieta tradicional.
Al final del experimento, todos los tratamientos presentaron organismos en la etapa de PL1 y se encontró que el promedio obtenido del régimen tradicional (A) de alimentación para las larvas, resultó en una tasa diaria de incremento en longitud de 0.33 mm/día, lo que equivale a un total de 3.53±0.21 mm durante los ocho días de cultivo, valores que son alrededor del 7 y 8% inferior a los 0.36 mm/día que correspondieron a las dietas B y C (3.79±0.14 y 3.82±0.09 mm, respectivamente), basadas ambas en rotíferos B. rotundiformis. El incremento en talla fue similar entre las dietas, aunque a partir del quinto día, el crecimiento se diferenció siendo menor en el tratamiento A, a diferencia del B y C (Figura 1).
Los resultados de las pruebas estadísticas con los valores promedios obtenidos para el octavo día (PL1), la LT en los organismos alimentados con microalgas y nauplios de Artemia (A) resultaron con diferencias significativas en las tallas de las larvas (p<0.05) entre los tratamientos que recibieron la alimentación B y C (Tabla 3). Con estos resultados de LT, al igual que el ID, se confirmó que el uso del B. rotundiformis como alimento para las larvas de P. vannamei registró mejores resultados que los nauplios de Artemia.
Tabla 3 Valores finales promedio (y desviación estándar) de longitud total LT, peso orgánico PO, tasa de crecimiento TC y etapa larval de Penaeus vannamei alimentadas con microalgas y (A) nauplios de Artemia a partir de mysis I, (B) rotíferos, a partir de mysis I y (C) rotíferos a partir de zoea I.
| Dieta | LT | PO | TC | Etapa larval | |
|---|---|---|---|---|---|
| (mm) | (μg/organismo) | (mm/día) | (μg/día) | ||
| A | 3.53(0.21)a | 58.37(19.09)a | 0.33 | 6.74 | PL1 |
| B | 3.79(0.14)b | 60.70(19.78)a | 0.36 | 7.03 | PL1 |
| C | 3.82(0.09)b | 64.95(18.02)a | 0.36 | 7.56 | PL1 |
Letras distintas indican diferencias significativas (ANAVA de una vía).
Al igual que la supervivencia, los valores promedios de los pesos orgánicos finales de las larvas no fueron estadísticamente diferentes entre las dietas (p>0.05). No obstante, el valor más alto en peso (64.95 μg) y la mayor tasa de crecimiento (7.56 μg/día) se presentaron en los organismos cultivados con B. rotundiformis a partir de zoea I con la dieta C (Tabla 3).
DISCUSIÓN
A pesar de los posibles intentos de sustituir el alimento vivo por una dieta inerte igualmente efectiva, conveniente y confiable, en la actualidad, las microalgas y micro-invertebrados no dejan de tener un rol crucial e importante en la supervivencia y metamorfosis cuando se han utilizado como fuente de alimento en las primeras etapas larvarias de los camarones peneidos 4. Mismo que puede influir dependiendo del tipo y tamaño del alimento seleccionado de manera positiva o negativa en el campo de crecimiento de los organismos en cultivo 20. Esto coincidió con el presente estudio debido a que las larvas zoea y mysis utilizaron adecuadamente los rotíferos proporcionados en las dietas B y C. Además, el uso de rotíferos y otros organismos zoo-planctónicos en cantidades considerables, resultan beneficiosos para la producción de larvas de peces y camarones no solamente en el crecimiento sino en la supervivencia, tanto en condiciones de laboratorio como en granjas comerciales 11,14,15.
Además, al suministrar B. rotundiformis a las larvas de camarón blanco, se encontró que puede ser utilizado como alimento vivo en una fase anticipada (zoea I) a la que no habían reportado otros autores (zoea III y Mysis I) para P. vannamei, cuando utilizaron con fines de alimentación a los nauplios de Artemia y al rotífero B. plicatilis como presas de mayor tamaño comparados con las tallas de B. rotundiformis2,16.
En este estudio las dietas alternativas o no tradicionales (B y C) fueron tan eficientes como la dieta tradicional (A) en cuanto a la supervivencia, sin embargo, en el índice de desarrollo y el crecimiento de las larvas, los mejores resultados se obtuvieron con la dieta B. Esto pudo deberse a que, a pesar de que la composición orgánica de las dietas fue equivalente, la composición proximal fue distinta entre las dietas. En este sentido se ha registrado que los nauplios de Artemia presentan un 58.20% de proteínas, 19.27% de lípidos y 3.69% de carbohidratos, mientras que el rotífero B. rotundiformis presenta de 45.73-61.37% de proteínas, 21.04-24.12% de lípidos y 10.36-22.72 % de carbohidratos 21,22.
A pesar de que las supervivencias fueron bajas probablemente como una consecuencia de los recambios diarios de agua a los cuales fueron sometidas las larvas, los resultados difieren con lo reportado anteriormente por otros autores 23,24,25, donde los nauplios de Artemia se mencionan como la alternativa principal y el mejor alimento vivo para el éxito del crecimiento y la supervivencia en larvas de los peneidos. No obstante, estudios realizados sobre P. vannamei15,16, mostraron que otros micro-invertebrados como los rotíferos pueden ser mejores alternativas que la Artemia para incrementar la supervivencia y el desarrollo de las larvas de camarón. Aunque el efecto del alimento no fue diferente en la supervivencia en las tres dietas ensayadas para el presente estudio, se sabe que influye en el tiempo que tardan los peneidos en pasar a cada etapa larval y el crecimiento del camarón.
Los resultados del presente estudio muestran que, las dietas a base de rotíferos B. rotundiformis que se utilizaron para verificar la eficiencia de las dietas alternativas no tradicionales (B y C) comparadas con los nauplios de Artemia (A) presentaron los mejores resultados en el índice de desarrollo. Los hechos indican que, durante el cultivo de las fases de zoea de esta especie no se alimentan exclusivamente de fitoplancton (microalgas) como alimento vivo sino, además de otros organismos zoo-planctónicos que estén acuerdo al tamaño de su boca y al desarrollo de otras estructuras especializadas en la alimentación 26,27. Un estudio realizado con larvas de P. vannamei16, encontró que el índice de desarrollo disminuye al alimentarlas con nauplios de Artemia en comparación cuando se utilizó B. plicatilis como alimento. Lo anterior, podría ser atribuido a los diversos componentes nutricionales en las dietas, los cuales son necesarios para alcanzar dichos estadios de acuerdo a sus cambios en los hábitos alimenticios durante su desarrollo larval 2.
Algunos investigadores también han señalado que la alimentación presenta una influencia significativa sobre la longitud durante las primeras etapas de vida de P. vannamei26,28 y en la biomasa de juveniles de la misma especie 15,25. La incidencia de los alimentos y las dietas en el crecimiento de las primeras etapas de vida esta especie de camarón le confieren un rol importante en el factor alimentación, el cual no puede obviarse al momento de cultivar organismos acuáticos 27. En el presente estudio (8 días), el mayor crecimiento se encontró con las dietas alternativas a base rotíferos, puesto que la longitud y el peso fueron considerablemente menores con los nauplios de Artemia en las dietas ensayadas. Otro informe revela que es mejor el crecimiento tanto en longitud y peso de larvas (mysis I) y postlarvas (1 y 6) de P. vannamei al alimentarlas con dietas (a base de nematodos) diferentes a los nauplios de Artemia24, lo cual corrobora la influencia que tiene el factor de la alimentación y el tipo de alimento sobre el crecimiento, el desarrollo y la supervivencia de las larvas del camarón blanco, así como de otros organismos marinos.
Por todo lo anterior, es necesario continuar con los estudios sobre: la búsqueda y la utilización de nuevos organismos como fuentes de alimento, entre ellos, otras especies de rotíferos y su cantidad más apropiada para alimentar a las larvas de camarón, lo cual dé como resultados un mejor crecimiento, supervivencia y desarrollo al ser suministrado por lo menos en una etapa adelantada a zoea III, como lo sugiere un estudio donde se utilizó B. plicatilis para alimentar larvas de camarón 16. Además, en los últimos años se han desarrollado nuevas técnicas para la producción masiva de rotíferos 13,14,29, su fácil captura y digestión permiten un mejor aprovechamiento por las larvas zoeas y mysis de camarones peneidos y otras larvas de peces.
En conclusión, se determinó que las larvas de camarón alimentadas con rotíferos en las dietas no tradicionales (B y C) registraron un desempeño similar que la dieta tradicional a base de nauplios de Artemia (A) con ventajas en el desarrollo y crecimiento, lo cual sugiere la implementación de nuevas alternativas de alimentación a base de rotíferos B. rotundiformis en el cultivo para las empresas comerciales productoras de larvas de camarón P. vannamei.















