INTRODUCCIÓN
La enfermedad renal crónica (ERC) es una causa común de morbilidad y mortalidad en perros, afectando del 1 al 3% de una población 1; es una patología progresiva e irreversible; el diagnóstico en las primeras etapas de la enfermedad donde no hay signos clínicos permite mejorar la calidad y expectativa de vida del paciente, y establecer estrategias terapéuticas adecuadas 2.
El abordaje diagnóstico comienza con la identificación de los factores de riesgo de que se consideran para presentación de la ERC en la actualidad se dividen en: Factores de susceptibilidad como la edad avanzada y raza; factores de iniciación que son comorbilidades asociadas, anestesias previas y exposición a sustancias nefrotóxicas. 3,4.
Posteriormente se deben utilizar biomarcadores de función renal para evidenciar la presencia y la gravedad de la enfermedad renal, e indentificar otros factores de riesgo: como son los factores de progresión de la enfermedad que son proteinuria renal hipertensión arterial e hiperfosfatemia; y los factores de etapa final como son anemia, hipoalbuminemia, caquexia 3,4.
De forma convencional, la determinación de creatinina sérica (CrS) es considerada el estándar para evaluar la tasa de filtración glomerular (TFG). Pero la tendencia diagnóstica actual es identificar la enfermedad de forma temprana, lo que hace a este un biomarcador tardío; ya que sus valores se incrementan con una pérdida del 75% de las nefronas funcionales.
Además, la precisión diagnóstica es variable, ya que depende de la masa muscular del individuo 5. El uso de otros marcadores que detecten la ERC en estadios preazotémicos o en estadios avanzados donde la masa muscular se encuentra disminuida, es necesario 6, y en respuesta a estas demandas, el uso de biomarcadores como la concentración sérica de dimetilarginina simétrica (SDMA por sus siglas en inglés) y la relación proteinuria/creatininuria (UPC por sus siglas en inglés) en orina, han sido anexados al protocolo de la International Renal Interest Society (IRIS) 7.
El SDMA es un derivado de la metilación postraduccional de residuos de arginina contenida dentro del núcleo de las células; posterior a su proteólisis, es liberado a la circulación y eliminado por vía renal en un 90%, haciéndolo un biomarcador endógeno de la TFG 8. En perros se incrementa cuando existe una pérdida del 40% de las nefronas funcionales y sin signología renal alguna 9. Aunque el SDMA forme parte del protocolo diagnóstico de la ERC desde el año 2015, su utilidad diagnóstica aún continua en estudio 9.
Otra forma de detección temprana de la ERC es la determinación del UPC, el cual evalúa de forma cuantitativa la pérdida de proteínas a través de la orina. La proteinuria puede presentarse desde las primeras fases, permitiendo detectar la enfermedad en estadios preazotémicos cuando se encuentra como único hallazgo; además, junto a la hipertensión arterial sistémica (HAS), son considerados factores de progresión de la ERC 10.
Existen trabajos que han estudiado la correlación entre el SDMA y diferentes biomarcadores de función renal, pero no se ha realizado ninguno en una población hospitalaria amplia, tomando en consideración la relación de los diferentes biomarcadores de funcionamiento renal en la primera evaluación del paciente. El objetivo fue determinar la correlación de los biomarcadores de funcionamiento renal en la primera evaluación en perros con diferentes factores de riesgo identificados para desarrollar ERC.
MATERIALES Y MÉTODOS
Tipo de estudio. Se realizó un trabajo de tipo descriptivo, prospectivo de casos y controles, de 388 perros que asistieron a consulta en el área de medicina interna.
Localización. Los animales fueron atendidos en el Hospital Veterinario de Pequeñas Especies de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Autónoma del Estado de México (HVPE-UAEMex), con las siguientes coordenadas a 19° 17' 29N y a los 99° 39' 38 de W, durante el período de agosto de 2016 a julio de 2018.
Obtención de datos. Se obtuvieron datos de los perros que acudieron por primera vez a consulta; se consideraron los factores de riesgo para desarrollar ERC (tales como de susceptibilidad, de iniciación y/o de progresión), se empleó el protocolo diagnóstico clínico establecido por la comunidad veterinaria 7.
Se tomaron en cuenta datos de la historia clínica y examen físico. Para cada caso se consideraron los datos sexo, edad, raza y condición corporal (CC); incluyendo animales delgados (1/9-4/9) y los animales con CC ideal o sobrepeso (5/9-9/9) para todos los grupos 11. Se tomaron muestras de sangre y orina con un ayuno previo de sólidos de ocho horas. Se realizó un perfil de laboratorio (Pro Cyte and Catalyst One IDEXX, USA), con determinación sérica de CrS, urea y fósforo (P). Además, se realizó la determinación de SDMA sérico por medio de análisis de cromatografía líquida espectroscopía de masas (LC-MS); se enviaron las muestras al laboratorio de referencia con los cuidados necesarios para su correcto transporte y conservación (IDEXX Laboratories, Inc. Westbrook, Maine USA). Las muestras de orina fueron obtenidas por cistocentesis para realizar urianálisis y determinación de UpC. Para el urianálisis, se realizó la determinación de la densidad urinaria (DU) por refractometría, el examen químico utilizando tira reactiva (VetLab UA y UA strips IDEXX), y el examen microscópico para el análisis del sedimento urinario por medio de microscopio óptico. Al observar sedimento urinario inactivo, se procedió a realizar la determinación de la UPC mediante la cuantificación de proteínas en orina por el método de rojo de pirogalol y molibdato en medio ácido, y la medición de creatinina urinaria por el método de picrato en medio alcalino (BTS-350, Biosystems S.A. Barcelona, España), y posterior ecuación.
Para la presión arterial no invasiva se utilizó un monitor oscilométrico (Vet 20, SunTech Medical Inc. USA). Los animales fueron colocados en recumbencia lateral derecha, y el brazalete fue colocado el miembro torácico izquierdo, en la arteria radial. La medición se realizó conforme al protocolo establecido, tomando como referencia un valor ≥160 mmHg de presión arterial sistólica (PAS) como HAS 1.
Los animales fueron clasificados de acuerdo con los siguientes parámetros 7:
Grupo control (GC): animales con algún factor de riesgo de susceptibilidad o de iniciación para desarrollar ERC, pero sin alteraciones de la TFG (CrS<125 μmol/L y SDMA<15 μg/dL), ni proteinuria (UPC<0.5), con densidad urinaria variable, acorde al estado de hidratación.
Para el resto de los grupos se consideraron aquellos pacientes que presentaron DU por debajo del punto crítico (<1.030) y que además presentaron las características siguientes:
Grupo 1 (G1): animales no azotémicos (CrS<125 mmol/L) y SDMA 15-17 μm/dL, con o sin proteinuria (UPC<0.5).
Grupo 2 (G2): animales con azotemia leve (CrS 125-250 mmol/L) y/o con un valor de SDMA de 18-35 μg/dL, con o sin proteinuria (UPC>0.5). En caso de evidenciarse valores de CrS dentro de los intervalos comentados, con valores de SDMA > 35 μg/dL, se procedió a clasificar a estos pacientes en el G3.
Grupo 3 (G3): animales con azotemia moderada (CrS 251-440 μmol/L), y/o con un valor de SDMA de 36-54 μg/dL, con o sin proteinuria (UPC>0.5). En caso de evidenciar valores de CrS dentro de los intervalos comentados, con valores de SDMA>54 μm/dL, se clasificó a estos pacientes en el G4.
Grupo 4 (G4): animales con azotemia severa (CrS>440 μmol/L) y/o con un valor de SDMA>54 μg/dL, con o sin proteinuria (UPC>0.5).
Los casos en los cuales los valores de CrS y SDMA establecidos para cada grupo no coincidieron, se clasificaron con el valor del analito de mayor valor, representando el verdadero estado de la TFG.
Criterios de exclusión: Los casos con evidencia de deshidratación, no considerados hemodinámicamente estables; así como de azotemia y proteinuria posrenal, con un diagnóstico de lesión renal aguda (LRA), y con enfermedades crónicas previamente diagnosticada o bajo tratamiento médico fueron descartados de este estudio.
Análisis estadístico. Se realizó prueba de normalidad de Kolmogorov-Smirnov y debido a la distribución no normal fueron utilizadas pruebas no paramétricas para el análisis estadístico. Los resultados fueron reportados en medianas y percentiles, se tomaron en consideración las variables edad, CC, DU, CrS, urea, SDMA, UPC, P y PAS para todos los grupos. Se realizó Xi2 para la relación de la CC (1-4/9, 5-9/9) y el aumento de SDMA en los grupos de estudio y la prueba de Kruskal Wallis y el estudio post hoc Dunn's multiple comparisons test para identificar diferencias entre los grupos. Se efectuó el coeficiente de correlación de Spearman para las variables DU, CrS, urea, SDMA, UPC, P y PAS para el GC, y para el grupo potencialmente Enfermos Renales Crónicos (pERC), interpretando los valores (Tabla 1) de acuerdo a Mukaka 12. La significancia estadística fue considerada con un valor de p<0.05. El análisis estadístico de los datos fue realizado con el programa Graph Pad Prism, Version 8.1.1 (California, USA, 2018); el diagrama de dispersión se realizó con IBM SPSS Statistics for Windows, Version 20.0 (New York, USA, 2011).
Tabla 1 Interpretación del coeficiente de correlación de acuerdo a Mukaka, 2012 (12).
| Valor de la correlación | Interpretación |
|---|---|
| 0.90 a 1.00 (-0.90 a -1.00) | Correlación muy alta |
| 0.70 a 0.90 (-0.70 a -0.90) | Correlación alta |
| 0.50 a 0.70 (-0.50 a -0.70) | Correlación moderada |
| 0.30 a 0.50 (-0.30 a -0.50) | Correlación baja |
| 0.00 a 0.30 (0.00 a -0.30) | Correlación muy baja |
Correlación positiva (Correlación negativa).
RESULTADOS
Distribución de la población. Un total de 545 casos fueron analizados, de los cuales 388 cumplieron con los criterios de inclusión; de estos el 51.8% (n=201) fueron hembras. La mediana de edad fue de 9 años, con un intervalo de 1-18 años. Se identificaron 49 razas diferentes, con mayor frecuencia en las razas Poodle (16.5%), Schnauzer miniatura (13.6%), Chihuahuahueño (6.9%), Cocker spaniel (5.6%) y Golden retriever (4.1%); los mestizos representaron el 13.9% de los casos. No observando riesgo significativo para presentar ERC en alguna raza en particular.
Distribución de los grupos. 388 casos clínicos estudiados, se distribuyeron en los diferentes grupos:
El GC fue compuesto por 226 animales, correspondiendo al 58.2% del total de casos. De estos, el 57.1% (129/226) fueron hembras; con una mediana de ocho años de edad. De los cuales 45 animales con CC 1/9-4/9, y 181 con CC 5/9-9/9.
El G1 fue formado por 86 animales, siendo el 22.1% del total de casos. El 51.2% fueron hembras (44/86), con una mediana de diez años de edad. Veintiséis animales con CC 1/94/9, y 60 con CC 5/9-9/9. El 25.6% (22/86) presentó alteración de la TFG identificada por valores de SDMA entre 15-17 μm/dL, el 59.3% (51/86) presentó proteinuria, y el 15.1% (13/86) presentó alteraciones en ambos biomarcadores de forma simultánea. El 9.3% (8/86) presentaron HAS.
En G2 se incluyeron 48 perros, siendo el 12.5% del total de casos. De estos, 29.2% fueron hembras (14/48), con una mediana de diez años de edad. Veintisiete animales con CC 1/9-4/9, y 21 con CC 5/9-9/9. En el 33.3% (16/48) el SDMA y CrS coincidieron según los criterios establecidos; el 16.7% (8/48) evidenció azotemia con un valor de SDMA<18 μg/dL; y el 50.0% (24/48) presentó valores de SDMA entre 18-36 μg/dL sin azotemia. El 56.3% (27/48) fueron proteinúricos, y 10.4% (5/48) con HAS.
En el G3 se incluyeron 15 casos, correspondiendo al 3.9% del total de la población. De estos, el 46.6% fueron hembras (7/15), con una mediana de 11 años de edad. Diez animales con CC 1/9-4/9, y 5 con CC 5/9-9/9. El 20.0% (3/15) presentó valores de SDMA entre 36-54 μg/dL y de CrS entre 251-440 μmol/L, coincidentes conforme lo establecido para este grupo. Por otro lado, el 20% (3/15) presentó valores de SDMA por debajo del rango establecido. El 60.0% restante (9/15) presentó valores de SDMA<36 μg/dL y una CrS entre 125-250 μmol/L. Se observó proteinuria en el 66.6% (10/15) de los animales, y la frecuencia de HAS fue de 13.3% (2/15).
El G4 fue conformado por 13 casos, correspondiente al 3.3% de los casos estudiados. De estos, el 53.8% fueron hembras (7/13), y tuvieron una mediana de edad de 9 años. Nueve animales con CC 1/9-4/9, y cuatro con CC 5/99/9. En el 61.5% (8/13) de los casos se observó la correlación entre los valores de SDMA (>54 μm/dL) y CrS (>440 mmol/L), el 15.4% (2/13) presentó valores de SDMA por debajo del rango sugerido, pero su CrS correspondía a este grupo. El 23.1% (3/13) tuvo una concentración de SDMA >54 μg/dL y CrS ≤440 mmol/L. El 77.0% (10/13) de los animales de los animales fueron proteinúricos. La HAS se observó en el 23.0% (3/13) de estos pacientes.
Se realizó Odds ratio en los grupos de estudio con respecto a la CC y la probabilidad de presentar incremento de SDMA. Se observó que los animales del grupo 2 tienen 3.55 veces mayor probabilidad (OR=3.55, p=0.005) de presentar incremento de SDMA cuando se tiene una CC por debajo de 5/9 (Tabla 2).
Diferencias entre variables por grupo. Las medianas de las variables edad, CC, DU, CrS, urea, SDMA, UPC y P fueron estadísticamente diferentes entre los grupos de estudio (Tabla 3). Para la variable edad como un factor de riesgo de susceptibilidad, se observó diferencia estadística significativa entre el GC con una mediana de ocho años, y el G2 con una mediana de diez años (p=0.002). En el caso de la CC se observaron diferencias significativas entre el GC y los grupos G2, G3 y G4; así como entre los grupos G1 y G3.
Tabla 2 ORs calculados para los grupos de estudio con respecto al incremento de SDMA y la CC.
| Grupo CC 1-4/9 CC 5-9/9 | OR | IC 95% | Valor p | ||
|---|---|---|---|---|---|
| G1 | 15 | 20 | 0.89 | 0.419-1.898 | 0.767 |
| G2 | 17 | 7 | 3.55 | 1.384-9.136 | 0.005 |
| G3 | 6 | 3 | 2.56 | 0.619-10.645 | 0.180 |
| G4 | 3 | 1 | 3.77 | 0.384-37.052 | 0.223 |
Tabla 3 Distribución de medianas y percentiles para las variables edad, peso y biomarcadores en los grupos de estudio.
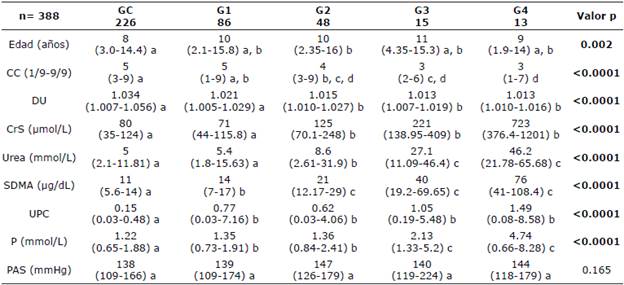
CC, condición corporal; DU, densidad urinaria; CrS, creatinina sérica; SDMA, dimetilarginina simétrica; UPC, relación proteinuria/ creatininuria; P, fosforo; PAS, presión arterial sistólica. Mediana y percentiles entre paréntesis (0.025-0.975). Literales distintas indican diferencias estadísticas significativas p<0.05; Análisis realizado con Kruskal-Wallis.
Para la variable DU se observó diferencia estadística significativa entre el GC y los G2, G3 y G4. Las variables CrS, urea y SDMA mostraron un incremento gradual de las medianas conforme la clasificación de los grupos. La CrS de los el GC y G1 fueron significativamente diferentes a los G2, G3 y G4. En el caso de urea, el GC fue estadísticamente diferente a los G2, G3 y G4, y el G2 fue diferente a los demás. Para la variable SDMA existieron diferencias entre el GC y los pERC, además el G1 fue diferente a G2, G3 y G4. En el caso de UPC se observaron diferencias significativas entre el GC y los pERC. Para la variable P, se observó una mediana mayor en los grupos G3 y G4 con respecto a G2, G1 y GC. Para la variable PAS no existieron diferencias estadísticas entre los grupos.
Correlaciones. Las correlaciones se realizaron de acuerdo con Mukaka (Tabla 1). En el GC, los resultados de las correlaciones estadísticamente significativas fueron determinadas como muy bajas (Tabla 4).
Las correlaciones de los pERC (G1, G2, G3 y G4) se analizaron en conjunto (Tabla 5), donde se muestras las correlaciones de las variables, se observan valores de correlación moderada entre las variables CrS, urea y SDMA.
Se puede observar también correlaciones bajas para las variables DU en relación a SDMA y el P en relación a CrS, urea y SDMA (Tabla 5).
Tabla 4 Correlaciones de las variables DU, CrS, urea, SDMA, UPC, P y PAS en el GC.
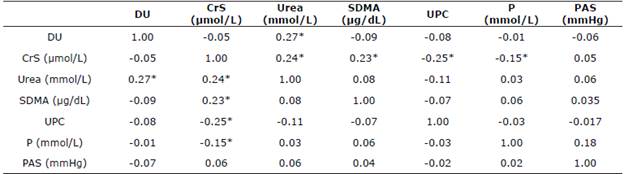
DU, densidad urinaria; CrS, creatinina sérica; SDMA, dimetilarginina simétrica; UPC, relación proteinuria/creatininuria; P, fosforo; PAS, presión arterial sistólica.
*La correlación tiene una significancia estadística p<0.05.
Tabla 5 Correlaciones de las variables DU, CrS, urea, SDMA, UPC, P y PAS para los pERC.
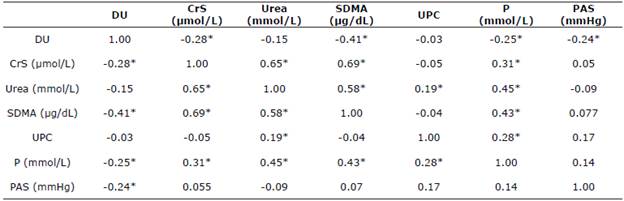
DU, densidad urinaria; CrS, creatinina sérica; SDMA, dimetilarginina simétrica; UPC, relación proteinuria/creatininuria; P, fosforo; PAS, presión arterial sistólica. *La correlación tiene una significancia estadística p<0.05.
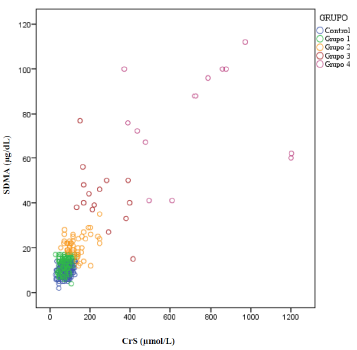
La relación entre las variables CrS y SDMA en los grupos de estudio se muestra en el diagrama de dispersión (Figura 1). Se observó incremento de ambos biomarcadores con relación a la gravedad de la enfermedad (GC: r=0.23, p<0.001, pERC: r=0.69, p<0.001).
DISCUSIÓN
El reconocimiento de factores de riesgo de susceptibilidad y de inicio de enfermedad son la clave en el abordaje diagnóstico temprano de la ERC. En este estudio, no se encontraron diferencias significativas respecto al sexo, al igual a lo descrito en otros trabajos, donde no se ha demostrado que el sexo represente un factor de riesgo para desarrollar ERC 13,14. Con respecto a la edad, el 88.2% de los animales de los grupos pERC presentó más de seis años, observando una mediana de edad de nueve años, similar a la reportada en otras poblaciones 15. Estos hallazgos se atribuyen a que la función renal se ve afectada con la edad, asociándose a enfermedades crónico-degenerativas que se relacionan con ERC 13,16.
Los casos estudiados fueron de diferentes razas y su frecuencia de aparición difirió con lo reportado por otros autores. O'Neill et al 13 observaron una mayor frecuencia en animales de la raza Yorkshire terrier, Jack Rusell terrier y West Highland White terrier. Pelander y et al 14 observaron mayor frecuencia de las razas Bernes de la montaña, Schnauzer miniatura y Bóxer. Estas diferencias en la frecuencia de las razas con ERC están atribuidas a la preferencia de los propietarios dependiendo de la zona geográfica donde se realice el estudio. En México, los animales de las razas Poodle, Schnauzer, Chihuahua, Cocker spaniel, y Golden retriever son de las más populares, y esto se refleja en este estudio, se ha documento que algunas de estas razas pueden presentar predispoción racial a enfermedades renales, futuros estudios serían necesarios en esta población 7,13.
Del total de casos pERC analizados, el 22.1% fue clasificado en el G1, considerada la etapa preazotémica de la ERC por los rangos de biomarcadores de TFG empleados 7, siendo evidenciada en un cuarto de estos casos una disminución de la TFG por un leve aumento del SDMA. Diferentes autores han reportado que el SDMA puede ser utilizado como un biomarcador temprano de ERC debido a que su concentración sérica se incrementa tiempo antes que la CrS, cuando hay una reducción aproximada del 40% de las nefronas funcionales 17,18. Además, casi dos tercios de los casos incluidos en este grupo presentó proteinuria como único hallazgo, haciendo el uso del UPC fundamental en el proceso diagnóstico, lo que permite identificar la enfermedad en etapas tempranas no azotémicas 10. La proteinuria ha sido considerada como un biomarcador de enfermedad renal y factor de progresión de gran valor. En muchos casos se presentan aumentos antes de observar incrementos de SDMA o de la CrS 10. Por otro lado, únicamente en el 15.1% de los casos del G1 se evidenció incremento en el SDMA y proteinuria de forma simultánea, sugiriendo un grado más avanzado de enfermedad en estos casos por presentar alteración de la TFG 19, pero sin llegar a la fase azotémica.
Empleando los rangos propuestos por IRIS en 2019 7; se observó la relación entre los rangos de CrS y SDMA para cada grupo en la mitad de los casos estudiados. En el 23.0% (12/52) de los animales azotémicos se evidenció CC menor de 5/9, lo que limitó la utilización de la concentración de CrS como criterio de clasificación y obligando a emplear los valores de SDMA para tal fin. En estos casos, al no poseer una buena condición muscular, y dado que el 95% de la creatinina corporal se encuentra en el músculo esquelético 5, el hallazgo de valores de CrS menores no suele ser representativo de la función renal, tendiendo a su sobreestimación 17. En este trabajo, se observó en los animales de G2, G3 y G4 una frecuencia mayor de CC de 1/9-4/9, semejante a lo observado por Rudinsky et al 15, donde evidenciaron una menor CC en pacientes en estadios avanzados, asociado a la presencia de caquexia y sarcopenia. Esto es generado por mecanismos fisiopatológicos multifactoriales que incluyen un incremento en los requerimientos energéticos, disminución de la absorción de los nutrientes, disminución de la ingesta energética y alteraciones en el metabolismo del paciente 20 . Además, la pérdida de peso en pacientes con ERC se ha relacionado con la disminución de sobrevida de los pacientes en estadios avanzados 21 . En estos casos, el SDMA debe ser usado como biomarcador de TFG, ya que se no es afectado por la masa muscular 17,22.
Por otro lado, en el 19.2% (10/52) de los casos, el SDMA se encontró dentro del rango de referencia (<18 μm/dL) en presencia de azotemia (CrS>125 Mmol/L), atribuyendo este hallazgo a interferencias analíticas o a falta de equilibrio hemodinámico 23, a pesar de que en este trabajo se consideró, que éstos casos se encontraban hemodinámicamente estables al momento de la toma de muestras; con base en la información obtenida en la consulta de cada uno de los pacientes. Esto reafirma lo indispensable de realizar la reevaluación de los pacientes para confirmar el diagnóstico de la ERC 7. Además, se ha reportado que la sola determinación del SDMA no permite diferenciar adecuadamente entre ERC y LRA 23, resultando imprescindible la evaluación detallada de la historia clínica, hallazgos clínicos y de laboratorio, así como seguimiento del paciente en el tiempo, para poder realizar la diferenciación entre estos procesos, y alcanzar el diagnóstico y estadificación de la ERC 24.
En referencia al comportamiento de las variables CrS, urea, SDMA y P, en los grupos de estudio, se evidenció incremento en sus valores relacionado a la probable severidad de la enfermedad.
Con respecto a la PAS, se ha demostrado en diversos estudios que la ERC es una de las principales patologías asociada con el hallazgo de HAS 1,13; en este trabajo no existieron diferencias estadísticas entre los grupos. Por otro lado, en los grupos pERC la HAS fue más frecuente en los grupos correspondientes a estadios avanzados de la enfermedad, siendo el resultado de diferentes alteraciones fisiopatológicas y de la interacción entre ellas, como son la retención de sodio, activación del sistema renina angiotensina aldosterona, aumento la actividad simpática, con el consiguiente aumente del gasto cardiaco y de la resistencia vascular periférica 25. En pacientes azotémicos la magnitud de la HAS se ha relacionado con la presencia de proteinuria renal, lo cual es más frecuente en estadios avanzados 1.
Con respecto a las correlaciones en los biomarcadores, la asociación de SDMA y CrS se observó una correlación muy baja en el GC, de manera similar, se han observado correlaciones semejantes en pacientes sanos; Hall et al 22 observaron una correlación una correlación de r=0.32 (p=0.04) en una población.
Con referencia a la correlación de los pERC, en medicina humana, se analizaron datos de 2100 pacientes, observando una correlación alta entre el SDMA y la CrS de r = 0.75 (p<0.001) 8. En medicina veterinaria, observaron en un estudio retrospectivo, en una colonia de perros Beagle bajo condiciones controladas, una correlación alta de r = 0.84 (p<0.001) 18. En otro estudio reportaron una correlación de r=0.74 (p<0.0001) en perros con ERC 23. En 2019, McKenna et al 7 evaluaron la correlación entre iohexol, SDMA y CrS en 119 perros no azotémicos observando una correlación baja r=0.33 (p<0.0001). Estos valores de correlación, se deben a que el SDMA tiene más del 90% de excreción renal, característica esencial que le permite ser considerarlo un biomarcador de función renal lo que se relaciona con la excreción de CrS. Al alterarse la TFG hay un incremento sérico de ambos biomarcadores. En este estudio, el valor de la correlación en pERC pudo deberse a la distribución no homogénea de los pacientes por la forma del abordaje de la enfermedad por factores de riesgo observando una menor frecuencia de animales azotémicos.
La correlación observada entre las variables urea y SDMA fue considerada moderada, la asociación existente entre las variaciones séricas de la urea por el metabolismo hepático, dieta, entre otros, la hacen un biomarcador renal inestable 6.
Se observó que las correlaciones de DU con los demás marcadores fueron negativas, debido a que al disminuir el punto crítico de la DU y llegar a la isostenuria, en pacientes con afectación de la masa funcional renal, los marcadores de TFG tienden a incrementarse. Esto es asociado a la incapacidad para concentrar la orina y eliminar sustancias de desecho 26.
Con respecto a los demás biomarcadores evaluados (UPC, P, PAS), las correlaciones observadas fueron consideradas bajas o muy bajas, debido a que estos son marcadores de progresión de la enfermedad, pero no son considerados marcadores de la TFG. Puntualmente para el P, se observó una correlación baja con la CrS, urea y SDMA; ya que al disminuir la TFG se reduce la excreción de P a nivel renal causando hiperfosfatemia, común en estadios avanzados de la enfermedad 2.
Basado en lo anterior, la justificación de anexar el SDMA al protocolo diagnóstico de ERC estriba en dos premisas, la primera es que favorece llegar al diagnóstico de la enfermedad en etapas preazotémicas (>40% de disminución de la TFG), y la segunda es que permite corroborar el diagnóstico de ERC en pacientes con pérdida de la masa muscular; en donde la CrS puede no determinar de forma adecuada la función renal, especialmente en animales caquéxicos. Es importante recalcar que en ninguna circunstancia el SDMA debe ser utilizado como único biomarcador en la evaluación de la función renal en perros 24.
En conclusión, en este estudio, se demostró la utilidad de la aplicación clínica del abordaje diagnóstico con base en factores de riesgo para identificar la ERC en estadios tempranos. La primera evaluación realizada de forma integral, considerando la evaluación de biomarcadores de función renal tempranos, permite tanto determinar si los animales requieren una reevaluación de la función renal futura próxima, como proporcionar información relevante de la función renal del paciente.
La correlación de los biomarcadores SDMA y CrS fue significativa en los grupos de pERC, menor a lo reportado a otros estudios, debido a que se analizó la enfermedad renal natural.
Cabe mencionar que la UPC fue útil como marcador de la enfermedad renal, por lo que debe ser incluido en el abordaje diagnóstico del paciente con factores de riesgo. En nuestra experiencia, el empleo del protocolo completo permite conocer desde una perspectiva integral el estado de función renal en el primer abordaje diagnóstico de la ERC.
Los animales pERC presentaron mayor edad que los controles, incrementándose la probabilidad de desarrollar ERC debido a la disminución de las nefronas funcionales secundario a la edad avanzada. Además, se evidenció disminución de la CC en los grupos de correspondientes a estadios avanzados de ERC.