INTRODUCCIÓN
El chame Dormitator latifrons (Richardson, 1844) es una especie de agua dulce, nativa del Pacífico centro oriental que tiene un alto potencial productivo 1. En Ecuador, D. latifrons se cultiva a pequeña escala con producciones que oscilan entre 800 a 1000 Ton 2, sin embargo, el cultivo de la especie se ha visto limitado por la obtención de alevinos 1,3. Los acuicultores capturan juveniles del ambiente natural para engorde 3, situación que puede ocasionar varios problemas como entrada de patógenos 4,5 que podrían tener un impacto a la salud pública 6 u ocasionar pérdidas económicas en la producción 7. A pesar de la importancia acuícola de D. latifrons en Ecuador, no existe información de las especies de patógenos que afectan los sistemas de cultivo, sin embargo, en México se han registrado 13 parásitos metazoarios infestando organismos de D. latifrons colectados en ambientes naturales y un crustáceo parásito en sistema de cultivo experimental 1,5.
Recientemente, en una granja acuícola de Ecuador se observó la infestación de cestodos en el hígado y posterior mortalidad de D. latifrons mantenidos en cultivos semi-intensivos (Empresario com. pers.). Esta infestación, según el productor, ocasionó limitaciones para el ingreso de D. latifrons vivos en el mercado internacional debido a restricciones sanitarias en frontera. Parvitaenia cochlearii es la única especie de cestodo que se ha reportado infestando a D. latifrons, y otras especies de peces como Atherinella crystallina (Jordan & Culver, 1895), Gobiomorus maculatus (Günther, 1859), Agonostomus monticola (Bancroft, 1834), Poeciliopsis gracilis (Heckel, 1848), Chirostoma jordani Woolman, 1894 y Eleotris picta Kner, 1863; registrados en organismos colectados en ambientes naturales de México 5,8,9,10,11,12,13. Parvitaenia cochlearii pertenece a la familia Gryporhynchidae, parásitos de amplia distribución que infestan a varias especies de peces de agua dulce de África, Asia, Europa y América del norte. En América del sur se han registrado varios géneros (Glossocercus, Parvitaenia y Valipora) de esta familia infestando a peces colectados de ambientes naturales de Brasil 14,15,16,17; sin embargo, no existen reportes de infestaciones en sistemas piscícolas de la región.
Especies de la familia Gryporhynchidae de los géneros Valipora y Cyclustera detectadas en sistemas de cultivo de carpa Cyprinus carpio (Linnaeus, 1758) en Mozambique provocan un retraso en el crecimiento y peso de los organismos infestados, así como cambios patológicos en la vesícula biliar, mucosa intestinal e hígado 18,19. De igual manera, la presencia de cestodos puede provocar problemas en la comercialización. La detección de estos parásitos tiene un efecto negativo en la estética del pescado dando un aspecto desagradable y la prohibición de su uso comercial por parte de los inspectores sanitarios lo que provoca un rechazo del producto en el mercado 20,21. Debido a todos estos efectos negativos es importante realizar monitoreos constantes en sistema de cultivo, identificar el agente patógeno y evaluar el estado de salud de los organismos cultivados. Por lo tanto, el objetivo del presente estudio fue identificar y determinar los parámetros de infección del cestodo en las diferentes fases de cultivo de D. latifrons, así como evaluar los daños histológicos ocasionados por dicho parásito.
MATERIALES Y MÉTODOS
Colecta del material. Se colectaron 45 ejemplares de D. latifrons en diferentes fases de cultivo, 15 organismos de pre-cría, 15 de pre-engorda y 15 de engorda mediante monitoreo simultáneo en una granja acuícola ubicada en la provincia del Guayas durante febrero de 2021. El agua recogida para los sistemas fue una mezcla de agua de río y pozo, siendo la salinidad inicial de 7 ups. Una vez en las piscinas, la temperatura se mantuvo entre 25-28°C, oxígeno disuelto de 3 - 5 mg/L, pH entre 7 - 8 y salinidad de 3 - 4 ups. El recambio de agua se realiza dos veces por semana para cada piscina. Los peces fueron cultivados en piscinas de tierra con densidad de siembra de 12 - 20 peces/m2 en pre-cría (piscinas de 2000 m2), mientras que en pre-engorda la densidad fue de 3 - 5 peces/m2, y en fase de engorda de 0.5 - 1 peces/m2 (piscinas de 1 hectárea). Los organismos capturados fueron revisados in situ; se le tomó el peso en gramos (g), la longitud total (LT) en centímetros (cm) y el peso del hígado en gramos (g). Se calculó el índice de condición de Fulton (K) K=100 (W/L3) donde; W es el peso corporal húmedo y L es la longitud total 22, este índice es considerado un indicador del estado nutricional o salud de los organismos, se espera que a mayor intensidad de parásitos el índice sea menor. Además, se calculó el índice hepatosomático IHS= (PH/PSV) x 100, donde PH es el peso del hígado y PSV es el peso del pez eviscerado. Un IHS mayor en un organismo implica mayor almacenamiento de reservas energéticas en el hígado y por tanto una condición mejor. Los peces fueron sacrificados mediante punción cerebral siguiendo las directrices para la eutanasia en animales de la Asociación Americana de Medicina Veterinaria 23. A todos los peces se les revisó la vesícula biliar, pared intestinal, riñón e hígado en búsqueda de cestodos, según lo reportado por varios autores 5,13,24. Se fijaron fragmentos de los órganos para análisis histológico y el resto fue revisado bajo un estereoscopio. Todos los cestodos observados fueron contados y preservados en tubos eppendorf con alcohol al 70% hasta su identificación. Los parámetros de infección prevalencia e intensidad fueron calculados de acuerdo con la definición dada por Bush et al 25, mientras que la intensidad mediana, al no verse afectada por los pocos hospederos altamente infestados, se calculó según Reiczigel et al 26.
Identificación taxonómica. Los metacestodos fueron aplanados bajo ligera presión, expuestos en agua caliente a 70°C y fijados en formalina. Posteriormente, fueron teñidos con carmín de Mayer, deshidratados en una serie ascendente de etanol y montados en bálsamo de Canadá. Para la visualización de los ganchos rostelares, los escólex de algunos especímenes fueron aplanados y montados en una solución de lactofenol. Las determinaciones morfométricas se realizaron con imágenes obtenidas en la cámara digital AmScope® de 18 MP acoplada al microscopio óptico Olympus CX41 mediante el software ImageJ. La identificación del metacestodo se basó en descripciones morfológicas de diferentes autores 8,27,28. Todas las medidas están dadas en micras.
Análisis histológicos. Para evaluar los daños tisulares ocasionados por el metacestodo, se fijaron fragmentos de hígado en formalina neutra al 10% por 48-72 h. Los tejidos con presencia de cestodos (puntos blancos) se procesaron con técnicas histológicas de inclusión en parafina, se tiñeron con hematoxilina y eosina (H-E) y las laminillas fueron montadas con resina Entellan® (29. La observación de las laminillas se realizó en un microscopio óptico de marca Olympus® BX53. Las imágenes fueron tomadas con una cámara de marca AmScope® de 18 MP.
Análisis estadísticos. Para determinar posibles diferencias de la intensidad mediana del metacestodo en los hospederos evaluados en las etapas de cultivo, se realizó la prueba de la mediana de Mood, según Reiczigel et al. 26, usando el paquete Coin en el programa R 30. Los valores de intervalos de confianza del 95% para los parámetros de infección se determinaron en QPweb. Para determinar posibles correlaciones entre la intensidad de infestación por el metacestodo y la talla o el peso de los hospederos; y entre la intensidad de infestación del metacestodo y el índice de Fulton y hepatosomático, se realizaron análisis de correlación lineal de Pearson o Spearman según la normalidad de las variables.
Aspectos éticos. Los procedimientos de bioética animal de este estudio contaron con el permiso del Comité de Bioética Institucional de la Universidad Técnica de Manabí, establecido en el tomo 021-12 folio: 21-12-02.
RESULTADOS
Los promedios con la desviación estándar de la longitud total, peso, índice de Fulton e índice hepatosomático de los peces según la fase de cultivo se describen en la Tabla 1.
Tabla 1 Variables biológicas registradas en las diferentes fases del cultivo de Dormitator latifrons. Para cada fase de cultivo se muestra la longitud total.
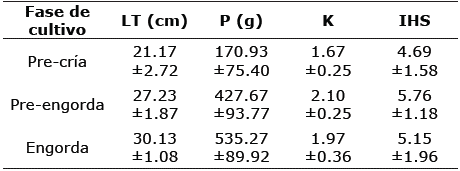
(LT) promedio ± desviación estándar (D.E.), el peso (P) promedio ± D.E., el índice de Fulton (K) ± D.E. y el índice hepatosomático (IHS) ± D.E.
Descripción del parásito. (Basada en 7 individuos). Los metacestodos se encontraron en el hígado y presentaron un color blanco cremoso (Figura 1A). La especie fue identificada como Parvitaenia cochlearii Coil, 1955 (Figura 1B). Las características distintivas fueron; cuerpo con escólex esférico que incluye rostelo y ventosas (Figura 1C); cuello y parte posterior ovalada (Figura 2A). La región posterior al cuello frágil, por lo que, en la mayoría de los organismos, los escólex se desprendieron. Rostelo compuesto por tres tipos de ganchos. El cuerpo es alargado (727 - 759 x 273 - 288 μm), dividido en escólex esférico (234 x 169 μm) y parte posterior ovalada (486 x 281 pm); ventosas (71 x 64 μm). Ganchos distales grandes (49 - 56 pm) (Figura 2B) y ganchos proximales más cortos (31 - 37 pm) (Figuras 1D, 2C). Todos los ganchos son rectos, con excepción del extremo distal de la hoja que es claramente curvado.
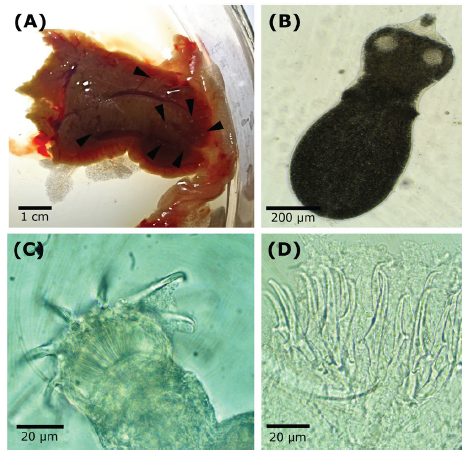
Figura 1 Metacestodos Parvitaenia cochlearii. A: Metacestodos (puntas de flecha) en fragmento posterior del hígado de D. latifrons; B: Ejemplar entero fresco (10x); C: Escólex (100x); D: Ganchos rostelares (100x).
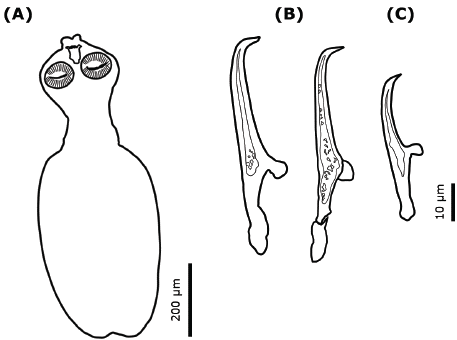
Figura 2 Parvitaenia cochlearii. A: Ejemplar entero (10x); B: Ganchos distales; C: Gancho proximal (100x).
Observaciones. Parvitaenia cochlearii se distingue por la presencia de tres ganchos rostelares de diferente forma y tamaño. Las medidas de las estructuras morfológicas en los especímenes del presente estudio coinciden con las reportadas para la especie, tales como cuerpo alargado 727 - 759 x 274 - 288 (670 - 800 x 336 - 344), escólex 234 x 169 (224 - 237 x 198 - 224), rostelo 54-57 x 57-58 (58 - 59 x 53 - 67), ventosas 71-72 x 63-65 (71 - 85 x 53 - 63) 8, ganchos distales 49 - 56 (55; 49 - 56; 49 - 55) y ganchos proximales 31 - 37 (33 - 35; 32 - 37; 32 - 36) 8,31,32.
Parámetros de infección. La prevalencia de P. cochlearii fue de 100 % en todas las fases de cultivo, mientras que la intensidad mediana varió entre fases de cultivo: en pre-ría 22 (7 - 33); en pre-engorda 189 (162 - 218) y en engorda 625 (824 - 1721) (X2= 29.391; p<0.0001). Los valores más altos se observaron en la fase de engorda.
El análisis de regresión lineal mostró una correlación positiva entre la longitud total de los peces y la intensidad de cestodos (r2= 0.45; p<0.05), al igual que el peso de los peces y la intensidad de cestodos (r2= 0.38; p<0.05), mientras que la intensidad de cestodos y el índice de Fulton no mostró correlación (r2= 0.01; p>0.05), al igual que la intensidad y el índice hepatosomático (r2= 0.01; p>0.05).
Evaluación histológica. El análisis histológico de hígados parasitados mostró la presencia de metacestodos entre los hepatocitos (Figura 3A-D). En hígados con pocos parásitos, los daños son focales. Los parásitos se encuentran aislados del tejido hepático por una delgada capa de fibroblastos, y se observa congestión de vasos sanguíneos y esteatosis hepática alrededor de los quistes (Figura 3B-C). En hígados con abundantes metacestodos se observa una reducción del parénquima hepático por la presencia de muchos parásitos y el incremento en número y tamaño de centros melanomacrófagos (Figura 3D).
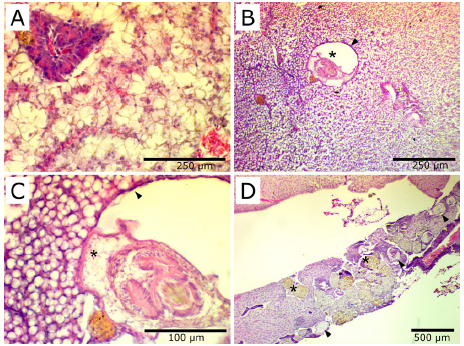
Figura 3 Secciones histológicas de hígados de Dormitator latifrons infestados por metacestodos de Parvitaenia cochlearii. (A) Corte histológico de hígado sin alteraciones. (B) Parvitaenia cochlearii (*) enquistada en hígado, rodeada por una fina capa de fibroblastos (cabeza de flechas). (C) Detalle de la imagen B mostrando el metacestodo (*) rodeado por fibroblastos (cabeza de flecha). Note la esteatosis hepática alrededor del parásito. (D) Hígado con abundantes metacestodos (cabeza de flecha) rodeados de centros melanomacrófagos (*). Tinción H&E.
DISCUSIÓN
En este estudio se reporta el cestodo P. cochlearii infestando a D. latifrons en diferentes fases de cultivo. Parvitaenia cochlearii corresponde a un estadio larval (metacestodo), por lo que D. latifrons es un hospedero intermediario en el ciclo de vida del parásito. Varios autores han registrado a P. cochlearii infestando a D. latifrons colectados en ambientes naturales de México 5,8,13,27; sin embargo, este estudio constituye el primer registro de P. cochlearii en América del sur, y el primero también en sistemas de cultivo.
Parvitaenia cochlearii en este estudio mostró la siguiente combinación de caracteres: cuerpo divido en escólex esférico y parte posterior ovalada; escólex compuesto de 4 ventosas y un rostelo con 20 ganchos de tres formas, dispuestos en dos hileras concéntricas. Estos caracteres y las medidas del cuerpo, escólex, ventosas y ganchos distales (gd) y ganchos proximales (gp) coinciden con lo reportado por varios autores 8,27,31,32. El género Parvitaenia comprende más de 15 especies descritas, de las cuales solo se conocen las fases larvarias de tres, P. cochlearii Coil, 1955, P. macropeos (Wedl, 1855) y P. samfyia Mettrick, 1967 8,33. Sin embargo, P. cochlearii (gd: 4956; gp: 31-37) se diferencia de P. macropeos por el mayor tamaño de los ganchos rostelares (gd: 43-46; gp: 26-30). Parvitaenia samfyia se diferencia de P. cochlearii por tener ganchos distales más pequeños (gp: 27-30).
Nuestros resultados mostraron la presencia del cestodo infestando todos los peces revisados, con intensidad mediana superior a 22 individuos, incrementando de pre-cría a engorda, y relacionado con el incremento en la talla y peso de los peces. Estos valores podrían deberse a que el ciclo de vida del parásito se completa en el sistema de cultivo con la presencia de sus hospederos intermedios (copépodos y peces) y finales (aves ictiófagas), acumulando así los parásitos. Poulin 34 estudió la relación intraespecífica entre la longitud de los peces e intensidad de infestación de parásitos metazoarios, encontrando que particularmente los cestodos, muestran una correlación entre la longitud de los peces y la intensidad de infestación. Experimentalmente, algunos estudios han demostrado que los copépodos planctónicos sirven como primer hospedero intermediario de cestodos de la familia Gryporhynchidae.
Por ejemplo, Jarecka 35,36 demostró que el copépodo Eudiaptomus graciloides sirvió como hospedero de los cestodos Neogryporhynchus cheilancristrotus y Valipora campylancristrota, y que el copépodo Mesocyclops oithonoides fue hospedero de N. cheilancristrotus. Posteriormente, Sysolyatina-Andakulova 37 demostró que Arctodiaptomus salinus es el primer hospedero de V. campylancristrota. Por otro lado, P. cochlearii ha sido detectada en aves de la familia Ardeidae 31,32. Algunas especies de esta familia han sido reportadas en Ecuador, tales como la garza agamí Agamia agami (Gmelin, 1789), garza morena Ardea cocoi Linnaeus, 1766 y garza pico de bota Cochlearius cochlearius Linnaeus, 1766 38,39,40,41.
La intensidad de cestodos no mostró un efecto en el factor de condición K de los peces ni en el IHS; esto concuerda con que la mayoría de los daños histológicos observados, excepto en los peces con altos niveles de infección, son focales y probablemente no son suficientes para modificar el estado de salud de manera inmediata. Laboni et al. 42 evaluaron el efecto de la infestación por cestodos de la familia Lystocestidae y encontraron que solo los peces fuertemente infestados (>10 individuos) presentaron una pérdida de peso de 26.49%. Estudios recientes de los daños ocasionados por metacestodos de la familia Gryporhynchidae en sus hospederos son muy escasos 43. De manera similar a nuestros resultados, Bauer et al 18 reportaron que metacestodos del género Valipora infestando a la carpa Cyprinus carpio en sistemas de cultivo, provocaron cambios patológicos en la vesícula biliar y otros órganos internos, de acuerdo con el grado de intensidad de infección. Los peces infestados por Valipora mostraron retraso en el crecimiento y peso a diferencia de los peces no infestados o con intensidad de infección baja. La reacción inflamatoria crónica observada alrededor del quiste de P. cochlearii, en forma de cápsula fibrosa y congestión, es similar a lo reportado por Saraiva et al. 19, quienes encontraron que larvas del metacestodo P. samfyia enquistado en la lámina propia de la mucosa intestinal provoca una reacción inflamatoria crónica en los tejidos de la carpa C. carpio, mientras que las larvas de Cyclustera enquistadas en el tejido conectivo de la cápsula hepática se encuentran rodeadas de una capa fina fibrosa y con necrosis e hiperemia en el tejido adyacente. Sin embargo, solo los peces con niveles altos de infección mostraron lesiones que podrían alterar su estado de salud, a diferencia de lo reportado recientemente por Scholz et al. 43, quienes evaluaron la infestación por larvas invasivas de Amirthalingamia macracantha, parásito de los cormoranes, en híbridos de tilapia y mencionaron que a pesar de encontrar valores bajos en los niveles de infestación (prevalencia 3% e intensidad promedio 1-2 individuos), esta especie podría representar una amenaza en los sistemas de cultivo de la tilapia. Nuestros resultados brindan la primera información sobre las alteraciones histológicas provocadas por P. cochlearii en D. latifrons, pero estudios futuros que correlacionen el grado de lesiones histológicas con el funcionamiento hepático y la condición corporal, serán necesarios para determinar el efecto real de este parásito en los organismos infestados.
Previo al desarrollo del presente estudio, un productor ecuatoriano de D. latifrons observó la infestación de cestodos en el hígado de los peces, lo cual fue motivo de rechazo en la exportación del producto. Dormitator latifrons es una especie atractiva para el mercado internacional, puesto que se puede transportar viva 44, siendo sus principales mercados Estados Unidos, Canadá y China 44. Sin embargo, la exportación de este recurso constituye un desafío debido a las restricciones impuestas por la autoridad competente del país importador. Según la Organización Mundial de Sanidad Animal (OIE), si los animales acuáticos vivos a exportar presentan infestaciones por parásitos que pueda ser un riesgo a la salud humana o a las poblaciones silvestres nativas, el productor no podrá exportarlos sin el consentimiento previo del país importador 45. Asimismo, menciona que la autoridad competente adoptará las medidas necesarias para impedir el transporte de animales acuáticos que presenten signos clínicos de alguna enfermedad, y evitar que se introduzcan en el contenedor posibles vectores o agentes patógenos. En este sentido, se recomienda mantener medidas para la prevención para esta parasitosis en cultivo de D. latifrons. Scholz et al. 24 y Scholz, Davidovich, et al. 43 mencionan que la detección de gryporhynchidos en sistemas de cultivo debe ser un motivo de monitoreo constante con el fin de tomar medidas preventivas para evitar que incrementen los niveles de infección.
En conclusión, este estudio constituye una ampliación en la distribución geográfica de P. cochlearii; primer reporte en cultivo y primer reporte de daños histológicos asociados a P. cochlearii en D. latifrons. A pesar de que los resultados mostraron que los parásitos no tienen un efecto en la condición corporal de los peces, se recomienda llevar un monitoreo constante en sistemas de cultivo para incrementar el tamaño de muestra y así determinar sí P. cochlearii constituye un riesgo para la salud de los peces. Este monitoreo podría incluir análisis no destructivos como determinación de transaminasa y así evaluar el funcionamiento del hígado. Adicionalmente se recomienda que los productores rompan el ciclo de vida del parásito, probablemente cubriendo las piscinas con mallas de sombra para evitar el hospedero final de P. cochlearii (aves).















