INTRODUCCIÓN
La pesca y acuacultura han tenido el propósito de suministrar alimentos y productos relevantes para el hombre, buscando la sustentabilidad en ambas actividades 1. En el último siglo, se experimentó un incremento en el consumo de productos acuáticos debido al sabor, calidad nutrimental, cualidades organolépticas, bienestar y salud que generan estos productos en el consumidor, lo que generó una intensificación de la industria pesquera. Esto aumentó la producción de productos acuícolas y el subsecuente agotamiento del recurso debido a la sobrepesca y sobreestimación de la cantidad de producto que se podía extraer 2. Ante este escenario y con una continua demanda de productos acuícolas, surge la acuacultura como una alternativa que puede apoyar en el suministro de alimentos acuáticos obtenidos por la pesca 1,2. Hoy en día, la acuacultura se ha convertido en una actividad a gran escala e importancia económica en muchos países 1,3. Sin embargo, este desarrollo no es ajeno a problemas que disminuyen la producción, tales como enfermedades, desabasto de alimentos o ingredientes para la fabricación de dietas adecuadas para el consumo de los organismos acuáticos, y el deterioro ambiental.
El cultivo de camarón comercial es uno de los productos más importante en la acuacultura mundial, especialmente en el sudeste asiático y China 1,3,4. En la actualidad, uno de los principales objetivos para mejorar la camaronicultura es la generación de alimentos de bajo costo que favorezcan la seguridad alimentaria, crecimiento y salud de los organismos, y que además reduzcan el impacto al medio ambiente 1. Diversas investigaciones buscan usar ingredientes alternativos como sustitutos de la harina de pescado o soya, y que sirvan como complemento nutricional o aditivos alimenticios que favorezcan el crecimiento de los animales. También se busca que estos ingredientes puedan ayudar en contra de los patógenos a los que están expuestos organismos acuáticos y puedan disminuir las aportaciones de materia orgánica al medio ambiente 3,5.
Las levaduras son un ingrediente convencional que ha sido usado desde hace tiempo en alimentación animal, donde la industria de la biotecnología ha trabajado con varios tipos de preparaciones y cepas que fungen como aditivos alimenticios para mejorar el crecimiento, nutrición, conversión alimenticia y sobrevivencia del camarón 6,7,8. Además, se han desarrollado para poder competir por el espacio intestinal y modificar la flora microbiana, disminuir la presencia de bacterias no benéficas, aumentar la producción de enzimas, y la asimilación de nutrientes o la digestión de estos 9,10,11.
La figura 1 muestra que los trabajos relacionados con la levadura (2000 al 2022) asociados al camarón de acuacultura y enfocados en el uso de la levadura activa o inactiva, y extractos o partes de esta en temas como parámetros de crecimiento, sistema inmune, sistema digestivo, metabolismo, medio ambiente y control de enfermedades. Esta figura también muestra que la levadura activa se usa principalmente en parámetros de crecimiento y sistema inmune (37 y 26%, respectivamente), fenómeno que se invierte al usar levadura inactiva o extractos de esta (2433 y 37-40% respectivamente). Los temas como metabolismo, medio ambiente, sistema digestivo y enfermedades son menos abordados (0-18%). Este trabajo busca mostrar la información actual sobre el uso de levaduras activas, mostrando el tipo de levaduras empleadas, dosis, y efecto generado en los parámetros de crecimiento de los camarones bajo cultivo.
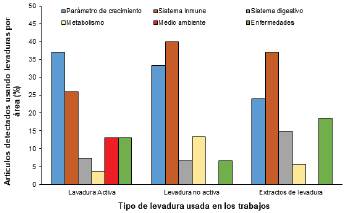
Figura 1 Porcentaje de artículos detectados del 2000 al 2022 que usan levaduras o partes de esta en camarón de cultivo y tema principal que abordan.
Levaduras usadas en camarón
Las levaduras son ascomicetos y basidiomicetos unicelulares con reproducción de gemación o fisión. Se considera que una fracción (2-5%) del total de especies de levaduras se conocen a nivel mundial 12 y se ha demostrado su potencial para producir muchas sustancias bioactivas, como enzimas, fitasa, glucanos, glutatión, toxinas y vitaminas con aplicación en acuacultura, alimentación, farmacéutica, medioambiental y química 13. Las levaduras son un producto popular para usar en la acuacultura como fuente de aminoácidos, proteínas y vitaminas (principalmente del complejo B) con efecto positivo sobre el crecimiento e inmunidad del camarón 14,15. Otro uso de las levaduras en la acuacultura es para el control de enfermedades (bacterias o virus), lo cual puede reducir el uso de antibióticos y otros productos químicos que afectan la resistencia o patogenicidad de los microorganismos 16,17. Las levaduras se pueden utilizar como ingredientes o aditivos alimenticios en dietas para mejorar el valor nutricional de las mismas, al igual que pueden mejorar la salud del crustáceo como fuente de proteínas anticoagulantes, aglutininas, péptidos antimicrobianos o AMP (defensinas y quimiocinas) y bacteriocinas. También se han utilizado como fuente de radicales libres, apoyo en la formación de componentes humorales, enzima fenoloxidasa, lisozimas, nódulos, proteasas, peróxido de hidrógeno, polimixina, sideróforos, y tirotricidina, además de favorecer la fagocitosis 17,18,19,20,21,22,23,24.
Las levaduras marinas son microorganismos que normalmente se encuentran en el entorno natural del camarón de cultivo donde se ha documentado su papel en la salud y nutrición 25. Estos microorganismos pueden obtenerse como subproductos de algunas industrias o bien producirse específicamente para incrementar el aporte de algún nutriente en particular o por sus productos bioactivos 9,17,26,27,28. A continuación, se muestras las principales levaduras usadas en nutrición de camarón.
Candida. Las levaduras conocidas como Candida pertenecen a la clase Saccharomycetes, división Ascomycota, están ampliamente distribuidas en la naturaleza ya que pueden crecer en diferentes ambiente y temperaturas, y se han descrito al menos 100 especies. Las células de esta levadura son de forma globosa, elipsoidal, cilíndrica o elongada y ocasionalmente ojivales y triangulares durante la reproducción asexual 29. Las levaduras del género Candida que se han usado en estas dos últimas décadas como ingrediente en trabajos de investigación asociados a los parámetros de crecimiento del camarón de cultivo (postlarvas de Litopenaeus schmitt, Fenneropenaeus indicus, y L. vannamei) son: Candida insectorum, C. parapsilosis, C. sake y C. utilis14,30,31,32 (Tabla 1). García-Galano y Carrillo-Farnés 30 y Sarlin y Philip 33 utilizaron levaduras activas C. sake y C. utilii como suplementos en dietas para postlarvas de camarón (L. schmitt y F. indicus, respectivamente) observando que el uso de las levaduras favoreció el crecimiento y sobrevivencia en camarones en comparación con otras cepas, lo que confirma que las levaduras marinas pueden servir como posibles suplementos alimenticios en camarones de esta talla cuya alimentación es a nivel de micropartículas 33. Gamboa-Delgado et al 14 formularon dietas con harina de pescado y C. utilis, observando que la mezcla de estos ingredientes favorecía la tasa de crecimiento de los camarones (L. vannamei), en comparación de las dietas que contenían solo C. utilis. También se observó que la dieta con 85/15% de harina de pescado/levadura proporcionó un resultado significativamente superior en peso final y tasa de crecimiento en comparación de las otras dietas (con o sin levadura). Esto sugiere que el suministro de esta levadura ayuda a mejorar el perfil de aminoácidos de la harina de pescado cuando esta disminuye en las dietas. Por su parte, Apún-Molina et al 31 usaron C. parapsilosis que fue aplicada externamente a una dieta comercial de camarón (32%, Purina, Ciudad Obregón, México) a una dosis de 5x105 UFC g-1. Los camarones juveniles L. vannamei (2.5±0.06 g) alimentados con esta dieta presentaron un significativo mayor peso final, tasa de crecimiento y tasa conversión alimenticia comparado con los organismos alimentados con la dieta control. Sin embargo, este efecto se veía reducido cuando el alimento no se usaba, lo que sugiere que la vida de anaquel puede afectar la viabilidad de las levaduras.
Tabla 1 Efecto de la levadura active sobre los parámetros de crecimiento de camarones de interés acuícola.
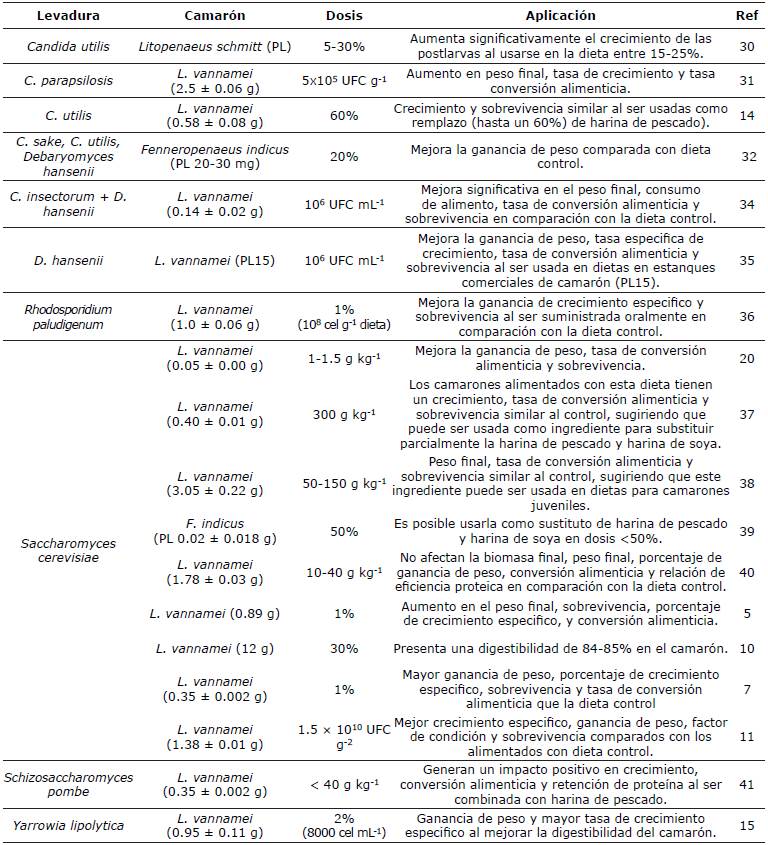
Debaryomyces. Este género de levadura pertenece a la clase Saccharomycetes, división Ascomycota, se encuentran comúnmente en el medio ambiente y se utilizan en la industria alimentaria. Se han descrito al menos 30 especies y sus células se caracterizan de por ser de forma globosa, ovoide o lenticular durante la reproducción asexual, la cual es de tipo germinación multilateral 42. Esta levadura se encuentra en la microflora intestinal y sedimentos en las áreas de cultivo de organismos marinos como el camarón 13. Debaryomyces hansenii es la principal especie observada en los estudios para camarón, y se ha empleado como ingrediente que favorece la ganancia de peso, crecimiento y conversión alimenticia tanto en postlarvas como juveniles (Tabla 1). Sarlin y Philip 32 utilizaron D. hansenii viva como suplemento en dietas para postlarvas de camarón (F. indicus) a diferentes dosis, mostrando que favoreció el crecimiento y sobrevivencia en camarones. Resultados similares fueron observados por Vidya et al 35 cuando la usaron con L. vannamei a la misma dosis (106 UFC g-1 de dieta). Campa-Córdova et al (34) la suministraron con C. insectorum para alimentar a L. vannamei (0.14 ± 0.02 g) generando resultados significativos en todos sus paramentes de crecimiento en comparación de una dieta control comercial (Tabla 1).
Rhodosporidium. Este género de levadura pertenece a la clase Ustilaginomycetes, división Basidiomycota. Las células son globosas, ovoides y elongadas durante la reproducción asexual, con germinación multilateral y polar. Posee una visible pigmentación rojiza por su capacidad de producir carotenoides 43). La identificación de las especies requiere de estudios bioquímicos, fisiológicos y filogenéticos y se conocen cerca de 9 especies (Rhodosporidium azoricum, R. babjevae, R. diobovatum, R. fluviale, R. kratochvilovae, R. lusitaniae, R. paludigenum, R. tutoroides y R. sphaerocarpum). Yang et al 36 alimentaron camarones L. vannamei (1.0 ± 0.06 g) con una dieta complementada con R. paludigenum al 1% (108 cel g-1 dieta) detectando una mejora en el crecimiento especifico y sobrevivencia de los camarones. Sería de gran interés estudiar también el efecto que poseen los carotenoides de esta levadura en los organismos acuáticos como el camarón.
Saccharomyces. Saccharomyces cerevisiae es la levadura cuyo uso en nutrición de camarón más se ha reportado (Tabla 1), y también más usada en diferentes procesos a nivel mundial, ya que está involucrada en la producción de cerveza, vino, y pan, siendo también la primera célula eucariota cuyo genoma fue secuenciado 44. Pertenece a la clase Saccharomycetes, división Ascomycota, las cuales se reproducen por medio de gemación presentando un ciclo de vida haploide y diploide. Los estudios genéticos señalan la existencia de ocho especies bien definidas (S. arboricolo, S. cerevisiae, S. eudayanus, S. jurei, S. kudiavzevii, S. mikatae, S. paradonus y S. uvarum)44. Se pueden obtener como un subproducto de varias industrias de fabricación de alimentos y bebidas alcohólicas, convirtiéndolas en un ingrediente interesante que se puede utilizar en la alimentación agropecuaria y organismos acuáticos, y se puede usar activa, no activa (muerta) o extractospartes de esta 28. La tabla 1 muestran que S. cerevisiae se ha usado principalmente en dietas para camarones L. vannamei desde postlarvas (0.05 g) hasta juveniles (0.4-3 g) y con postlarvas de F. indicus (0.02 g). Los resultados señalan que el uso de este ingrediente mejora la ganancia de peso, tasa de conversión alimenticia, sobrevivencia y relación de eficiencia proteica (PER en sus siglas en inglés) de los camarones de forma similar a la dieta control que emplea ingredientes como harina de pescado y soya. Esto sugiere que puede ser usada como ingrediente para substituir parcialmente a los ingredientes antes mencionados. Sharawy et al 39 muestran resultados similares y sugieren el uso de la levadura a una dosis <50%. Qiu et al 10 reportan que el uso de S. cerevisiae a una dosis de 30% en dietas para L. vannamei (12 g), mostrando que el ingrediente tiene un 84-85% de digestibilidad en camarón, lo cual favorece su uso. las levaduras son interesantes en dietas para larvas de camarón donde el tamaño de la célula incrementa la digestión de esta, debido al sistema digestivo que tienen. Es importante señalar que los camarones juveniles al ser sembrados en las granjas tienen una alimentación inicial asociada a la productividad natural de los estanques de cultivo que favorece su crecimiento 45, lo que hace que el uso de la levadura sea un ingrediente natural para ellos en comparación con juveniles de mayor talla que dependen de alimentos formulados para su alimentación 8,20,37,38).
Schizosaccharomyces. Esta levadura pertenece a la clase Schizosaccharomycetes, división Ascomycota, las cuales se reproducen por medio fisión binaria y tiene una forma de bastón que mide 3-4 u de diámetro y 7-14 u longitud. Se conocen cerca de cinco especies de este género (Schizosaccharomyces cryophilus, Sc. japonicus, Sc. pombe, Sc. octosporus y Sc. osmophilus)46. Solorzano-Reyes et al 47 señalan que Schizosaccharomyces es una de las levaduras marinas que forman parte de la comunidad microbiana de los ambientes costeros y manglares, contribuyendo al equilibrio de estos ecosistemas y conforman parte de la dieta natural de peces, crustáceos y moluscos que se alimentan de ellas a través de las partículas en suspensión o adheridas a los sustratos donde hay presencia de levaduras. Los trabajos con Sc. pombe como ingrediente en la nutrición de camarón en forma activa son escasos, Qiu 41 usó esta levadura en dietas para camarón juvenil L. vannamei (0.35 g) a una dosis de 40 g kg1, observando que este microorganismo tuvo un efecto positivo en el crecimiento, conversión alimenticia, y retención de proteína al ser combinada con harina de pescado en la dieta (Tabla 1).
Yarrowia. Esta levadura pertenece a la clase Saccharomycetes, división Ascomycota que poseen un crecimiento asexual por gemación multilateral. Solo existe la especie Yarrowia lipolytica, de forma esferoidal, elipsoidal o alargada, encontrándosele sola, en pares o pequeños grupos. Las células de esta levadura tienen características dimórficas, se puede observar pseudomicelio y ramificado 48. Patsios et al 49 señalan que Y. lipolytica es una levadura detectada en varios tipos de alimentos como carne, pescado, productos lácteos entre otros, lo cual ha llamado la atención ya que puede crecer en diferentes subproductos agropecuarios con altos contenidos de ácidos grasos. Es usada en organismos terrestres y acuáticos generado resultados positivos en su nutrición ya que almacena ácidos grasos esenciales intracelularmente (< 20%), posee un bajo contenido de ácidos nucleicos que favorece la palatabilidad de las dietas. También, secreta proteínas heterólogas, tiene un alto contenido de lisina y genera enzimas que favorecen la digestión animal (esterasas, fosfatasas, lipasas y proteasas) 49,50. Álvarez-Sánchez et al 15 emplearon esta levadura activa mezclada en la dieta para camarones juveniles (0.95 g) a una dosis del 2%, detectando que los organismos mostraron una mayor ganancia de peso y tasa de crecimiento comparados con la dieta control, sugiriendo esto a la mejor digestibilidad de las dietas que fue observada en las pruebas in vitro (Tabla 1).
Contexto del uso de levadura en nutrición de camarón de cultivo
La camaronicultura es una actividad que evoluciona conforme se mejoran las técnicas y conocimientos sobre los organismos de cultivo y su fisiología, medio ambiente e interacciones bióticas-abióticas, requerimientos nutrimentales y procesos productivos. Las levaduras que se encuentran en el medio ambiente y camarones pueden ser herramientas que favorezcan el crecimiento y salud de los camarones, además de mejorar el medio ambiente para esta industria. Sin embargo, el conocimiento sobre este campo es aún limitado y las levaduras no son la excepción. Las diferentes especies de levaduras, como cualquier otro microorganismo, no funcionan de la misma forma. Existen diferencias entre las especies o cepas usadas, medio de cultivo donde se produjeron, producto, subproducto o partes de las células obtenido de estas, método de extracción y purificación de estos subproductos o partes celulares y aplicación específica considerada.
La información en este estudio muestra que las levaduras desempeñan un papel interesante y tienes varias aplicaciones en la camaronicultura por su versatilidad. Las levaduras se han empleado en camarón tanto en forma activa, como inactiva o extractos obtenidos de esta (pared celular, glucanos, nucleótidos, entre otros) (Figura 1). En la parte activa destacan el uso en nutrición (Tabla 1), seguido del sistema inmune, control de enfermedades y para la sustentabilidad del medio ambiente 5,8,17. Mientras que en su forma inactiva o extractos de la célula se usa principalmente para activadores del sistema inmune, seguido de componentes que favorecen la nutrición, control de enfermedades, apoyo del sistema digestivo o metabolismo del camarón 8,10,15,16,23,31.
Inicialmente, las cepas de levadura utilizadas en la acuacultura eran subproductos obtenidos para otras industrias donde se suministraba en diferentes niveles (1-60%). Hoy en día se pueden encontrar levaduras obtenidas biotecnológicamente con aplicaciones muy específicas en nutrición animal (proteínas, lípidos, vitaminas, minerales, etc.) y presencia de compuestos bioactivos con efecto en el crecimiento, sobrevivencia, sistema digestivo, estructura intestinal e interacción de la microflora del camarón 10,13,25. Los resultados presentes en la Tabla 1 revelan la importancia de comprender las características de las diferentes especies o cepas de levadura para su aplicación en la dieta de camarón. Levaduras activas pueden ser usadas como sustituto parcial de la harina de pescado y soya en alimentos balanceados o aditivos con efecto sobre los parámetros de crecimiento 7,8,14.
En camarón, un adecuado balance entre el contenido de proteína, digestión, y absorción de los aminoácidos que contiene las dietas y sus respectivos ingredientes, generalmente representa un mayor crecimiento, sobrevivencia, y menor tasa conversión alimenticia en los organismos cultivados como lo sugieren Ceseña et al 8 y Méndez-Martínez et al 51. Las levaduras activas se han utilizado en las últimas décadas como parte de las dietas para camarón como fuente de proteínas, a pesar de la falta de algunos aminoácidos esenciales y su alto contenido de ácidos nucleicos 6,16,52. Las levaduras activas han mostrado ser un ingrediente potencial para ser usado en dietas para camarón (postlarvas - juveniles). Esta estrategia puede favorecer la asimilación de nutrientes de las dietas, disminuir el costo de estas, y mejorar el crecimiento de los organismos bajo cultivo.
Es importante en futuras investigaciones con células activas visualizar que estas interactúan de varias formas con el organismo que las ingieren, por ejemplo, las levaduras pueden interactuar como un componente nutricional (nivel de proteínas, aminoácidos, microelementos, ácidos grasos, vitaminas, etc.) y como activadores o reforzadores del sistema inmune, espacio, o competidor de nutrientes en contra de patógenos.
Las levaduras activas pueden interactuar como reforzadores del sistema digestivo con la producción de enzimas extracelulares, reduce el impacto en el medio ambiente o estrés en las interacciones bióticas y abióticas de los organismos cultivados, etc.
Es posible que los estudios moleculares, proteómica, e isotopos, etc. puedan generen nueva información que ayude a entender la aplicación de las diferentes especies de levaduras y cepas usadas en dietas para camarón de acuacultura, y el funcionamiento especifico de estas células activas en los organismos y su entorno.















