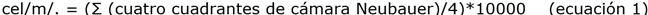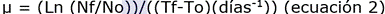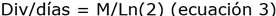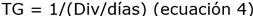INTRODUCCIÓN
Los lixiviados son líquidos que provienen principalmente de rellenos sanitarios, caracterizados por su fuerte olor y coloración oscura, y pueden contener diferentes elementos como metales pesados, contaminantes orgánicos, sales inorgánicas, compuestos de azufre, compuestos nitrogenados, compuestos oxigenados, hidrocarburos aromáticos, compuestos halogenados y terpenos, que son los principales contaminantes del aire debido a su mal olor y propiedades peligrosas 1,2. El aumento en las actividades antropogénicas ha contribuido con un incremento en la generación de residuos sólidos, relacionado directamente con mayor producción de lixiviado, los cuales, debido a los contaminantes que los constituyen, resultan difíciles de tratar o purificar, y al ser descargados en los cuerpos de agua, se convierten en un problema para los ecosistemas y la salud humana 2,3,4.
Por su parte, las microalgas son microrganismos fotosintéticos acuáticos, caracterizados por su gran diversidad metabólica, al ser capaces de producir diferentes compuestos como proteínas, carbohidratos, lípidos, vitaminas, minerales y sustancias específicas como ácidos grasos, entre otros 5,6. Asimismo, estos organismos son empleados para la eliminación de una gran variedad de sustancias tóxicas como plaguicidas, metales pesados e hidrocarburos, entre otros, debido a su capacidad de almacenar altas concentraciones de compuestos venenosos, sin afectar su actividad biológica 7,8, gracias a sus propiedades de bioadsorción, bioacumulación y biodegradación 9. Incluso, en algunos estudios se han utilizado algunas especies como son Chlorella sp., Nannochloropsis sp., Ankistrodesmus sp., entre otras, en tratamientos de aguas residuales, así como procesos de remediación en lixiviados de rellenos sanitarios, para la eliminación de nutrientes nocivos (p. ej. nitritos y nitratos), metales pesados y contaminantes orgánicos, mediante diferentes ensayos 1,2,3,6,7,8,9,10,11,12.
Los cultivos microalgales son una herramienta efectiva en ensayos de fitorremediación y bioprospección, dado que el crecimiento de las microalgas está estrechamente relacionado con las condiciones lumínicas, concentraciones de oxígeno, disponibilidad de nutrientes, pH, entre otras 13,14, permitiendo la exploración de los efectos de diversos compuestos y condiciones ambientales 14.
Por todo lo anterior, el presente estudio evaluó la cinética de crecimiento de dos consorcios de microalgas marinas y de agua dulce, en tres concentraciones de lixiviados del relleno sanitario regional La Paz, del municipio de Turbana, partiendo de la hipótesis que las microalgas pueden ser cultivadas empleando lixiviados como nutriente esencial.
MATERIALES Y MÉTODOS
Caracterización del Lixiviado. La muestra de lixiviado fue tomada directamente de una poza de recolección del Relleno Sanitario Regional "La Paz", ubicado en las coordenadas 10.23746 N y -75.46976 O, en el norte del Departamento de Bolívar, a una distancia adecuada de los cascos urbanos de Cartagena (17 Km), Turbana (8 Km), Turbaco (12 Km) y Arjona (20 Km). El lixiviado fue entregado por la empresa Ingeambiente S.A.S. y su caracterización fue realizada por el Laboratorio Microbiológico Barranquilla S.A.S.
Obtención y cultivo de microalgas. Las microalgas se obtuvieron a partir del banco de cepas monoalgales del laboratorio de Biotecnología Microalgal de la Universidad del Sinú. Las cepas se cultivaron bajo condiciones controladas y siguiendo el sistema de escalamiento tipo batch, donde el crecimiento se presentó en cinco fases de desarrollo: inducción o adaptación, exponencial, declinamiento relativo del crecimiento, estacionaria y muerte, partiendo desde tubos de ensayo. Una vez alcanzada su fase logarítmica, se transfirieron a Erlenmeyer de 250 mL, 500 mL y 1000 mL, hasta llegar a un volumen de 2 L en fotobiorreactores 15.
Preparación de los ensayos. El consorcio de agua de mar se conformó a partir de las especies Chlorella marina y Nannochloropsis oculata y el consorcio de agua dulce por Chlorella vulgaris y Ankistrodesmus falcatus, las cuales fueron elegidas por su capacidad de adaptación, generación de biomasa aprovechable, disponibilidad y resistencia, de acuerdo con los trabajos de 3,16,17,18.
Se establecieron cuatro tratamientos para cada consorcio, tres de ellos enriquecidos con diferentes concentraciones de lixiviados (5%, 10% y 15%), y un tratamiento control (0% de lixiviado), cada uno contemplando una muestra original y tres réplicas (K=4) 19. Estos fueron preparados empleando un medio de cultivo Conway modificado, el cual contiene principalmente sales para el suministro de nitrógeno y fósforo (15,20), usando frascos de borosilicato de 500 mL como fotobiorreactores, con un volumen de 400 mL de cada consorcio de microalgas, aireación constante por 24 horas (proporcionada por un compresor de membrana ActiveAQUA para 110L), un fotoperiodo de 12:12 horas (luz: oscuridad), una intensidad de luz de 5000 lux (proporcionada por cuatro lámparas fluorescentes T8 36W/865) y una temperatura de 24±1°C 20. Para el consorcio marino, el agua utilizada en el cultivo se obtuvo directamente del mar, mientras que para el de agua dulce, se utilizó agua potable de acueducto. Ambas muestras de agua fueron filtradas con una membrana de 0.1 um, y esterilizadas.
Los experimentos iniciaron con una densidad celular aproximada de 762000 cel/mL para el consorcio de agua de mar y 727500 cel/mL para el consorcio de agua dulce, en una relación aproximada de 50:50 por cepa. No se evaluó recambio del cultivo.
Determinación del crecimiento celular. Para obtener la curva de crecimiento, se realizó la cuantificación celular a través de una cámara de Neubauer WILDCO (0.1 mm) 21 y con un espectrofotómetro Fisher Scientific Modelo
EVOLUTION 60S PC a 680 nm. La densidad de células por mililitro (cel/mL) se calculó de acuerdo con la ecuación 1 20:
Asimismo, se obtuvo la tasa específica de crecimiento poblacional, divisiones por día y tiempo de generación, utilizando las ecuaciones 2, 3 y 4, respectivamente, en la fase exponencial de la curva de crecimiento de cada consorcio 20:
Dónde: μ (tasa de crecimiento); To (tiempo inicial); Tf (tiempo final); Nf (densidad celular en Tf); No (densidad celular en To) y TG (tiempo de generación).
Análisis de datos. Los datos de crecimiento celular diario fueron analizados inicialmente utilizando estadística básica descriptiva 22. Adicionalmente, se aplicó la prueba no paramétrica Kruskal-Wallis de una vía, una vez se probaron los supuestos de normalidad y homocedasticidad (Tests Shapiro-Wilks y Levene, respectivamente; p<0.05) 22,23, para determinar si existían diferencias significativas entre las densidades de cada consorcio. Posteriormente, para conocer cuáles muestras eran diferentes, se ejecutó una prueba post hoc de Dunn 24. Finalmente, para determinar posibles asociaciones entre la concentración de lixiviados y el crecimiento microalgal de cada consorcio, se aplicó la prueba no paramétrica de correlaciones de rangos de Spearman 25. Se utilizó el programa estadístico Past 4.10 26 para la evaluación de dichos análisis.
RESULTADOS
Caracterización del lixiviado. A continuación, se muestra la tabla con los resultados obtenidos en el laboratorio correspondientes a la caracterización de parámetros fisicoquímicos de las muestras de aguas de la laguna de lixiviados recolectadas del relleno sanitario "La paz" (Tabla 1). Adicionalmente, se logró medir en campo un pH de 8.05.
Tabla 1 Caracterización fisicoquímica de la muestra de lixiviados. LCM= Límite de cuantificación del método
| Parámetro | Unidades | LCM | Valor |
|---|---|---|---|
| Cianuro total | mg CN/L | - | 0.035 |
| Cloruros | mg Cl/L | - | 913.72 |
| Demanda biológica de oxígeno DBO5 | mg O2/L | - | 73.22 |
| Demanda química de oxígeno DQO | mg O2/L | - | 369.8 |
| Surfactantes aniónicos SAAM | mg SAAM/L | - | 1.026 |
| Fenoles | mg/L | 0.1 | <0.1 |
| Fosforo reactivo Total (Leído como Ortofosfato) | PO43-/L | 0.46 | <0.46 |
| Hierro | mg Fe/L | - | 0.97 |
| Magnesio | mg Mg/L | - | 23.57 |
| Mercurio | mg Hg/L | - | 0.0016 |
| Nitratos | mg NO3-N/L | - | 12.45 |
| Nitritos | mg NO2-N/L | - | 5.092 |
| Nitrógeno amoniacal | mg NH3 -N/L | - | 235.78 |
| Sodio | mg Na/L | - | 503.92 |
| Sulfatos | mg SO42-/L | - | 10.76 |
| Sulfuros | mg S2-/L | 1 | <1.0 |
| Zinc | mg Zn/L | - | 0.18 |
Determinación del crecimiento celular del consorcio de agua de mar. Los ensayos del consorcio de agua de mar, compuesto por Chlorella marina y Nannochloropsis oculata, iniciaron con una concentración de 762000 cel/ mL, y presentaron un periodo de adaptación de ~2 días, teniendo una duración de 9 días desde la fase de inducción hasta la fase muerte (Figura 1) y alcanzando la densidad celular máxima al cuarto día del estudio.

Figura 1 (a) Curvas de crecimiento poblacional del consorcio de agua de mar expuesto a concentraciones de lixiviados de 5%, 10% y 15% (A, B, C y D, corresponden a las réplicas de los diferentes experimentos). (b) Micrografía de las microalgas que conforman el consorcio (1-Chlorella marina y 2-Nannochloropsis oculata). Aumento de 10x
A partir del séptimo día, la densidad se mantuvo constante en los tratamientos al 5% y 10%, mientras que para el grupo control y el tratamiento al 15%, la densidad celular continuó disminuyendo hasta el día nueve (Figura 1).
Analizando el crecimiento celular, se observó que los tratamientos alcanzaron densidades superiores a 2000000 cel/L al tercer día, a excepción del tratamiento al 15%, cuya densidad celular máxima fue inferior. En los tratamientos con lixiviados, se evidenció la mayor densidad celular en el tratamiento al 5% (3257500±177500 cel/mL), mientras que los ensayos con 15% de lixiviado presentaron las menores densidades (1995000±123000 cel/ mL). Asimismo, el grupo alcanzó una densidad celular máxima de 7472500±555000 cel/mL al cuarto día del ensayo.
Adicionalmente, la prueba de Kruskal-Wallis mostró diferencias significativas en las tasas de crecimiento microalgal entre los cuatro tratamientos (H = 12.9768; p = 0.0046). Dichas diferencias estuvieron ocasionadas principalmente por la prevalencia del grupo control con respecto a los demás tratamientos (PostHoc Dunn p<0.05) y al experimento con lixiviado al 15% (PostHoc Dunn p<0.01) (Tabla 2), el cual presentó los valores de densidad más bajos del estudio.
Tabla 2 Comparaciones de prueba post hoc de Dunn (Valor p) entre el grupo control y tratamientos de concentraciones de lixiviados del consorcio de agua marina.
| Lixiviado (%) | Control | 5% | 10% 15% |
|---|---|---|---|
| Control | - | ||
| 5 | 0.0115* | - | |
| 10 | 0.0082* | 0.909 | - |
| 15 | 0.0007* | 0.4 | 0.467 - |
*Diferencias significativas
El grupo control presentó la mayor tasa de crecimiento, mayor división por día y por ende menor tiempo de generación, entre todos los tratamientos durante la fase exponencial (Tabla 3). En cuanto a los tratamientos con lixiviado, se observó que el tratamiento con 15% presentó el mayor tiempo de generación, menor tasa de crecimiento y menor número de divisiones por día, mientras que los tratamientos al 5% y 10% presentaron valores similares.
Tabla 3 Densidad (cel/mL) máxima por tratamiento del consorcio de agua de mar Chlorella marina y Nannochloropsis oculata.
| L | DM | M | Div/día | TG |
|---|---|---|---|---|
| 0% | 7143750 ±121026.4 | 0.55 ±0.0042 | 0.8 ±0.006 | 1.23 ±0.0092 |
| 5% | 3151500 ±61984.2 | 0.28 ±0.0039 | 0.4 ±0.0056 | 2.44 ±0.034 |
| 10% | 2592625 ±61386.88 | 0.3 ±0.0058 | 0.44 ±0.0084 | 2.26 ±0.0429 |
| 15% | 1929875 ±25609.55 | 0.23 ±0.0033 | 0.33 ±0.0047 | 2.98 ±0.0423 |
L= Lixiviado (%); DM= Densidad máxima (promedio); u = Tasa de crecimiento poblacional; Div/día= Divisiones por día; TG= Tiempo de generación; Densidad inicial= 762 000 cel/mL
Determinación del crecimiento celular consorcio de agua dulce. Los ensayos del consorcio de agua dulce compuesto por Chlorella vulgaris y Ankistrodesmus falcatus iniciaron con una concentración de 727500 cel/mL, y presentaron un periodo de adaptación de ~2 días, teniendo una duración de 10 días desde la fase de inducción hasta la fase muerte (Figura 2), comportándose de forma similar al consorcio de agua de mar, solo con una diferencia de 34500 cel/mL en el inoculo inicial (Figura 2).
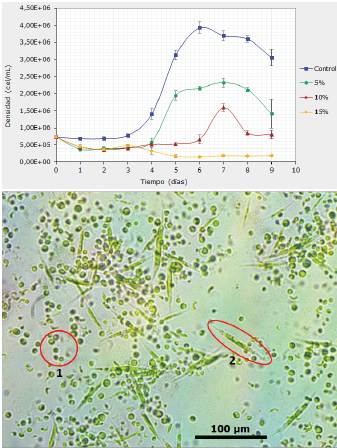
Figura 2 (a) Curvas de crecimiento poblacional del consorcio de agua de dulce expuesto a concentraciones de lixiviados de 5%, 10% y 15%. (b) Micrografía de las microalgas que conforman el consorcio (1-Chlorella vulgaris y 2-Ankistrodesmus falcatus). Aumento de 10x
En cuanto a densidad celular, el tratamiento al 5% alcanzó la mayor densidad entre los tratamientos con lixiviado (2397500±160000 cel/mL), seguido de tratamiento al 10% (1735000±230000 cel/ mL). Sin embargo, para el tratamiento con 15% de lixiviado, se observó una disminución del 28% en la densidad celular inicial, alcanzando una densidad celular de 525000 cel/mL (±87000) (Tabla 4; Figura 2).
Tabla 4 Densidad (cel/mL) máxima por tratamiento del consorcio de agua dulce Chlorella vulgaris y Ankistrodesmus falcatus.
| L | DM | M | Div/día | TG |
|---|---|---|---|---|
| 0% | 3929375 | 0.28 | 0.40 | 2.46 |
| ±83087.4 | ±0.0035 | ±0.0051 | ±0.0318 | |
| 5% | 2345250 | 0.17 | 0.25 | 3.99 |
| ± 37570.21 | ±0.0045 | ±0.0065 | ±0.0989 | |
| 10% | 1596750 | 0.11 | 0.16 | 6.21 |
| ±52691.52 | ±0.0046 | ±0.0067 | ±0.2506 | |
| 15% | 476250 | -0.14 | -0.20 | -5.01 |
| ±18089.48 | ±0.0125 | ±0.0180 | ±0.4840 |
L= Lixiviado (%); DM= Densidad máxima (promedio); u = Tasa de crecimiento poblacional; Div/día= Divisiones por día; TG= Tiempo de generación. Densidad inicial 727500 cel/mL
Adicionalmente, el grupo control tuvo el comportamiento esperado con la tasa de crecimiento más alta, más divisiones por día y, por ende, menos tiempo de generación, así como una densidad celular máxima de 4077500±375000 cel/mL (Figura 2).
La prueba Kruskal-Wallis mostró diferencias significativas en el crecimiento de las microalgas en los cuatro tratamientos (H = 20.0097; Valor-p= 0.0001), ocasionado principalmente por la prevalencia del grupo control (PostHoc Dunn p<0.01) en comparación con los demás tratamientos (Tabla 5).
Tabla 5 Comparaciones de la prueba post hoc de Dunn (valor p) entre el grupo control y tratamientos de concentraciones de lixiviados.
| Lixiviado (%) | Control | 5% | 10% | 15% |
|---|---|---|---|---|
| Control | - | |||
| 5 | 0.1624 | - | ||
| 10 | 0.0251* | 0.4 | - | |
| 15 | 1.282E-5* | 0.003* | 0.033* | - |
| *Diferencias significativas |
Comportamiento consorcio de agua de mar vs consorcio de agua dulce. De forma general, se evidenció una mayor prevalencia del consorcio de agua de mar en las diferentes concentraciones de lixiviado, dado que presentó un mayor crecimiento microalgal desde el periodo de adaptación hasta la fase muerte. Asimismo, se observaron diferencias en los picos máximos de crecimiento poblacional. En el consorcio de agua de mar, estos picos se alcanzaron en todos los tratamientos entre los 3 y 5 días, mientras que, para el consorcio de agua dulce, se alcanzaron entre los 6 y 7 días, con excepción del tratamiento con lixiviado al 15%, el cual tuvo su densidad máxima al tercer día, y a partir de allí, presentó un comportamiento negativo evidenciando disminución su densidad hasta el final del ensayo.
Al evaluar el efecto de las diferentes concentraciones de lixiviados sobre la cinética de crecimiento microalgal, se encontró que para el consorcio de agua marina existe una correlación negativa y significativa con la tasa de crecimiento y la división celular (Tabla 6). Por el contrario, se observó una correlación positiva significativa (R= 0.77; p=0.0004) que sugiere que, a mayor concentración de lixiviados, mayor es el tiempo de generación. Para el consorcio de agua dulce se evidenció una correlación negativa y altamente significativa (Tabla 6), indicando que, a mayor concentración de lixiviados, se tendrá una menor tasa de crecimiento y menos divisiones por día.
Tabla 6 Matriz de correlación de Spearman entre la concentración (%) de lixiviados y el crecimiento microalgal en los consorcios de agua marina y agua dulce.
| Consorcio | Variables | R | Valor p |
|---|---|---|---|
| u | -0.77611 | 0.0004* | |
| Agua Marina | Div/día | -0.77611 | 0.0004* |
| TG | 0.77611 | 0.0004* | |
| u | -0.97014 | 5.2416E-10* | |
| Agua dulce | Div/día | -0.97014 | 5.2416E-10* |
| TG | -0.19403 | 0.4715 |
u= Tasa de crecimiento poblacional; Div/día= Divisiones por día; TG= Tiempo de generación. *Diferencia significativa
Adicionalmente, el análisis de similaridad de medianas Kruskal-Wallis comprobó que existen diferencias altamente significativas entre las densidades de los consorcios de agua dulce y agua de mar (H=38.86; p<0.0001), las cuales pueden observarse principalmente entre el grupo control de agua de mar con todos los tratamientos de ambos consorcios (PostHoc Dunn p<0.05), con excepción del grupo control de agua dulce, y entre el tratamiento al 15% en agua dulce con todos los tratamientos, excepto el tratamiento al 10% en agua dulce (PostHoc Dunn p<0.01). Lo anterior puede evidenciarse en el gráfico de densidades promedio (cel/mL), siendo el tratamiento control en agua marina el de mayor densidad, contrastando con una menor densidad en el tratamiento al 15% en agua dulce (Figura 3).
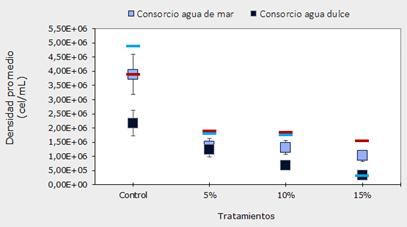
Figura 3 Gráfico de densidad promedio (cel/mL) de los consorcios microalgales bajo las diferentes concentraciones de lixiviado. Las líneas azules corresponden a valores PostHoc de Dunn <0.05 entre el tratamiento al 15% en agua dulce con todos los tratamientos, mientras que líneas rojas corresponden a PostHoc Dunn <0.01 entre el tratamiento control marino y los demás tratamientos señalados.
DISCUSIÓN
En la presente investigación se realizaron cultivos discontinuos, pues se utilizó una cantidad específica del compuesto esencial en cada ensayo, en este caso el lixiviado, por su contenido de nutrientes como nitritos, nitratos, amonio, ortofosfatos, entre otros (Tabla 1), que pueden ser aprovechables por las microalgas para sus procesos metabólicos y crecimiento 1,27. Teniendo en cuenta la capacidad fitorremediadora de muchas especies microalgales, que les permite biotransformar compuestos de un medio líquido o gaseoso 28, se esperaba que ambos consorcios pudieran crecer en este medio, lo cual se logró, dado el florecimiento de los consorcios tanto en el grupo control, como en las diferentes concentraciones de lixiviado, obteniéndose curvas de crecimiento de tipo logístico, frecuentes en este tipo de cultivos 29,30.
No obstante, a pesar de que se observó un comportamiento favorable en el crecimiento poblacional a concentraciones bajas de lixiviado, se evidenció una menor tasa de crecimiento en la medida que aumentaban las concentraciones del lixiviado para ambos consorcios. Este fenómeno también es conocido como "Hormesis", el cual consiste en la respuesta bifásica a la concentración de un químico, siendo positiva cuando es baja, y negativa en dosis más altas 1. Si bien, las muestras de lixiviados provenientes de rellenos sanitarios presentan una alta carga de nitrógeno y otros compuestos que pueden ser favorables para las microalgas, se han reportado otros componentes que tienen un efecto inhibitorio, e incluso tóxico, en el crecimiento microalgal 1,3,12,30, tales como la presencia de varios tipos de compuestos orgánicos (fósforo, sulfato, entre otros), y contaminantes como amonio y metales pesados, al igual que otros factores como la salinidad, el pH, y la posible reducción en la penetración de la luz debido al color o turbidez, limitando la fotosíntesis, y por ende, el crecimiento poblacional 1,3,12,28,30.
El género Chlorella ha sido utilizado en diversos estudios de biorremediación de lixiviados provenientes de rellenos sanitarios, en especial Chlorella vulgaris, por su resistencia a muchos de los contaminantes presentes en este tipo de lixiviados, además de su efectividad en procesos de biodegradación 3,31, por lo que se estableció como parte del consorcio de agua dulce del presente estudio. En un estudio realizado por El Ouaer et al 1 se evaluó el crecimiento de Chlorella vulgaris en un medio estándar BBM y a diferentes concentraciones de lixiviado, y se observó un mayor crecimiento de la microalga, en términos de densidad celular, al 10%, superando incluso las densidades alcanzadas en el tratamiento control, mientras que en mayores concentraciones del lixiviado (30, 50%, 80% y 100%) se obtuvo un declive en el crecimiento, mostrando la disminución en la densidad celular, comportamiento similar al observado en el presente estudio. Asimismo, Porto et al 3 realizaron ensayos con Chlorella vulgaris para evaluar su potencial biorremediador en lixiviados de relleno sanitario utilizando un fotobiorreactor tubular, y encontraron que la microalga presentó un mayor crecimiento en cultivos con concentraciones de lixiviado al 5%, mientras que en concentraciones del 10% y 25%, se obtuvo una tasa de crecimiento más lenta.
En general, la capacidad fitorremediadora y la resistencia a diferentes contaminantes en especies del género Chlorella podrían estar relacionadas con la estructura de su pared celular, la cual posee en sus capas más externas esporopolenina, un polímero natural altamente resistente a ataques químicos, y que puede fijar compuestos tóxicos como metales, pesticidas, insecticidas y fertilizantes químicos (1,32). Como tal, no se conoce con exactitud la composición química de la esporopolenina debido a su estabilidad química y resistencia a la degradación por enzimas y por agentes químicos fuertes. Sin embargo, algunos análisis químicos indican la existencia de una mezcla de biopolímeros, principalmente de ácidos grasos, fenilpropanoides, fenoles, entre otros 32. Adicionalmente, se han reportado algunas especies de este género como mixotróficas, lo que quiere decir que, dada la circunstancia, las células podrían usar simultáneamente CO2 y otros compuestos orgánicos como fuente de carbono, especialmente en condiciones de poca luz 1, como ocurre en muchas ocasiones en el cultivo con lixiviados.
Considerando estas características, se estableció la especie Chlorella marina como parte del consorcio de agua de mar, para evaluar su crecimiento en presencia de diferentes concentraciones de lixiviados, que si bien no ha sido tan utilizada como su contraparte de agua dulce, si se ha estudiado su potencial biorremediador y para obtención de biodisel (33,34,35) en conjunto con Nannochloropsis oculata, la cual ha sido utilizada en estudios de bioprospección (11,36,37,38), teniendo en cuenta la efectividad de poblaciones mixtas de microalgas en este tipo de ensayos, ya que exhiben mayor resistencia a los cambios en el ambiente, favoreciendo su crecimiento 39, lo cual se presentó en este estudio.
Lo anterior se evidencia en los altos valores de densidad celular, mayor tasa de crecimiento, y mayor número de divisiones por día, observados en el consorcio de microalgas marinas, en todas las concentraciones de lixiviado, con respecto a los resultados obtenidos con el consorcio de agua dulce, por lo que se cree que los consorcios marinos podrían llegar a generar una mayor producción de biomasa, incrementando así su efectividad en procesos de biorremediación de contaminantes lixiviados de rellenos sanitarios, convirtiéndose en una potencial alternativa en la ejecución de estos ensayos, especialmente en zonas costeras.
Finalmente, la producción masiva de cultivos de microalgas usualmente requiere medios nutritivos para su incremento de biomasa, por lo que es común el uso de reactivos de alta pureza o industriales con precios altos y de compleja preparación. Es por esto que el presente estudio plantea una alternativa de suministro de nutrientes a partir de la adición de lixiviado, lo que se traduciría en el aprovechamiento de estos desechos y la reducción de costos de cultivos microalgales marinas y dulceacuícolas