Introducción
Los escorpiones son un grupo de artrópodos que tienen hábitos sigilosos y nocturnos, durante el día se ocultan bajo piedras, troncos y grietas o en galerías que cavan ellos mismos, la mayor parte del tiempo se encuentran en sus refugios de donde sólo salen para alimentarse y reproducirse. Por su condición de cavadores, muchas especies dependen de la granulometría y humedad del suelo (1-3).
El envenenamiento por escorpiones del género Tityus en América del sur es causa de emergencia pediátrica en diferentes áreas endémicas, las cuales coinciden con el sistema montañoso de los Andes, en Colombia (4) y de la floresta amazónica en Brasil(5).
Venezuela se ubica en el primer lugar de los países suramericanos en cuanto a la diversidad de escorpiones, seguido de Brasil. Hasta el presente se han registrado cinco familias de escorpiones (Buthidae, Chactidae, Euscorpiidae, Hemiscorpiidae y Scorpionidae), 17 géneros y 184 especies. Las dos primeras son las más diversas y reúnen el 51,6 % y 43,0 % de las especies del país, respectivamente. Tityus, el género más amplio de la familia Buthidae y de la escorpio fauna venezolana, constituyendo cerca del 30 % de las especies identificadas, de importancia clínica y epidemiológica (6,7).
En Venezuela se han descrito 7 regiones macroendémicas de escorpionismo: región Andina, Centro-Occidental, Centro-Norte Costera, región Nororiental, serranía de Preijá, región Delta y la región Guayano Amazónica, pero son escasas las publicaciones con accidentes en humanos (8). Aun cuando no se llevan registros detallados de la morbilidad se sabe que el escorpionismo es importante en varias regiones de Venezuela y en el estado Bolívar poco se conoce sobre la epidemiologia del escorpionismo; según los registros del Distrito Sanitario Nro 2 que señalan 3 muertes entre 1994 - 2004 (9).
El veneno escorpiónico es un liquido opalescente y turbio, lo cual se debe a las granulaciones, contiene 15-25 % de sólidos. La sustancia activa es soluble en agua, solución salina y glicerina, insoluble en alcohol etílico y metílico, éter, cloroformo y acetona, con pH de 6. El veneno es insípido e irritante para las mucosas y su administración vía oral carece de acción toxica (10).
En su composición contienen proteínas de bajo peso molecular, esenciales en el efecto tóxico y causante de las alteraciones fisiológicas. Sus componentes más letales son las toxinas α y β; cuyos blancos moleculares son los canales de Na+ dependientes de voltaje de las membranas excitables (11).
El envenenamiento escorpiónico es un complejo sindromático principalmente asociado a disfunción en los sistemas cardiorespiratorios, nervioso e inflamatorio. Los síntomas suelen comenzar entre uno y sesenta minutos posteriores al evento. Las manifestaciones tóxicas dependen de la especie y el tamaño del animal, de la cantidad de veneno inyectado, del peso corporal del individuo y de su suceptibilidad siendo más grave en niños, en especial menores de 6 años, y ancianos; de tal manera que la severidad puede clasificarse en leve, moderada y severa (12).
Las manifestaciones clínicas pueden agruparse en aquellas de tipo colinérgicas y adrenérgicas, pudiendo presentarse aislada o una combinación de ambas. Las complicaciones más frecuentes son: alteraciones cardíacas, pancreatitis y edema aguda de pulmón. En pacientes graves, es posible observar agitación psicomotriz, fasioculaciones musculares, convulsiones, cambios electrocardiográficos, insuficiencia cardíaca, insuficiencia respiratoria o edema agudo de pulmón y shok así como coagulación intravascular diseminada y anemia hemolítica (4,13,14).
Las complicaciones cardiovasculares del escorpionismo a menudo son inducidas por venenos del género Tityus provenientes del occidente del país. Por ejemplo, el veneno del Tityus falconensis, induce miocarditis en todos los casos descritos, el daño aparece rápidamente (15). Se ha conseguido una correlación directa entre envenenamiento severo y el aumento de la creatinfosfoquinasa (CPKMB), isoenzima relacionada con síndromes coronarios agudos y se usa como marcador temprano de daño cardíaco (16).
Considerando las repercusiones histopatológicas deletéreas del veneno escorpiónico en las células cardíacas y los mecanismos por lo que se producen, resulta de suma importancia escudriñar dichos efectos, mediante el análisis de cortes histológicos que permitan establecer los efectos clínicos e histopatológicos agudos del veneno de escorpión (Buthidae: T. breweri) en miocardio de hámsteres para contribuir con el abanico de información existente sobre T. breweri, de gran importancia epidemiológica en el estado Bolívar.
Material y Métodos
Estudio experimental, exploratoria, descriptiva, analítica y correlacional.
Para la obtención del veneno de escorpiones, especímenes de T. breweri fueron capturados en su hábitat natural. Para ello, se seleccionaron zonas adyacentes al sector de la Tigra en la localidad de El Palmar, municipio Padre Pedro Chien, Estado Bolívar, Venezuela. Localizados durante el día debajo de troncos secos en el suelo, piedras, hojarascas, debajo de corteza de arboles. Durante las noches, para facilitar la búsqueda, se utilizaron lámparas de luz morada (ultravioleta) aprovechando la propiedad de fluorescencia del exoesqueleto de los escorpiones a esta luz, posteriormente trasladados en cautiverio al laboratorio de Alacranología situado en la Escuela de Ciencias de la Salud “Dr. Francisco Battistini Casalta”, Ciudad Bolívar, Municipio Heres, Estado Bolívar y alimentados con larvas de Tenebrio mollitor y aclimatados durante dos a tres semanas previas a su ordeño.
Ocurrida la aclimatación, los mayores de 1 g se ordeñaron para la obtención del veneno por el método de estimulación eléctrica de telson según la técnica desarrollada en el laboratorio de Alacranología de la Escuela de Ciencias de la Salud, Universidad de Oriente, Núcleo Bolívar. Se procedió a la inmovilización del escorpión. Luego se le colocaron 2 electrodos, el primero en la quela derecha, y el segundo en el telson, lugar donde se encuentra la glándula que se estimula para la liberación del veneno, estos electrodos estaban conectados a un estimulador Grass® modelo S-D5.
Se aplicaron de 3 a 5 trenes de pulsos con una potencia de 10 milivoltios, entre 10 y 20 segundos cada uno, dependiendo de la cantidad de veneno expulsado por cada escorpión. El veneno expulsado por el acúleo, fue recogido a través de tubos capilares de vidrio no heparinizados (75 µl de capacidad) y traspasados a tubos de Eppendorf, para luego almacenarlos y refrigerarlos a 4 °C hasta el momento de su procesamiento.
Posterior a la extracción se procedió a la purificación parcial del veneno y se separaron los diferentes componentes. Luego se procedió a la recuperación del sobrenadante, que contienen las proteínas con la actividad farmacológica, se cuantifico mediante espectrofotometría a una longitud de onda de 280nm asumiendo que la unidad de absorbancia corresponde a una concentración de 1mg/ml.
Se utilizaron hámsteres de ambos sexos, con pesos promedios de 30g del género Cricetus, alimentados con comida para perros y provistos de agua potable “ad libitum” sometidos a ayuno de una hora y se tomaron al azar para los experimentos descartando los animales con signos de enfermedad.
Ensayo experimental:
Tomando en cuenta que la Dosis letal 50 (DL50) conocida para el escorpión T. caripitensis es de 20.2 µg/g determinado por el método de Dixon y Mood, con la finalidad de utilizar una dosis de veneno que no produjera la muerte de los hámsteres, se tomaron 5 animales al azar, se pesaron y se les administró una dosis de veneno variable a cada animal, desde 10 µg/g hasta 50 µg/g. se observó y registró la clínica aguda y subaguda mediante el uso de videocámaras, además de un instrumento creado para anotar los efectos producidos por el veneno. La dosis más alta que no mató al hámster fue usada para establecer los efectos agudos, mientras que la mitad de ésta para los subagudos.
Protocolo experimental:
Para evaluar los cambios histopatológicos agudos, se escogieron 6 hámsteres al azar, se inyectaron por vía intraperitonial con veneno de Tityus breweri a las dosis determinadas en el ensayo anterior, con intervalo de 15 minutos de diferencia, identificados con la letra “H” seguido de números arábigos ascendentes. Tres (H1-H3) fueron sacrificados 30 min posteriores a la inoculación del veneno y los otros tres (H4-H6) a los 60 minutos. Tres fueron usados como controles, a los cuales se les administró agua destilada.
Para los cambios histopatológicos subagudos, se escogieron 18 hámsteres al azar del grupo existente , se inyectaron por vía intraperitonial con veneno de Tityus breweri con la mitad de la dosis a la que se les administró para los efectos agudos, con un intervalo de diferencia de 15 minutos, y sacrificado a las 3 (H7-H9), 6 (H10-H12), 12 (H13-H15), 24 (H16-H18, 48 (H19-H21) y 72 horas (H22-H24).
Posteriormente los animales fueron sacrificados mediante dislocación cervical y diseccionados, extrayéndoles el corazón y sumergiéndolos en formol al 10 %, se colocaron las piezas en un frasco con agua corriente por 15 minutos para eliminar el formol, se deshidrataron mediante colocación de alcohol en concentraciones de 100 % durante 6 horas cambiando cada 60 minutos el alcohol. Se fijaron, a través de la inmersión de la pieza en Xilol por 2 horas, cambiando cada 60 minutos.
Una vez fijada, deshidratada y adecuadamente identificada, las muestras se colocaron en parafina durante 2 horas, en estufa a 54-55 °C., repitiendo por dos horas más, las piezas se colocaron en un molde cuadrangular con una capa de parafina aún líquida, finalmente se vertió parafina líquida hasta llenar el recipiente, obteniendo un cubo solidificado.
Los ejemplares preparados fueron cortados con micrótomo, teñidos con Hematoxilina-Eosina (H-E), posteriormente observados y analizados a través de microscopía óptica por patólogo especialista.
Resultados
Para la obtención del veneno, se usaron 26 escorpiones, ordeñados por el método de estimulación de telson y posteriormente cuantificados por espectrofotometría obteniéndose 1,287 ml. La dosis de experimentación para evaluar los efectos agudos resultó de 40 µg/g hámster, mientras que para establecer los efectos subagudos fueron la mitad.
Las manifestaciones agudas reflejadas, posterior a la exposición durante 30 minutos al veneno de T. breweri, fueron progresivas en el tiempo, presentando inicialmente hiperactividad, rascado en el área de la inoculación (sugiriendo prurito y/o dolor), dificultad para respirar, aumenta de la actividad peristáltica evidenciada por defecaciones pastosas recurrentes, marcha torpe, espasmos musculares generalizados y debilidad muscular en tren posterior. A los 60 minutos se observan los mismos signos aunado a bradipnea, hipoactividad y micciones constantes.
La clínica subaguda a las 3 horas de exposición al veneno, estuvo representada en primera instancia por hiperactividad, que evoluciona a hipoactividad (desde los 20 minutos aproximadamente), espasmos musculares generalizados, debilidad en patas posteriores, defecaciones sólidas, erección de la cola, piloerección, imposibilidad para la marcha, taquipnea y distención abdominal. Los signos de toxicidad a las 6 horas fueron los descritos aunado a cianosis, defecaciones solidas constantes y aumento de frecuencia miccional. En los hámsteres con 12 horas de exposición al veneno, se añadió a la clínica mayor hipoactividad, disnea franca y se produjo la muerte de uno (H18) a las 8 horas y 39 minutos de la inoculación, aquellos con 24 y 48 horas presentaron cese de las manifestaciones clínicas y de los 3 animales de experimentación que fueron expuestos por 72 horas al veneno, murieron dos (H22 y H23), el resto sobrevivieron en buenas condiciones.
La inoculación de veneno de T. breweri provocó cambios histológicos agudos y subagudos en el miocardio de los hámsteres.
La figura 1, muestra imagen de tejido cardiaco normal de un hámster control, el cual se caracterizó por presentar fibras paralelas, de diámetro variable, con numerosos haces cruzados de fibras que se bifurcan y se conectan con fibras adyacentes para formar una red tridimensional. Entre ellos se encuentran un tejido conectivo fino que contienen vasos sanguíneos. Los núcleos celulares están ubicados dentro de la misma con apariencia central.

Figura 1: Microfotografía de tejido miocárdico de hámster inyectado intraperitonealmente con agua destilada, donde se evidencia: Fibras musculares normales con H-E, 400x
En los hámsteres a los que se les administró la dosis experimental para evaluar los cambios histopatológicos agudos (40 µg/g hámster), se evidenciaron cambios progresivos, a los 30 minutos se observaron edema interfasicular y congestión vascular (Figura. 2), seguidamente, a los 60 minutos aparece infiltrado linfohistiocítico perivascular (Figura. 3). En los que se les administró la mitad de la dosis de experimentación, para evaluar los cambios histopatológicos subagudos, se observaron variaciones sucesivas en el tejido miocárdico, evidenciando a las 3 horas, presencia de coagulo fibrinohemático en la superficie endocárdica (Figura. 4), posteriormente a las 6 horas se observó hemorragia focal y subendotelial (Figura. 5). Al transcurrir 12, 24, 48 y 72 horas de exposición al veneno, no se evidenciaron cambios histopatológicos relevantes.

Figura 2: Microfotografía del tejido miocárdico de hámster inyectado intraperitonealmente con veneno de T. breweri 40 µg/g. 60 minutos de exposición donde se evidencia: (A) Edema interfascicular acentuado. H-E, 200x

Figura 3: Microfotografía del tejido miocárdico de hámster inyectado intraperitonealmente con veneno de T. breweri 40 µg/g. 30 minutos de exposición donde se evidencia: (A) Edema interfascicular. (B) Infiltrado Linfohistiocítico perivascular. H-E, 400x.

Figura 4: Microfotografías del tejido miocárdico de hámster inyectado intraperitonealmente con veneno de T. breweri 20 µg/g. 3 horas de exposición donde se evidencia: (A) Edema interfascicular acentuado. (C) Congestion vascular, (D) Coagulo fibrinohemático. H-E.100 - 200x.
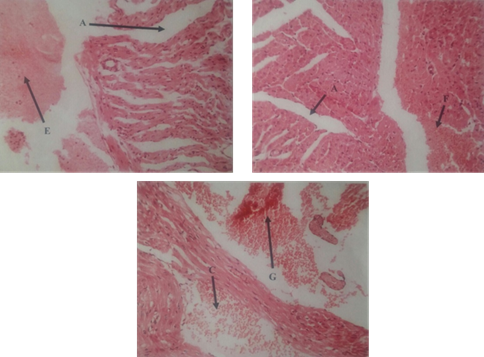
Figura 5: Microfotografías del tejido miocárdico de hámster inyectado intraperitonealmente con veneno de T. breweri 20 µg/g. 6 horas de exposición donde se evidencia: (A) Edema interfascicular acentuado. (E) Hemorragia reciente subendotelial. (F) Hemorragia reciente focal. (G) Hemorragia. H-E, 200x.
Discusión
La primera fase colinérgica generalmente es autolimitada y puede progresar hacia una pancreatitis necrohemorrágica fatal. (17) o estar seguida por una segunda fase adrenérgica, cuyas manifestaciones clínicas son: piloerección, palidez cutáneo-mucosa, hipertensión arterial, taquicardia sinusal, arritmias cardíacas, edema pulmonar y choque cardiogénico (15,18).
Resulta importante destacar que las manifestaciones clínicas adrenérgicas se observaron en menor proporción con respecto a las colinérgicas en el envenenamiento experimental, podría ser debido a que estos signos no pueden observarse en el modelo utilizado, ya que sería necesaria su cuantificación experimental. Por otra parte, el prurito observado y la piloerección, están asociadas con la activación de receptores α1 adrenérgicos (19).
Se ha demostrado in vitro que el veneno de escorpión de diversas especies se distribuye a diferentes órganos y que tienes efectos tóxicos en corazón, estómago y páncreas, así mismo en pulmón, hígado, y riñones (20,21).
Una reciente investigación clínica encontró alteraciones de la perfusión miocárdica y espasmos microvasculares. La mejoría simultánea de estas dos alteraciones fue considerada por los autores como evidencia indirecta del papel patognomónico de la activación del sistema nervioso simpático en la génesis de la disfunción ventricular izquierda (22)
Martínes y Noriega (2010) determinaron los efectos histopatológicos agudos del veneno de escorpión Tityus caripitensis en el miocardio de ratones en presencia de atropina, administrando una dosis de 20 µg/g ratón, vía intraperitoneal. Un segundo grupo fue inyectado con atropina a dosis de 5 µg/g ratón, 10 minutos antes del veneno. Los animales fueron sacrificados a los 30, 60 y 90 min. En aquellos tratados sólo con veneno, se evidenciaron cambios histopatológicos progresivos a partir de los 30 minutos, congestión vascular y hemorragia leve, posteriormente a los 60 minutos, edema intersticial y edema de fibra muscular, que a partir de los 90 minutos, progresa a miocitólisis focal y multifocal, hemorragia y trombosis. Aquellos que se le administró atropina y veneno, mostraron alteración histopatológicas leves a partir de los 30 minutos. Histopatológicamente los cambios producto de isquemia en el miocardio se pueden evidenciar por microscopía óptica a partir de las 24 horas, por tanto los cambios detectados en los cortes histológicos son debidos en lugar de la hipoxia, a un efecto inflamatorio causado directamente por la venina en el tejido cardiaco (23).
Los hallazgos comparados con los causados por el veneno de T. caripitensis indicarían que el veneno T. breweri produce cambios histológicos similares, aunque menos acentuados, ya que en este estudio no se evidenció miocitólisis y los cambios histopatológicos fueron reversibles a partir de las 12 horas de exposición al veneno. Las alteraciones apreciadas en este estudio fueron menos notorias probablemente por el tiempo de exposición al veneno.
El efecto deletéreo sobre la fibra cardiaca, podría ser producto del efecto tóxico directo del veneno sobre el miocito, aunado a una respuesta inflamatoria y la consecuente liberación de citocinas, ya que, algunos autores han propuesto que el daño a tejidos, la pancreatitis, síndrome de dificultad respiratoria y falla multiorgánica, están asociados con una producción incontrolada de citocinas y otros productos de la activación de macrófagos y linfocitos.
El envenenamiento escorpiónico en Venezuela es uno de los procesos no infecciosos que induce la liberación masiva de citocinas proinflamatorias, principalmente IL6, IL1-α, y pueden llevar una respuesta inflamatoria generalizada, en el cual se activa la cascada de coagulación, el sistema fibrinolítico y plaquetario; se liberan mediadores inflamatorios y proteasas, con incrementos de antitrombina III, antiplasmina, contribuyendo a expandir la inflamación a todos los órganos (24).
En todos los casos de escorpionismo ocurridos en nuestro país, donde se detectaron alteraciones en el TP y TTP, han estado involucradas especies del género Tityus. Aún se desconocen los componentes responsables de este efecto y la manera de actuar de los mismos (25).
En todos los casos, las manifestaciones sistémicas que predominaron en el cuadro neurotóxico agudo producto de la inyección intraperitoneal del veneno de T. breweri, fueron de naturaleza colinérgica (producto de la exacerbación de las funciones del sistema nervioso parasimpático), con algunas manifestaciones centrales y adrenérgicas.
El veneno de T. breweri, produjo alteraciones histológicas agudas y subagudas en el tejido cardiaco de los ratones de experimentación y en los Hámsteres utilizados como control no se evidenció ninguna alteración histopatológica, dejando como recomendación continuar investigando y profundizando el tema desarrollado en esta investigación, así como los efectos clínicos e histopatológicos crónicos causados por el veneno del escorpión Tityus breweri en el corazón.














