Introducción
El Theobroma cacao L. (Malvaceae) es una especie vegetal con centro de origen en los bosques húmedos de América del sur; sus granos y derivados son un insumo básico para la industria del chocolate, cosmética y farmacéutica (Zhang & Motilal, 2016). Las tres principales enfermedades del T. cacao que limitan la producción mundial son la pudrición parda (causado por Phytophthora spp.), moniliasis (Moniliophthora roreri) y escoba de bruja (Moniliophthora perniciosa) (Bailey & Meinhardt, 2016). Estos fitopatógenos son capaces de limitar significativamente la producción comercial y reducir los rendimientos en un 20 %; por ejemplo, la disminución de la producción de T. cacao en el 2012 se estimó en 1,3 millones de toneladas de grano seco (Bailey & Meinhardt, 2016). Otra enfermedad que limita severamente la producción en Uganda, Brazil y Colombia es la muerte repentina del T. cacao causado por Verticillium dahliae Kleb (Resende, Flood, & Cooper, 1994).
Las especies V. dahliae y V. albo-atrum son altamente patogénicas al causar marchitez en más de 200 especies de plantas, incluyendo cultivos importantes desde el punto de vista económico (Pegg & Brady, 2002; Schnathorst, 1981). Verticillium dahliae ocasiona pérdidas en los rendimientos de hasta el 80 %, siendo su control un desafío debido a que su patogenicidad es altamente variable y por su gran capacidad de supervivencia (Wang et al., 2016).
Actualmente, no hay un manejo o tratamientos de biocontrol para las plantas infectadas, ni existen fungicidas efectivos disponibles para controlar la marchitez por Verticillium, siendo la prevención el único método efectivo para evitar pérdidas (Yildiz & Benlioglu, 2010; Yuan et al., 2017). Las medidas de control y prevención actualmente disponibles no son completamente exitosas cuando se aplican individualmente. Por lo tanto, la única forma de controlar eficazmente la enfermedad en los campos agrícolas es a través del manejo integrado para reducir la enfermedad hasta niveles de coexistencia (López-Escudero & Mercado-Blanco, 2011).
Una estrategia ecológica prometedora dentro del manejo integrado de las enfermedades es el uso de hongos endófitos del cultivo de interés, ya que estos son taxonómica y biológicamente diversos, colonizan los tejidos internos de las plantas sin causar síntomas visibles y pueden mejorar el crecimiento y la salud de las plantas, así como inducir la producción de compuestos y activar algunos genes implicados en respuestas de defensa de las plantas a factores bióticos y abióticos (Bae et al., 2009; Bailey et al., 2008; De Souza et al., 2008; Hanson & Howell, 2004). Entre los principales endófitos usados como agentes de control biológico, están algunas especies del género Trichoderma, consideradas antagonistas naturales de fitopatógenos, ampliamente utilizados en la agricultura, que contribuyen al mejoramiento del crecimiento y desarrollo de las plantas (Guedez, Cañizales, Castillo, & Olivar, 2009; Harman, 2006; Junaid, Dar, Bhat, Bhat, & Bhat, 2013; Toghueo et al., 2016). En T. cacao, recientes estudios han mostrado que hongos endófitos pueden limitar el daño por M. perniciosa, M. roreri y Phytophthora palmivora (Bailey et al., 2008; De Souza et al., 2008; Mejía et al., 2008).
En Perú, personal del Instituto de Cultivos Tropicales (ict) realizo una expedición en la región del Alto Amazonas en el 2008, con el propósito de buscar endófitos evolucionados con los patógenos, obteniendo una colección diversa con 126 aislamientos de Trichoderma de tallos y hojas (Márquez et al., 2010). Solo un numero pequeño de aislamientos de Trichoderma spp. de la colección ha sido estudiado para determinar su habilidad endofítica y de biocontrol de los principales patógenos del cacao (Arévalo, Canto, León, & Meinhardt, 2010a; Arévalo, Canto, León, Meinhardt, & Cayotopa, 2010b; León et al., 2010a; León, Rojas, Rodríguez, Arévalo, & Márquez, 2010b).
Verticillium dalhiae no ha sido confirmada en el Perú, por lo que se procedió al aislamiento del agente causal a partir de plantas de T. cacao clon CCN-51 de dos años de edad, colectadas en el sector Atusparia, Tocache, de la Región de San Martin, Perú, y que presentaron por primera vez en enero del 2010 síntomas de amarillamiento de hojas, marchitez generalizada y muerte, e internamente obstrucción del sistema vascular. Por lo tanto, el objetivo de este estudio fue identificar y caracterizar el agente causal de la muerte repentina del T. cacao y determinar la capacidad antagónica in vitro de aislamientos de Trichoderma endofito sobre el agente causal.
Materiales y métodos
Localización del experimento
Este trabajo de investigación fue realizado en el vivero y en el laboratorio de Fitopatología de la Estación experimental Juan Bernito del ict, ubicado en el distrito de La Banda de Shilcayo, Provincia y Región de San Martin, Perú, a 76°00´18" O y 06°00´28" S, a una altitud de 315 m s. n. m. La temperatura, humedad relativa y precipitación media fueron de 25 °C, 73 % y 1.188 mm, respectivamente.
Material vegetal
Para el aislamiento e identificación del agente causal se utilizaron muestras de tejidos afectados con síntomas de muerte y plantas “muerte súbita” característicos de Verticillium, colectadas en enero del 2010 en una plantación de cacao CCN-51 de dos años de edad del Sector Atusparia, Distrito y Provincia de Tocache de la Región de San Martin, Perú. En esta plantación, el 5 % de las plantas exhibían síntomas de amarillamiento de hojas, marchitez generalizada y muerte de la planta. Al realizar cortes transversales del tallo, internamente se observó obstrucción vascular en forma de puntos, mientras que en los cortes longitudinales se observaron estrías marrones en el sistema vascular.
Las muestras fueron llevadas al laboratorio de Fitopatología del ict para realizar su aislamiento e identificación.
Aislamiento e identificación
El aislamiento del agente causal fue obtenido a partir de tejidos segmentados del tallo, raíz y cuello de plantas enfermas. Los segmentos fueron lavados con agua y desinfestados con hipoclorito de sodio al 1 % durante 10 minutos, para eliminar microorganismos superficiales; además, fueron lavados con agua destilada estéril y colocados sobre papel toalla para su secado. De cada segmento se cortaron porciones de 1 cm, que fueron sembradas en cajas Petri conteniendo medio Papa Dextrosa Agar con Oxitetraciclina (pdao), e incubados por 7 días a 25 °C (Resende, Flood, & Cooper, 1995). Las placas fueron sometidas a iluminación artificial a temperatura ambiente de 28 °C ±} 0,57 °C y humedad relativa de 70 % ±} 1,71 % durante 10 días ±} 1 para favorecer la esporulación de los hongos.
La identificación taxonómica del hongo se hizo por observación de las características morfológicas macroscópicas de la colonia (aspecto y coloración) y las características morfológicas microscópicas (tipo y tamaño de las estructuras vegetativas y de reproducción). Las claves de Barnett y Hunter (1998), Barrón (1968) y Watanabe (2010) fueron empleadas para la identificación.
Asimismo, la identificación del aislamiento se realizó por secuenciación de Sanger. Para ello, el aislamiento se cultivó en matraces que contenían 50 mL de caldo papa dextrosa (pdb, 24 g/L) a 25 °C, hasta que el micelio colonize la superficie del caldo. El micelio fue lavado, filtrado y almacenado a -20 °C hasta la extracción del adn. El micelio se trituro en nitrógeno líquido y el adn se extrajo utilizando el kit DNeasy PowerPlant Pro (Qiagen, Alemania), siguiendo las instrucciones del fabricante. Los partidores ITS1/ITS4 (ITS1: 5'-tccgtaggtgaacctgcgg-3'; ITS4: 5'-tcctccgcttattgatatgc-3') (White, Bruns, Lee, & Taylor, 1990) se usaron para amplificar el adn. La mezcla de pcr se preparó usando pcr Master Mix 2x (Promega, EE. UU.), en un volumen final de 25 μL que contenía agua Milli-Q, 1x pcr MasterMix, 0,5 μM de cada partidor 5' a 3' (directo), 5' a 3' (inverso) y 2 μl de ADNc.
La pcr se realizó en un termociclador Techne TC- 412 (Techne). Las condiciones fueron 94 °C por 2 minutos, seguidas de 35 ciclos de 94 °C durante 10 segundos, 54 °C durante 30 segundos y 72 °C por 1 minuto, con una fase de elongación final de 72 °C durante 10 minutos. Los amplicones se controlaron mediante electroforesis en gel de agarosa al 1 % antes de la purificación, usando el kit de purificación QIAquick pcr (Qiagen, Alemania). Los amplicones se secuenciaron en ambas direcciones, haciendo uso de la secuenciación de Sanger (gatc Biotech, Konstanz, Alemania). Las secuencias recortadas y alineadas con BioEdit Sequene Alignment Editor (Hall, 1999) se compararon con las accesiones de V. dahliae en GenBank utilizando la herramienta Nucleotide blast.
Prueba de patogenicidad
Para la realización de la prueba de patogenicidad, se desarrolló el inoculo de V. dalhiae a partir de un cultivo joven en medio pdao. Tres discos de medio colonizado con el hongo (6 mm de diámetro) fueron colocados en 100 mL de caldo papa con 2 % de dextrosa, e incubado en agitación a 110 rpm a temperatura ambiente (27 °C), durante una semana, para favorecer el desarrollo del hongo. Para remover el micelio formado y obtener la suspensión de esporas empleada como inoculo, el caldo fue filtrado a través de cuatro capas de gasa estéril, cuyo inoculo obtenido se ajustó a una concentración de 107 ufc/mL (Resende et al., 1995). Para la inoculación del patógeno se emplearon 40 plantas procedentes de semillas de T. cacao ICS-1 de tres meses de edad (Resende et al., 1994, 1995), crecidas en suelo estéril contenido en bolsas de polietileno negro. El suelo fue autoclavado a 121 °C y 15 lb/pulg2 durante dos días consecutivos, por 45 y 30 min (Ormeno-Orrillo & Dávila, 1999).
Dos métodos de inoculación fueron evaluados: a) vía Drench al suelo, se inoculo con 50 mL de la suspensión de conidias (107 ufc/mL) alrededor del cuello de la raíz de 20 plantas (Resende et al., 1995); b) punción en el tallo, con la ayuda de una aguja estéril se realizaron heridas en cuatro puntos en el tallo a una profundidad de 2 mm (dos sobre la yema de las hojas cotiledonales y dos sobre la yema de las primeras hojas verdaderas), y se inocularon 5 μL de suspensión de conidias en cada herida localizada de 20 plantas (Trapero, Diez, Rallo, Barranco, & López-Escudero, 2013).
Las plantas fueron mantenidas en el invernadero del Laboratorio de Fitopatología del ict, a temperatura de 28 °C ±} 0,57 °C, humedad relativa de 70 % ±} 5,71 % y condiciones de suelo a capacidad de campo (Resende et al., 1995).
Por otra parte, se evaluó la severidad de la enfermedad con una escala de 0 a 6 (Villarroel- Zeballos, Feng, Iglesias, du Toit, & Correll, 2012), en la que 0 = sin síntomas; 1 = entre 0 y 10 % de clorosis o necrosis en la planta; 2 = entre el 10 y el 25 % de clorosis o necrosis; 3 = entre el 25 y el 50 % de clorosis o necrosis; 4 = entre el 50 y el 75 % de clorosis o necrosis; 5 = entre el 75 y el 100 % de clorosis o necrosis, y 6 = planta muerta.
El reaislamiento del patógeno se realizó a partir de secciones (raíz y tallo) de tejidos de las plantas, en las que se lograron observar los síntomas de la enfermedad, siguiendo la misma metodología de aislamiento descrita con anterioridad.
Trichoderma endófito
Los aislamientos de Trichoderma endofito (TE) empleados en este estudio son parte de la colección del ict. Diez aislamientos de té (tabla 1), con capacidad endofítica (Arévalo et al., 2010b) y antagónica contra Moniliophthora perniciosa, M. roreri y Phytophthora palmivora (Arévalo et al., 2010a; León et al., 2010a, 2010b), fueron seleccionados para determinar la capacidad antagónica contra V. dahliae.
Antibiosis
Metabolitos inhibitorios solubles fueron producidos en tres caldos de cultivo y la prueba de antibiosis fue adaptada al método descrito por Bailey et al. (2008). Los aislamientos de Trichoderma fueron sembrados en placas Petri de 90 cm de diámetro, conteniendo medio de cultivo Extracto Malta Agar (ema) e incubados a 25 °C +} 0 °C durante cinco días.
A partir de estos cultivos se obtuvo una suspensión de conidias por adición de agua destilada estéril (ade) a cada placa. Para este ensayo, se utilizaron tres caldos de cultivo: 1) a base de mínimo en sales (min), 2) extracto de malta (cem) y 3) papa sacarosa (cps). Para cada caldo se adiciono 1 mL de suspensión de conidias (106 ufc/mL-) por cada 100 mL; fue incubada a 25 °C en agitación a 110 rpm durante una semana. Los micelios fueron filtrados a través de una capa de algodón estéril y lo obtenido fue centrifugado por 20 minutos a 2.500 rpm. El sobrenadante fue conservado a -20 °C hasta ser utilizado.
Antes de ser incorporado al medio, el filtrado centrifugado fue colocado en bano María a 90 °C +} 0 °C por dos horas para inactivar las enzimas; después, se agregó un volumen igual de medio PSA con agar solidificado (3 %) en las cajas Petri. Una rodaja de 4 mm de diámetro de medio con el patógeno desarrollado, de una colonia de cinco días de edad, fue colocada al centro de la caja Petri. Se registraron la inhibición del crecimiento micelial del patógeno cuando el testigo cubrió toda la caja (Osorio Hernández et al., 2016).
Micoparasitismo
Para esta prueba, se utilizó el método de placa precolonizada, descrito por Bailey et al. (2008). Un trozo de inoculo de 2,5 × 0,5 cm fue extraído de un cultivo joven de cada aislamiento de Trichoderma y localizado en un extremo de la placa, conteniendo medio papa dextrosa agar con oxitetraciclina (pdao) precolonizadas por V. dahliae. Tres placas fueron utilizadas como repeticiones. Las cajas Petri fueron incubadas a 25 °C en oscuridad. Dos semanas después se realizó el reaislamiento de los hongos. Un total de ocho muestras (discos de medio) de cada caja o replica fueron removidos con un sacabocado de 5 mm de diámetro, a partir del punto de donde se sembró el patógeno. Estas muestras fueron localizadas en cajas Petri con medio pdao e incubadas a 25 °C en oscuridad; a los 14 días, se observó el crecimiento de Trichoderma y el patógeno, y se determinó el porcentaje de colonización del biocontrol Trichoderma sobre discos de medio con el patógeno.
Análisis estadístico
Las pruebas de antibiosis y micoparasitismo fueron establecidas bajo un diseño experimental completamente al azar (dca). Diez tratamientos fueron evaluados y correspondieron a los aislamientos de Trichoderma endófitos seleccionados. Tres repeticiones por tratamientos fueron realizadas.
Los parámetros evaluados fueron el porcentaje de inhibición del crecimiento micelial y colonización por Trichoderma del micelio precolonizado por V. dahliae. Los datos expresados en porcentaje fueron transformados angularmente (arco seno √X), con cuya transformación se confirió la normalidad y homogeneidad de varianzas como lo recomendado por Montgomery (2008), y procesados en el software estadístico InfoStat, versión 2008 (Di Rienzo et al., 2008) para realizar el análisis de varianza (anova) y las pruebas de contraste de Duncan, con un nivel de significancia de 0,05 %.
Resultados y discusión
Síntomas in situ
En la figura 1, se presentan los diferentes síntomas de la muerte repentina en una plantación de T. cacao CCN-51 de dos años de edad, ubicada en el Sector Atusparia, Distrito y Provincia de Tocache, Perú. Inicialmente se observaron flacidez, epinastia, clorosis, necrosis de hojas superiores y, finalmente, marchitez de toda la planta. Al realizar un corte transversal de la rama superior, se identificaron puntos necróticos del sistema vascular y, en un corte longitudinal, estrías necróticas, mostrando ennegrecimiento de los vasos infectados en la madera. De igual manera, en el corte transversal de la raíz de plantas afectadas se detectaron anillos necróticos.

Figura 1. Síntomas de la muerte repentina del cacao en una plantación de T. cacao CCN-51 ubicado en el Sector Atusparia, Distrito y Provincia de Tocache, Perú. a. Amarillamiento, epinastia y marchitez; b. Decoloración del sistema vascular; c. Puntos necróticos en todo sistema vascular; d. Estrías necróticas en un corte longitudinal de la rama; e. Anillos necróticos en un corte transversal de la raíz.
Identificación morfológica y molecular de Verticillium
La coloración de la colonia en medio pdao fue de grisáceo a negruzco, debido a la formación de los microesclerocios (figura 2a). En el micelio inmerso al medio y ralo, con la ayuda de un estereoscopio, se observaron claramente las conidias inmersas en mucilago como pequeñas gotitas de agua. Estas características de la colonia corresponden a las observadas en el género Verticillium (Barnett & Hunter, 1998; Barrón, 1968).

Figura 2. Morfología macroscópica de colonia y microscópica de estructuras vegetativas y reproductivas de Verticillium dahliae Kleb. a. Colonia de 15 días de edad en medio pda; b. Conidias y fiálides verticiladas (40 X); c. Microesclerocios (40 X).
Los conidióforos son hialinos, erectos y llevan una masa de conidias apicalmente en cada fiálide verticilada en 2-3 porciones fértiles (figura 2b). Las conidias son hialinas, de pared lisa, elipsoidales, uniceluladas, no septados, y miden en promedio de 6,7 ±} 1,4 μm × 2,9 μm ±} 0,5 μm. En las figuras 2a y 2c, se observan los microesclerotes inmersos en el medio de cultivo pdao, regularmente distribuidos en toda la colonia, de coloración marrón negruzco en cadenas y agregados, redondeados y de pared celular delgada. Las características de morfología microscópica mencionadas ubican el patógeno como perteneciente a la especie de V. dalhiae (Inderbitzin et al., 2011; Watanabe, 2010).
El análisis de la secuencia blast revelo que el aislamiento de Verticillium presento un 100 % de homología con las secuencias de V. dahliae en GenBank (número de accesión ncbi: NR_126124.1 y HQ206718.1) y V. longisporum (HQ206832.1).
Patogenicidad
Con los dos métodos de inoculación se cumplieron los postulados de Koch y se confirmó que el agente causal de la muerte repentina de T. cacao fue la especie V. dahliae. Tanto el método vía Drench al suelo como la inoculación de punción en tallos utilizando suspensiones de conidios de V. dahliae fueron capaces de reproducir síntomas de marchitamiento en 28 plantas jóvenes de cacao inoculadas. Sin embargo, el periodo de incubación en las plantas inoculadas por el método vía Drench fue mayor, en el que los primeros síntomas de flacidez de hojas seguido de clorosis y necrosis del ápice de las hojas superiores se observaron en diez plantas (50 %) a los 30 días después de la inoculación (ddi) del patógeno (figura 3a); diez días después se percibieron los primeros síntomas de necrosamiento del área foliar de las hojas superiores (figura 3b) con una severidad de 55 % ±} 1,70. No obstante, con el método punción en tallos, los primeros síntomas se observaron a los 10 ddi (figura 3c) en 18 plantas (90 % ±} 2,37), mostrando síntomas iguales a los del método vía Drench. El avance de la enfermedad fue severo; cuatro días después de observar los primeros síntomas, se presentó epinastia, arrugamiento y necrosamiento de todas las hojas de la planta (figura 3d), y dos días después de esto algunas plantas murieron con una severidad de 80 % ±} 2,38 % (tabla 2).
Tabla 2. Incidencia y severidad de la muerte repentina del T. cacao por V. dahliae mediante dos métodos de inoculación, en la estación experimental Juan Bernito del ICT, distrito de La Banda de Shilcayo, Provincia y Región de San Martin, Perú, en 2010

Fuente: Elaboración propia
Nota: Datos promedio de 20 plantas para severidad por cada método de inoculación. Letras distintas indican diferencias significativas según Duncan (p ≤ 0,05).

Figura 3 Síntomas de patogenicidad con V. dahliae en plantas de T. cacao clon ICS-1. Método vía Drench al suelo. a. Marchitamiento; b. Necrosis causada mediante método de punción en el tallo; c. Clorosis; d. Marchitamiento; e. Planta sana; f. Tallo mostrando estrías necróticas; g y h. Puntos necróticos en el sistema vascular; i. Patógeno reaislado en medio pdao (en circulo amarillo).
En ambos métodos, se realizaron cortes longitudinales y transversales del tallo, y se identificó la presencia de estrías y puntos necróticos respectivamente en todo el sistema vascular (figuras 3f y g). El patógeno se reaislo en medio pdao a partir de secciones del tejido del tallo superior, de 10 y 18 plantas afectadas (figura 3i), que se inocularon con los métodos vía Drench y de punción, respectivamente, y de 12 plantas asintomáticas inoculadas. Se observo que las plantas que mostraron 80 % de severidad no fueron capaces de retomar el crecimiento a diferencia de algunas de las plantas que habían mostrado ligeros síntomas que si retomaron su crecimiento.
El presente estudio constituye el primer reporte de la presencia de la muerte repentina del cacao en el Perú, que corrobora mediante los postulados de Koch que V. dahliae es el agente causal de la enfermedad. De las 40 plantas inoculadas con el patógeno, 50 % y 90 % mostraron síntomas característicos de la enfermedad con el método vía Drench y de punción en tallos, respectivamente. Esta enfermedad causada por V. dalhiae fue reportada en 1965 en Uganda (Emechebe, Leakey, & Banage, 1971; Leakey, 1965), y en Brasil se ha convertido en un serio problema en los estados de Bahía y Espíritu Santo, en los que se produce el 85 % del cacao (Resende et al., 1995). Además, T. cacao, en norte-oriental de Brasil, puede ser considerado un hospedante favorito para Verticillium, porque todos los aislamientos brasileños de T. cacao fueron patogénicos y destructivos (Resende et al., 1994).
En este estudio, la infección de V. dahliae fue estudiada en plantas de cacao de tres meses de edad del genotipo ICS-1, con los métodos vía Drench y de punción en el tallo, cuyos primeros síntomas se observaron a los 30 días por vía Drench; por el contrario, Resende et al. (1994) reportaron los primeros síntomas a los 20 días y al termino de los 36 días el índice de enfermedad fue más alto, causando una marchitez en un número pequeño de plantas clon ICS-1. Probablemente esta diferencia de días se deba a las condiciones climáticas, temperatura de 28 °C ±} 0,57 °C y humedad relativa de 70 % ±} 5,71 %, que fueron distintas a las reportadas por Resende et al. (1994) a 25 °C ±} 2 °C y humedad relativa 60 % ±} 10 %. Sin embargo, el progreso de la enfermedad fue rápido y presentaron síntomas más severos en 90 % de plántulas inoculadas por punción, lo que concuerda con lo reportado por Resende et al. (1995), quienes emplearon el mismo método de inoculación, concentración de inoculo y plantas ICS-1, y los primeros síntomas se observaron a los 10 días, lo que probablemente muestra que el patógeno aislado de Perú tenga el mismo comportamiento que el de Brasil. Además, con el reaislamiento del patógeno se cumplieron los postulados de Koch y se indicó su distribución interna dentro de la planta.
De la misma forma, Trapero et al. (2013) señalan que la inoculación con inyección de tallos en plántulas jóvenes (40 días de edad) de olivo fue el método de inoculación más eficaz para comenzar el proceso de selección de genotipos de olivo resistentes al marchitamiento de Verticillium, constituyéndose en un método eficaz para ahorrar trabajo, espacio y recursos. Este método también fue utilizado para aislamientos de V. dahliae de cacao en Abelmoschus esculentus Medik y Gossypium hirsutum L. (Malvaceae), que indujo síntomas similares sobre plántulas de T. cacao inoculadas artificialmente (Emechebe et al., 1971).
Capacidad antagónica de Trichoderma endófitos hacia V. dahliae
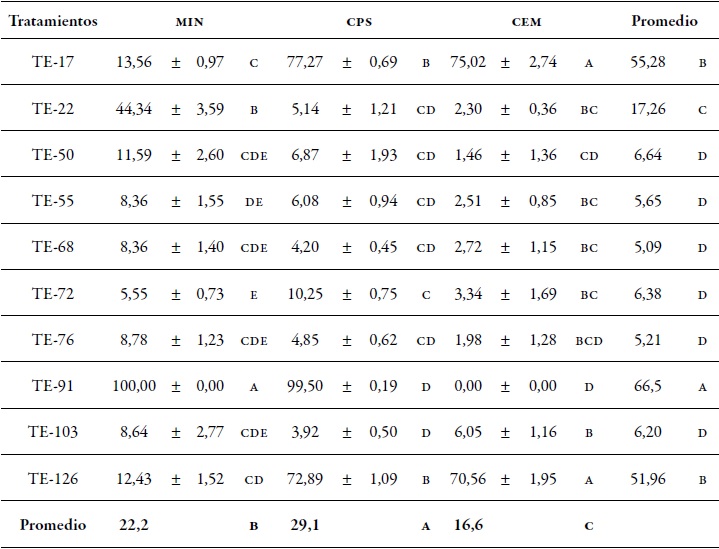
En la prueba de antibiosis, los aislamientos de Trichoderma endófitos de cacao fueron diferentes en su habilidad para impedir el crecimiento micelial de V. dahliae en medio psa con mezclas de metabolitos inhibitorios (tabla 3). Los metabolitos obtenidos en cps tuvieron mayor efecto en la inhibición micelial (29,1 %) de V. dahliae, seguido por min (22,2 %) en comparación con los metabolitos obtenidos en cem, que exhibieron el menor porcentaje (16,6 %).
Tabla 3. Efecto de metabolitos inhibitorios de aislamientos de Trichoderma endofito obtenidos en tres caldos de cultivo en el porcentaje de inhibición micelial de V. dahliae
Fuente: Elaboración propia
Nota: min: Caldo a base de sales minerales; cps: Caldo papa sacarosa; cem: Caldo extracto de malta. Promedios seguidos por letras distintas indican diferencias significativas entre tratamientos según la prueba (Duncan p ≤ 0,05). Valores a la derecha de la media indican el error estándar.
De acuerdo con los datos promedios de los medios de cultivos, los metabolitos de los aislamientos TE- 91, TE-17 y TE-126 impidieron el crecimiento del patógeno con un 66,5 %, 55,2 % y 51,9 %, respectivamente, en comparación con los demás aislamientos que inhibieron menos del 17,2 %. En la figura 4, se observa que los metabolitos obtenidos del aislamiento TE-91 en caldo min impidieron completamente el crecimiento micelial de V. dahliae, seguido de TE-17 con 77,2 % y 75,0 % en cps y cem, respectivamente; TE-126 con 72,8 % y 70,5 % en cps y cem, respectivamente, y TE-22 con 44,3 % en min. Los demás aislamientos tuvieron un bajo porcentaje de inhibición, menor a 13,5 %.
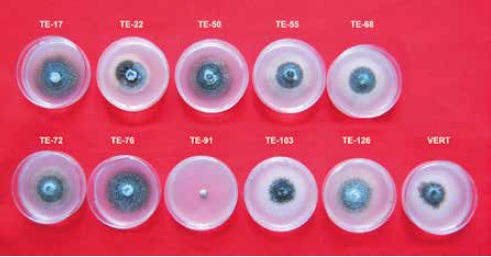
Figura 4. Inhibición del crecimiento micelial de V. dahliae con metabolitos inhibitorios solubles de Trichoderma endofito.
En la prueba de micoparasistismo, el anova mostro diferencias significativas entre los aislamientos de Trichoderma endofito (p = 0,05) en la colonización de V. dahliae (figura 5), siendo los aislamientos TE-91 y TE-126 los micoparasitos más agresivos de V. dahliae con 100 % de colonización sobre el patógeno, seguidos de TE-68, TE-72 y TE-76, con 80 %, 70 % y 87 % de colonización, respectivamente, en comparación con los aislamientos TE-17, TE- 22, TE-50 y TE-55, que colonizaron a V. dahliae en porcentajes menores a 30 %.

Figura 5. Inhibición del crecimiento micelial de V. dahliae con metabolitos inhibitorios solubles de Trichodermaendófito.
La antibiosis, la producción de compuestos antimicrobiales, el micoparasitismo y la alimentación de un hongo por otro organismo son algunos de los mecanismos de las especies de Trichoderma que brindan protección a las plantas contra sus patógenos (Junaid et al., 2013; Martínez, Infante, & Reyes, 2013). La colonización y la producción de metabolitos inhibitorios solubles de aislamientos de Trichoderma endofito obtenidos de diferentes caldos variaron en su habilidad para micoparasitar e inhibir el crecimiento micelial de V. dahliae en medio psa, respectivamente, lo que concuerda con lo reportado por Bailey et al. (2008), cuyos aislamientos de Trichoderma variaron en gran medida en su capacidad para producir compuestos inhibidores de M. roreri y en sus capacidades para parasitarlo. En este estudio, Trichoderma asperellum (TE-91) resulto ser el micoparasito más agresivo que colonizo e inhibió completamente el crecimiento micelial del patógeno. Probablemente se deba a una acción combinada entre metabolitos secundarios como terpenoides, que libera esta especie de Trichoderma hacia el patógeno, inhibiendo la germinación, y las interacciones sinérgicas de enzimas hidrolíticas como quitinasas, glucanasas y proteasas que degradan la pared celular del patógeno hasta ocasionar su muerte (Lorito, Farkas, Rebuffat, Bodo, & Kubicek, 1996; Sivasithamparam & Ghisalberti, 1998; Zeilinger, Gruber, Bansal, & Mukherjee, 2016). Asimismo, aislamientos de especies de Trichoderma han sido reportados como biocontroladores de V. dalhiae (Carrero-Carrón et al., 2016; Gao, Jun, Pan, Wu, & Zhang, 2007; Jabnoun-Khiareddine, Daami-Remadi, Ayed, & El Mahjoub, 2009; Meng, Tang, Huang, Ye, & Kan, 2007) y Phytophthora megacarya (Mbarga et al., 2014).
Además, los caldos de cultivo tienen influencia en la producción de metabolitos inhibitorios como péptidos no ribosómicos (peptaibioticos, sideróforos y dicetopiperazinas), como la gliotoxina y la gliovirina, los policetidos, terpenos, pironas y metabolitos de isociano, que varían con la especie de hongo y condiciones ambientales (Zeilinger et al., 2016). Los metabolitos de los aislamientos TE-17, TE-91 y TE-126 obtenidos en caldo papa sacarosa fueron los que más inhibieron el crecimiento micelial de V. dahliae y pertenecen a las especies de T. brevicompactum, T. asperellum y T. atroviride, respectivamente. Al mismo tiempo, el TE-126 resulto también ser un micoparasito muy agresivo, a tal punto que no pudo ser recuperado el patógeno. Trichoderma atroviride, reportado como un micoparasito, responde a un numero de estímulos externos, produce enzimas hidrolíticas en presencia de un hospedante fungal y se enrolla alrededor de la hifa del hospedante (Harman, 2006). De la misma forma, Degenkolb, Grafenhan, Nirenberg, Gams y Bruckner (2006) analizaron la formación de antibióticos polipéptidos a partir de cuatro aislamientos de T. brevicompactum, seleccionados por su potencial antagonista contra la muerte regresiva. Los aislamientos TE-50, TE- 55, TE-68 y TE-76, pertenecientes a la especie T. harzianum, fueron los que menor inhibieron el crecimiento micelial del patógeno en la prueba de antibiosis; sin embargo, TE-68 y TE-76 resultaron ser micoparasitos agresivos. Bailey et al. (2008) indican que aislamientos de T. harzianum tienden a tener de moderada a baja actividad de antibiosis, y de moderada a alta actividad de micoparasitismo. Esto probablemente se debe a la formación paralela de enzimas hidrolíticas, junto con un grupo de antibióticos polipéptidos que activan la membrana, llamados peptabióticos, cuya acción sinérgica induce un papel importante en micoparasitismo entre T. harzianum y su hospedante fungal (Lorito et al., 1996; Schirmbock et al., 1994).
La selección de las cepas de Trichoderma con buena capacidad endofítica, además de otros atributos tales como micoparisitismo, antibiosis o resistencia inducida, puede mejorar en gran medida las posibilidades de desarrollar estrategias de control biológico de las enfermedades del cacao (Bailey et al., 2008).
Conclusiones
Se reporta por primera vez en el Perú la presencia de la especie V. dahliae, produciendo la muerte repentina o súbita del cacao. Metabolitos extraídos de los aislamientos de Trichoderma endofito en caldo cps tuvieron mayor efecto en la inhibición micelial de V. dahliae. El aislamiento TE-91 en min y cps presentaron muy buena capacidad de biocontrol in vitro por su habilidad para inhibir completamente el crecimiento micelial de V. dahliae, seguido de TE-17 y TE-126 obtenidos en cps y cem, respectivamente. Asimismo, los aislamientos TE-91 y TE-126 fueron los micoparasitos más agresivos para la especie V. dahliae. Estos resultados indican que el uso de Trichoderma podría ser una alternativa biológica a considerar en el manejo integrado de la enfermedad.











 text in
text in 




