Introducción
La papa Solanum tuberosum L. (Solanaceae) es un tubérculo cultivado a nivel mundial con una taza de producción que alcanza los 325 millones de toneladas, siendo el quinto cultivo alimenticio más importante del mundo después de la caña de azúcar Saccharum officinarum L., el arroz Oryza sativa L., el maíz Zea mays L. y el trigo Triticum aestivum L. (Poaceae) en términos de área cultivada y producción total (Corzo & Quiñones, 2017; Douches et al., 1996). La variabilidad de las plantas nativas y su adaptabilidad a diferentes condiciones permitió que las papas se cultivaran en climas diversos, lo que generó que el cultivo se distribuyera en todos los continentes (Flores-Magdaleno et al., 2014; Ojeda-Bustamante et al., 2004).
Diferentes enfermedades bacterianas han sido reportadas por atacar este cultivo, contribuyendo sustancialmente a que se generen pérdidas económicas para los productores (Potrykus et al., 2014). Entre las enfermedades que se destacan se encuentra la pudrición marrón causada por Ralstonia solanacearum (Smith), la necrosis bacteriana causada por Clavibacter michiganensis subsp. sepedonicus (Spieckermann & Kotthoff), la costra de la patata causada por Streptomyces scabies (Lambert & Loria) y la pudrición blanda, cuyo agente causal es Pectobacterium carotovorum (Jones) (Al-Zomor et al., 2013).
P. carotovorum es uno de los patógenos más importantes de la papa, porque genera grandes pérdidas económicas que han sido estimadas entre 50 y 100 millones de dólares anuales a nivel mundial (Al-Zomor et al., 2013; Franco & Stefanova, 2008). Esta enfermedad es reconocida como la más severa que ataca al tubérculo a nivel poscosecha específicamente durante el almacenamiento (Toth et al., 2003).
Los tubérculos-semillas son la principal fuente de distribución del inóculo y, dado que no existe un mecanismo químico de control efectivo contra el patógeno, los métodos de prevención de la enfermedad se limitan a medidas sanitarias y al uso de semillas certificadas libres del patógeno (Diallo et al., 2009). Para certificar dichas semillas libres del patógeno, se requieren técnicas de detección, en donde los métodos moleculares, como la reacción en cadena de la polimerasa (PCR), y los inmunológicos son los preferidos por ser los más rápidos y precisos (Abu-Obeid et al., 2018; Perombelon, 2002).
El objetivo de esta revisión fue explorar la biología del patógeno y los métodos existentes para la detección de dicho agente, así como realizar la descripción del quorum sensing como mecanismo de la regulación de la expresión génica de sus factores de virulencia, los mecanismos de acción del patógeno, el proceso infectivo y los métodos actuales de control.
Materiales y métodos
Se realizó una revisión bibliográfica retrospectiva en bases de datos en sistemas como National Center for Biotechnology Information (NCBI), Scielo y ScienceDirect, con la utilización de descriptores validados como “papa”, “Pectobacterium carotovorum”, “quorum sensing”, “control biológico” y “antagonistas”. En la revisión se identificaron las características morfológicas y aspectos taxonómicos de esta especie. Además, la recopilación de información se centró en los estudios realizados que describen el proceso infectivo, mecanismo de acción, técnicas de diagnóstico y mecanismos de control, como un lineamiento base y de fortalecimiento para las futuras investigaciones.
Características morfológicas y aspectos taxonómicos de Pectobacterium carotovorum
P. carotovorum (Bacteria: Enterobacterales: Pectobacteriaceae) es una bacteria pectinolítica gramnegativa, en forma de bacilo, que mide de 0,7 a 1,0 μm de ancho y de 1 a 2,5 μm de largo; no esporulada, motil y con flagelos perítricos; sus colonias muestran elevación convexa y son de color blanco cremoso; las células pueden aparecer de manera individual o en parejas (Czajkowski et al., 2011).
Dado que es una bacteria gramnegativa, su pared celular cuenta con una capa externa de lipopolisacárido (LPS) que contiene, dentro del polisacárido O, azúcares como la ramnosa, fucosa, glucosa y metilramnosa; no obstante, se ha encontrado que la composición química de este polisacárido O puede variar y ser específica para cada serogrupo (Senchenkova et al., 2003) y, por esa razón, la capa LPS es un determinante utilizado en la serotipificación de P. carotovorum (De Boer et al., 1986; Evans et al., 2010).
Por otro lado, se conoce que algunas estructuras celulares están involucradas en etapas tempranas de la infección y que contribuyen a su virulencia. Estas incluyen el pili, el flagelo, las capas de exopolisacáridos y las porinas, que son proteínas de canal que permiten la difusión pasiva de moléculas a través de la membrana (Berne et al., 2015; Hamel et al., 2001). También ha sido reconocido recientemente que una mutación en el gen requerido para la síntesis de LPS puede afectar igualmente la virulencia de esa bacteria (Fukuoka et al., 2001).
P. carotovorum subsp. carotovorum se conocía previamente como Erwinia carotovora subsp. carotovora, bacteria que pertenece a las γ-proteobacterias y a la familia Enterobacteriaceae (Czajkowski et al., 2011; Potrykus et al., 2014). En la tabla 1 se puede observar la clasificación taxonómica completa de dicha bacteria fitopatógena.
Tabla 1. Clasificación taxonómica de Pectobacterium carotovorum

Fuente: Adaptada de Hauben & Swings (2015)
Actualmente, el género Pectobacterium se divide en seis especies y subespecies, a saber: P. carotovorum subsp. atrosepticum (van Hall), P. betavasculorum (Gardan, Gouy, Christen, & Samson), P. carotovorum subsp. brasiliensis (Duarte, De Boer, Ward, & De Oliveira), P. carotovorum subsp. carotovorum (Jones), P. carotovorum subsp. odoriferum (Gallois, Samsung, Ageron, & Grimont) y P. wasabiae (Gardan, Gouy, Christen, & Samson) (Czerwicka et al., 2011; Duarte et al., 2004; Lee et al., 2017).
Las especies caracterizadas como fitopatógenas incluyen P. carotovorum subsp. atrosepticum (van Hall), P. carotovorum subsp. carotovorum (Jones) y P. chrysanthemi (Burkholder). Estas afectan los órganos de almacenamiento y las hojas de especies vegetales como la papa S. tuberosum (Aysan et al., 2003). Aunque las bacterias de esos tres taxones pueden causar pudrición blanda en plantas, su rango de hospedero y su temperatura óptima de crecimiento es distinta: P. carotovorumsubsp. atroseptica infecta principalmente plantas de papa y tubérculos a una temperatura óptima de 20 °C, mientras que P. carotovorum subsp. carotovora y P. chrysanthemi tienen un amplio rango de hospedero y causan la enfermedad a temperaturas más elevadas en el rango de los 20 °C y los 35 °C (Diallo et al., 2009). P. carotovorumsubsp. brasiliensis es una especie altamente virulenta, responsable de la mayoría de las incidencias de la enfermedad del pie negro en Brasil y Sudáfrica (Duarte et al., 2004; Van der Merwe et al., 2010).
Métodos para la identificación de Pectobacterium carotovorum
Los métodos de identificación de P. carotovorum se dividen en dos grupos: los métodos clásicos y los moleculares (Dadaşoğlu & Kotan, 2017). Los primeros se basan en la caracterización de rasgos fenotípicos a nivel morfológico, bioquímico, fisiológico y patológico (Dadaşoğlu & Kotan, 2017). Estos se llevan a cabo en paralelo con otros métodos para identificar y caracterizar el grupo como las reacciones serológicas (Costa et al., 2006). En relación con los métodos moleculares, se han usado técnicas basadas en el ADN de los microorganismos con las que, empleando múltiples marcadores genéticos, es posible la identificación de P. carotovorum (Dadaşoğlu & Kotan, 2017; Zanoli & Spoto, 2013; Zhang & Tanner, 2017).
Métodos clásicos
Para el aislamiento tradicional de la bacteria, se utiliza el medio de cultivo selectivo Cristal Violeta Pectato (CVP), en donde se puede evidenciar la habilidad de degradar pectato por parte del aislamiento, generando el crecimiento de colonias incoloras que son características de P. carotovorum (Al-Zomor et al., 2013; Scala et al., 2018). Se conoce que el aislamiento del agente causal de la pudrición blanda utilizando dicho medio de cultivo puede ser seriamente afectado por la presencia de gran cantidad de bacterias saprofíticas en una misma muestra (Fraijee et al., 1997; Jones & Darrah, 1994).
Adicionalmente, se puede hacer el aislamiento en el medio de Steward modificado, o en el Caldo de Soja con Tripticasa (TSBA), Agar Nutritivo (NA) y Agar de Carbonato de Dextrosa de Levadura (YDC) (Dadaşoğlu & Kotan, 2017). La incubación a diferentes temperaturas permite la detección y diferenciación de las especies; sin embargo, este procedimiento no es adecuado para los análisis de rutina de tubérculos de papa, y se ha observado que no todas las cepas de Pectobacterium pueden ser distinguidas por este método (Gorris et al., 1994).
Diversas pruebas bioquímicas y el perfil de ácidos grasos han sido utilizados para diferenciar las tres subespecies de Pectobacterium, pero su uso ha sido restringido por la necesidad de contar con cultivos puros (Perombelon, 2002). En la tabla 2 se pueden observar los resultados esperados de las pruebas bioquímicas para la detección de la bacteria P. carotovorum (Al-Zomor et al., 2013; Bhat et al., 2012; Costa et al., 2006; Perombelon, 2002).
Tabla 2. Resultados de las pruebas bioquímicas utilizadas para la detección de P. carotovorum

Fuente: Elaboración propia con base en Al-Zomor et al. (2013), Bhat et al. (2012) y Costa et al. (2006)
Las cepas que muestran las características del género Pectobacterium pueden ser identificadas a nivel de especie o al nivel de subespecie, con base en pruebas adicionales como las que se listan en la tabla 3.
Tabla 3. Pruebas bioquímicas complementarias para la identificación de Pectobacterium carotovorum

Fuente: Adaptada de Czajkowski et al. (2015)
Los métodos inmunológicos han mostrado resultados inespecíficos para detectar bajas concentraciones bacterianas; asimismo, pueden reaccionar con otras subespecies o con microflora epífita de los tubérculos generando falsos positivos. Además, dichos métodos consumen tiempo y son relativamente costosos (Al- Zomor et al., 2013; Fraijee et al., 1997; Gorris et al., 1994).
Métodos moleculares
Un método diagnóstico rápido para la detección e identificación de P. carotovorum es la reacción en cadena de la polimerasa (PCR), técnica caracterizada por ser rápida, específica y altamente sensible (Abu-Obeid et al., 2018; De Boer & Ward, 1995; Fraijee et al., 1997; Perombelon et al., 1995). Para esta metodología y sus variantes, tales como PCR anidada, PCR múltiple y PCR en tiempo real, se han seleccionado algunos marcadores moleculares para identificación y caracterización de Pectobacterium sp. como los ITS 16S- 23rRN y 16S rDNA (Abu-Obeid et al., 2018; Diallo et al., 2009; Nikitin et al., 2018; Potrykus et al., 2014). En la tabla 4 se pueden observar algunos primers empleados para la amplificación del gen 16 r DNA de P. carotovorum.
Adicionalmente, se han desarrollado técnicas alternativas que emplean metodologías y equipos que permiten la identificación de P. carotovorum, entre las que se encuentra la amplificación isotérmica basada en la microfluídica, una técnica que estudia el comportamiento de los fluidos a través de microcanales y se caracteriza por usar una temperatura estable, reducir el volumen de la muestra, el tiempo de análisis y los costos del procedimiento (Zanoli & Spoto, 2013; Zhang & Tanner, 2017). Estas metodologías pueden emplear helicasas y polimerasas para la amplificación de ácidos nucleicos (Vincent et al., 2004). Finalmente, la técnica de MALDI-TOF ha sido implementada exitosamente para la identificación rutinaria de microorganismos en los laboratorios de microbiología, debido a que es un método rápido, preciso y de alto rendimiento (Maldonado et al., 2018), siendo principalmente empleado para la identificación específica de especies de Dickeya dianthicola (Hellmers), D. dadantii (Samson), D. dieffenbachiae (Samson), D. chrysanthemi(Burkholder), D. zeae (Samson), D. paradisiaca (Fernandez-Borrero & Lopez- Duque), D. solani (Van der Wolf), P. carotovorum. P. atrosepticum (Šalplachta et al., 2015). En la tabla 5 se muestra una comparación de los métodos moleculares empleados para identificar Pectobacterium sp. y P. carotovorum subsp. carotovorum.
Biosensores para la detección de Pectobacterium carotovorum
Las técnicas convencionales empleadas para detectar patógenos en plantas demandan mucho tiempo y requieren instrumentos complejos para su implementación; en consecuencia, existe un gran interés por comercializar sistemas de biosensores que muestran alta sensibilidad y especificidad para la detección temprana de agentes fitopatógenos (Kather et al., 2017).
La detección temprana de patógenos vegetales es esencial para poder contrarrestar y manejar adecuadamente enfermedades a nivel de invernadero y de campo, así como minimizar el riesgo de diseminación de estas (Miller et al., 2009). Los biosensores son una herramienta innovadora para la identificación de fitopatógenos, debido a que pueden detectarlos a nivel del aire, agua, semillas y en otras etapas durante el ciclo productivo del cultivo (Fang & Ramasamy, 2015).
Los biosensores son dispositivos analíticos que combinan el reconocimiento biológico de un ligando con una señal física o química que es transformada en una señal digital, que luego se interpreta en sistemas computarizados (Byrne et al., 2009). Con estos dispositivos se puede analizar diversos tipos de muestras, incluidas muestras biológicas, y son capaces de detectar la presencia de hasta una sola célula de interés según el elemento de biorreconocimiento seleccionado (Hellinga et al., 2013).
Su fundamento se basa en el reconocimiento de células completas o macromoléculas tales como anticuerpos, enzimas, fragmentos de ADN, entre otros (Hellinga et al., 2013; Khater et al., 2017). Los sensores se clasifican de acuerdo con el tipo de señal que emiten, que puede ser de tipo eléctrico, químico, electroquímico, óptico, magnético y vibratorio (Fang & Ramasamy, 2015).
Los biosensores basados en anticuerpos permiten un análisis cualitativo y cuantitativo de los patógenos; sin embargo, el desarrollo de anticuerpos frente a agentes fitopatógenos no es usual. Por otro lado, los biosensores basados en ADN presentan mejor sensibilidad gracias al uso de técnicas de amplificación de ácidos nucleicos, que permiten detectar el contenido genético de los patógenos antes de la aparición de los síntomas de la enfermedad a nivel de los cultivos (Khater et al., 2017).
Después de realizar la revisión bibliográfica correspondiente, se encuentra que para P. carotovorum no se han desarrollado biosensores. Solo se tiene una referencia hacia el 2015 en donde se desarrolló un dispositivo portátil que incluye tres sensores cerámicos para la detección temprana de la pudrición blanda causada por P. carotovorum en tubérculos almacenados. Los sensores funcionan al generar cambios en la resistencia eléctrica frente a compuestos orgánicos volátiles (VOC), involucrados en el desarrollo de la enfermedad, y puede detectar un tubérculo infectado en 100 kg de estos (De Lacy Costello et al., 2000).
Quorum sensing en Pectobacterium carotovorum
El quorum sensing (QS) es un sistema de comunicación celular dependiente de la densidad de los microorganismos presentes en el medio, que activa o inhibe la expresión génica de acuerdo con la secreción y acumulación de moléculas de señalización química, denominadas N-acil homoserina lactonas (AHL) (Czajkowski et al., 2011; Henke & Bassler, 2004; Matsumoto et al., 2003; Põllumaa et al., 2012; Whitehead et al., 2002).
Las AHL fueron descritas inicialmente en Vibrio fischeri (Beijerinck), estimulando la producción de bioluminiscencia. Además, en Pseudomonas aeruginosa (Schroeter) se ha descrito que regulan la interacción entre especies, así como el medio que la rodea (Abisado et al., 2018; Gurney et al., 2018; McCready et al., 2019; Visick & McFall-Ngai, 2000). Adicionalmente, en Escherichia coli (Escherich) y en Vibrio cholerae (Pacini) regulan la formación de biofilms, importante en la patogénesis de la enfermedad (Culler et al., 2018; Jemielita et al., 2018; Ng et al., 2019).
En P. carotovorum el QS modula diversos procesos biológicos, como el control de la virulencia, al regular la producción de enzimas degradadoras de pared celular de las plantas, así como la producción de antibióticos, entre los que se encuentra el carbapenem (Burr et al., 2006; Byers et al., 2002; Corbett et al., 2005; Pemberton et al., 2005).
Las cepas de P. carotovorum se clasifican en clase I y II, de acuerdo con las características de las AHL, debido a que las primeras sintetizan 3-oxo-C8-AHL y las segundas 3-oxo-C6-AHL (Watson et al., 2002). En las dos clases, la producción de las AHL es función del gen LuxI (ExpT) y el reconocimiento de los autoinductores es realizado por el regulador transcripcional, sensible a la densidad celular, denominado LuxR (ExpR/VirR) (Burr et al., 2006; Põllumaa et al., 2012).
Para llevar a cabo el proceso infectivo en P. carotovorum, la bacteria requiere una densidad celular aproximada de 107 a 108 células/g de tejido a nivel del tubérculo (Põllumaa et al., 2012). Adicionalmente, durante el proceso de infección al hospedero son activados diversos genes reguladores, entre los que se encuentra el hrpN, que activa el gen que codifica para la proteína inductora de necrosis Nip (Burr et al., 2006; Mattinen et al., 2004; Smadja et al., 2004), así como genes que codifican proteínas y enzimas que permiten la lisis de pared y entrada de la bacteria a la célula vegetal, como el gen PrtA, B y C, la flagelina (FliC) y la proteína de virulencia (AvrL) (Kazemi-Pour et al., 2004; Laatu & Condemine, 2003).
La función de resistencia intrínseca a antibióticos es regulada en P. carotovorum por un gen homólogo de LuxR, denominado CarR, que censa la población bacteriana que sintetiza el antibiótico; por otra parte, la producción de metabolitos secundarios es regulada por RmsA, incrementando la producción de enzimas degradadoras de pared celular de la planta (Burr et al., 2006). Adicionalmente, se ha propuesto la hipótesis de la existencia de procesos de cooperación interespecies mediados por QS, que se relacionan con la producción de compuestos que degradan los tejidos de la planta hospedera (Valente et al., 2017).
Proceso infectivo y mecanismo de acción de P. carotovorum
El patógeno inicialmente interactúa con el huésped mediante la secreción de una serie de proteínas efectoras, utilizando el sistema de secreción tipo III (TTSS). Estos efectores y otras proteínas externas no se comportan como virulentos; es decir, se camuflan para estimular en la planta la respuesta de hipersensibilidad (HR) (Khosro et al., 2012).
Una vez que se da la interacción, se despliega el sistema de regulación génica QS y se liberan los factores de virulencia de la bacteria, que incluyen enzimas extracelulares como las pectinasas, que tienen la capacidad de disolver la lámina media que actúa como agente cementante entre paredes celulares de células adyacentes y juegan un rol fundamental en el desarrollo de la pudrición blanda. En este tipo de infecciones, la acción patogénica está provocada por la difusión de enzimas con el avance de bacterias, que pueden prosperar como saprofitos sobre la laminilla media hidrolizada (Bhat et al., 2012; Doolotkeldieva et al., 2016). En la tabla 6 se listan algunas enzimas involucradas en el desarrollo de la enfermedad, aunque también son relevantes otras enzimas como las fosfoglucomutasas (PGM) y las PG o glucosidasas (Matsumoto et al., 2003).
Tabla 6. Enzimas involucradas en la degradación de la pared celular, maceración de tejido y disminución de los mecanismos de defensa de la planta en la enfermedad de la pudrición blanda

Fuente: adaptada de Matsumoto et al. (2003)
El desarrollo de la enfermedad inicia a partir de áreas infectadas previas como restos de cosecha o tubérculos infectados. La bacteria puede sobrevivir en el suelo de dos semanas a seis meses, dependiendo de condiciones ambientales como la humedad, el pH y la temperatura; este último factor puede determinar qué tipo de organismo predomina en una lesión (figura 1). La bacteria se encuentra en estado latente y, bajo condiciones ambientales apropiadas, inicia su multiplicación hasta que alcanza una densidad celular crítica, entre 107 y 108 células/g de tejido que es el umbral para que se active el sistema de regulación de la expresión génica QS (Smadja et al., 2004). En una segunda fase cuando la bacteria despliega los factores de virulencia se produce la degradación o maceración del tubérculo que adquirirá una consistencia cremosa tornándose de color negro en presencia de aire (Czajkowski et al., 2011; Perombelon, 2002; Scott et al., 1996).

Figura 1. Desarrollo de la enfermedad de la pudrición blanda del tubérculo de papa. Fuente: adaptada de Franco y Stefanova (2008), Khosro et al. (2012), Phokum et al. (2006), y Smith y Bartz (1990)
La bacteria también puede afectar tallos y peciolos. Cabe aclarar que P. carotovora subsp. carotovora es la subespecie más comúnmente encontrada en la superficie de las plantas (Doolotkeldieva et al., 2016; Fucikovsky & Villarreal, 1991; Perombelon, 2002).
La infección a nivel del tallo puede ocurrir en cualquier momento después de la multiplicación del patógeno en el tubérculo madre podrido, a través del sistema vascular. Una vez en el tallo, la bacteria puede permanecer en dormancia o causar una infección y, si las condiciones son favorables, se produce el pie negro; una vez que el tubérculo madre se pudre, las bacterias son liberadas en el suelo y llevadas por el agua hasta los tubérculos hijos o tubérculos de una planta cercana aparentemente sana, propagando la enfermedad (Acuña & Araya, 2017).
P. carotovorum subsp. carotovorum produce una o más sustancias antibacterianas llamadas bacteriocinas, que mejoran su competitividad con otras especies rivales relacionadas a la hora de propagarse en el tejido vegetal. La capacidad de esta especie bacteriana para producir bacteriocina ha sido explotada en muchos programas de control biológico para la enfermedad de podredumbre blanda (Khosro et al., 2012).
Mecanismos de control convencionales frente a P. carotovorum
Las estrategias de control químico se basan en la erradicación del patógeno o en la creación de un ambiente desfavorable para el desarrollo de la enfermedad. La utilización de compuestos químicos genera problemas de contaminación ambiental y efectos secundarios para los seres humanos expuestos a estas sustancias, tales como intoxicaciones y enfermedades a nivel cutáneo y respiratorio (Czajkowski et al., 2011; Del Puerto et al., 2014; Doolotkeldieva et al., 2016; Miles et al., 2012; Montesinos, 2003).
La mayoría de los compuestos químicos utilizados contiene antibióticos, sales orgánicas e inorgánicas que inhiben el crecimiento del patógeno in vitro. Este efecto se atribuye a la presencia de cationes que pueden inhibir la función de ciertas proteínas de membrana o por la modulación del pH del ambiente (Czajkowski et al., 2011; Mills et al., 2006). Dentro de los antibióticos que más se utilizan se encuentra la estreptomicina, que ha sido considerada promisoria para el control de P. carotovorum en la papa; el procedimiento consiste en hacer una inmersión de los tubérculos en una mezcla que contiene estreptomicina, hipoclorito de oxitetraciclina y mercurio. Esto se debe realizar antes de la siembra y lo que se logra es la reducción de la incidencia de la enfermedad (Czajkowski et al., 2011; Mills et al., 2006).
El uso de pesticidas en Colombia es un problema ambiental importante, dadas las prácticas agrícolas caracterizadas por un uso excesivo y deliberado de estos que, si bien traen ventajas a los productores, también pueden generar efectos deletéreos a nivel ambiental y ecosistémico, ya que simultáneamente a la eliminación de agentes patógenos se pueden afectar microorganismos benéficos para los cultivos que podrían actuar como biofertilizantes o biopesticidas. Para el 2005, el uso total de agroquímicos en Colombia alcanzó 68.000 toneladas, y para el 2010 se calculó una aplicación de 27 millones de toneladas de productos sintéticos a diversos cultivos de interés agronómico en el país (Miles et al., 2012). De acuerdo con el Instituto Colombiano Agropecuario (ICA, 2020), en el 2015 el país logró una producción de 50,9 millones de litros y 24,5 millones de kilos de plaguicidas; para el 2016, la producción de agroquímicos fue de 1.400 millones. Con respecto al 2015, hubo un incremento del 6,9% y, de acuerdo con las estadísticas de ventas, los productos más utilizados son insecticidas y fungicidas químicos. Con base en estas cifras, Colombia es el país de la región con el mayor consumo de fertilizantes por hectárea (Procolombia, 2020; Vega, 2018). En la tabla 7 se describen algunos ingredientes activos que han sido cancelados para su comercialización en Colombia por el ICA (2020). Este tipo de control químico no ha sido efectivo contra este agente fitopatógeno, por lo que se hace necesario buscar nuevas alternativas como el empleo de microorganismos antagonistas naturales (Doolotkeldieva et al., 2016).
Control biológico y posibles agentes antagónicos microbianos frente a P. carotovorum
El control biológico es un método efectivo e innovador para el control de patologías vegetales, que consiste en la utilización de microorganismos vivos o productos abióticos que proveen protección frente a la enfermedad a través de diversos mecanismos, como la producción de antibióticos u otras moléculas deletéreas para el patógeno, a través de fenómenos de competencia por nutrientes o espacio, al inducir la resistencia sistémica en plantas (Doolotkeldieva et al., 2016).
Los microorganismos evaluados para el control biológico en contra de P. carotovorum incluyen rizobacterias promotoras de crecimiento vegetal, Pseudomonas fluorescentes (Migula), bacterias endófitas y Bacillus subtilis (Ehrenberg). Esta última bacteria ha sido la antagonista más efectiva en función de reducir la pudrición blanda en tubérculos de papa, debido a su notable capacidad para sobrevivir en condiciones adversas gracias al desarrollo de endosporas y la producción de compuestos antimicrobianos como lipopéptidos, antibióticos y bacteriocinas que son beneficiosos para las plantas, a través de la inducción de la activación de respuestas de defensa del huésped (Abd El-Khair & Haggag, 2007; Gerayeli & Baghaee, 2018). En la tabla 8 se listan algunos microorganismos antagonistas reportados frente a P. carotovorum.
Tabla 8. Microorganismos antagonistas reportados frente a Pectobacterium sp
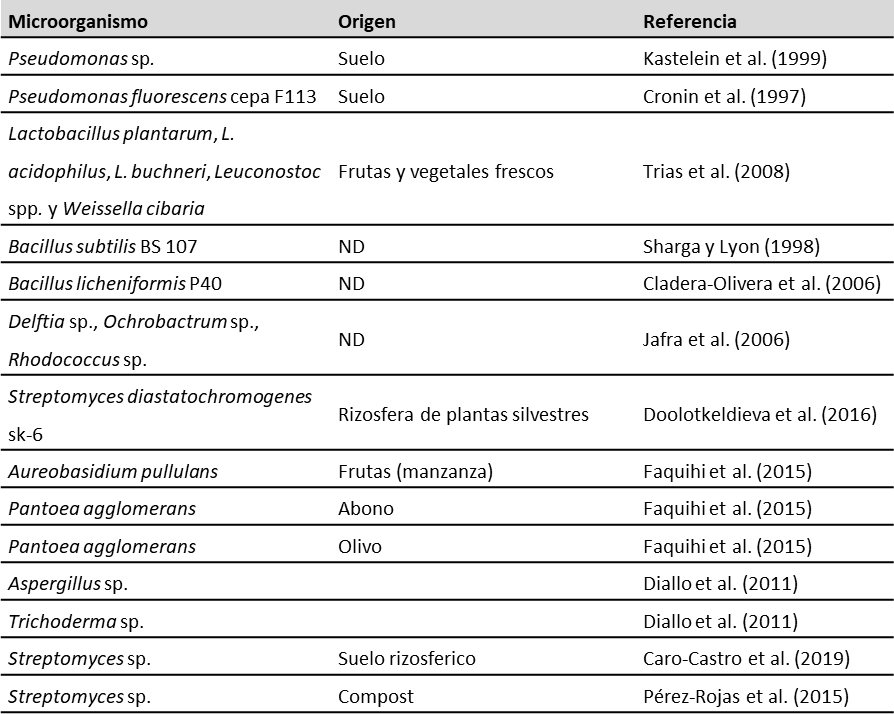
Fuente: Elaboración propia
También se encuentran los endófitos, que colonizan discretamente los tejidos de las plantas sanas durante todo su ciclo de vida, y cuya función es proteger la planta contra diversos patógenos (Siegel, 1987). Esta protección se ha atribuido a su capacidad para producir metabolitos secundarios con actividad biocida (Strobel et al., 2004).
Las estrategias de control biológico también comprenden el uso de antagonistas que pueden afectar las poblaciones de patógenos directamente por vía antibiosis, competición por nutrientes o por la inducción de resistencia sistémica en plantas (Czajkowski et al., 2011). Debido a la producción de peróxido de hidrógeno, la actividad de las bacterias acidolácticas contra P. carotovorumsubsp. carotovorum (Pcc) ha sido reportado como una alternativa satisfactoria; también se ha demostrado que la detección de las bacterias de la rizosfera es un método de control exitoso gracias a su capacidad para degradar las moléculas de Pcc N-acil homoserina lactona implicadas en el QS (Gerayeli & Baghaee, 2018).
Discusión
La papa (Solanum tuberosum) es un tubérculo que presenta una alta tasa de variabilidad y adaptabilidad para su producción en todos los continentes (Rodríguez, 2010). También es considerado un alimento versátil que representa un suministro alimentario nutricionalmente apropiado por su contenido de micronutrientes y vitaminas, contribuyendo a garantizar la seguridad alimentaria de los pueblos (Borba, 2008; Devaux et al., 2011). Entre los principales productores de papa se encuentran los países en vía de desarrollo, que han implementado nuevas estrategias de comercialización de este producto, asociadas a las modificaciones de consumo como la de tubérculos frescos o de productos elaborados como congelados, harinas y almidón, que también han contribuido en su comercialización (Borba, 2008).
Debido al aumento de la tasa poblacional a nivel mundial, es una necesidad apremiante mantener y garantizar la seguridad alimentaria. Una de las posibles causas que pone en peligro tal seguridad es la presencia de agentes fitopatógenos que atacan cultivos de interés agronómico en cualquiera de sus estadios. Por esta razón, se están implementando medidas desde las prácticas de agricultura tradicional, como el empleo de pesticidas para el manejo de enfermedades vegetales que, por una parte, generan costos adicionales para los productores y, por otra, repercuten negativamente en la calidad ambiental de los agroecosistemas, dada la contaminación a nivel de suelos y aguas que se produce por el uso indiscriminado de esos insumos.
Asimismo, el uso de antibióticos como agentes de control de las bacterias puede afectar otros procesos biológicos como el crecimiento apropiado de las raíces y la simbiosis entre plantas y bacterias fijadoras de nitrógeno; adicionalmente, puede generar resistencia a los antimicrobianos causando alteraciones en la estructura y función de las comunidades microbianas del ecosistema (Williams-Nguyen et al., 2016).
El estudio de agentes fitopatógenos es un área de interés en el país. Específicamente los estudios encaminados a conocer la biología de los agentes fitopatógenos que pueden alterar la calidad de los productos alimenticios a nivel de poscosecha representan un área de investigación en emergencia. Las enfermedades que atacan este cultivo se caracterizan por reducir la calidad y productividad de los tubérculos y por generar pérdidas económicas para los productores (Méndez et al., 2009). Entre fitopatógenos encontramos aquellos de origen bacteriano como Ralstonia solanacearum, que produce marchitez y atrofiamiento de la planta. Esta enfermedad es catalogada como la segunda en importancia por su capacidad para limitar la producción de papa, causando elevadas pérdidas al año (Muzira et al., 2018).
Otra enfermedad de origen bacteriano es la costra de la papa, causada por S. cabies, enfermedad muy común en el cultivo y que, al contrario de Ralstonia sp., es una de las más inocuas en lo que hace referencia a la repercusión económica, porque causa efectos cosméticos en la cosecha, afectando la calidad pero no el rendimiento ni la conservación de los cultivos (Beaulieu et al., 2019; Dees & Wanner, 2012). Finalmente, la pudrición blanda causada por P. carotovorum, objeto de esta revisión, es una de las enfermedades más relevantes en la afectación del tubérculo, en la etapa de poscosecha, generando grandes pérdidas económicas.
Esta enfermedad se evidencia a nivel de campo y de almacenamiento, generando pérdidas de entre 50 y 100 millones de dólares anuales a nivel mundial (Al-Zomor et al., 2013; Franco & Stefanova, 2008). Varios autores han indagado acerca de diversos aspectos biológicos de esta bacteria (Czajkowski et al., 2011; Fukuoka et al., 2001; Senchenkova et al., 2003) y, a la fecha, múltiples aspectos fenotípicos, bioquímicos y moleculares han sido esclarecidos. Por otro lado, la taxonomía de este agente es un área en constante reevaluación (Czerwicka et al., 2011; Duarte et al., 2004; Lee et al., 2017). Actualmente, se han descrito seis subespecies, de las cuales tres se caracterizan como agentes fitopatógenos afectando diversos órganos vegetales, como tubérculo y hoja en plantas de papa (Aysan et al., 2003).
Estudios en el área de regulación de la expresión génica de esta bacteria han permitido establecer aspectos relevantes del mecanismo quorum sensing como medio para la expresión de diversos factores de virulencia con los que cuenta el microorganismo. Se destaca la secreción de exoenzimas de tipo pectinasas como principales responsables de generar la pudrición del tubérculo. También se ha detectado la producción del antibiótico de tipo carbapenem que facilita la competencia con otros microorganismos propios de la superficie del tubérculo y que permite que se produzca la infección del tejido vegetal de manera efectiva (Burr et al., 2006; Byers et al., 2002; Corbett et al., 2005; Pemberton et al., 2005).
Con respecto a los métodos empleados para la detección de dicho agente, se encuentran los métodos clásicos, que presentan ventajas en relación al costo, fácil acceso de los reactivos y, en algunos casos, la identificación entre especies, pero muestran baja sensibilidad y especificidad, además de requerir bastante tiempo para su ejecución (Gorris et al., 1994; Perombelon et al., 2002). Por otra parte, los métodos inmunológicos han evidenciado reacciones cruzadas con microflora epífita y su costo es mayor (Al- Zomor et al., 2013; Fraaije et al., 1997; Gorris et al., 1994). Actualmente, las técnicas moleculares son las más eficientes para detectar el ADN del patógeno y, a la fecha, se han desarrollado primers específicos para revelar su presencia en una muestra de origen vegetal (De Boer & Ward, 1995; Doolotkeldieva et al., 2016; Frechon et al., 1998; Kang et al., 2003; Laurila et al., 2010). Adicionalmente, es necesario perfeccionar e implementar los métodos clásicos y moleculares de diagnóstico para la detección temprana de la enfermedad, con metodologías como los biosensores, que toman menos tiempo, no requieren de equipamientos sofisticados y son altamente sensibles (Fang & Ramasamy, 2015; Khater et al., 2017).
Dado que las estrategias convencionales para el manejo de esta enfermedad no han resultado eficientes, es relevante destacar los estudios desarrollados en el área de control biológico que permite la utilización de antagonistas naturales tales como Bacillus subtilis (Ehrenberg) y B. amyloliquefaciens (Priest, Goodfellow, Shute, & Berkeley); asimismo, el uso de extractos naturales de plantas y semillas ha permitido aislar compuestos bioactivos de actividad antibacterial frente a la pudrición blanda para su manejo (Azaiez et al., 2018; Gerayeli & Baghaee, 2018; Hajian-Maleki et al., 2019). Finalmente, como perspectivas para el control de esta bacteria fitopatógena, se considera, en primer lugar, la obtención de variedades genéticamente modificadas que produzcan cosechas más estables y menos susceptibles a patógenos. Aunque es importante resaltar que los recursos genéticos de las variedades silvestres particularmente de los Andes, como la adaptación climática a condiciones externas y la resistencia a plagas, deben ser preservadas, no solamente como baluartes ancestrales, sino también como una herramienta en la obtención de este tipo de variedades. También resultaría interesante el desarrollo de nanosensores basados en nanoparticulas plata (AgNP) con acción antibacterial para detectar y eliminar este agente a nivel del almacenamiento (Gasparyan & Bazukyan, 2013).
Conclusiones
Pectobacterium carotovorum es el agente causal de la pudrición blanda de la papa, la enfermedad poscosecha más relevante, que causa grandes pérdidas económicas para los productores y comerciantes. La biología del patógeno está ampliamente esclarecida en términos de sus características fenotípicas, genotípicas y bioquímicas, así como en la forma en que emplean el sistema de regulación de la expresión génica quorum sensing para desplegar sus factores de virulencia con el fin de generar la enfermedad; sin embargo, la taxonomía de la especie está siendo reevaluada. Están disponibles diferentes métodos para la identificación del patógeno, tanto clásicos como moleculares, pero para lograr detectar la presencia de este agente fitopatógeno en una muestra biológica existen ciertas limitaciones en las técnicas convencionales. Por eso, se están empezando a desarrollar sistemas de biosensores que permiten la detección temprana de estos patógenos de una manera específica y sensible; no obstante, a la fecha no se ha desarrollado este tipo de dispositivos para la detección de P. carotovorum y, por lo tanto, esta sería un área interesante de investigación con el fin de poder generar dispositivos de tipo comercial que puedan ser utilizados por los productores.
Para el control de este agente fitopatógeno, usualmente se emplean prácticas culturales y pesticidas; sin embargo, estos no son muy efectivos, ya que una vez la patología ha iniciado el control es limitado debido al rápido crecimiento del patógeno y la inhabilidad del producto para penetrar los tejidos. Por tal motivo, se han desarrollado investigaciones en el control biológico de este agente siendo Pseudomona fluorescens (Migula) y Bacillus subtilis los antagonistas sobresalientes.


















