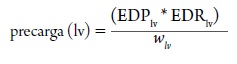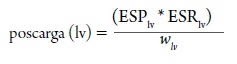Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354On-line version ISSN 2389-8526
Rev. Med. Vet. no.21 Bogotá Jan./June 2011
Fisiología cardiovascular aplicada en caninos
con insuficiencia cardiaca
Applied Cardiovascular Physiology in Dogs with Heart Failure
Iván Álvarez Ramírez1 / Luís Eduardo Cruz Martínez2
1 MV MSc Fisiología. Centro de investigaciones CISAHE. Departamento de Fisiología y Medicina Interna de Pequeños animales de la Universidad de La Salle. ivalvarez@unisalle.edu.co
2 Médico anestesiólogo e intensivista. Departamento de Fisiología Universidad Nacional de Colombia. lecruzm@unal.edu.co
Recibido: 5 de agosto del 2010 Aceptado: 4 de marzo del 2011
Resumen
La insuficiencia cardiaca está relacionada con anormalidades de la contracción y relajación ventricular. Recientes publicaciones han mostrado que la mayoría de los pacientes con enfermedades cardiacas coexiste alteraciones de la función sistólica y diastólica. Actualmente, hay muchas ambigüedades en el uso de términos clínicos y fisiológicos usados cotidianamente con respecto a este tema. Este artículo pretende revisar algunos conceptos fisiológicos del sistema cardiovascular.
Palabras clave: fisiología cardiovascular, insuficiencia cardiaca, caninos.
Abstract
Congestive heart failure is related to abnormal ventricular contraction and relaxation. Recent publications show that the alteration of systolic and diastolic function coexists in most patients with heart diseases. There are currently several ambiguities in the daily use of clinical and physiological terms regarding this topic. This paper aims to review certain physiological concepts of the cardiovascular system.
Key words: cardiovascular physiology, heart failure, canines.
Introducción
La insuficiencia cardiaca es un síndrome clínico en el cual una enfermedad cardiaca reduce el gasto cardiaco, incrementa la presión venosa y está acompañada de anormalidades moleculares y muerte celular miocárdica, aspectos que causan un deterioro progresivo del corazón. Este síndrome representa un complejo de interacciones de respuestas compensatorias para atender y preservar la función cardiaca y el flujo sanguíneo tisular. Esto va a depender de la severidad de la enfermedad cardiaca subyacente y en la cual los mecanismos compensatorios pueden preservar la homeostasis sin alcanzar el punto de la producción de efectos deletéreos (Ettinger, 2007).
Desde el punto de vista mecanicista, el corazón puede fracasar como bomba, ya que no puede eyectar suficiente sangre hacia la aorta o arteria pulmonar para mantener la presión arterial (alteraciones anterógradas) o también puede haber alteraciones en el llenado cardiaco o reducción del retorno venoso (alteraciones retrógradas). Los animales pequeños, tanto perros como gatos con falla cardiaca también pueden ser clasificados de acuerdo con el origen de la anormalidad primaria, involucrando el corazón derecho o izquierdo. La insuficiencia cardiaca derecha se asocia con signos de congestión en la circulación sistémica (ascitis, edema periférico), mientras que la insuficiencia cardiaca izquierda ocasiona signos de congestión en la circulación pulmonar (edema pulmonar, disnea). La insuficiencia cardiaca bilateral presenta una combinación de signos de insuficiencia cardiaca derecha e izquierda. Todo esto sugiere que hay varias maneras de clasificar la insuficiencia cardiaca, pero esto es una sobre simplificación, porque el llenado es el mayor determinante de la eyección, la cual, a su vez, es un determinante del llenado, puesto que los dos ventrículos operan en serie (Katz, 2001).
Por tanto, la insuficiencia cardiaca en caninos puede ser desencadenada por muchas etiologías y, en consecuencia, no se puede definir en un simple término universal. Hay etiologías que conllevan a una sobrecarga mecánica de volumen o presión sistólica sobre el corazón o entidades que generan depresión de la contractilidad miocárdica o interfieren con el llenado ventricular o simplemente condiciones que incrementan los requerimientos metabólicos (Knight, 1996).
Hay muchas ambigüedades en el uso de términos clínicos y fisiológicos usados cotidianamente. Este artículo pretende revisar algunos conceptos fisiológicos del sistema cardiovascular.
El corazón como bomba
Al abordar la anatomía funcional del corazón en lo que respecta al comportamiento hemodinámico, el corazón mecanicistamente se describe como dos bombas independientes. Cada lado, o bomba, posee su propia circulación y sus propias características de presión; por esta razón, se utilizan los términos corazón derecho o corazón izquierdo, junto con circulación menor y circulación mayor, respectivamente.
El corazón derecho está constituido por la aurícula derecha y el ventrículo derecho, que actúan como una unidad. Su principal función es recibir sangre venosa sistémica en la aurícula derecha, que se continúa con el ventrículo derecho, este genera una baja presión para bombear la sangre por medio de la válvula pulmonar hacia los capilares pulmonares en un tejido de baja resistencia. Por ello, el corazón derecho está considerado un sistema de baja presión.
Por su parte, el corazón izquierdo es una unidad similar que recibe sangre oxigenada desde el sistema pulmonar. Está considerado como un sistema de alta presión, ya que el ventrículo izquierdo necesita generar una mayor presión para bombear la sangre a través de la válvula aórtica, hacia la aorta y luego hasta la microcirculación sistémica, y así mantener el impulso que permita el retorno de la sangre a la aurícula derecha.
Por tanto, el sistema circulatorio está constituido por dos circuitos dispuestos en serie: la circulación pulmonar, que es un sistema de baja presión con baja resistencia al flujo sanguíneo, y la circulación sistémica, que es un sistema de alta presión con mayores resistencias a este flujo. Para conservar en todo momento un flujo derecho-izquierdo será importante considerar el acople circulatorio y su desempeño en diferentes circunstancias (Braunwald, 1976).
La capacidad del corazón para actuar como bomba está estrechamente integrada al organismo, a fin de asegurar un trasporte de oxígeno y nutrientes adecuado que cubra las necesidades metabólicas de los tejidos. En ciertas condiciones fisiológicas, que pueden oscilar desde la enfermedad hasta el ejercicio, el corazón normal tiene capacidad de compensación para cubrir las demandas que se le plantean; fisiológicamente, la actividad cardiaca posee cuatro componentes fundamentales: frecuencia cardiaca, precarga, poscarga y contractilidad. En un corazón enfermo o en caso de alteración del sistema circulatorio, se pueden modificar uno o más de estos determinantes en el intento por mantener un rendimiento cardiaco adecuado (Katz, 2001; Opie, 2004).
La función del corazón
Obedece a la contracción de las sarcómeras en el miocardio, a la configuración geométrica de los ventrículos y a las fuerzas que se producen. Por otra parte, el volumen sistólico es el resultado de la interacción del ventrículo con las demás cavidades cardiacas y con la circulación arterial y venosa. Por consiguiente, la función cardiaca se evalúa en diferentes niveles: 1) función miocárdica; 2) función de bomba de las cavidades, por lo general, del ventrículo izquierdo, y 3) el gasto cardiaco. Es importante distinguir el nivel de interacción de la función cardiaca que se está evaluando; así por ejemplo, los cambios del gasto cardiaco y de la función de bomba del ventrículo izquierdo son ocasionados por factores múltiples y no solo reflejan la contractilidad miocárdica. De esta manera, el gasto cardiaco por sí solo proporciona una evaluación limitada y poco sensible de la función ventricular o de la contractilidad miocárdica y la sola evaluación de la función de bomba del ventrículo izquierdo tampoco permite valorar el grado de contractilidad miocárdica ni la adecuación a los factores vasculares a la cual el corazón normalmente se encuentra unido.
El gasto cardiaco depende de cuatro factores: 1) precarga, 2) poscarga, 3) contractilidad y 4) frecuencia y ritmos cardiacos.
-
La precarga es proporcional al alargamiento miocárdico previo al estímulo, según la ley de Starling del corazón dentro de ciertos límites fisiológicos: cuanto mayor sea la precarga más intensa será la contracción y mayor el grado de acortamiento.
-
La poscarga es la carga que el miocardio debe vencer para contraerse y acortarse, también después de un límite a mayor poscarga menor acortamiento.
-
La expresión contractilidad miocárdica se refiere a una propiedad intrínseca de la célula miocárdica, que refleja la velocidad de activación, formación y periodicidad de los puentes cruzados entre los filamentos de actina y miosina. A su vez, cuando la precarga y la poscarga son constantes, a mayor contractilidad se obtiene un mayor grado y velocidad de acortamiento.
-
Por último, en cuanto a la frecuencia y el ritmo cardiaco, dentro de un margen muy amplio, al aumentar la frecuencia se acentúa la contractilidad (relación positiva de fuerza-frecuencia), efecto denominado Bowditch (Klabunde, 2005).
Estos factores representan una simplificación de los procesos fundamentales, puesto que en el corazón las cargas, la contractilidad y la frecuencia están interrelacionadas de forma simultánea y durante cada ciclo cambian dinámicamente. Sin embargo, hay que tener en cuenta que todos estos son conceptos identificados y probados en modelos ideales de fibras miocárdicas, músculos papilares y corazones aislados. La realidad hace que el complejo circulatorio sea una unidad y que sea un reto hacer un abordaje conceptual y fisiológico, para evaluar la función integrada y correlativa entre estas variables.
Determinantes del gasto cardiaco
El gasto cardiaco (GC) se define como la cantidad de sangre bombeada por el corazón hacia la aorta en cada minuto (Guyton, 2000); también es la cantidad que fluye por la circulación, este es un factor que se designa para determinar la función del corazón. Matemáticamente, el GC corresponde a:
Gasto cardiaco = Frecuencia cardiaca x Volumen sistólico (Lt/min o ml/min)
Es importante tener en cuenta que el GC puede variar ampliamente según el grado de actividad del cuerpo; por tanto, factores como la edad del animal, el tamaño del cuerpo, ejercicio o reposo, así como cierto número de factores adicionales pueden afectar el GC. Por ejemplo, en los trabajos de Haskins y Pascoe, en California (2005) el GC promedio para perros jóvenes entre 15 a 30 kg fue de 3,3 ±1,3 Lt/min, comparado con los trabajos de Vega y Oropeza, en México (2002), en los cuales se pudo ver que el GC para perros mestizos adultos entre 10 a 30 kg fue de 2,32 ± 0,88 Lt/min (Sotres, 2002; Haskins, 2005), lo que muestra la falta de uniformidad y la necesidad de evaluar este parámetro en diversas poblaciones (ver tabla 1).
Para comparar el gasto cardiaco en animales de diferentes tamaños, los valores se expresan, generalmente, en términos de superficie corporal (m2) o peso metabólico (Kg066) y se conoce como índices. El índice cardiaco y el índice del volumen de latido se obtiene al dividir el gasto cardiaco o volumen entre la superficie corporal, respectivamente. En el perro la superficie corporal se calcula, según (Detweiler, 1999):
El gasto cardiaco y el metabolismo se relacionan de manera similar con la superficie corporal o con una función exponencial del peso corporal y, por tanto, están correlacionados. De hecho el requerimiento total de oxígeno de los tejidos, que refleja el metabolismo general o el intercambio energético, es determinante principal del gasto cardiaco en todos los animales.
Determinantes de la frecuencia cardiaca
La frecuencia cardiaca se encuentra normalmente bajo la influencia tónica de ambos componentes del sistema nervioso autónomo. La estimulación del sistema nerviosos simpático aumenta la frecuencia cardiaca, mientras que la estimulación del sistema parasimpático la reduce. Normalmente, los cambios en la frecuencia cardiaca implican una acción recíproca de los dos componentes del sistema nerviosos autónomo. Por tanto, una frecuencia cardiaca aumentada suele ser el resultado de una atenuación de la actividad parasimpática con aumento concomitante de la actividad simpática; la desaceleración se debe normalmente a los cambios opuestos en la actividad neuronal (Berne, Levy, 1998).
El aumento de la frecuencia cardiaca compromete el gasto cardiaco, por las siguientes consideraciones:
1) aumento de la cantidad de oxígeno consumida por el miocardio, 2) reducción del tiempo diastólico, que puede dar lugar a un menor tiempo de perfusión de las arterias coronarias, y 3) acortamiento de la fase de llenado ventricular, que ocasiona una disminución del volumen de sangre cuando bombea en la siguiente contracción.
La frecuencia cardiaca lenta o reducida también tiene algunos efectos nocivos. Inicialmente, el tiempo de llenado es más prolongado, lo que podría dar lugar a un aumento del gasto cardiaco. Sin embargo, incluso, con este aumento de volumen, el miocardio puede estar tan deprimido que el músculo no se contrae lo bastante fuerte como para impulsar dicho aumento de volumen. El resultado es una disminución del gasto cardiaco (Guyton, 2000).
En caninos, al igual que humanos, predomina la actividad parasimpática, muchos de los estudios que defienden esta teoría se basa en experimentos de tipo farmacológico como los realizados por Katona, en 1982, y Kollai, en 1994; en estos, la abolición de la influencia parasimpática por atropina suele aumentar casi dos veces la frecuencia cardiaca. Por el contrario, la abolición de los efectos simpáticos por fármacos betabloqueadores, como el Propanolol, por lo general, solo redujo un 20% la frecuencia cardiaca y cuando los efectos de ambos componentes del sistema nervioso autónomo son bloqueadas por la combinación de ambos fármacos, la frecuencia cardiaca alcanzó un valor medio, 1,6 veces superior al basal normal (Katona, 1982; Berne y Levy, 1998).
La frecuencia cardiaca de los caninos puede variar entre un rango de 60 a 150 latidos/min, dependiendo de factores como el tamaño del animal y con este la raza; por ejemplo, en un canino grande la frecuencia, por lo general, es de solo de 60 latidos/min durante el sueño y aproximadamente 90 latidos/min, si el perro está quieto y despierto; pero durante el ejercicio o despertar emocional la frecuencia cardiaca puede elevarse hasta 250 latido/ min en un perro que realiza ejercicio máximo o que está intensamente asustado, lo cual demuestra que uno de los factores que determina la frecuencia cardiaca es el sistema nervioso autónomo (Sthephenson, 1999).
Existen otros mecanismos que determinan la frecuencia cardiaca. Uno de ellos es la fluctuación de la temperatura ambiental, en la que se ha observado que los cambios de temperatura inducidos experimentalmente en el hipotálamo anterior modifican la frecuencia cardiaca y las resistencias periféricas, ya que estímulos aplicados en el diencéfalo aumentan la frecuencia cardiaca parecidas a las observadas durante el ejercicio (Berne y Levy, 1998).
Los cambios agudos en la presión arterial modifican de forma refleja la frecuencia cardiaca; estos cambios están mediados por los barorreceptores localizados en los glomos carotideos, arco aórtico, ventrículos, arteriola glomerular aferente (Sisson, 2004). Estas estructuras son inervadas por el sistema nervioso autónomo, de manera que cuando aumenta la presión arterial por estímulo sobre los barorreceptores carotideos, mejor estudiados, lleva a una disminución de la descarga simpática con disminución de la frecuencia cardiaca (Berne y Levy, 1998).
El llenado cardiaco aumentado eleva la frecuencia de forma refleja, dicha observación fue postulada en 1915 por Bainbridge, quien demostró que las infusiones de sangre o de solución salina aumentaban la frecuencia cardiaca independientemente de que dichas infusiones modificaran la presión arterial, con lo cual llegó a la conclusión que la elevación de la presión venosa central se eleva lo suficiente como para distender el lado derecho del corazón, produce una aceleración cardiaca denominado a esto reflejo de Bainbridge.
En el animal intacto, la estimulación de los quimiorreceptores carotideos aumenta considerablemente la frecuencia cardiaca y la profundidad de la ventilación. Cuando la estimulación del quimiorreceptor aumenta la ventilación solo ligeramente, la frecuencia cardiaca suele descender; cuando el aumento en la ventilación pulmonar es más pronunciado, habitualmente, la frecuencia cardiaca aumenta (Berne y Levy, 1998).
Volumen sistólico
El volumen sistólico o volumen latido (VL) es la cantidad de sangre impulsada fuera del ventrículo cada vez que este se contrae. Es la diferencia entre el volumen de final de diástole (VFD) y el volumen de final de sístole (VFS). En un corazón humano adulto típico, el VFD del ventrículo izquierdo es de 2 ml/kg, en caninos se han reportado valores normales de 2-3ml/kg (Fox, 1988) y el VFS en caninos puede ser de 30 a 35 ml, la diferencia entre estos dos volúmenes puede ser de 30 ml para un canino sano (Sthephenson, 1999), la cual representa el VL.
Cualquier factor que altere el VFD y el VFS cambia el volumen latido. Por ejemplo, dentro de un límite, los aumentos en el VFD dan lugar a incrementos en el volumen latido, esta es la ley de Starling del corazón, a un mayor llenado ventricular durante la diástole pone al ventrículo en una geometría más favorable para la expulsión de la sangre durante la siguiente sístole. También el estiramiento de las fibras musculares ventriculares durante la diástole hace que haya una mejor posición de los filamentos de actina y miosina, que aumentan el número de puentes y con ello la generación de fuerza durante la contracción sistólica siguiente. En general, en un animal normal, los aumentos o las disminuciones en el volumen ventricular durante el final de la diástole dan lugar a incrementos o reducciones proporcionales en el volumen latido (Detweile, 1998).
El volumen sistólico, como componente del gasto cardiaco, está influido por los otros tres determinantes de la función cardiaca: precarga, poscarga y contractilidad, todos ellos interrelacionados. En muchos casos, cuando se altera uno, también lo hace el otro. Por ejemplo, un cambio en la precarga incrementa el VS por un incremento del VFD, mientras que un aumento en la poscarga disminuye el VS con un incremento del VFS. El VFD y el VFS son variables interdependientes, así un cambio en una variable lleva a un cambio en la otra (Klabunde, 2005).
Cuando el volumen sistólico se expresa como porcentaje del VFD, recibe el nombre de fracción de eyección (FE). La FE es la diferencia entre el volumen diastólico final y el volumen sistólico final dividida en el VFD. Este índice es relativamente constante en condiciones fisiológicas, representa un 50 a 70% del VFD y se altera en forma significativa en condiciones de falla miocárdica.
Hacia el entendimiento de la poscarga y precarga
Existen muchas diferencias significativas entre los conceptos de precarga y poscarga en la literatura, las cuales discrepan mucho entre autores de los textos de fisiología. Esta observación fue encontrada en el trabajo de Norton publicada (2003). Este autor revisó veintinueve textos, monografías y revisiones de literatura de fisiología cardiovascular de ediciones actuales; los resultados claramente revelaron una variedad e inconsistencia que confunde no solo a estudiantes, sino también a clínicos y profesores del área.
Algunos autores proponen que la ley de Laplace sirve como una base para definir tanto la precarga como la poscarga. La precarga la define como "todos los factores que contribuyen al stress de la pared ventricular al final de la diástole". Y la poscarga como "todos los factores que contribuyen al stress de la pared ventricular al final de la sístole". Basándose en la ley de Young-Laplace donde:
Donde el estrés de la pared (a) es directamente proporcional a la presión de la cámara (P) y al radio de la cámara (R), e inversamente proporcional al espesor de la pared (w); aplicando este principio físico se puede definir la precarga para el ventrículo izquierdo como:
Donde EDPlv es la presión de llenado al final de la diástole, y EDRlv es el radio de la cámara del ventrículo izquierdo al final de la diástole y wlv, es el espesor de la pared al final de la diástole (Norton, 2001).
Similarmente, con la ley de Laplace, la poscarga del ventrículo izquierdo puede ser mejor descrita como el stress de la pared del ventrículo izquierdo durante la eyección sistólica:
Donde ESPlv es la presión de llenado al final de la sístole y ESRv es el radio de la cámara del ventrículo izquierdo al final de la sístole y wlv, es el espesor de la pared al final de la sístole (Norton, 2001).
Sin embargo, a esta definición conceptual se oponen algunos autores, los cuales objetan que para que algo sea válido debe ser capaz de medirse y demostrarse, concepto que no se puede desarrollar con la ponencia de Norton.
Ante la gran variedad de conceptos, este trabajo pretende definir estos términos con base en varias consideraciones: la precarga es el estiramiento inicial del miocito cardiaco antes de la contracción, por tanto, este concepto está relacionado con el tamaño de la sarcómera al final de la diástole. El tamaño de la sarcómera no puede ser determinado en corazones intactos y, actualmente, es imposible de medir in vivo, por consiguiente, un índice indirecto de precarga es el volumen o presión al final de diástole (Conde, 1981). Sin embargo, estas mediciones de precarga no son ideales tampoco, porque ellas no reflejan objetivamente el tamaño de la sarcómera, por ejemplo, con incremento agudo en el volumen ventricular, ocurre un incremento en el tamaño de la sarcómera. No obstante, en dilataciones ventriculares crónicas, como ocurre en algunos tipos de falla cardiaca, el tamaño de la sarcómera puede ser normal, porque hay adición de nuevas sarcómeras en serie y, por tanto, la presión a final de diástole es un pobre indicador de precarga (Klabunde, 2005).
La relación de los volúmenes de llenado y las presiones de llenado dependen de la distensibilidad ventricular (compliance). En presencia de aumento de la distensibilidad ventricular, como en pacientes con cardiopatía dilatada, un gran aumento de los valores del volumen de llenado se refleja en unos pequeños cambios de las presiones de llenado. Por el contrario, en presencia de una distensibilidad disminuida como en corazones hipertrofiados un pequeño cambio del volumen de llenado se refleja en un cambio drástico de la presión de llenado (figura 1). Esto se debe tener en cuenta en la práctica clínica, ya que una disminución en la PVC (presión venosa central) no necesariamente indica una disminución en la precarga y, por tanto, una disminución de la volemia (Klabunde, 2005).
Se han realizado diferentes trabajos para evaluar las presiones auriculares al final de la diástole, como se muestra en la tabla 1, en la que se presentan diferentes parámetros hemodinámicas en perros sanos. Hasta el momento, no se conocen trabajos en Colombia, lo que conduce la falta de uniformidad y revela la necesidad de evaluar este parámetro en diversas poblaciones, que es uno de los objetos del presente trabajo.
Relación de Frank-Starling. Relación longitud-tensión
La precarga también se puede expresar como la relación longitud-tensión de la fibra miocárdica o por la relación de volumen y presión generada durante la actividad ventricular.
La relación entre el volumen de sangre en el ventrículo al momento de iniciar su contracción (volumen de fin de diástole), y la presión sistólica, que puede ser desarrollada por el corazón, fue descrita para el corazón de sapo por Otto Frank, en 1895, y para el corazón de mamífero por Starling, en 1914. Dicha relación es conocida como la relación de Frank-Starling o la ley de Starling del corazón (Katz, 2002).
Generalmente, el descubrimiento de que el volumen de fin de diástole regula el trabajo del corazón es acreditado a Ernest Henry Starling, quien trabajando en preparaciones corazón-pulmón de perros, realizó trabajos experimentales que relacionan el gasto cardiaco con las presiones de llenado ventriculares; quien describió esta relación en una serie de documentos publicados entre 1912 y 1914 y en su lectura Linacre publicada, en 1918, en la que se escribió que la ley del corazón era semejante a la ley del tejido muscular, puesto que la energía de contracción es una función de la longitud de la fibra muscular. Sin embargo, en este último documento Starling y sus colaboradores, reconocen que ellos no fueron los primeros en describir esta relación y citan los trabajos de autores como Blix y Evans-Hill, sobre la liberación de energía dependiente de la longitud en el músculo esquelético y la descripción de Frank, en 1895, sobre la influencia del volumen diastólico sobre el trabajo del ventrículo del sapo.
Otto Frank, quien estudió con Ludwing, de 1891 a 1893, fue estimulado para estudiar el corazón con base en los análisis termodinámicos iniciales de la contracción del músculo esquelético, sustituyendo volumen y presión de la longitud y tensión; asimismo, describió cómo con un incremento en el llenado inicial del ventrículo del sapo, se incrementaba la presión pico hasta cierto nivel de llenado, más allá del cual la presión ventricular pico declinaba (Katz, 2002).
Esta relación es una manifestación de la relación longitud-tensión vista en el músculo esquelético —la cual es bien conocida por los fisiólogos desde la segunda mitad del siglo XIX y descubierta por Schwann's en 1832—. De esta relación se deduce que sobre un rango normal de volúmenes de fin de diástole, el corazón es capaz de aumentar la presión generada durante la sístole. Cuando la magnitud de la presión intraventricular desarrollada es graficada como una función del volumen de fin de diástole, la curva que se obtiene es análoga a la relación longitud-tensión de un músculo esquelético. El corazón normalmente opera sobre la porción ascendente (izquierda) de la curva de Starling, la cual, al igual que en la curva longitud-tensión, también es llamada brazo ascendente. La baja complacencia del músculo cardiaco, así como la rigidez del pericardio, normalmente, previenen que el ventrículo se dilate a un punto que llegue al brazo descendente de la curva (Katz, 2001).
La curva de relación longitud tensión muestra que al aumentar la longitud de la fibra muscular y, por tanto, la precarga se aumenta la tensión hasta un punto máximo. Este valor máximo en la fibra miocárdica corresponde a un tamaño de la sarcómera de 2,2 ^m, por encima de este valor la fibra miocárdica pierde su capacidad de tensión (figura 2).
La relación longitud-tensión usualmente se usa para describir la contracción del músculo aislado, sin embargo, si se sustituye el volumen ventricular por la longitud y la presión ventricular por la tensión, se muestra que hay una relación entre la tensión y la presión ventricular, la longitud y el volumen ventricular, en consecuencia, se puede inferir que al aumentar la precarga se aumenta el volumen de la cámara y también se aumenta el tamaño de la fibra, efecto que genera un aumento de la tensión y, a su vez, un aumento de presión de la cámara. Este hecho puede ser aplicado in vitro, donde se aisla una fibra de músculo papilar, pero, in vivo este efecto puede variar.
Poscarga
La poscarga es la tensión o estrés que debe desarrollar la pared ventricular durante la contracción o sístole. Está determinada por una serie de factores: geometría ventricular, impedancia arterial y resistencia periférica (Schlant, 1994).
La geometría ventricular afecta la tensión sistólica de la pared ventricular, este postulado se entiende mejor aplicando la ley de Laplace, como es sugerido por Norton, el cual fue discutido anteriormente, al describir el concepto de precarga (Norton, 2003).
La impedancia, en términos eléctricos, mide la oposición de un circuito o de un componente eléctrico al paso de una corriente eléctrica alterna sinusoidal. Este concepto fue estudiado por el físico Oliver Heaviside en julio 1886 (Serway, 1997). En la circulación de los mamíferos, el flujo de sangre ocurre por el impulso alterno que produce el corazón y, por tanto, se ha tratado de entender la impedancia arterial como la resistencia ofrecida por las arterias a la salida de la sangre de la cavidad ventricular e involucra tanto la resistencia ofrecida por sus paredes como por su contenido sanguíneo.
La resistencia periférica y sus determinantes
La presión, el flujo y la resistencia suelen relacionarse mediante la ecuación de Poiseuille, formulada por vez primera en 1842. A partir de una serie de observaciones cuidadosas sobre el flujo del agua por medio de tubos rígidos, Poiseuille demostró que la resistencia al flujo R a través de un tubo es proporcional a la longitud del tubo L y a la viscosidad del líquido n e inversamente proporcional al radio del tubo elevado a la cuarta potencia (r4). Estas variables pueden relacionarse entre ellas de la forma siguiente (Badeer, 2001):
La ecuación de Poiseuille se aplica al comportamiento de los líquidos newtonianos que fluyen de forma no pulsátil ni turbulenta (laminar) por tubos rígidos. Aunque el sistema vascular no cumple ninguna de estas condiciones, la ecuación es útil, pues permite predecir que el flujo Q será proporcional a r4 —e inversamente proporcional a la resistencia: Q a r4 o Q a 1/R4, donde r es el radio y R la resistencia—, es decir, para una misma presión inicial, la duplicación del radio interno de un tubo producirá un aumento de dieciséis veces (24) del flujo. Resulta evidente que los cambios relativamente pequeños del calibre arterial pueden producir modificaciones importantes de la resistencia y el flujo (Badeer, 2001; Guyton, 2002).
La relación entre la resistencia vascular y el flujo sanguíneo se puede definir mediante una ecuación análoga a la ley de Ohm para el flujo de electrones, en la que flujo (Q) = presión de perfusión (P)/ Resistencia (R).
En condiciones fisiológicas, un componente importante de la resistencia vascular es el diámetro de la luz. Su control es el objetivo final fundamental de los distintos mecanismos fisiológicos. La mayor parte de la caída de presión que se produce entre los grandes conductos arteriales y los capilares tiene lugar en vasos con calibres de algunos cientos de micras o menores. Por ello, se admite que las arterias de pequeño calibre y las arteriolas tienen una importancia primordial en la regulación y determinación de la resistencia periférica (Schlant, 1994).
Estos vasos musculares contienen de una a tres capas de células musculares lisas y pueden cambiar su diámetro desde una apertura total a un cierre casi total, lo que hace que su capacidad para influir en la resistencia sea considerable. Por el contrario, las grandes arterias de conducción, como la aorta, solo pueden constreñirse entre un 10 y un 20%. A menos que enfermen, su importancia en el control de la resistencia periférica y del flujo sanguíneo es escasa. Además, la sumatoria del área de sección trasversal en la enorme cantidad de arteriolas produce una superficie de paso mucho mayor que la existente en la aorta y grandes arterias. En la Figura 3, se resumen las relaciones entre presión arterial, velocidad del flujo sanguíneo y área transversal total de varios vasos sanguíneos de la circulación sistémica.
Los vasos de gran calibre contribuyen significativamente a la resistencia en ciertos órganos, como el encéfalo, lo que se explica, sobre todo, por la geometría más lineal de la vascularización arterial. En una organización en serie de los tubos, la resistencia total Rf es la suma de las resistencias individuales (R, = R} + R2 + Rj, etc.). Por el contrario, en las circulaciones regionales, en las cuales los vasos se ramifican mucho y de manera secuencial, la resistencia tiende a localizarse en las arterias de menor calibre, pues el gran número de elementos en paralelo reduce la resistencia total de la red. Ya que la sumatoria de la resistencia en paralelo está en relación inversa, así (Badeer, 2001):
En el contexto clínico, la medida más sensible de la poscarga ventricular izquierda es la resistencia vascular sistémica (RVS) y la resistencia vascular pulmonar (RVP) para el ventrículo derecho. En realidad, la resistencia del sistema vascular se deriva de las mediciones del gasto cardiaco (GC) y de la presión arterial media (PAM) asumiendo un modelo mecanicista del flujo continuo aplicado, según la ley de Ohm (Guyton, 2000). Se han realizado varios estudios en caninos para determinar la poscarga del corazón a través de mediciones invasivas teniendo en cuenta valores de resistencia vascular (tabla 1), en la cual se observa una falta de uniformidad por los datos encontrados. Estas resistencias vasculares se puede definir matemáticamente así (Conde, 1981; Haskins, 2005):
PAM: presión arterial media
PAPM: presión arterial Pulmonar media
PVC: presión venosa central
PcP: presión en cuña pulmonar
GC: gasto cardiaco
La función ventricular está en relación inversa con la poscarga. Al aumentar la resistencia a la eyección, disminuye el volumen sistólico. La interrelación entre poscarga y volumen sistólico, como determinantes de la función cardiaca, es importante (Figura 4). En el corazón normal, el aumento de resistencia produce pocos cambios en el volumen sistólico. Al disminuir la función miocárdica, el aumento de resistencia produce una mayor disminución del volumen sistólico (Cohr, 1977; Gilbert, 1979).
Contractilidad y estado inotrópico
La contractilidad hace referencia a la capacidad de contracción del músculo cardiaco, la cual permite la generación de fuerza con independencia de las condiciones de carga. La contractilidad depende de la disponibilidad de los sustratos utilizados por las proteínas contráctiles, como el O2, ATP y el calcio, así como la velocidad o de la cinética de interacción de estas proteínas entre sí (Guyton, 2002).
Katz (2001) la define como la manifestación de todos los factores que influyen en la interacción entre las proteínas contráctiles. Una definición simple es la capacidad del corazón de realizar trabajo, refleja el hecho de que la contractilidad es una expresión de muchas variables que influencian el número y la tasa de recambio de las interacciones actina-miosina durante la sístole. Aunque la aplicación de esta definición es difícil, un cambio de la contractilidad miocárdica es fácil de visualizar en el contexto de cualquier cambio en la eyección en el cual no existan cambios en la longitud inicial de la fibra. En una fibra aislada, un aumento del desempeño del trabajo de la fibra que se contraiga a una longitud fija reflejará un aumento en la contractilidad. En el corazón intacto, un cambio en la contractilidad puede ser definido como un cambio en el desempeño del trabajo por latido a volumen de fin de diástole constante. Si bien es cierto se puede definir un cambio en la contractilidad, desde este punto de vista, permanece como un desafío poder definir qué fue lo que exactamente cambió, por tanto, la definición simple falla.
Por su parte, según Opie (2004), la contractilidad es un concepto difícil de definir con exactitud; sin embargo, un aumento en la contractilidad resulta en una mayor velocidad de contracción, con una mayor tensión pico o fuerza, cuando factores como la precarga, la poscarga y la frecuencia cardiaca permanecen constante. Da como nombre alternativo a la contractilidad estado inotrópico.
En el ámbito molecular, un aumento en el estado inotrópico produce un aumento en la interacción, independiente de la carga, entre los iones de calcio y las proteínas contráctiles. Por tanto, una interacción positiva podría ser un incremento en el calcio transitoriamente o la sensibilización de las proteínas contráctiles (Opie, 2004).
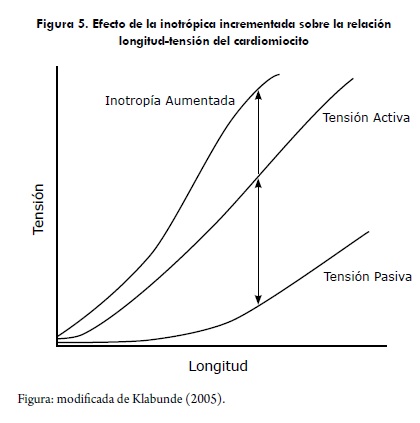
Los cambios en la inotropía son causados por mecanismos celulares intrínsecos que regulan la interacción entre la actina y miosina independientemente del tamaño de la sarcómera; por ejemplo, si el músculo cardiaco es expuesto a dosis de norepinefrina, se incrementa la tensión activa en cualquier tamaño de la precarga (Figura 4). Esto ocurre, porque la norepinefrina se une a receptores b1; de esta manera, se incrementa la entrada del calcio al miocito y liberando más calcio a través del retículo sarcoplásmico durante la contracción (Klabunde, 2005).
La contractilidad en términos de mecánica muscular. Relación fuerza-velocidad
A principios del siglo XX, una serie de observaciones fueron realizadas a fin de evaluar la dependencia de la liberación de energía mecánica sobre la carga en el nivel muscular. Fue así como inicialmente se propuso la teoría del "nuevo cuerpo elástico" en la contracción muscular, según la cual se podía predecir que una cantidad de energía constante estaba disponible para la liberación en cada contracción independiente de las condiciones bajo las cuales el músculo se contrajera. Esta teoría fue aceptada hasta 1923, cuando Fenn demostró que la energía total liberada cuando un músculo se contrae bajo diferentes condiciones de carga no era constante, y en vez de eso, cuando el músculo hace más trabajo, libera más energía. Este efecto es conocido como el efecto Fenn (Katz, 2001).
La relación fuerza-velocidad, que define la influencia de la carga sobre la velocidad de acortamiento muscular, provee una evidencia adicional de lo expuesto cuando Fenn y Marsh, en 1935, demostraron que la relación se mostraba de una forma hiperbólica y no lineal, tal como lo muestra la figura 5. Es ahora claro que la forma hiperbólica de esta relación es una expresión de la energética de la contracción muscular, lo que fue demostrado por las mediciones de trabajo y calor, publicadas en 1938 por A. V. Hill, quien relacionó la tasa de liberación de energía extra en función de la carga, encontrando que esta curva fue idéntica a la obtenida por Fenn y Marsh, anteriormente citada. Estos hallazgos le sirven a Hill para formular su ecuación y establecer su postulado (Katz, 2001).
Los cambios en la inotropía también alteran la relación velocidad-fuerza, al incrementarse el estado inotrópico del miocito, se incrementa la fuerza isométrica y la velocidad máxima de acortamiento (Vmax). El incremento en la Vmax representa un incremento en la capacidad intrínseca de la fibra muscular para generar fuerza independiente de la carga, Figura 6 (Detweiler, 1998; Klabunde, 2005).
Hay varios factores que influyen sobre el estado inotrópico, el más importante es la actividad del sistema autónomo. Los nervios simpáticos por liberación de norepinefrina, la cual se une a receptores beta-1 del miocito, regulan la inotropía ventricular y auricular. Los nervios parasimpáticos los cuales liberan acetilcolina se unen a receptores M2 del miocito, tienen un efecto inotrópico negativo sobre las aurículas y, en menor grado, sobre los ventrículos.
En humanos y algunos mamíferos un incremento abrupto en la poscarga puede causar un incremento modesto en la inotropía fenómeno denominado efecto Anrep. Adicionalmente, un incremento en la frecuencia cardiaca puede causar un efecto inotrópico positivo, fenómeno denominado efecto Bowditch o activación de la Fuerza-Frecuencia (Klabunde, 2005).
En resumen, aunque en modelos experimentales es posible fijar las condiciones de longitud de la fibra cardiaca, es posible evaluar la poscarga que va a ser movilizada en estas, casi celular y molecularmente, la velocidad máxima del acortamiento durante el estado activo. Esta propiedad emergente es la que en rigor define el término de contractilidad. Sin embargo, en el corazón íntegro, haciendo parte de la circulación de un organismo, es decir, in vivo, con respiraciones espontáneas, cambios rápidos en el volumen de llenado o precarga y también efectos respiratorios y autónomos (simpáticos) sobre el tono vascular periférico que define la poscarga, en estas condiciones "reales" el termino contractilidad se hace difícil o aun imposible de precisar y medir. Por lo anterior, muchos autores (Katz, Opie) proponen utilizar el término estado de inotropía o inotropía para caracterizar el desempeño cardiaco total frente al mínimo de cambios en la poscarga, frecuencia cardiaca, volumen de final de diástole. Así, se usará el término inotropía para referenciar al desempeño (performance) integral del corazón intentando describir el estado independiente de la precarga y de la poscarga, según la intervención explicada.
Referencias
Badeer, H. (2001). Hemodynamics for medical students. Advances in Physiology Education, 25 (1), 44-52. [ Links ]
Berne, R. y Levy, M. (1998). Regulación del latido cardiaco en fisiología (2a Ed.). Harcourt-Brace. [ Links ]
Braunwald (1976). Mechanisms of contraction of the normal and failing heart (2a Ed.). Boston: Little, Brown & Col. [ Links ]
Celis, E. (2003). Tecnología ética y evidencia en fundamentos de medicina paciente en estado crítico (3a Ed.). CID. [ Links ]
Cohn, J.N., Franciosa, J.A. (1977). Vasodilator theraphy of cardiac failure. N England J Med, 27, 297. [ Links ]
Cohn, J.N. et ál. (1991). A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive heart failure. N Engl J Med, 325, 303-310. [ Links ]
Cohn, J.N. (1995). Structural basis for heart failure ventricular remodeling and its pharmacological inhibition. Circulation, 91, 2504-2507. [ Links ]
Conde, A. y Vargas, E. (1981). Nuevos Conceptos en el manejo del paciente de alto riesgo. Curso de postgrado. Colegio Colombiano de cirujanos. Sociedad Colombiana de cuidado intensivo. [ Links ]
Detweiler, K., Riedesel, D. y Knight, D. (1999). Actividad mecánica del corazón. En Dukes. Fisiología de los animales domésticos (2a Ed.). México: Limusa. [ Links ]
Dittoe, N., Stultz, D. y Hahn, H. (2007). Quantitative left ventricular systolic function: From chamber to myocardium. Critical Care Medicine, 35 (8), 330-339. [ Links ]
Ettinger, S. y Feldman, E. (2007). Fisiopatología de la insuficiencia cardiaca en tratado de medicina interna veterinaria. Madrid: Elsevier Saunders. [ Links ]
Gilbert, B. y Hew, E. (1979). Physiologic significance of Homodynamic measurements and their derived indices. Canadian Medical Association, 121 (6), 871-876. [ Links ]
Guyton, A. y Hall, J. (2000). Gasto cardiaco, retorno venoso y su regulación en tratado de fisiología médica (12a Ed.). Madrid: McGraw-Hill. [ Links ]
Guyton, A. y Hall, J. (2000). Distensibilidad vascular y funciones de los sistemas arterial y venoso en tratado de fisiología médica (12a Ed.). Madrid: McGraw-Hill. [ Links ]
Haskins, S., Pascoe, P., IlKiw j. (2005). Reference cardiopulmonary values in normal dogs. Comparative medicine, 55 (2), 156-161. [ Links ]
Katona, P.G., McLean, M. y Dighto, D. (1982). Sympathetic and parasympathetic cardiac control in athletes and non-athletes at rest. J Appl Physiol; 52, 1652. [ Links ]
Katz, A. (2001). Energy utilization. Work and heat. En: A. Katz. Physiology of the Heart (3a Ed., 101-122). [ Links ]
Katz, A. (2002). Ernest Henry starling, His predecessors, and the "law of the heart". Circulation, 106, 2986-2992. [ Links ]
Klabunde, R. (2005). Cardiac Function en Cardiovascular Physiology concepts. Ed Lippincott Williams & Wilkins. [ Links ]
Knight, D. (1996). Phatophysiology of heart failure and clinical Evaluation of cardicac function in Textbook of Internal Medicine in Small Animals. Elsevier Saunders. [ Links ]
Norton, J. (2001). Toward consistent definitions for preload and afterload. Advances in Physiology Education, 25 (1), 53-61. [ Links ]
Norton, J. (2003). An invitation to readers. Advances in Physiology Education, 27 (1), 44-45. [ Links ]
Opie, L. y Perlroth, M. (2004). Ventricular function. En: L. Opie. Hearth Phisiology from Cell to Circulation. (4a Ed., 355-401). [ Links ]
Rabanal, R., Mons, L., Galindo, P., Teja, B. y Castrillo. (1998). Modelo experimental canino de sangrado agudo: fisiopatología y factores predictores de la pérdida de Volemia. Emergencias, 10 (5), 298-305. [ Links ]
Schlant, R. y Edmund, H. (1994). Sonnenblick. Fisiología normal del Aparato Cariovascular en el corazón. Hurst. Ed Interamericana McGraw-Hill. [ Links ]
Sisson, D. (2004). Neuroendocrine evaluation of cardiac disease. Vet Clin Small Anim, 34, 1105-1126 [ Links ]
Serway, R. (1997). Circuitos de corriente alterna en Física (2a Ed.). Madrid: Interamericana McGraw-Hill. [ Links ]
Serway, R. Dinámica defluidos (2a Ed.). Madrid: Interamericana McGraw-Hill. [ Links ]
Sotres, A., Olmos, J., Jasso, R., Franco, A., Loyola, U. y Santillán, P. (2002).Registro hemodinámico en perros mestizos. Rev Inst Nal Enf Resp Mex, 15 (2), 69-77. [ Links ]
Sthephenson, R. (1998). El corazón como bomba enfisiología cardiovascular en fisiología veterinaria cunningham (2a Ed.). Madrid: McGraw-Hill. [ Links ]
Swan, H.J.C, et ál. (1970). Catheterization of the heart in man with the use of the flow directed balloon-tipped catheter. New England J Med, 51, 283-447. [ Links ]