Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.32 no.1 Santa Marta Jan./Dec. 2003
ESTRUCTURA DE LA COMUNIDAD ÍCTICA DE LA CIÉNAGA DE MALLORQUÍN, CARIBE COLOMBIANO
STRUCTURE OF FISH COMMUNITY IN THE CIÉNAGA DE MALLORQUÍN, COLOMBIAN CARIBBEAN
Liliana Arrieta Vera1 y Joel de la Rosa Muñoz2
1Carrrera 27 # 74 – 70 Apto E Pasaje (Barrio El Silencio). Barranquilla, Colombia. Email: liliav82@hotmail.com. (L.A.V.).
2Carrrera 26 C 5 # 76 – 27 Bloque 1 Apto 301 (Barrio El Silencio) Barranquilla, Colombia. (J.D.L.R.)
RESUMEN
Con el fin de evaluar la estructura de la comunidad íctica de la laguna costera de Mallorquín, desde julio de 1998 hasta abril de 1999, se realizaron muestreos quincenales en nueve estaciones distribuidas ampliamente en el área de estudio. Se analizó un total de 36 especies correspondientes a 22 familias. De acuerdo con la frecuencia de aparición, el 58% de las especies se categorizó como visitante ocasional, el 26% como visitante frecuente y el 16% como residente. La abundancia total en los muestreos fue de 2424 individuos, que en biomasa representaron 187 Kg (peso fresco). El 89,3% de la abundancia total y el 89,6% de la biomasa total estuvo representado por cuatro familias (Mugilidae, Engraulidae, Gerreidae y Ariidae). Cuatro especies (Mugil incilis, Cetengraulis edentulus, Diapterus rhombeus y Eugerres plumieri) pertenecientes a tres familias dominaron, representando el 85,4% del total de los peces capturados. El comportamiento de la abundancia, biomasa y riqueza de las especies fue homogéneo durante las tres épocas climáticas. El índice de diversidad de Shannon-Weaver osciló entre 0,13 y 0,33.
PALABRAS CLAVE: Ictiofauna, Comunidad, Laguna costera, Caribe.
ABSTRACT
In order to evaluate the structure of the fish community in the coastal lagoon of Mallorquín, sampling was made each two weeks in nine stations widely allocated in the study area from July 1998 to April 1999. A total of 36 species corresponding to 22 fish families were analized. Based on the frequency of occurrence, 58% were classified as occasional visitors, 26% as frequent visitors, and a 16% as residents. Total abundance was 2424 individuals and 187 Kg of biomass (fresh weight). 89,3% of total abundance and the 89,6% of total biomass was represented by four families (Mugilidae, Engraulidae, Gerreidae and Ariidae. Four species (Mugil incilis, Cetengraulis edentulus, Diapterus rhombeus and Eugerres plumieri), included in three families, were dominant, representing 85,4% the whole sample. Species abundance, biomass y richness was homogeneous throughout the three climatic periods. Shannon-Weaver diversity index values oscillated between 0,13 and 0,33.
KEY WORDS: Ichthyofauna, Community, Coastal lagoon, Caribbean.
INTRODUCCIÓN
Los ecosistemas lagunares-estuarinos son cuerpos de agua poco profundos que reciben flujos de agua continental provenientes de ríos, arroyos o quebradas y flujos marinos a través de una barra de arena, de tal forma que su comunicación con el mar puede ser permanente o efímera. Esta característica permite que la fauna de estos ecosistemas sea diversa (de origen marino y dulceacuícola), y apetecida por el hombre debido a su abundancia, variedad, exquisitez y facilidad de extracción del medio (Yáñez–Arancibia et al., 1985, 1994; Yáñez-Arancibia, 1986; Roldán, 1992).
Entre los grupos faunísticos de mayor éxito biológico en la zona costera se encuentran los peces, los cuales poseen mecanismos de supervivencia que comprenden adaptaciones morfológicas, fisiológicas, estrategias reproductivas, alimentarias y patrones de migración altamente integrados a los procesos físicos y a la heterogeneidad de la zona costera. Su papel ecológico y económico es de suma importancia y requiere de investigación (Yáñez–Arancibia et al., 1985, 1994; Yáñez-Arancibia, 1986).
Yáñez-Arancibia y Nugent (1977) afirman que ciertos peces tienen papeles ecológicos críticos en las lagunas costeras, ya que transforman la energía a través del consumo directo de productores primarios, detritus y otras materias mediante la depredación de detritivoros, y hacen que esta energía esté disponible en niveles tróficos mayores. En ese sentido, el estudio de la comunidad de peces permitiría conocer gran parte de la fisiología de dichos ecosistemas.
En el Caribe colombiano la ictiofauna estuarina ha sido ampliamente estudiada, principalmente en la Ciénaga Grande de Santa Marta (CGSM) (Rubio, 1975; Arango y Rodas, 1978; González, 1981; Lamprea, 1990; Santos-Martínez y Acero, 1991; Santos-Martínez y Arboleda, 1993; Bateman y Rojas, 1999; entre otros). Sobre la ciénaga de Mallorquín se han realizado informes técnicos, estudios preliminares en aspectos biológicos y trabajos de pregrado no publicados (Gutiérrez, 1986; Galvis et al., 1989; Viloria, 1989; Universidad del Norte, 1993; CRA, 1995 y 1997; Sociedad Portuaria Bocas de Ceniza, 1998); pero, hasta ahora, su ictiofauna y aspectos de su biología en general no han sido formalmente estudiados.
La ciénaga de Mallorquín es una laguna costera tropical con características estuarinas; su forma es triangular y con un área superficial de 9 Km2 aproximadamente constituye el segundo ecosistema de este tipo en el departamento del Atlántico (Gutiérrez, 1986). El presente documento analizó la comunidad íctica en términos de: composición de especies, abundancia, dominancia, riqueza específica, diversidad y categorización de acuerdo a su frecuencia durante el tiempo de estudio.
ÁREA DE ESTUDIO
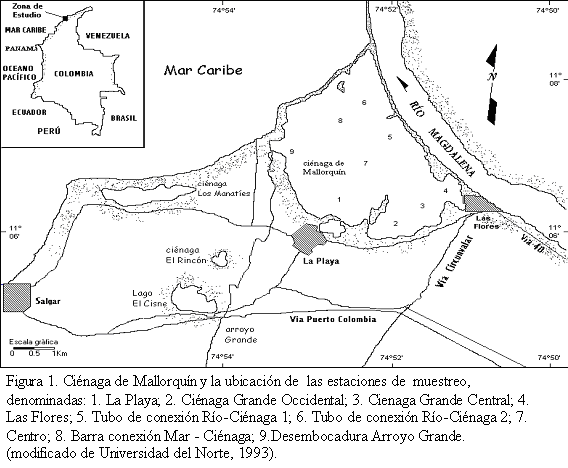
La ciénaga de Mallorquín (11º 05 55-08 54 N y 74º 5100-53 28 W) localizada en el centro de la costa norte de Colombia (Figura 1), hace parte de los 2250 Km2 de la llanura aluvial septentrional inundable del río Magdalena (Galvis et al., 1992). Al norte se comunica con el mar Caribe de manera natural y artificial durante cualquier época del año, cuando los habitantes del área abren una o varias bocas a través de la barra de arena, al sur limita con la carretera que comunica al corregimiento de La Playa con el barrio Las Flores, al oriente se conecta con el río Magdalena por medio de dos tubos que atraviesan el tajamar occidental y al occidente con la desembocadura del arroyo Grande, el cual aporta volúmenes importantes de agua durante los períodos de lluvias (CORMAGDALENA-CRA-Uninorte, 1998; Sociedad Portuaria Bocas de Ceniza, 1998).
En términos generales, Mallorquín es un cuerpo de agua somero, con un promedio de profundidad de 0,70 m, sustrato predominante areno-fangoso, con partes extensas cubiertas de restos de moluscos. Se encuentra rodeada por llanuras de inundación, arenales y dunas con la presencia de mangle rojo (Rhizophora mangle), mangle salado (Avicennia germinans), mangle amarillo (Laguncularia racemosa) y zaragoza (Conocarpus erectus) (Galvis et al., 1992; Minambiente-ICFES-PAC BID, 1998; Arrieta y de la Rosa, 2000). Presenta un clima de bosque muy seco tropical (bms - T) (Viloria, 1989); con un breve período seco de julio a agosto (Esm), un período de fuertes lluvias de septiembre a diciembre (ELLM) y un período seco de enero a abril (ESM). La tasa de precipitación y evaporación media es de 835,5 mm y 1948,9 mm respectivamente (CRA, 1997; Sociedad Portuaria Bocas de Ceniza, 1998).
Según la Universidad del Norte (1993), en las aguas de la ciénaga los sólidos suspendidos llegan a 600 mg/L, la turbiedad a 60 UNT y la dureza total a 5800 mg/L CACO3. A nivel de otras variables físico-químicas se registraron valores de temperatura del agua de 23,4º C - 34,2° C, con un promedio de 28,4º C y valores de salinidad desde 2 hasta 34, con un promedio de 15,1 (Arrieta y de la Rosa, 2000). En las riberas de la Ciénaga se localizan dos poblaciones humanas que albergan cerca de 20300 habitantes de los cuales unos 15300 pertenecen al corregimiento La Playa ubicado en el costado suroccidental y 5000 al barrio Las Flores localizado en el costado suroriental. Más de 400 habitantes dependen directamente de la riqueza íctica de la ciénaga (CRA, 1995; CORMAGDALENA–CRA-Uninorte, 1998; Sociedad Portuaria Bocas de Ceniza, 1998; Imbeth et al., 2000). La actividad pesquera es de tipo artesanal y se realiza con atarraya, único arte de pesca permitido por las entidades ambientales competentes (E. Leal, com. pers.).
MATERIALES Y MÉTODOS
Para el seguimiento de la comunidad íctica en la ciénaga de Mallorquín se realizaron muestreos quincenales durante diez meses abarcando tres épocas climáticas (época seca menor, Esm, época lluviosa mayor, ELLM, y época seca mayor, ESM), desde julio de 1998 hasta abril de 1999, en nueve estaciones distribuidas ampliamente en el área de estudio y que coinciden con los sitios habituales de pesca. Cuatro estaciones se ubicaron en sitios de intervención antrópica, tres en áreas de influencia fluvial, una en el límite con el mar y una en el centro del espejo de agua.
Como método de captura se utilizó la atarraya individual (10,5 m de diámetro y 2,5 a 6 cm de abertura de malla, medida tomada del centro a los extremos de la atarraya, escogida previo censo realizado en el área), arte de pesca poco selectivo que permite la captura de ejemplares en un ámbito de tallas amplio (Santos-Martínez, 1998) y se adapta fácilmente a las características batimétricas, sedimentológicas y topográficas de la ciénaga de Mallorquín (Galvis et al., 1989). El número de lances por estación fue de 12. Según lo establecido por León y Montero (1993), el área total muestreada por jornada sería representativa con respecto a la de la ciénaga.
Los peces colectados se guardaron en bolsas plásticas previamente rotuladas y se transportaron en una nevera de poliestireno con hielo. Estos fueron identificados utilizando principalmente los trabajos taxonómicos de Dahl (1971), Fischer (1978), Acero y Arenas (1990), Cervigón et al. (1992) y Arenas y Acero (1993); los ejemplares se pesaron con una balanza triple brazo de 0,1 g de precisión.
Para el análisis de la información a nivel comunitario se tomaron datos de abundancia y biomasa y se utilizaron los índices de riqueza específica de Margalef, dominancia de Simpson y diversidad de Shannon–Weaver (1949). Los resultados de abundancia, biomasa y riqueza específica por época climática se analizaron con ANOVA a una vía para determinar si existen o no diferencias significativas. La clasificación de los peces por categorías de acuerdo con la frecuencia de aparición se basó en lo propuesto por Santos-Martínez y Acero (1991), donde las especies que aparecen de uno a ocho meses se consideraron visitantes (visitantes ocasionales 1–3 meses, visitantes frecuentes 4–8 meses) y las colectadas de nueve meses en adelante como residentes.
RESULTADOS
Composición: En la ciénaga de Mallorquín se registró un total de 42 especies de peces pertenecientes a 24 familias; sin embargo, la evaluación de la estructura y dinámica de la comunidad íctica se realizó con 36 especies pertenecientes a 22 familias. Seis especies adicionales aunque se registraron fueron excluídas del análisis de la comunidad por haberse capturado únicamente en muestreos preliminares. Esos peces son Centropomus ensiferus (Centropomidae); Dormitator maculatus y Eleotris pisonis (Eleotridae); Awaous banana y Gobionellus boleosoma (Gobiidae) y Poecilia sphenops (Poeciliidae). Treinta del total de especies se registran por primera vez para esta ciénaga.
Las familias con mayor número de especies durante el tiempo de estudio fueron Carangidae y Gerreidae con cuatro especies cada una (11% de la captura total cada una), Mugilidae, Ariidae y Sciaenidae con tres cada una (8%). En su clasificación por categorías se encontró que de las 36 especies registradas, el 16% fueron consideradas como residentes y el 84% como visitantes (el 58% como visitantes ocasionales y el 26% como visitantes frecuentes) (Tabla 1).
Abundancia: En el período de estudio se capturó un total de 2424 individuos. Se encontraron los mayores registros en las familias Mugilidae, Engraulidae, Gerreidae y Ariidae, representadas por las especies Mugil incilis (40,6% de la captura total), Cetengraulis edentulus (26,6%), Diapterus rhombeus (9,5%), Eugerres plumieri (8,8%) y Cathorops spixii (3,1%), entre todas con un 88,6% (2147 individuos) de la captura total (Figura 2).
Aún cuando el análisis de varianza a una vía no arroj ó diferencias estadísticamente significativas por épocas climáticas (ANOVA F2,15 = 1,83 p>>0,05); el número de individuos capturados fue ascendiendo de la Esm a la ESM; en la Esm se registraron 276 individuos (11,4% del total de la captura), en la ELLM 823 individuos 34,0%) y en la ESM 1325 individuos (54,7%).
Detallando el comportamiento por mes de muestreo se encontró el menor valor en julio, 118 individuos (4,9%), y el mayor valor en febrero, 524 individuos (21,6%). En cuanto a las especies M. incilis se destaca durante el tiempo de estudio; siendo superada por la especie C. Edentulus en enero, 147 individuos (44,3%), y febrero, 235 individuos (44,9%). En este último mes aumentaron de forma considerable con relación a los anteriores las especies D. Rhombeus, 56 individuos (10,7%), E. Plumieri, 69 individuos (13,2%) y C. Spixii, 18 individuos (3,4%) (Figura 3).
Biomasa: La biomasa total capturada fue de 187 kg. Estuvo conformada en un 89,6% por las familias Mugilidae, Engraulidae, Gerreidae y Ariidae, representadas por las especies M. incilis (62,4%), C. edentulus (14,5%), E. plumieri (5,4%), A. bonillai (3,0%) y M. liza (2,7%), con un valor de 164,5 Kg. (Figura 4).
Aún cuando el análisis de varianza a una vía no arrojó diferencias estadísticamente significativas por épocas climáticas (ANOVA F2,15 = 0,65 p>>0,05); se puede observar una tendencia al aumento de la Esm con 25,3 kg (13,5%), a la ELLM con 79,1 kg (42,3%) hasta la ESM con 82,6 kg (44,2%). Por mes de muestreo se encontr ó el menor valor en julio 11 kg (5,9%) y el mayor valor en febrero 28,7 kg (15,4%). En cuanto al comportamiento por especies se destacó M. incilis durante los 10 meses, registrándose el máximo valor en noviembre, 19,8 kg (77,7%), y C. edentulus con un aumento en enero 6,5 kg (29,5%) y febrero 9,6 kg (34,3%) (Figura 5).
Dominancia: Los valores de dominancia de Simpson obtenidos durante el tiempo de estudio se observan en la tabla 2. Cuatro especies de tres familias dominaron, M. incilis (s=0,165), C. edentulus (s=0,070), D. rhombeus (s=0,009) y E. plumieri (s=0,008), representando un 85,4% del total capturado. Por época clim ática se encontró que las especies dominantes en Esm fueron M. incilis (s=0,302) y E. plumieri (s=0,031); en ELLM dominaron C. edentulus (s=0,0252) y M. incilis (s=0,243) y en ESM C. edentulus (s=0,146) y M. incilis (s=0,103).
Riqueza: Por mes de muestreo se registró el menor valor en julio (11) y el mayor valor en octubre (17) (Figura 6). Sin embargo, el análisis de varianza a una vía no arrojó diferencias estadísticamente signficativas por épocas climáticas (ANOVA F2,15 = 0,11 p>>0,05).
Diversidad: A través del tiempo de estudio los valores de diversidad oscilaron entre 0,33 obtenido en agosto de 1998 y 0,13 obtenido en febrero de 1999 (Tabla 3). En el comportamiento por épocas climáticas se observó un descenso en los valores registrados de Esm a ESM (0,20 y 0,07 respectivamente).
DISCUSIÓN
Las fluctuaciones físico-químicas típicas de los ecosistemas lagunares costeros favorecen el desarrollo de especies pioneras o euritolerantes. En el caso de la ciénaga de Mallorquín, 29 especies (80,5%) del total son típicas de ambientes costeros y estuarinos (incluyendo las eurihalinas y las que habitan en zonas con afluencia de aguas dulces o marinas), seis (16,7%) son costeras y una (2,8%)% es típica de agua dulce, llegando a los estuarios de forma ocasional.
Según su estatus, aunque la gran mayoría de las especies fueron consideradas como visitantes ocasionales o frecuentes, estas nunca lograron desplazar a las residentes que alcanzaron los mayores valores en abundancia numérica y biomasa durante el tiempo de estudio. Entre estas se destacaron en orden de importancia M. incilis, C. edentulus, E. plumieri y D. rhombeus; correspondiendo al 11% del total de especies analizadas (36).
Según Yáñez-Arancibia et al. (1985), una especie es dominante en aguas tropicales cuando se destaca por su abundancia numérica, biomasa, distribución amplia dentro del ecosistema y elevada frecuencia. Para el caso de la ciénaga de Mallorquín la dominancia íctica estuvo representada por M. incilis, C. edentulus, D. rhombeus y E. plumieri, lo cual puede ser un indicio de que esas especies se encuentran mejor adaptadas al ecosistema.
Las cuatro especies antes mencionadas son típicas de ambientes costeros y estuarinos; tal es el caso de C. edentulus, que es considerada común en aguas marinas cercanas a la costa, y M. incilis, E. plumieri y D. rhombeus, catalogadas como típicas de ciénagas y aguas salobres; los mayores valores de abundancia y biomasa se registraron para M. incilis y C. edentulus. Basado en estudios previos realizados por Yáñez-Arancibia et al. (1985) en estuarios tropicales de México, Aguirre y Yáñez (1986) en la laguna de Términos (México) y Santos-Martinez (1989) y Arenas y Acero (1993) en CGSM, mientras que M. incilis se caracteriza por ser omnívora y C. edentulus macrofiltradora, E. plumieri y D. rhombeus comedoras de pequeños invertebrados que demandan en su dieta copépodos, poliquetos, moluscos y crustáceos, al parecer pocos abundantes en Mallorquín. Por lo tanto, es importante realizar estudios que involucren la ecología trófica de estas especies para aclarar tales presunciones.
Los mayores registros de especies costero-estuarinas en las tres épocas climáticas estudiadas, Esm (79%), ELLM (69%) y ESM (74%), se presentaron debido al permanente contacto de la ciénaga con el mar, ya sea de forma natural o artificial. Esto podría estar ejerciendo algún tipo de cambio en las condiciones fisico-químicas de la ciénaga y por lo tanto influyendo en los ciclos reproductivos de algunas especies y en los procesos de migración de otras.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al Instituto del Agua de la Universidad del Atlántico por su apoyo y solidaridad; a la facultad de Ciencias Básicas de esta universidad por su apoyo logístico. A los pescadores quienes aportaron su trabajo y paciencia para obtener el total de las muestras de este estudio. A Arturo Acero, Profesor Universidad Nacional de Colombia y al Ingeniero Pesquero Efraín Viloria Maestre, por sus acertadas asesorías y comentarios. A los Biólogos Edgar Patiño, Luis Carlos Gutiérrez y al Estadístico Carlos Panza, por las revisiones del documento con sus respectivas recomendaciones. A los evaluadores quienes contribuyeron con sus valiosas críticas y sugerencias a mejorar la calidad de este artículo. A la familia Guerrero Barrios y especialmente a Andrés por su apoyo incondicional durante el desarrollo del estudio.
BIBLIOGRAFÍA
1 Acero, A. y P. Arenas. 1990. Gobioides broussonneti Lacepède (Pisces: Gobiidae) en el Caribe colombiano. An. Ins. Invest. Mar. Punta Betín. Santa Marta, 19-20: 197-200. [ Links ]
2 Aguirre, A y A. Yáñez. 1986. Las mojarras de la laguna de Términos: taxonomía, biología, ecología y dinámica trófica (Pisces: Gerreidae). An. Inst. Cienc. Mar Limnol. Univ. Nal. Autón. México, 13 (1): 369-444. [ Links ]
3 Arango, R. y E. Rodas. 1978. Fecundidad, maduración y ciclo anual de los oocitos de la mojarra rayada Eugerres plumieri (Cuv. et Val). 1830 (Pisces: Gerridae) en la Ciénaga Grande de Santa Marta. Tesis de grado, Univ. Jorge Tadeo Lozano, Bogot á, 65 p. [ Links ]
4 Arenas, P. y A. Acero. 1993. Taxonomía y distribución de las mojarras (Pisces: Perciformes: Gerreidae) de la Ciénaga Grande de Santa Marta (Colombia). Bol. Ecotrópica, 20: 1-19. [ Links ]
5 Arrieta, L. y J. de la Rosa. 2000. Distribución espacio-temporal de la mojarra rayada (Eugerres plumieri) en la ciénaga de Mallorquín. Tesis de grado, Univ. del Atlántico, Barranquilla, 78 p. [ Links ]
6 Bateman N. y Y. Rojas. 1999. Proyecto evaluación ecológica del antiguo delta del río Sinú. Córdoba (Colombia), 157 p. INVEMAR, Santa Marta. [ Links ]
7 Cervigón, F, R. Cipriani, W. Fischer, L. Garibaldi, M. Hendrickx, A. J. Lemus, R. Márquez, J.M. Poutiers, G. Robaina y B. Rodríguez. 1992. Guía de campo de las especies comerciales marinas y de aguas salobres de la costa septentrional de Sur América. Fichas FAO de identificación de especies para los fines de la pesca. FAO, Roma, 513 p. [ Links ]
8 CORMAGDALENA-CRA-Uninorte. 1998. Estudio de factibilidad de la recuperación de la ciénaga de Mallorquín. Inf. Ejecutivo, Corporación Autónoma Regional del Atlántico, Barranquilla, 254 p. [ Links ]
9 CRA. 1995. Estudio ambiental de la ciénaga de Mallorquín. Anaya y Asociados Ltda, Corporación Autónoma Regional del Atlántico, Barranquilla, 237 p. [ Links ]
10 CRA. 1997. Ciénaga de Mallorquín. Resumen Ejecutivo CRA, Barranquilla, 12 p. [ Links ]
11 Dahl, G. 1971. Los peces del norte de Colombia. INDERENA, Bogot á, 248 p. [ Links ]
12 Fischer, W. 1978. FAO Species Identification Sheets for Fishery Purposes. Western Central Atlantic. FAO. Roma. [ Links ]
13 Galvis, O., O. Herrera y L. Rodríguez. 1989. Diagnóstico biológico-pesquero de la Ciénaga de Mallorquín. Informe Técnico. Universidad del Atlántico, Barranquilla, 12 p. [ Links ]
14 Galvis, O., S. Téllez y A. Lora. 1992. Contribución al conocimiento de las características medio-ambientales de la ciénaga de Mallorquín. VIII Semin. Nac. Cien. Tecnol. Mar. CCO, Bogotá, Vol. 1: 483-489. [ Links ]
15 González, E. 1981. Estudio bioecológico de los estadios juveniles de peces en la Ciénaga Grande de Santa Marta y zonas adyacentes. Tesis de grado, Univ. Nacional de Colombia, Bogotá, 95 p. [ Links ]
16 Gutiérrez, E. 1986. Evaluación ambiental preliminar de las lagunas costeras de Mallorquín y Puerto Colombia (Atlántico). Informe Técnico, Unidad Ambiental Cartagena, Barranquilla, 17 p. [ Links ]
17 Imbeth, O., F. Ortega, E. Romero y K. Sierra. 2000. Unidad de actuaci ón urbanística y parque ecológico para la ciénaga de Mallorquín y su área de influencia. Tesis de grado, Univ. del Atlántico, Barranquilla, 196 p. [ Links ]
18 Lamprea, L. 1990. Aspectos ecológicos de los juveniles de peces en la Ciénaga Grande de Santa Marta con énfasis en las ciénagas menores del margen occidental. Tesis M. Sc. Biol. Mar., Univ. Nacional, Bogotá, 98 p. [ Links ]
19 León, O. y I. Montero. 1993. Diseño de investigaciones. Edit. McGraw Hill, Madrid, 311 p. [ Links ]
>20 Minambiente-ICFES-PAC BID. 1998. Manejo de ecosistemas de manglar y arrecifes de coral. Santa Marta, 200 p. [ Links ]
21 Roldán, G. 1992. Fundamentos de limnología neotropical, Colombia. Universidad de Antioquia, Medellín, 522 p. [ Links ]
22 Rubio, C. 1975. Sobre el crecimiento, sexualidad y desarrollo gonadal de la mojarra rayada Eugerres plumieri (Cuvier), de la Ciénaga Grande de Santa Marta, con anotaciones sobre su biología. Tesis de grado, Univ. Jorge Tadeo Lozano, Bogot á, 100 p. [ Links ]
23 Santos-Martínez, A. 1998. Evaluación de los principales recursos pesqueros en la Ciénaga Grande de Santa Marta, costa Caribe colombiana. Informe de proyecto, INVEMAR., Santa Marta, Vol.2. Sin paginar. [ Links ]
24 Santos-Martínez, A. y A. Acero. 1991. Fish community of the Ciénaga Grande de Santa Marta (Colombia): composition and zoogeography. Ichthyol. Explor. Freshwaters, 2 (3): 247-263. [ Links ]
25 Santos-Martínez, A. y S. Arboleda. 1993. Aspectos biológicos y ecológicos del macabí Elops saurus (Pisces: Elopidae) en la Ciénaga Grande de Santa Marta y costa adyacente, Caribe colombiano. An. Inst. Invest. Mar. Punta Betín, 22: 77 - 96. [ Links ]
26 Shannon - Weaver. 1949. The mathematical theory of communication. University of illinois Press. Urbana. [ Links ]
27 Sociedad Portuaria Bocas de Ceniza. 1998. Estudio impacto ambiental del puerto de aguas profundas de Bocas de Ceniza. Barranquilla, Tomos 3 y 4, 455 p. y sin paginar. [ Links ]
28 Universidad del Norte. 1993. Estudio para determinar el comportamiento de la ciénaga de Mallorquín al recibir el agua procedente del Río Magdalena a través del Tajamar Occidental. Centro de consultoria y servicios, Barranquilla, 56 p. [ Links ]
29 Viloria, G. 1989. La Ciénaga de Mallorquín. Barranquilla, 89 p. [ Links ]
30 Yáñez-Arancibia, A. 1986. Ecología de la zona costera: análisis de siete tópicos. A.G.T. México, 189 p. [ Links ]
31 Yáñez-Arancibia, A. y R.S. Nugent. 1977. El papel ecológico de los peces en estuarios y lagunas costeras. An. Centro Cienc. Mar Limnol. 4 (1): 107-114. [ Links ]
32 Yáñez-Arancibia, A., A.L. Lara-Domínguez, A. Aguirre-León, S. Díaz-Ruiz, F. Amezcua-Linares, D. Flores-Hernández y P. Chavance. 1985. Ecología de poblaciones de peces dominantes en estuarios tropicales: Factores ambientales que regulan las estrategias biológicas y la producción. 311-366. En: A. Yáñez-Arancibia (Ed.). Fish community ecology in estuaries and coastal lagoons: Towards an ecosystem integration. UNAM, México. [ Links ]
33 Yáñez-Arancibia, A., A.L. Lara-Domínguez y D. Pauly. 1994. Coastal lagoons as fish habitats. 363-377. En: A. Yáñez-Arancibia (Ed.). Coastal lagoons processes, Elsevier science. Mexico [ Links ]
FECHA DE RECEPCIÓN: 02/04/01 FECHA DE ACEPTACIÓN: 23/06/03