Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.34 no.1 Santa Marta Dec. 2005
Juan Carlos Márquez¹ y Juan Manuel Díaz²
¹Instituto de Investigaciones Marinas y Costeras, INVEMAR, AA. 1016, Santa Marta, Colombia. Instituto Alexander von Humboldt, Kra. 7 No. 35-20, Bogotá D.C., Colombia. E-mail: jcmarquez@invemar.org.co
²Instituto de Investigaciones Marinas y Costeras, INVEMAR, AA. 1016, Santa Marta, Colombia.Instituto Alexander von Humboldt, Kra. 7 No. 35-20, Bogotá D.C., Colombia. E-mail: jmdiaz@humboldt.org.co
RESUMEN
La proliferación de las macroalgas en los arrecifes coralinos es un fenómeno reconocido desde hace más de dos décadas y se atribuye, generalmente, a las actividades humanas en las costas. No obstante, el papel de la competencia en este proceso es poco claro y se ha asumido que las algas son competitivamente superiores que los corales, aun cuando se he demostrado que esto no es cierto para todos los casos. El objetivo del presente estudio fue demostrar que existe una dependencia entre la categoría de interacción y las especies en interacción. Para ello se cuantificó la frecuencia de las diferentes categorías de interacción a lo largo de transectos de 20 m de longitud, dispuestos sobre el fondo en tres localidades representativas en el archipiélago de San Bernardo. Los resultados mostraron una dependencia significativa entre la categoría de interacción y las combinaciones coral-macrolga. En la categoría Recubrimiento (R) se destacó el alga Halimeda opuntia, en interacción con los corales Montastraea annularis, Porites astreoides y Porites porites, este último también, con el alga Lobophora variegata. En las otras categorías Halimeda discoidea fue la macroalga con mayor porcentaje de encuentros en las categorías Contacto periférico (CP), Contacto de tejido (CT) y No contacto (NC). En la categoría CP, fueron frecuentes además las interacciones entre M. annularis con las algas H. opuntia y Dictyota bartayresiana y con el grupo de las algas rojas calcáreas. Todo lo anterior nos llevo a la conclusión de que los factores intrínsecos, es decir los factores propios de las especies de coral y las macroalgas involucrados en interacción, tienen el potencial de determinar la categoría de interacción o la manera como se relacionan estos dos componentes bentónicos de los arrecifes coralinos.
PALABRAS CLAVE: Corales, Macroalgas, Interacciones, Islas de San Bernardo, Colombia, Caribe
ABSTRACT
Macroalgae proliferation on coral reefs has been a recognized phenomenon for the past two decades and is generally entitled to the human activities on the coasts. Even thought, the role of competition in this process is not clear and it has been assumed that algae are competitively superiors to corals, even when has been demonstrated that this is not always the case. It is probable that the result of coral-macroalgae depends upon the species involved. The goal of this study was to demonstrate that there is a dependence relation between interaction category and interacting species. In order to resolve this, quantifications of interactions per category along 20 m transects were done on three representative localities at the Archipielago de San Bernardo. The results show a significant dependency between interaction category and coral-macroalgae combinations. The highest percentage of encounters at the R (overgrowth) category was that one between Halimeda opuntia, and the coral species Montastraea annularis, Porites astreoides and Porites porites, as well as this last coral with the algae Lobophora variegta.. Halimeda discoidea was the macroalgae with the highest percentage of interactions on the categories CP (peripheral contact), CT (tissue contact) and NC (no contact). At the CP category, it was common to find the interactions between the coral M. annularis and the algae H. opuntia and Dictyota bartayresiana besides of the interactions with the red calcareous algae group. All this have led us to conclude that the intrinsic factors, those inherent to the coral and macroalgae species involved in interactions, have the potential to determine the category of interaction or the way this two benthic components relate to each other.
KEY WORDS: Corals, Macroalgae, Interactions, San Bernardo islands, Colombia, Caribbean
INTRODUCCIÓN
En las pasadas dos décadas, los arrecifes coralinos en el Caribe han experimentado cambios en la dominancia de sus componentes bentónicos. El más notorio ha sido la disminución de la cobertura coralina acompañada por un aumento de las macroalgas (Littler y Littler, 1985; Hughes, 1994; Szmant, 2002). Esto generalmente se ha asociado a perturbaciones de origen humano, como son eutroficación, altas tasas de sedimentación y sobrepesca, que han generado mortalidad coralina, y una consecuente liberación de espacio, que ha favorecido el crecimiento desmesurado de las algas, lo que a su vez pueden desplazar más el coral vivo remanente (Steneck, 1988; Littler et al., 1992; McCook et al., 1997; Te, 1997). En este esquema, sin embargo, el papel de la competencia entre los corales y las macroalgas no es muy claro y se asume que una vez liberadas las algas de sus factores limitantes (disponibilidad de nutrientes y herbivoría por ejemplo), están en plena capacidad de recubrir a los corales. En otras palabras, se asume que las algas son competitivamente superiores a los corales (Birkeland, 1977; Tanner, 1995; Paine, 1984). Empero esto no ha sido demostrado a cabalidad (McCook et al., 2001). En estudios recientes se ha señalado que el resultado neto de la competencia entre corales y macroalgas puede ser muy variable y que estas variaciones pueden depender de los organismos involucrados (McCook et al., 2001).
Así por ejemplo, Nugues et al., (2003) encontraron que el efecto de los filamentos mesentéricos de los corales sobre las algas depende de las especies de coral y algas involucradas, aún cuando en todos los casos estudiados los filamentos inhibieron el crecimiento de las algas sobre el tejido coralino vivo. Jompa y McCook (2003 a y b), por el contrario, hallaron que solo algunas especies de macroalgas están en capacidad de recubrir y matar tejido coralino mediante el uso de sustancias químicas o por abrasión. Así, mientras que en unos estudios se ha encontrado que las algas pueden afectar negativamente a los corales (Tanner, 1985; Hughes, 1989; River y Edmunds, 2001, Jompa y McCook 2002) en otros, se afirma lo contrario (McCook, 2001; McCook et al., 2001).
Estos resultados muestran la potencial variabilidad, tanto del proceso, como el resultado de la competencia entre corales y algas. Según Jompa y McCook (2003b), esta variabilidad puede ser interpretada en términos del limitado número de mecanismos por los cuales los corales y las algas pueden afectarse unos a otros, los cuales dependen en gran proporción de sus propiedades físicas, biológicas y químicas. Siguiendo esta idea el objetivo del presente estudio fue evaluar si el resultado de la competencia entre corales y macroalgas depende del carácter de las especies involucradas, es decir los factores intrínsecos a las interacciones.
ÁREA DE ESTUDIO
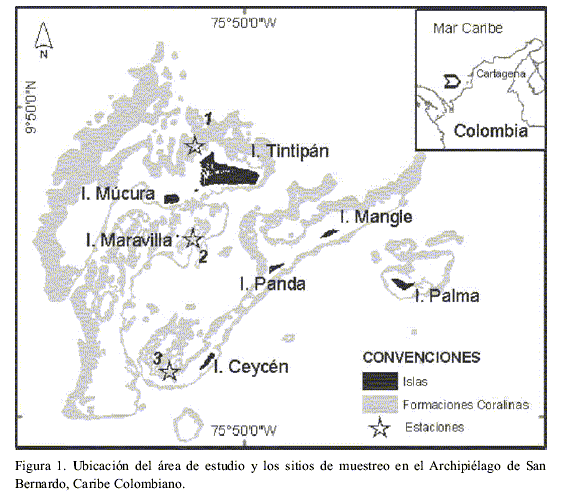
El trabajo fue adelantado en las formaciones coralinas del archipiélago de San Bernardo, localizado en la región central de la plataforma continental del Caribe colombiano, frente a las costas del Golfo de Morrosquillo (9° 39’ y 9°52’ N; 75º 41’ y 75° 57’ W) (Figura 1). El Archipiélago tiene una extensión aproximada de 255 km² e incluye un conjunto de ocho islas, un islote artificial y una serie de bancos y bajos coralinos de poca profundidad (Díaz et al., 2000; López-Victoria y Díaz, 2000). Desde el año1996, el archipiélago fue adherido al Parque Nacional Corales del Rosario, mediante la resolución 1425 del Ministerio del Medio Ambiente.
Las formaciones coralinas del archipiélago conforman un complejo arrecifal del que hacen parte estructuras franjeantes y de parche, tapetes coralinos de escaso relieve, domos y bancos coralinos, en las que están representadas distintas comunidades coralinas, dominadas por corales como Porites porites, Agaricia spp. y Montastraea spp., entre otros (Díaz et al., 2000). Cerca del 40 % de la extensión ocupada por las formaciones coralinas distribuidas entre 4 y 20 m de profundidad corresponde a arrecifes franjeantes y de parche dominados por Montastraea annularis, M. favelolata y M. franksi (López-Victoria y Díaz, 2000).
El régimen climático e hidrográfico es el característico para esta región, con una precipitación promedio anual de alrededor de 1000 mm distribuida en dos épocas climáticas principales, una seca, de diciembre a abril, y otra lluviosa, de mayo a noviembre. La temperatura promedio anual del aire es 26.7ºC. Las aguas que bañan las islas son relativamente transparentes, con una temperatura media de 28ºC y una salinidad de 34 (Patiño y Flórez, 1993).
MATERIALES Y MÉTODOS
Se seleccionaron tres estaciones de muestreo (Figura 1), en la unidad ecológica Montastraea spp. y en formaciones arrecifales de tipo tapete coralino, ubicadas entre 4 y 6 m de profundidad (Figura 1). Esto con el fin de lograr la mayor representatividad posible dentro del archipiélago en lo que respecta a las interacciones entre corales y macroalgas, pues esta zona ecológica así como el tipo de formación son las que representan mayor cobertura en el Archipiélago (López–Victoria y Díaz, 2000). Los muestreos se realizaron durante los meses de febrero a mayo de 2000 durante la época seca.
Se definieron las siguientes categorías de interacción, siguiendo los criterios y categorías propuestos por Aerts (1999) para las interacciones entre corales y esponjas (Figura 2): (R) recubrimiento del coral vivo por macroalgas; (CP) contacto periférico de una macroalga a lo largo y paralelo al coral vivo por más de 3 cm del perímetro; (CT) contacto de tejidos (una macroalga en contacto con el borde de un coral vivo por 3 cm o menos del perímetro) y; (NC) no contacto en donde la macroalga se encuentra a una distancia inferior a 5 cm de distancia del coral, al alcance de los tentáculos barredores, pero no en contacto con tejido vivo de éste.

Con el fin de establecer las frecuencias de interacción, tanto para cada especie de coral y de macroalga, como para cada categoría de interacción se realizaron cuantificaciones empleando transectos de 20 m de longitud tendidos aleatoriamente sobre sustrato predominantemente coralino, con 8 repeticiones por estación. Cada colonia coralina interceptada por el transecto fue revisada minuciosamente en busca de interacciones; en los casos en que una colonia presentaba más de una interacción, cada una se registraba individualmente. Para cada interacción se anotaron las especies de coral y macroalga involucradas (identificación in situ, las macroalgas no identificadas en campo se recolectaron para posterior identificación) a excepción de las algas rojas calcáreas que se tomaron como un grupo funcional. Adicionalmente se realizaron anotaciones sobre las características particulares observadas en los corales y macroalgas en el área de interacción, tales como palidecimiento, blanqueamiento, enfermedades etc.
Con el fin de evaluar si las proporciones en que se encontraron las categorías de interacción eran independientes de las estaciones y combinaciones coral-macroalga, se llevaron a cabo análisis de tablas de contingencia. El grado de significancia de la independencia se estableció mediante pruebas de bondad de ajuste Chi cuadrado (Sokal y Rohlf, 1995). Adicionalmente y sólo en las tablas en donde se encontró dependencia, se llevaron a cabo pruebas de partición de grados de libertad (Sokal y Rohlf, 1995) para conocer la identidad de la combinación coral-macroalga que mostró dependencia por las categorías de interacción. Para evitar sesgos ocasionados por las bajas frecuencias de interacción de algunas combinaciones, se tuvieron en cuenta solo 12 combinaciones, que reunieron aproximadamente el 74 % de las interacciones.
RESULTADOS
En total se cuantificaron 394 interacciones, las cuales involucraron 19 especies de coral y cinco de macroalga, además del grupo de algas rojas calcáreas (Tabla 1), para un total de 59 combinaciones coral-macroalga (Tabla 2). Las interacciones más frecuentes estuvieron dentro de la categoría CP (43.1%) seguida por las interacciones en las categorías NC (28.7%) y R (21.6%), por último la categoría menos frecuente fue CT con el 6.6% del total de las interacciones registradas. Las proporciones de los diferentes tipos de interacción no variaron significativamente entre estaciones (P>0.05, n=394), lo que permitió una evaluación en conjunto de las interacciones combinadas para las tres estaciones.

Contrario a lo anterior, la proporción de las categorías de interacción sí varió con las combinaciones de coral-macroalga más frecuentes (X²= 213.3, P=0.000, n=291). Los análisis a-posteriori de repetición de grados de libertad no revelaron un patrón generalizado, indicando que prácticamente cada especie de coral o macroalga rara vez interactúa de manera consistente con las especies del otro grupo.
Dependiendo de la categoría y de las especies involucradas se observaron tendencias de asociación. En las interacciones de la categoría R se destacó el alga Halimeda opuntia, que recubrió principalmente a los corales Montastraea annularis (43.6 %), Porites astreoides (66.7 %) y Porites porites (100 %). Este último también se vio recubierto casi en todas las interacciones en que se involucró, con el alga Lobophora variegata (92.9 %), contrario a lo que sucedió en los encuentros entre esta macroalga y M. annularis, interacciones que en su mayoría fueron de tipo NC (50 %). Estos encuentros solo se observaron en la estación uno, para la cual fue exclusiva la presencia de esta especie de macroalga.
No obstante lo anterior, los recubrimientos no fueron las interacciones más frecuentes entre los corales y las macroalgas como se señaló en el primer párrafo, como si lo fueron las otras tres interacciones con un 74 % de las interacciones registradas. En estas categorías también se encontraron algunos patrones destacables como que por ejemplo, Halimeda discoidea fue la macroalga con mayor porcentaje de encuentros en las categorías CP, CT y NC (53.4 %). En la categoría CP, fueron frecuentes además las interacciones entre M. annularis con las algas H. opuntia (32.7 %) y Dictyota bartayresiana (82.9 %), sin dejar a un lado el grupo de las algas rojas calcáreas (87.5 %).
Los corales involucrados en interacciones de la categoría de recubrimiento mostraron signos claros de estrés. Las áreas de coral que fueron sobrecrecidas primero, esto es, las zonas cercanas al borde de la colonia, mostraron blanqueamiento total. Las áreas sobrecrecidas más recientemente (más alejadas del borde de la colonia) mostraron por lo general palidecimiento del tejido. En las interacciones de las categorías CP y CT los corales no mostraron ningún signo de afección; la coloración del tejido en contacto con las algas era similar a la del resto de la colonia. Tampoco en las interacciones de categoría NC se evidenciaron signos de estrés en el coral, sin embargo, en los casos en los que el alga se encontraba lo suficientemente cerca, sus frondas hacían contacto con el tejido coralino, evidenciándose un ligero oscurecimiento de éste.
Algunas de las algas en interacción, principalmente del género Halimeda, mostraron signos de mortalidad, particularmente en las porciones superiores. En contraste, las especies de Dictyota no evidenciaron mortalidad en sus frondas, al igual que L. variegata.
DISCUSIÓN
La monopolización del sustrato coralino por parte de macroalgas, observada en las últimas décadas ha sido tema de amplio estudio (McCook et al., 2001). Este fenómeno se adjudica generalmente a una alta concentración de nutrientes o a la sobrepesca de herbívoros, como también a las altas tasas de sedimentación y al estado de deterioro actual de los arrecifes coralinos, propiciado por las actividades humanas en las costas (Szmant, 2002). Todo lo anterior ha resultado en que la mayoría de estos estudios se hayan concentrado en entender el papel de estos factores, extrínsecos a las interacciones, y poco se haya hecho en el contexto de los factores intrínsecos, es decir, los que conciernen a los organismos involucrados en las interacciones (Nugues et al., 2004; McCook et al., 2001). Este estudio revela que los factores intrínsecos juegan también un papel dentro de este fenómeno, considerando la dependencia significativa entre las proporciones de las categorías de interacción con y de las combinaciones corales macroalgas, indicadas por los análisis de las tablas de contingencia.
Esta tendencia de asociación o dependencia ya se había observado anteriormente (Mejía-Niño y Garzón Ferreira, 2003) y está dada principalmente por la notoria dominancia de las interacciones de tipo contacto periférico (CP), contacto de tejido (CT) y no contacto entre las macroalgas y los corales, dominancia que se ha establecido también en otros estudios (Jompa y McCook, 2002; Mejía-Niño y Garzón Ferreira, 2003). Por lo anterior, es claro que los corales deben tener una manera de evitar ser recubiertos por las algas que crecen en sus inmediaciones. La respuesta está probablemente en sus mecanismos de competencia. Para los corales se han señalado básicamente dos: filamentos mesentéricos y tentáculos barredores (Lang, 1973; Logan, 1984; Chornesky, 1989; Chadwick, 1991). Nugues et al. (2004), encontraron que algunas especies de corales pétreos son capaces de evitar el recubrimiento por las algas H. opuntia, L. variegata y Dictyota sp., gracias a al acción de los filamentos mesentéricos. Las observaciones de estos autores coinciden además con las de este estudio, en cuanto a los efectos de los filamentos sobre las frondas de H. opuntia, como el palidecimiento y muerte de las mismas dentro del ámbito de acción los filamentos mesentéricos. Empero, la mortalidad que fue más evidente aquí, es decir la de las frondas superiores, probablemente solo se deba a las altas tasas de mortalidad, productividad y crecimiento características de esta alga (Freile y Hillis, 1997), ya que estas porciones están fuera del alcance de los mecanismos de defensa de los corales. La producción de mucus y/o aleloquímicos son otros de los mecanismos defensivos que se han observado pueden causar efectos similares sobre las algas (De Ruyter van Steveninck, 1988; McCook, 2001) y que pueden resultar en los patrones observados, es decir, una mayor proporción de interacciones diferentes al recubrimiento.
Ahora bien, no todas las especies de coral están igualmente capacitadas para evitar el recubrimiento por parte de las algas, lo que depende de sus capacidades competitivas, así, especies como P. porites y P. astreoides, registraron más del 90 % de sus interacciones en la categoría recubrimiento, principalmente por las algas H. opuntia y L. variegata, que se explicaría por su pobre capacidad competitiva (Lang, 1973; Logan 1984). Un caso similar está en las interacciones entre M. annularis y H. opuntia. Aunque en menor grado, este coral fue frecuentemente recubierto por esta alga, el cual es considerado como uno de capacidad competitiva intermedia (Lang, 1973; Logan 1984, Nugues et al., 2004).
No obstante lo anterior, y aunque las capacidades competitivas de los corales pueden explicar a grandes rasgos las tendencias observadas, ciertas características de las macroalgas pueden ofrecer explicaciones más claras en casos particulares de dependencia entre las especies (coral o macroalgas) y las categorías de interacción. La macroalga que con mayor frecuencia se observó recubriendo corales pétreos fue H. opuntia, mientras que H. discoidea fue registrada en las otras categorías de interacción. Por su parte, D. bartayresiana fue observada generalmente en interacciones de contacto periférico. Estas frecuencias posiblemente se relacionan con la forma de crecimiento y la susceptibilidad a los herbívoros. H. opuntia es un alga que crece formando agregaciones, por lo que requiere mayor espacio para la fijación (Hay, 1981); además, posee mecanismos de defensa contra los herbívoros como la calcificación y metabolitos secundarios (Hay, 1997; Littler et al., 1983). Todas estas características favorecen en buena medida el recubrimiento de los corales por parte de esta alga. La formación de agregaciones, además de requerir más espacio, favorece la acumulación de sedimentos en las partes bajas que ahogan a los pólipos adyacentes en caso de interacción, dejando sustrato libre para ocupar. No se puede descartar, sin embargo, que los metabolitos secundarios tengan algún efecto en la competencia con los corales, empero, no se observaron evidencias de lo anterior, como serían cambios en la coloración, blanqueamiento, oscurecimiento o muerte del tejido coralino en interacciones de no contacto con esta macroalga.
Aunque H. discoidea posee los mismos mecanismos de defensa contra los herbívoros que H. opuntia, su forma de crecimiento es diferente; no forma agregaciones. De manera generalizada, esta macroalga crece como individuos aislados y fijos al sustrato por un sólo apéndice de sujeción del que se desprenden algunas “ramas” (frondas), que usualmente no sobrepasan los 20 cm de altura (Littler y Littler, 2000). Las algas que crecen de esta manera requieren menos espacio (Hay, 1981), lo que disminuye la probabilidad de interacciones de contacto. No obstante la presencia de esta macroalga a corta distancia de los corales puede favorecer el recubrimiento por algas filamentosas, ya que si bien el apéndice de sujeción no está en contacto con el tejido coralino, es usual que sus frondas si lo estén, ejerciendo abrasión sobre el tejido que no le permite a los pólipos salir y alimentarse. Ello conduce a la muerte del pólipo, sobre el cual las algas filamentosas se posan rápidamente, como se ha observado en otros estudios (Coyer et al., 1983; River y Edmunds, 2001).
En lo que se refiere a las especies de Dictyota, siendo estas macroalgas oportunistas y muy susceptibles a ser consumidas por organismos herbívoros (Littler et al., 1983), su población no tiene la capacidad de eliminar por competencia a otras especies; sin embargo, su reproducción es vegetativa, por tanto, se encuentran con mayor frecuencia en interacciones de contacto periférico o contacto de tejido, limitadas en su distribución por la cantidad de espacio disponible y los mecanismo defensivos de los corales.
En cuanto a L. variegata, esta macroalga solo se encontró en la estación 1 (costado de barlovento del Archipiélago) y recubriendo a P. porites; en muy pocas oportunidades se observó en interacciones con otras especies. Es probable que las colonias de P. porites además de ser pobres competidoras, como se señaló anteriormente, por su forma y tamaño, no permitan el acceso del erizo, por lo que entonces pueden considerarse refugios contra la herbivoría del erizo, aunque esto no ha sido comprobado.
En resumen, las frecuencias de interacción para cada una de las categorías consideradas dependen de las especies involucradas en interacción y de sus propiedades intrínsecas; en el caso de los corales, se trata principalmente de sus mecanismos de competencia y de la eficacia y momento de acción de estos. En cuanto a las macroalgas, el tipo y estrategia de crecimiento, la susceptibilidad a los herbívoros y probablemente las sustancias aleloquímicas, son algunas de las propiedades que explicarían los patrones observados en este estudio en cuanto a las frecuencias de interacción por categoría entre los corales y las macroalgas. En consecuencia, podemos decir que estos factores intrínsecos a las especies de coral y las macroalgas involucrados en interacción, tienen el potencial de determinar la categoría de interacción o la manera como se relacionan estos dos componentes bentónicos de los arrecifes coralinos.
AGRADECIMIENTOS
Los autores agradecen al INVEMAR por la financiación y apoyo logístico a este trabajo. A Sven Zea por los aportes en los análisis estadísticos y sus oportunas observaciones, a Mateo López-Victoria por la colaboración en las labores de campo y sus sugerencias, a Diana Báez y Pablo Berrío por la asistencia en campo y a Gabriel González, Marta Montero (Tolú Náutica) y Luz Marina (Punta Faro) por su hospitalidad en Isla Mucura. A Germán Bula-Meyer(?) por su generosa ayuda en la identificación de las algas.
BIBLIOGRAFÍA
1. Aerts, L.A.M. 1999. Sponge-coral interactions on Caribbean Reefs. Disertación doctoral, Universidad de Ámsterdam, Holanda, 157 p. [ Links ]
2. Birkeland, C. 1977. The importance of rate of biomass accumulation on early successional stages of benthic communities to the survival of coral recruits. Proc. 3th Int. Coral Reef Symp., 15-21 pp. [ Links ]
3. Chadwick, N.E. 1991. Spatial distribution and the effects of competition on some temperate Scleractinia and Corallimorpharia. Mar. Ecol. Progr. Ser. 70: 39-48. [ Links ]
4. Chornesky, E.A. 1989. Repeated reversals during spatial competition between corals. Ecology, 70(4):843-855. [ Links ]
5. Coyer J.A. 1993. Interactions between corals and algae in a temperate zone rocky reef: Mediation by sea urchins. J. Exp. Biol. Ecol., 167: 21- 37. [ Links ]
6. De Ruyter van Stevenick, E.D. y A.M. Breeman. 1987. Deep Water Populations of Lobophora variegata (Phaeophyceae) on the Coral Reef of Curacao: Influence of Grazing and Dispersal on Distribution Patterns. Mar. Ecol. Prog. Ser. 38:241-250. [ Links ]
7. De Ruyter van Stevenick ED, LL Van Mulekon y AM Breeman. 1988. Growht inhibition of Lobophora variegata (Lamaroux) Womersly by scleractinian corals. J. Exp. Mar. Biol. Ecol. 115: 169-178. [ Links ]
8. Díaz, J.M., L.M. Barrios, M.H. Cendales, J. Garzón-Ferreira, J. Geister, M. López-Victoria, G.H. Ospina, F. Parra-Velandia, J. Pinzón, B. Vargas-Ángel, F.A. Zapata y S. Zea. 2000. Áreas Coralinas de Colombia. INVEMAR, Ser. Publ. Esp. 5, Santa Marta, 175 p. [ Links ]
9. Freile, D., y L. Hillis. 1997. Carbonate Productivity by Halimeda incrassata in a land proximal lagoon, Pico Feo, San Blas, Panamá. Proc. 8th Int. Coral Reef Symp., Panamá, 1: 762-772. [ Links ]
10. González, A.M., y J. Rojas. 1995. Estructura y composición de la comunidad macroalgal en el sistema arrecifal coralino del Archipiélago de San Bernardo, Caribe colombiano. Tesis profesional, Facultad de Biología Marina, Fundación Universidad de Bogotá Jorge Tadeo Lozano, Bogotá. [ Links ]
11. Hay, M.E. 1981. The functional morphology of turf-forming seaweeds persistence in stressful marine habitats. Ecology, 62(3): 743-750. [ Links ]
12. _____. 1997. The ecology and evolution of seaweed-herbivore interactions on coral reefs. Coral reefs 16 Suppl.: 67-76. [ Links ]
13. Hughes, T.P. 1989. Community structure and diversity of coral reefs: the role of history. Ecology, 70: 275-279. [ Links ]
14. _____. 1994. Catastrophes, phase ships, and large-scale degradation of a Caribbean coral reef. Science 265: 1547-1551. [ Links ]
15. Jompa J. y L.J. McCook. 2002. The effects of nutrients and herbivory on competition between a hard coral (Porites cylindrica) and a brown alga (Lobophora variegata). Limnol. Oceanogr., 47:527–534 [ Links ]
16. ______. 2003a. Contrasting effects of turf algae on corals: massive Porites spp. Are unaffected by mixed-species turfs, but killed by the red alga Anotrichium tenue. Mar. Ecol. Prog. Ser., 258: 79-86. [ Links ]
17. ______. 2003b. Coral-algal competition: macroalgae with different properties <have different effects on corals. Mar. Ecol. Prog. Ser., 258: 87-95. [ Links ]
18. Lang, J. 1973. Interspecific aggression by scelactinian corals. 2. Why the race is not only to the swift. Bull. Mar. Sci., 23(2): 261-279. [ Links ]
19. Littler, M.M. y Littler, D.S. 1985. Factors controlling relative dominance of primary producers on biotic reefs. Proc. Fifth Inter. Coral Reef Congress, Tahiti 4:35-40. [ Links ]
20. Littler D.S. y M.M. Littler. 2000. Caribbean Reef Plants. Offshore Graphics, Washington. [ Links ]
21. Littler, M.M, D.S. Litter y B.E. Lapointe. 1992. Modification of tropical reef community structure due to cultural eutrophication: The southwest coast of Martinique. Proc. 7th Int. Coral Reef Symp., Guam, Vol. 1: 335-343. [ Links ]
22. Littler, M.M., P.R. Taylor y D.S. Littler. 1983. Algal Resistance to Herbivory on a Caribbean Barrier Reef. Coral Reefs, 2: 111-118. [ Links ]
23. Logan, A. 1984. Interspecific aggression in hermatypic corals from Bermuda. Coral Reefs, 3: 131-138. [ Links ]
24. López-Victoria, M. y J.M. Díaz. 2000. Morfología y estructura de las formaciones coralinas del Archipiélago de San Bernardo, Caribe Colombiano. Rev. Acad. Col. Cienc. Exact. Fís. Nat., 24 (91):219-230. [ Links ]
25. McCook, L.J. 2001. Competition between corals and algal turfs along a gradient of terrestrial influence in the nearshore central Great Barrier Reef. Coral Reefs, 19:419-425. [ Links ]
26. McCook, L.J., I.R. Price y D.W. Klumpp. 1997. Macroalgae on the GBR: Causes and consequences, indicators or models of reef degradation. Proc. 8th Int. Coral Reef Symp., Panama, 2: 1851-1856. [ Links ]
27. McCook, L.J., J. Jompa y G. Díaz-Pulido. 2001. Competition and algae on coral reefs: a review of evidence and mechanism. Coral Reefs, 19:400-417. [ Links ]
28. Mejía-Niño, N. y J. Garzón-Ferreira. 2003. Dinámica de las inetracciones alga-coral en dos bahías de la región de Santa Marta (Caribe Colombiano) con distinto grado de influencia antropogénica. Bol. Invest. Mar. Cost., 32:243-261. [ Links ]
29. Morrison, D. 1988. Comparing fish and urchin grazing in shallow and deeper coral reef algal communities. Ecology 69(5): 1367-1382. [ Links ]
30. Nugues, M.M., L. Delvoyne y R.P.M. Bak. 2004. Coral defence against macroalgae: differential effects of mesenterial filaments on the green alga Halimeda opuntia. Mar. Ecol. Prog. Ser. 278: 103- 114. [ Links ]
31. Paine, R.T. 1984. Ecological Determinism in the Competition for Space. Ecology, 65(5):1339-1348. [ Links ]
32. Patiño, F. y F. Flórez. 1993. Estudio Ecológico del Golfo de Morrosquillo. Universidad Nacional de Colombia y fondo FEN-Colombia, Bogotá. 295p. [ Links ]
33. River, G.F. y P.J. Edmunds. 2001. Mechanims of interaction between macroalgae and scleractineans on coral reef in Jamaica. J. Exp. Mar. Biol. Ecol. 262: 159-172. [ Links ]
34. Sokal, R.R. y F.J. Rohlf. 1995. Biometry. 3ª edición. W.H. Freeman and Company. New York. 358p. [ Links ]
35. Steneck, R.S. 1988. Herbivory on coral reefs: a synthesis. Proc. 6th Int. Coral Reef Sym. 1: 37-49. [ Links ]
36. Szmant, A. M. 2002. Nutrient enrichment on coral reef: is it a major cause of coral reef decline? Estuaries, 25: 743-766. [ Links ]
37. Tanner, J.E. 1995. Competition between scleractinian corals and macroalgae: An experimental investigation of coral growth, survival and reproduction. J. Exp. Mar. Biol. Ecol., 190: 151-168. [ Links ]
38. Te, F.T. 1997. Turbidity and its effect on corals: A model using the extinction coefficient (K) of photosynthetic activity radiance (PAR). Proc 8th Int. Coral Reef Symp., Panama, 2: 1899-1904. [ Links ]













