Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.40 no.1 Santa Marta Jan./June 2011
EFECTO DEL TRATAMIENTO ALCALINO SOBRE LA PRODUCTIVIDAD Y LAS PROPIEDADES FÍSICAS DEL AGAR-AGAR PROVENIENTE DE GRACILARIA VERRUCOSA
EFFECT OF THE ALKALINE TREATMENT ON THE PRODUCTIVITY AND PHYSICAL PROPERTIES OF AGARAGAR FROM GRACILARIA VERRUCOSA
Efraín Andrés Montilla-Escudero1, Miryam Fátima Dulce-Rivadeneira1, Balkys Quevedo-Hidalgo2, Marcela Mercado-Reyes3, Ricardo Álvarez-León4, Jairo Napoleón Molina-Vargas5 y Alba Alicia Trespalacios-Rangel3
1 Pontificia Universidad Javeriana, Bacteriología. Bogotá, D.C. emontilla@ins.gov.co (E.A.M.E.), mfat45@hotmail.com (M.F.D.R.)
2 Pontificia Universidad Javeriana, Grupo de Biotecnología Ambiental e Industrial, Bogotá, D.C. bquevedo@javeriana.edu.co
3 Pontificia Universidad Javeriana, Grupo de Enfermedades Infecciosas, Bogotá, D.C. mmercado@javeriana.edu.co (M.M.R.), alba.trespalacios@javeriana.edu.co (A.T.R.)
4 Fundaciones Maguare y Verdes Horizontes, Manizales (Caldas), Colombia. alvarez_leon@yahoo.com
5 Asociación de Pescadores de Santa Verónica. jnmolinav@hotmail.com
RESUMEN
Se evaluó el efecto del tratamiento alcalino con NaOH sobre el rendimiento en la extracción y en las propiedades físicas del agar de Gracilaria verrucosa recolectada en Santa Verónica (Atlántico, Colombia). El tratamiento alcalino se realizó a temperatura entre 80 y 85 ºC, con concentraciones de solución de NaOH 3, 5, 7 y 10 % (p/v). Se determinó el rendimiento de la extracción y al agar obtenido se le midió la fuerza de gel y las temperaturas de fusión y gelificación. Aunque el rendimiento máximo se obtuvo para una concentración del 10 %, se encontraron diferencias significativas en las propiedades del agar, obteniéndose fuerza de gel máxima con solución 3 %. El agar-agar obtenido fue utilizado como base para agar nutritivo y se determinó su productividad mediante el método ecométrico utilizando 23 especies bacterianas, de las cuales Salmonella Enteritidis, Salmonella Typhimurium, Salmonella Cholerasuis y Morganella morganii no tuvieron una recuperación satisfactoria en el medio prueba ni en los controles (agares comerciales). Los resultados del índice de crecimiento relativo (ICR) mostraron que el agar nutritivo a base G. verrucosa tiene las mismas o mejores propiedades que los controles comerciales.
PALABRAS CLAVE: Agar, Gracilaria verrucosa, Productividad, Algas rojas.
ABSTRACT
The effect of the alkaline treatment on the yield of the extraction and physical properties of agar from Gracilaria verrucosa collected in Santa Verónica (Atlántico, Colombia) was investigated. The concentrations of sodium hydroxide solutions during the alkaline treatment were 3, 5, 7 and 10 % (w/v), while temperature was maintained in the range of 80-85 ºC. The agar yield, gel strength, melting and gelification temperatures were determined. Although the maximum yield was obtained with 10 % sodium hydroxide solution, the maximum gel strength was obtained at 3 %. The agar-agar was used as a base of nutritive agar for 23 bacterial cultures and the productivity was measured using the ecometric method. From the bacterial strains tested, Salmonella Enteritidis, Salmonella Typhimurium, Salmonella Cholerasuis and Morganella morganii did not grow in the test or commercial media. The measures of relative growth index showed that nutritive agar from G. verrucosa have the same or better properties than the commercial ones.
KEY WORDS: Agar, Gracilaria verrucosa, Productivity, Red algae.
INTRODUCCIÓN
El agar es una mezcla de polisacáridos obtenidos de algas rojas conocidas como agarófitas. Está compuesto por dos fracciones: un polímero neutro, agarosa, de alta fuerza de gel y agaropectina, un polisacárido sulfatado de baja fuerza de gel (Yaphe, 1984). Se extrae de las paredes de las algas Rhodophyta del género Gelidium, Gracilaria, Pterocladia y Gelidiella (Boraso de Zaixso, 1995). Este compuesto es utilizado como base de solidificación en los medios de cultivo empleados en microbiología, aunque tiene muchas otras aplicaciones en las industrias de alimentos, médica, biotecnológica y farmacéutica (Freile-Pelegrín, 2002).
El proceso de obtención de agar contempla diferentes etapas, de las cuales el pretratamiento alcalino y el método de extracción tienen un papel determinante en la calidad del producto obtenido. Este pretratamiento o cualquier otro, debe ser adaptado a cada especie de alga, ya que factores como diversidad morfológica, ciclo de vida, estado fisiológico de la especie de alga seleccionada, influyen en la calidad del agar extraído (Brito, 2000).
Según el procedimiento establecido por la Farmacopea de Estados Unidos (TUSPC, 2006) el agar debe gelificar a una concentración de 1.5 % en un rango de temperatura entre 32 y 39 °C para formar un gel firme y resistente, no se debe fundir a una temperatura inferior aproximada a los 85 °C. La calidad del agar tiene que ver con la temperatura de gelificación, temperatura de fusión y la resistencia de los geles, cuanto más fuerte es el agar menos cantidad necesita para formar gel. El agar de buena calidad suele resistir entre 400 y 500 g cm-2 de fuerza. El agar puro bien elaborado llega a los 500 g cm-2, mientras que uno inferior pocas veces sobrepasa los 200 g cm-2 (McHugh, 2003). Referente a las propiedades físicas y contenidos del agar, básicamente dependen de la materia prima empleada (géneros y especies), procedencia geográfica, época de cosecha, madurez del alga, parámetros ambientales y método de extracción (Marinho- Soriano y Bourret, 2003).
Los agares bacteriológicos no deben contener elementos que puedan inhibir el crecimiento de la bacteria, como trazas de metales, carbohidratos solubles, proteínas o esporas bacterianas. El agar no debe interactuar con ningún material que pueda ser adicionado como nutriente para la bacteria bajo estudio. El gel debe ser fuerte y transparente. La composición química de un medio de cultivo debe proveer los requerimientos nutricionales básicos para el crecimiento de microorganismos; el medio debe cumplir con dos características importantes, su productividad y su selectividad. La productividad, se refiere a la formulación básica del medio de tal forma que favorezca el crecimiento de microorganismos con las características microscópicas y macroscópicas esperadas. Es una variable de especial interés cuando se trabaja en el desarrollo de la producción de nuevos medios, ya que siempre se espera que los aportes nutricionales sean equilibrados para obtener el crecimiento y la producción de los metabolitos de interés. El análisis ecométrico establece la eficiencia con la cual un medio de cultivo sirve para recuperar una cepa, mediante la comparación que se realiza entre un microorganismo que crece (referente) y un microorganismo que no crece (interferente) (Mossel, 2003).
Generalmente las especies de Gracilaria producen "agaroides" que son agares de baja calidad debido a las altas concentraciones de sulfatos. Sin embargo, las propiedades de los geles preparados con agares extraídos de Gracilaria pueden ser mejorados con un tratamiento alcalino; este tratamiento convierte la L-galactosa- 6-sulfato en 3,6-anhidro-L-galactosa, eliminando el exceso de sulfato (Freile-Pelegrín y Robledo, 1997).
La farmacopea exige la verificación de la productividad de un medio de cultivo descrita como promoción de crecimiento. Los centros de control y prevención de enfermedades también exigen el uso de un método para verificar la eficacia del medio previo al uso (Kornacki et al., 2003). Uno de estos métodos es la técnica ecométrica descrita por Mossel et al. (1983) que implica la inoculación de poblaciones definidas de un cultivo específico sobre un medio sólido (Kornacki et al., 2003). Los parámetros para interpretar los resultados son el índice de crecimiento absoluto (ICA) que denota el último sector de la placa en el cual ha producido un crecimiento significativo y el índice de crecimiento relativo (ICR) que relaciona los valores de ICA del medio a evaluar con el ICA del medio control (Mossel, 2003).
El objetivo de este trabajo fue determinar la influencia de cuatro concentraciones de hidróxido de sodio sobre las propiedades físicas (fuerza de gel, temperatura de gelificación y temperatura de fusión) del agar obtenido a partir de Gracilaria verrucosa. Además, se evaluó la calidad del agar obtenido por medio del método ecométrico y se comparó con agares comerciales.
MATERIALES Y MÉTODOS
Área de estudio
La colecta del alga roja Gracilaria verrucosa (Hudson) Papenfuss (=G. caudata J. Agardh) (Rhodophyta: Gracilariaceae) se realizó en la bahía de Fray Domingo (playa de Punta de Piedra, 10° 52' N y 75° 08' W aprox., departamento del Atlántico), Caribe colombiano, en el mes de marzo de 2005. La playa tiene las siguientes características: parcialmente protegida de los vientos alisios por una barrera natural de pequeñas dunas y manglares (Rhizophora mangle, Avicennia germinans, Conocarpus erecta); oleaje suave, profundidad aproximada de 1.20 m, fondo arenoso e inestable.
Las frondes de G. verrucosa fueron recolectadas en la playa expuesta al mar abierto con oleaje de rompientes. El lecho marino está constituido cerca de la playa por arena y rocas pequeñas, y mar adentro por rocas grandes, con un diámetro promedio de 30 cm, en la zona eulitoral. Allí las rocas están cubiertas por arena o quedan expuestas según los movimientos del mar. Los penachos de algas estaban sobre las rocas semicubiertas por la arena durante la marea baja en la zona supralitoral, allí las rocas con penachos de algas, quedan al aire libre; también se incluyeron algas ubicadas en la zona sublitoral a una profundidad de 70 cm. No se hizo selección alguna para la recolecta, se desprendieron penachos grandes a mano y se llevaron a la cabaña de trabajo, para la operación de identificación, secado y una primera separación de otras algas, y su posterior empaque en bolsas de polietileno para su procesamiento y análisis en Bogotá. En el laboratorio se prehidrató con agua dulce y se hizo una segunda y cuidadosa separación en bandejas porcelanizadas blancas, de otras algas verdes, pardas y rojas, invertebrados (esponjas, moluscos, crustáceos, ascidias) y arena. Una vez eliminadas las impurezas, se secaron a 60 °C durante 20 h.
El reconocimiento e identificación del alga roja Gracilaria verrucosa (Hudson) Papenfuss (=G. caudata J. Agardh) (Rhodophyta: Gracilariaceae), se realizó con base en claves específicas como la de Schnetter (1971) para las costas colombianas. Se herborizaron y conservaron ejemplares que se depositaron en colección especializada del INVEMAR. Desafortunadamente, los ejemplares carecían de estructuras reproductivas por ello figuran como Gracilaria sp. No obstante, ante la experiencia en el trabajo con algas del área de colecta y su utilización en trabajos biológicos, fisiológicos y bioquímicos, no hay duda que los frondes colectados corresponden a la especie Recientemente se le considera como sinónima de G. caudata J. Agardh, lo cual explica la anotación incluida.
Tratamiento alcalino
El tratamiento alcalino fue llevado a cabo empleando concentraciones de 3, 5, 7 y 10 % (p/v) de NaOH. Se hidrataron 200 g de G. verrucosa (peso seco) en 4000 mL de cada una de las soluciones de NaOH, durante 16 h a temperatura ambiente. Estas se mantuvieron durante 3 h en un baño de agua a 80-85 °C, con agitación (Freile-Pelegrín y Robledo, 1997).
Extracción de agar
Después del tratamiento alcalino, las algas fueron lavadas cuatro veces con abundante agua para eliminar el exceso de NaOH. Para disminuir el pH se usaron diferentes concentraciones de ácido sulfúrico. En los tratamientos (3, 5, 7 y 10 %) se empleó 1 mL de ácido 0.025 %, 2 mL de ácido 0.025, 2 mL de ácido 0.048 % y 3 mL de ácido 0.048 % (v/v) en un volumen total de 4000 mL de agua, respectivamente, con agitación. Para eliminar el ácido, las muestras fueron lavadas con agua, quedando con un pH final entre 6.3 a 6.6. Las algas se llevaron a ebullición en 6000 mL de agua temperatura ambiente, se congelaron durante 24 horas y se descongelaron a temperatura ambiente (Marinho-Soriano y Bouret, 2003). Finalmente, el extracto fue secado a 50 °C en un horno de convección, durante 48 h. De acuerdo con las características físicas y el rendimiento (g agar g alga seca-1) se seleccionó la concentración de NaOH más adecuada.
Determinación de la concentración de agar y propiedades físicas de G. verrucosa
Se preparó un gel de agar a diferentes concentraciones: 1. 0, 1. 5, 2. 0, y 2.5 % (p/v), para seleccionar el agar con mejor fuerza de gelificación. La determinación de las propiedades se realizó tanto en el agar base G. verrucosa como en agares comerciales marca Scharlau y Oxoid. El agar seco se molió en molino de atrición, se preparó en agua destilada 1.5 % (p/v) y se midió la fuerza de gel, temperaturas de fusión y gelificación. Para determinar la fuerza de gel, el agar se sirvió en placas de cristalización a una altura de 1 cm y se dejó estabilizar 24 horas a 20 °C, se midió por el método de Rowerbal (Armisen y Galatas, 1987). La temperatura de gelificación se obtuvo vertiendo 10 mL de la solución de agar caliente en un tubo de ensayo, el cual contenía una perla de vidrio de 10 mm de diámetro (4.96 g) en su interior, el tubo se giró lentamente en un baño de agua a temperatura ambiente, la temperatura de gelificación se registró cuando la perla de vidrio cesó su movimiento con un termómetro de escala 100 °C (Freile-Pelegrín, 2002) Para determinar la temperatura de fusión se vertieron 10 mL de agar en un tubo de ensayo y se dejó estabilizar durante 24 horas a temperatura ambiente. Se colocó una perla de vidrio en la superficie del gel y el tubo de ensayo se introdujo en un baño termostatado, elevando la temperatura lentamente de 50 a 95 °C. La temperatura de fusión fue registrada con un termómetro de escala 100 °C en el momento en que la perla inicia su recorrido a través del gel (Freile-Pelegrín y Robledo, 1997; Grajales y Poveda, 1997).
Control de calidad del agar obtenido de G. verrucosa. Para verificar que el agar obtenido del alga G. verrucosa fuera completamente inerte y no aportara nutrientes que favorecieran el crecimiento de microorganismos, se sembraron todas las bacterias utilizadas en el estudio (Tabla 1) en agar que no contenía ningún componente adicional y se incubaron durante 24 horas a 37 °C.
Método ecométrico
Preparación de agar nutritivo. Se siguió el procedimiento para la preparación de agar nutritivo según el PNT-ME-010. Los componentes fueron: triptona 10 g L-1, extracto de carne 5 g L-1, cloruro sódico 5 g L-1 y agar bacteriológico 15 g L-1 (Vandevenne y Escola, 2002).
Se utilizaron 23 especies bacterianas (Tabla 1) para los análisis de productividad por el método ecométrico provenientes de la Colección de Microorganismos del Departamento de Microbiología de la Pontificia Universidad Javeriana, Sede Bogotá (CMDM-PUJ). El método se realizó por triplicado para cada uno de los 23 microorganismos y para cada uno de los medios incluidos en el estudio, utilizando dos agares comerciales como controles. Se realizaron curvas de crecimiento de los microorganismos en estudio para obtener su fase exponencial, con esto se aseguró la viabilidad y se partió de la misma concentración celular para evaluar el agar nutritivo (Calderón y Villalobos, 2003; Fierro y Otálora, 2005; Pedroza et al., 2007). Se tomaron dos cajas de petri con el medio prueba (agar nutritivo a base de G. verrucosa) y dos con cada medio comercial (Scharlau y Oxoid) y se utilizó un microorganismo referente que crece en el medio prueba y otro interferente que no crece (Roberts et al., 2000). Con asa calibrada se sembraron 10 pL de los microorganismos a una concentración de 3x108 células mL-1, según la escala de McFarland. Se realizaron las estrías según el método ecométrico descrito por Mossel (2003). Un parámetro para interpretar los resultados es el Índice de Crecimiento Absoluto (ICA), el cual se calculó para determinar la productividad de los medios. La interpretación de este índice se fundamenta en la siguiente clasificación: Bajamente productivo si su ICA es menor a 2.5, medianamente productivo si su ICA está entre 2.5- 4.0 y altamente productivo si su ICA es mayor a 4.0. Medios con ICA menor a 2.5 no deben utilizarse (Michanie et al., 1992).
Análisis estadístico
Los datos fueron analizados para normalidad con Shapiro-Wilk usando un análisis de varianza ANOVA de una vía para datos con distribución normal y ANOVA de una vía Kruskal Wallis para datos que no tenían distribución normal en el programa Statistix 7.0 para las propiedades físicas del agar (fuerza de gel, temperatura de gelificación y temperatura de fusión) y Bonferroni se usó para la comparación de medias entre los tratamientos. También se usó prueba de proporción de una y dos muestras para el análisis ecométrico con el programa Statistix 7.0.
RESULTADOS
Tratamiento alcalino y propiedades físicas
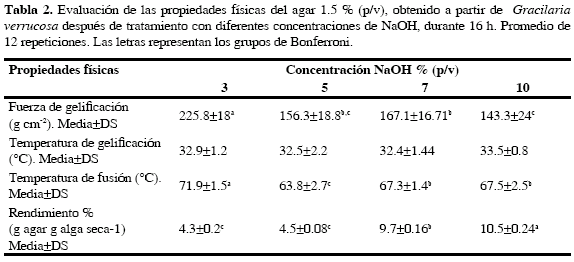
Los resultados de la variación del rendimiento y sus propiedades físicas a diferentes concentraciones de NaOH en el proceso de producción de agar se muestran en la Tabla 2. Se encontró que la consistencia más sólida del agar se logró a concentraciones de 1.5 y 2.0 % (p/v) en todos los tratamientos. Para mejor aprovechamiento del agar se seleccionó la concentración de 1.5 % (p/v) con la cual se realizaron las demás pruebas. Estos resultados son comparables con los agares comerciales que emplean la misma concentración (1.5 %). A medida que se aumentó la concentración de NaOH se incrementó el rendimiento del agar (Tabla 2); hubo diferencias estadísticamente significativas dentro los tratamientos (p<0.05). La Tabla 2 muestra que el mayor rendimiento fue obtenido con NaOH 10 % (p/v). La fuerza de gel disminuyó significativamente (p<0.05) a medida que aumentó la concentración de NaOH. El mejor resultado se obtuvo en el tratamiento con NaOH 3 % (p/v), con una fuerza de gel de 225.8 g cm-2. La temperatura de fusión fue significativamente (p<0.05) más baja para el tratamiento con NaOH 5 % (p/v), mientras que los tratamientos del 7 % (p/v) y 10 % (p/v) no fueron significativamente diferentes (p>0.05). Los datos de temperatura de gelificación no se distribuyeron normalmente, por lo tanto se utilizó un ANOVA no paramétrico con el que se concluyó que no hubo diferencias significativas dentro de los tratamientos (p > 0.05, promedio 32.8 °C). El mejor resultado se obtuvo con el tratamiento con NaOH 3 % (p/v), según la comparación de medias. El agar obtenido bajo estas condiciones fue comparado con dos agares comerciales, las características físicas se muestran en la Tabla 3.
Control de calidad del agar-agar G. verrucosa. Ninguna de las 23 bacterias incluidas en el estudio crecieron en agar-agar obtenido a partir de G. verrucosa, lo que demuestra que el agar no aportó ningún nutriente para el crecimiento de las bacterias estudiadas.
Método ecométrico
Para la evaluación del medio prueba se utilizó el método ecométrico ya que puede establecer la eficiencia de un medio de cultivo para recuperar una cepa (Mossel, 2003). Se utilizó como microorganismo interferente Streptococcus pneumoniae, en el cual los valores de ICA e ICR fueron de 0, que es lo esperado de este microorganismo, ya que el agar nutritivo no le aporta los suficientes nutrientes para su desarrollo. De 22 microorganismos referentes, 18 mostraron ICA altamente productivos en agar nutritivo base G. verrucosa, a excepción de Salmonella enterica serovar Enteritidis, S. enterica serovar Typhimurium, S. enterica serovar Choleraesuis y Morganella morganii que son bacterias más exigentes en sus requerimientos nutricionales (Tabla 2). Aunque no hubo diferencias significativas entre los resultados altamente productivos del agar obtenido a partir de G. verrucosa frente al agar Oxoid (p> 0.05) y G. verrucosa frente al agar Scharlau (p> 0.05), el agar nutritivo preparado con agar de G. verrucosa permitió el crecimiento de un mayor número de microorganismos que los controles comerciales. Todos los valores de ICR de los microorganismos referentes fueron mayores o iguales a 0.9, lo que significa que el medio de prueba permite una recuperación de microoganismos igual o mayor que los agares comerciales (Tabla 2). La proporción de cepas con resultados de ICR > 1 para el agar nutritivo base de G. verrucosa fue menor e igual al 80 % con respecto al agar oxoid (p> 0.05) con un IC 95 % (0.59761-0.94784), lo que significa que el medio de prueba recuperaría entre el 59 al 94 % de las cepas cultivadas con respecto al medio nutritivo con agar oxoid. La proporción de cepas con resultados de ICR > 1 para el agar nutritivo base G. verrucosa son menores e iguales al 80 % con respecto al control 2 (p> 0.05) con un IC 95 % (0.51844-0.93610), lo que significa que el medio prueba recuperaría entre el 51 al 93 % de las cepas cultivadas con respecto al medio nutritivo con agar Scharlau.
DISCUSIÓN
La calidad del agar con respecto a la fuerza de gel es variable dependiendo de la especie de Gracilaria, de la estación de recolección y por lo tanto no existe un método estándar de procesamiento para todas las especies, por esto es necesario buscar el proceso más adecuado para obtener un agar con características óptimas. Freile-Pelegrín y Murano (2005) estudiaron tres especies de Gracilaria para la producción de agar y encontraron diferencias en las propiedades fisicoquímicas confirmando la heterogeneidad de los polímeros de agar en este género.
Vergara-Rodarte et al. (2010) compararon las propiedades físicas y el rendimiento de G. vermiculophylla con y sin tratamiento alcalino 7 %, teniendo en cuenta las estaciones. En cuanto al rendimiento afirmaron que en todas las estaciones se obtuvo más agar cuando no se hizo tratamiento alcalino. Adicionalmente, en verano sin tratamiento alcalino se obtuvo la mayor fuerza de gel, contrario a otoño e invierno que fue necesario este tratamiento para mejorar la fuerza de gel.
Freile-Pelegrín y Robledo (1997) estudiaron la influencia del tratamiento alcalino en agar obtenido de Gracilaria cornea, a concentraciones de 0.5, 1, 3 y 5 % de NaOH. Observaron que la fuerza de gel variaba entre 118 a 155 g cm-2 para la concentración más baja y aumentaba hasta valores entre 1694-1758 g cm-2 para 5 % de NaOH; este comportamiento lo relacionaron con la disminución de iones sulfato y el aumento de la concentración de 3,6-anhidro-galactosa. En este trabajo se aumentó el porcentaje de NaOH a 7 y 10 % para mejorar la fuerza de gel, pero disminuyó al aumentar la concentración de NaOH. Esto no coincide con los resultados de Sasikumar et al. (1997), quienes obtuvieron los valores más elevados de fuerza de gel cuando las algas Gracilaria blodgettii y G. verrucosa, fueron tratadas con NaOH 6N. Los resultados obtenidos para G. verrucosa mostraron que la fuerza de gel se incrementó ocho veces (434 g cm-2) con respecto al control (56 g cm-2) y el rendimiento se redujo en un 65 % (de 24 a 8.9 %). Sin embargo, Brasch et al. (1983) señalan que concentraciones de NaOH mayores al 4 % y temperaturas altas aparentemente provocan una depolimeración y serían capaces de degradar polisacáridos que incluso contengan 3,6 anhidrogalactosa. Lo anterior podría explicar los resultados obtenidos en este trabajo como se muestra en la Tabla 2, donde la fuerza de gel disminuye al aumentar la concentración de NaOH.
En cuanto a las propiedades físicas determinadas se confirma la heterogeneidad de los polímeros de agar en el género Gracilaria. La temperatura promedio de gelificación de Gracilaria puede variar de acuerdo con la especie Así, para G. cornea fue 33.8-43.0 °C (Freile-Pelegrín y Robledo, 1997), para G. cervicornis fue 36-37 °C, para G. blodgetti fue 42-45 °C, para G. crassissima fue 50 °C (Freile-Pelegrín y Murano, 2005), para G. vermiculophylla fue 36.5-39. 6 °C (Arvizu-Higuera et al., 2008) y para G. verrucosa estuvo entre 32.4 y 33.5 °C, cumpliendo con los estándares de la farmacopea de Estados Unidos (32-39 °C).
En cuanto a la temperatura de fusión de los agares de Gracilaria sp., la influencia del tratamiento alcalino es diferente de acuerdo con la especie. En el caso de G. vermiculophylla, en agar obtenido de alga sin tratamiento alcalino la temperatura de fusión estuvo entre 66 y 77 °C, comparado con 94 °C obtenida después del tratamiento alcalino (Vergara-Rodarte et al, 2010); sin embargo, en el caso de G. cervicornis se observa que la temperatura de fusión del agar del alga sin tratamiento fue de 67 °C y se afectó por el tratamiento alcalino disminuyendo entre 54-57 °C (Freile-Pelegrín y Murano, 2005). Para G. cornea se obtuvo una temperatura entre 76.2 y 96.7 °C, cuando se aumentó la concentración de NaOH de 0.5 a 5 % (Freile-Pelegrín y Robledo, 1997).
El agar extraído de G. verrucosa presentó una temperatura de fusión menor que la de los agares comerciales, esto puede deberse a la diferencia encontrada en las fuerzas de gelificación, ya que existe una relación directa con la fuerza de gel (Freile-Pelegrín y Robledo, 1997); además porque la mayoría de agares comerciales emplean una mezcla de polisacáridos extraídos de algas rojas como Gelidium sp., Gracilaria sp., Pterocladia sp., Acanthopeltis sp. y Ahnfeltia sp. (Bridson, 1998) y no a partir de una sola alga como es el caso de este trabajo.
Aunque el agar G. verrucosa no tiene la misma fuerza de gel que la de los comerciales, éste mostró la elasticidad suficiente a una concentración de 1.5 % (p/v), para resistir el peso del asa bacteriológica durante la siembra. Además, la productividad del medio con agar base G. verrucosa para todas las bacterias estudiadas, arrojó un valor de ICA mayor o igual a 3.6, indicando que el medio es apto para el crecimiento de bacterias, y vale resaltar que la mayoría de estos microorganismos son de importancia en salud pública. Esto no se dio con los agares comerciales, donde se presentaron casos con valores de ICA bajos, como S. enterica serovar Paratyphi A (ICA 2.87) y S. enterica serovar Enteritidis (ICA 2.8) para Scharlau y S. enterica serovar Enteritidis (ICA 2.6) y Salmonella enterica serovar Choleraesuis (ICA 2.4) para Oxoid.
El método ecométrico ha sido usado para el mismo propósito en el estudio de Villalobos et al. (2007), donde los resultados obtenidos mediante este método, permitieron evaluar los medios elaborados con agar de G. cylindrica y G. mammillaris y compararlos con los medios preparados con agares comerciales. Los valores de ICA e ICR permitieron clasificar los medios en productividad baja media o alta, donde se observaron resultados bajamente productivos en dos controles comerciales para algunas bacterias como Salmonella Typhimurium y Shigella flexneri que presentaron productividad media con el agar base G. mammillaris.
Por lo anterior, se ve la importancia de evaluar los agares por el método ecométrico, ya que la productividad de algunos microorganismos puede ser afectada por la composición del agar, debido a la presencia de sustancias que puedan inhibir el crecimiento. Adicionalmente, según la norma ISO 17025 los medios usados en los laboratorios deben tener una apropiada productividad, selectividad y niveles de esterilización y la farmacopea de Estados Unidos también exige la verificación de la productividad de medios, descrita como "promoción de crecimiento".
AGRADECIMIENTOS
Los autores agradecen a la Vicerrectora Académica de la Pontificia Universidad Javeriana por su apoyo financiero para la elaboración de este trabajo (Proyecto N° 000668), a la Fundación para la Promoción de la Investigación y la Tecnología del Banco de la República y a Alberto Acosta por sus valiosos aportes en la revisión de este artículo.
BIBLIOGRAFÍA
1 Armisen, R. y M. Galatas. 1987. Production, properties and uses of agar. 1-38. En: McHugh, D. J. (Ed.). Production and utilization of products from commercial seaweeds. FAO Fisheries Technical Paper, Roma. 194 p. [ Links ]
2 Arvizu-Higuera, D. L, Y. E. Rodríguez-Montesinos, J. I. Murillo-Álvarez, M. Muñoz-Ochoa y G. Hernández-Carmona. 2008. Effect of alkali-treatment time and extraction time on agar from Gracilaria vermiculophylla. J. Appl. Phycol., 20: 515-519. [ Links ]
3 Boraso de Zaixso, A. L. 1995. Utilización de algas marinas. 15-55. En: Ferrario, M. y E. Sar (Eds.). Macroalgas de interés económico. Editorial de la Universidad Nacional de La Plata, Red de Editoriales Universitarias, La Plata, Argentina. 296 p. [ Links ]
4 Brasch, D., C. Chuah y L. Melton. 1983. The agar type polysaccharide from the red alga Gracilaria secundata. Carbohydrate Research, 115: 191-198. [ Links ]
5 Bridson, E. Y. (Compilador). 1998. Peptones, hydrolysates, agars and constituents. The Oxoid Manual. Octava edición, Oxoid Ltd, Basingstoke, Reino Unido. 371 p. [ Links ]
6 Brito, L. 2000. Influencia del tratamiento alcalino sobre el agar de Gracilariopsis tenuifrons (Gracilariales: Rhodophyta). Bol. Inst. Ocean. Venezuela, 39 (1832): 67-70. [ Links ]
7 Calderón, D. y A. Villalobos. 2003. Determinación de la productividad de agar bacteriológico obtenido a partir de algas (Gracilaria mammillaris) con diferentes especies bacterianas. Trabajo de grado Bacteriología, Pont. Univ. Javeriana, Bogotá. 83 p. [ Links ]
8 Fierro, J. y G. Otalora. 2005. Determinación de la productividad de agar base Gracilaria cylindrica. Trabajo de grado Bacteriología, Pont. Univ. Javeriana, Bogotá. 51 p. [ Links ]
9 Freile-Pelegrín, Y. 2002. Efecto del tratamiento de oscuridad y salinidad en el rendimiento y calidad del agar de Gracilaria cornea (Rhodophyceae). Cienc. Mar., 28 (3): 289-296. [ Links ]
10 Freile-Pelegrín, Y. y E. Murano. 2005. Agars from three species of Gracilaria (Rhodophyta) from Yucatán Peninsula. Biores. Technol., 96: 295-302. [ Links ]
11 Freile-Pelegrín, Y. y D. Robledo. 1997. Influence of alkali treatment on agar from Gracilaria cornea from Yucatán, México. J. Appl. Phycol., 9: 533-539. [ Links ]
12 Grajales, A. y L. Poveda. 1997. Abundancia, estados reproductivos y algunos parámetros químicos de las macroalgas Gracilaria mammillaris y Solieria filiformis en Cartagena de Indias, Caribe colombiano. Tesis Biol. Mar., Univ. Jorge Tadeo Lozano, Bogotá. 98 p. [ Links ]
13 Kornacki, J., J. Gurtler, Z. Yan y M. Cooper. 2003. Evaluation of several modifications of an ecometric technique for assessment of media performance. J. Food Prot., 66 (9): 1727-1732. [ Links ]
14 McHugh, D. 2003. A guide to the seaweed industry. Food and Agriculture Organization of the United Nations. FAO Fish. Tech. Paper, 441, Roma. 105 p. [ Links ]
15 Marinho-Soriano, E. y E. Bourret. 2003. Effects of season on the yield and quality of agar from Gracilaria species (Gracilariaceae, Rhodophyta). Biores. Techn., 90: 329-333. [ Links ]
16 Michanie, S. A. Rodríguez, E. Lara y A. Brizzion. 1992. Comparación de tres medios empleados para control de calidad de medios de cultivo sólidos. Acta Bioq. Clín. Latinoam., 26 (3): 311-317. [ Links ]
17 Mossel, D. A. 2003. Microbiología de los alimentos. Segunda edición, Editorial Acribia, Zaragoza, España. 703 p. [ Links ]
18 Mossel, D. A., M. Trees, A. Bonats, M. Ligtenberg y M. Werdler. 1983. Quality assurence of selective culture media for bacteria, moulds and yeast: an attempt at standardization at the international level. J. Appl. Bacteriol., 54: 313-327. [ Links ]
19 Pedroza, A., B. Quevedo y A. Matiz. 2007. Manual de laboratorio de procesos biotecnológicos. Colección de Apuntes, Editorial Pontificia Universidad Javeriana, Bogotá. 91 p. [ Links ]
20 Roberts, D., W. Hooper y M. Greenwood. 2000. Microbiología práctica de los alimentos: métodos para el examen de microorganismos de los alimentos de interés para la salud pública. Editorial Acribia. Zaragoza, España. 276 p. [ Links ]
21 Sasikumar, C., V. Rao y R. Rengasamy. 1997. Effect of alkali treatment of red algae Gracilaria blodgettii and Gracilaria verrucosa (Rhodophyta) on agar quality. Indian J. Mar. Sci., 26 (2): 191-194. [ Links ]
22 Schnetter, R. 1971. Claves para las algas rojas del Caribe colombiano. Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Biología. Serie de Claves para Algas Marinas de Colombia. Bogotá D. E. Mimeografiado. [ Links ]
23 TUSPC. 2006. USP 29 NF 24. The United States Pharmacopeial Convention, Toronto. 3539 p. [ Links ]
24 Vandevenne, C. A. y M. Escola. 2002. Métodos de análisis microbiológicos de los alimentos. Ediciones Díaz de Santos, Madrid. 162 p. [ Links ]
25 Vergara-Rodarte, M. A, G. Hernández-Carmona, Y. E. Rodríguez-Montesinos, D. L. Arvizu-Higuera, R. Riosmena-Rodríguez y J. I. Murillo-Álvarez. 2010. Seasonal variation of agar from Gracilaria vermiculophylla, effect of alkali treatment time, and stability of its Colagar. J. Appl. Phycol., 22 (6): 753-759. [ Links ]
26 Villalobos, A., L. Calderón, C. Figueroa, J. Fierro, G. Otálora, R. Álvarez-León, B. Quevedo-Hidalgo, M. Mercado-Reyes, M. Huertas-Valero y A. Trespalacios-Rangel. 2007. Evaluación por método ecométrico de agar obtenido de algas rojas colombianas. Univ. Sci., 12: 57-65. [ Links ]
27 Yaphe, W. 1984. Properties of Gracilaria agars. Hydrobiologia, 116/117: 171-186. [ Links ]
FECHA DE RECEPCIÓN: 28/04/2009 FECHA DE ACEPTACIÓN: 18/01/2011