Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.44 no.1 Santa Marta Jan./June 2015
NERÉIDIDOS (NEREIDIDAE, POLYCHAETA, ANNELIDA) ASOCIADOS A RAÍCES DE MANGLE ROJO, RHIZOPHORA MANGLE, EN ISLAS SAN ANDRÉS Y PROVIDENCIA, CARIBE COLOMBIANO
NEREIDIDS (NEREIDIDAE, POLYCHAETA, ANNELIDA) ASSOCIATED TO RED MANGROVE ROOTS, RHIZOPHORA MANGLE, IN SAN ANDRÉS AND OLD PROVIDENCE ISLANDS, COLOMBIAN CARIBBEAN
Catalina Arteaga-Flórez y Mario H. Londoño-Mesa
Universidad de Antioquia, Facultad de Ciencias Exactas y Naturales, Instituto de Biología, Grupo de Limnología Básica y Experimental y Biología y Taxonomía Marina (LimnoBasE y Biotamar). Apartado1226, Medellín, 05001000, Colombia. takalina85@gmail.com, mariolon@gmail.com, hernan.londono@udea.edu.co.
RESUMEN
Nereididae Blainville, 1818, es una de las familias de gusanos poliquetos errantes más representativas, con cerca de 535 especies descritas en 43 géneros, y de gran importancia biológica y económica. El objetivo de esta investigación fue realizar un análisis taxonómico de los neréidido asociados a las raíces de mangle rojo, Rhizophora mangle, en el archipiélago de San Andrés, Providencia y Santa Catalina. El archipiélago forma parte de la Reserva de Biosfera Seaflower. San Andrés es la isla más importante en el archipiélago, con 27 km2 de área emergida, mientras que isla Providencia, localizada a 95 km al norte de San Andrés, posee 17 km2; ambas islas tienen buen desarrollo de bosque de manglar, compuesto principalmente por R. mangle. Los neréididos, depositados en la Colección de Invertebrados Marinos de la Universidad de Antioquia (CEMUA), fueron identificados con la ayuda de claves actualizadas, mediante disección y extracción de estructuras con valor taxonómico. Se encontraron cuatro especies de poliquetos de la familia Nereididae: Neanthes acuminata, Neanthes succinea, Neanthes sp., y Platynereis mucronata. De las especies identificadas, N. succinea y N. acuminata habían sido registradas para el Caribe colombiano, y solo N. succinea había sido registrada para el archipiélago. Consideraciones sistemáticas, ecológicas y biogeográficas fueron adicionadas para cada especie.
PALABRAS CLAVES: Gran Caribe, Distribución, Estuarios, Manglar, Sistemática.
ABSTRACT
The family Nereididae Blainville, 1818, is one of the most representative group of errant polychaete worms, with about 535 described species in 43 genera, with great biological and ecological importance. The aim of this research was to make a taxonomic analysis of the nereidids associated to red mangrove roots, Rhizophora mangle, in the San Andrés, Old Providence and Santa Catalina Archipelago. This archipelago is part of the Seaflower Biosphere Reserve. San Andrés is the largest island, having 27 km2 of landmass area, while Old Providence Island, located 95 km to the north of San Andrés, has 17 km2; both islands have well developed mangrove forests, composed mainly by R. mangle. The nereidids, deposited in the Coleccion Estuarina y Marina de la Universidad de Antioquia (CEMUA), were identified with updated keys, by performing dissections and extracting parts with taxonomic value. Four species of polychaetes from the family Nereididae were found: Neanthes acuminata, Neanthes succinea, Neanthes sp., and Platynereis mucronata. Only N. succinea and N. acuminata had been reported from the Colombian Caribbean, being N. succinea the only species previously reported from the archipielago. In addition, systematic, ecological and biogeographical considerations were added for each species.
KEYWORDS: Grand Caribbean, Distribution, Estuaries, Mangroves, Systematics.
INTRODUCCIÓN
Los anélidos son un gran grupo de animales conocidos como gusanos segmentados. La clase Polychaeta comprende la mayor parte de la diversidad de los anélidos, encontrándose en casi todos los hábitats marinos, desde zonas intermareales hasta el mar profundo (Rouse y Pleijel, 2001). Sin embargo, también se pueden encontrar especies de agua dulce, e incluso terrestres, asociadas a localidades con alta humedad en el suelo.
El cuerpo de los poliquetos está dividido en prostomio, peristomio, metastomio (tronco) y pigidio. La región anterior o cefálica está conformada por prostomio y peristomio. En el prostomio se pueden encontrar estructuras sensoriales como ojos, palpos y antenas, mientras que en el peristomio se encuentra la boca y, en algunos casos, cirros tentaculares sensoriales o largos palpos tentaculares con función alimentaria. El metastomio es la región segmentada del cuerpo de los poliquetos que porta, casi siempre, parápodos y setas; en algunos grupos, esta región se encuentra dividida en tórax y abdomen, mientras que en otros es indiferenciada, llamándose sólo tórax. El pigidio es la parte posterior del cuerpo de los poliquetos, en donde se encuentra el ano.
Dentro de la clase Polychaeta, la familia Nereididae Blainville, 1818, incluye los poliquetos errantes más representativos del grupo, con cerca de 535 especies descritas en 43 géneros (Glasby y Fauchald, 2000). Los neréididos se caracterizan morfológicamente por tener cirros tentaculares, faringe eversible, posición ventral de los palpos, antenas anteriores y setas compuestas (Rouse y Fauchald, 1997). Ecológicamente, por ser un grupo caracterizado por vivir en la superficie de diferentes sustratos, se alimentan de otros invertebrados y de algas; además, tienen gran importancia en estudios ambientales debido a que son excelentes indicadores del grado de conservación y/o contaminación en ecosistemas particulares, siendo de gran utilidad para programas de monitoreo ambiental (Cañete et al., 2000).
Es importante resaltar su función trófica, ya que son fuente primordial de alimento para otros animales, como crustáceos y peces, lo cual da pie a que sean utilizados y cultivados económicamente como carnada para pesca artesanal o deportiva, así como alimento de camarón. Adicionalmente, al ser uno de los grupos más abundantes y diversos en los ambientes marinos, los neréididos y en general los poliquetos, son considerados importantes para caracterizar los distintos hábitats bentónicos, ayudan a la deposición, descomposición, incorporación y recambio de materia orgánica en el lecho marino, contribuyendo al reciclaje de nutrientes en la columna de agua (Liñero-Arana y Díaz-Díaz, 2011).
Según de León-González (2009), los caracteres taxonómicos más importantes para determinar géneros o especies de neréididos son: (i) estructuras asociadas al prostomio y peristomio (antenas, ojos, palpos, cirros tentaculares); (ii) forma, número y disposición de paragnatos y papilas en las diferentes áreas de la faringe; y (iii) estructuras parapodiales (1óbu1os, lígulas, cirros dorsal y ventral, tipos y distribución de setas) en parapodios anteriores, medios y posteriores. El estudio en Colombia de los neréididos, y en general de los poliquetos, aún es escaso, por lo cual, las investigaciones taxonómicas en los diferentes ecosistemas marinos y estuarinos son indispensables para incrementar el conocimiento de este grupo. El objetivo de esta investigación fue realizar un análisis taxonómico de los neréididos asociados a las raíces de mangle rojo, Rhizophora mangle, en el archipiélago de San Andrés, Providencia y Santa Catalina, mediante una revisión de material depositado en la Colección Estuarina y Marina de la Universidad de Antioquia (CEMUA).
ÁREA DE ESTUDIO
El archipiélago de San Andrés, Providencia y Santa Catalina se encuentra al noroeste del Caribe colombiano, en la frontera con Nicaragua. Junto con los cayos de Albuquerque, bajo Nuevo, Bolívar, Quitasueño, Roncador, Serrana y Serranilla y el bajo Alicia, forman la Reserva de la Biósfera Seaflower, con gran importancia en recursos marinos pesqueros para la región. La reserva fue establecida en el año 2000 por la Unesco y reconocida por el país como área marina protegida (AMP), con una extensión de 65000 km2. Esto significó para el país, pasar de tener cerca de 4% a un 9.6% de su área marina protegida. No obstante, pese a esta área de mar considerable, Seaflower es una de las 6000 AMP en el mundo, siendo la más grande Isla Chagos, con 545000 km2 (Gómez-López et al., 2012).
La isla más importante tanto en el archipiélago como en la reserva, es San Andrés, con 27 km2 de área emergida, posee el Parque Regional (PR) Old Point, al noreste de la isla, en el que se encuentran las bahías Honda y Hooker. Bahía Honda, en el extremo norte del PR, posee cerca de 34.4 ha de bosque de manglar, mientras que bahía Hooker, al sur, posee 15.1 ha de manglar (Figura 1). Ambos bosques son formados por manglar de borde, compuesto principalmente por el mangle rojo, R. mangle. Ambas bahías son cuerpos semiabiertos, con una influencia directa de la marea. Igualmente, al situarse junto al área más poblada de la isla, todo el PR presenta una gran cantidad de descargas. Adicionalmente, debido a las constantes labores de dragado en el pasado, cuando allí se encontraba la planta eléctrica, bahía Hooker es ahora un cuerpo semicerrado (Londoño-Mesa et al., 2002).
La isla Providencia está localizada a 95 km al norte de San Andrés. Es una isla pequeña, con 17 km2 de área emergida. Sobre el costado este se encuentra el Parque Nacional Old Providence McBean Lagoon (PNOPML), con un bosque de manglar de borde de 27 ha. El bosque de manglar, compuesto principalmente por mangle rojo, R. mangle, tiene una dependencia directa del sedimento que llega por el drenaje natural, pero es independiente y libre de impacto humano directo.
MATERIALES Y MÉTODOS
Esta investigación es un producto posterior, no comprometido, de un proyecto mayor realizado durante 1998, llamado Evaluación preliminar de la biodiversidad marina asociada a los manglares del Parque McBean Lagoon en Providencia y bahías Honda y Hooker en San Andrés, Caribe colombiano (Santos-Martínez et al., 1998).
Se muestrearon 17 raíces de mangle rojo en tres diferentes localidades, cinco raíces en las bahías Honda y Hooker y siete en McBean Lagoon. Dicho material fue fijado y almacenado en formalina al 10%, en bolsas debidamente rotuladas. Los poliquetos fueron extraídos de las raíces en el laboratorio y preservados en etanol al 70%. Mayores detalles de los métodos de colecta se describen ampliamente en Londoño-Mesa et al. (2002).
El material estudiado, depositado en la CEMUA, se identificó taxonómicamente mediante el uso de microscopio compuesto y de disección. Se tomaron fotografías digitales con el microscopio de disección, de los lados dorsales, ventrales y laterales de los extremos anteriores de los organismos, debido a que en dicha región se concentra la mayoría de los caracteres con valor taxonómico. Igualmente, se realizaron montajes semipermanentes en placas, usando glicerol y sellando con barniz, de estructuras como parápodos y setas, con el fin de realizar ilustraciones usando un microscopio compuesto con cámara lúcida. Se usó literatura actualizada, siguiendo las claves e información de León-González et al. (1999), Bakken y Wilson (2005), y de León-González (2009).
RESULTADOS Y DISCUSIÓN
Familia Nereididae Blainville, 1818
Subfamilia Nereidinae Blainville, 1818
Neanthes Kinberg, 1866
Neanthes acuminata (Ehlers, 1868)
Figuras 2a-l
Nereis acuminata Ehlers, 1868: 552.
Neanthes caudata, Renaud, 1956: 16-17, Figura 11.
Nereis (Neanthes) acuminata, Gardiner, 1976: 149, Figuras 15e-f.
Neanthes acuminata, Taylor, 1984: 31.15, Figuras 31.11, 31.12a-2. Laverde- Castillo y Rodríguez-Gómez, 1987: 101. Salazar-Vallejo, 1996: 21. Salazar-Vallejo y Jiménez-Cueto, 1997: 465, Figuras 6, 22, 23, 45. De León-González et al., 1999: 668-669. Santos, 2007: 372-373; Figura 3.
Nereis (Neanthioides) bolivari Rioja, 1918.
Nereis riisei non Grube, Londoño-Mesa et al., 2002: 229.
Material examinado. CEMUA-POLY-NERE-0402 (3), PNNOPML, isla Providencia, Caribe colombiano, Estación MBJ2 (13°21'46.43"N 81°21'16.71"W), julio/1998.
Descripción. Organismo incompleto, deteriorado, color beige (Figuras 2a, b). Con 8 mm de largo, 1 mm de ancho, 20 setígeros. Prostomio más largo que ancho, sin hendidura distal, con un par de cicatrices de antenas. Dos pares de ojos alineados longitudinalmente, negros, los anteriores en media luna y de mayor tamaño, los posteriores redondos. Palpos sub-triangulares, con palpostilo digitiforme, tan largos como el prostomio. Peristomio tan ancho como el setígero 1, con cuatro pares de cirros tentaculares, el dorsal posterior más largo, alcanzando el setígero 9. Faringe evertida, con paragnatos en ambos anillos faríngeos (Figuras 2c, d). Área I: 21 conos en triángulo; área II: 19-22 conos en diagonal; área III: 36 conos agrupados pentagonalmente; área IV: 37 conos triangulares; áreas V, VI, VII y VIII con una banda continua de conos grandes y pequeños. Mandíbulas ámbar, con 7-9 dientes (Figura 2e). Parápodos birrámeos, deteriorados, con lóbulos, lígulas y cirros (Figura 2f). Acícula notopodial puntiaguda (Figura 2g) y neuropodial de punta roma (Figura 2h). Parápodos anteriores con tres lóbulos sub-triangulares notopodiales y dos neuropodiales, de igual tamaño, cirros cirriformes noto y neuropodiales, insertos basalmente. Parápodos posteriores con tres lóbulos subtriangulares notopodiales, el dorsal de mayor tamaño, y tres lóbulos subtriangulares neuropodiales, el medio de mayor tamaño; cirros cirriformes insertos basalmente, el dorsal de mayor tamaño. Notópodos de parápodos anteriores y posteriores con espinígeros homogonfos espinulados (Figura 2i); neurópodos en parápodos anteriores y posteriores con falcígeros heterogonfos supra (Figura 2j) e infraciculares (Figura 2k), espinulados con lámina larga, superando la longitud de la base de la misma, y espinígeros homogonfos espinulados (Figura 2l). Pigidio ausente.
Variaciones. Los organismos tienen 4-8 mm de largo, 0.7-1 mm de ancho y 20-22 setígeros. Los demás caracteres no variaron en los organismos observados.
Observaciones. Neanthes acuminata es encontrada en aguas poco profundas, en la zona intermareal, asociada a diferentes sustratos como roca coralina y raíces de mangle. Londoño-Mesa et al. (2002) identificaron inicialmente este material como Nereis riisei Grube, 1857, asociada a las raíces sumergidas de R. mangle en la zona intermareal. No obstante, una revisión taxonómica más exhaustiva del material, usando literatura actualizada, ayudó a identificar este material como N. acuminata. Según de León-González (2009), N. riisei posee falcígeros homogonfos notopodiales en parápodos posteriores, con lámina larga, espinulada y con el diente apical dirigido hacia abajo, mientras que N. acuminata carece de falcígeros homogonfos notopodiales en parápodos posteriores. Adicionalmente, el número y posición de paragnatos en la faringe difiere entre estas dos especies ya que N. riisei posee en el área I 4 paragnatos en línea y el área VI con 10 paragnatos en disposición circular; mientras que N. acuminata posee 21 paragnatos en disposición triangular en el área I y las áreas V, VI, VII y VIII poseen una banda continua de paragnatos grandes y pequeños. Dueñas (1999) presenta un registro de N. caudata para isla Providencia, pero posiblemente, un análisis más detallado de dicho material podría confirmar que realmente se trata de N. acuminata, debido a que al parecer son sinónimas.
Los organismos identificados como N. acuminata fueron comparados con la descripción original, coincidiendo en los caracteres morfológicos evaluados. Estos individuos se diferencian del material identificado como N. succinea y Neanthes sp., descritos en el presente documento, en la cantidad y distribución de los conos y paragnatos en la faringe. Mientras N. acuminata presenta una banda continua de conos grandes y pequeños en las áreas V-VIII, N. succinea presenta dos conos en línea vertical en el área V, y 5-6 conos en grupo circular en el área VI; Neanthes sp., presenta cinco conos en organización de dado en el área V y seis a nueve conos en grupo circular en el área VI. Áreas VII-VIII: dos a tres líneas de conos. Las tres especies presentan similitud con lo presentado en las áreas VII y VIII.
Según de León-González (1999, 2009), N. acuminata y N. caudata (Delle Chiaje, 1827) (Mediterráneo) son especies que no presentan ninguna diferencia morfológica aunque, de acuerdo con Weinberg et al. (1990), están aisladas reproductivamente debido a que N. acuminata posee 11 pares de cromosomas, mientras que N. caudata tiene 9 pares. De esta forma, pese a una ausencia de cariotipo para este material, pero de acuerdo con la distribución en el Caribe, se considera que el material examinado corresponde a N. acuminata.
Neanthes acuminata es diferente a N. brandti (Malmgren, 1866) (Siberia), la especie más cercana en el Caribe, en cuanto a la forma, distribución y número de conos y paragnatos en la faringe. Mientras N. acuminata presenta una banda continua de conos grandes y pequeños en las áreas V-VIII, de León-González (2009) menciona que N. brandti presenta una mancha difusa de numerosos paragnatos pequeños en el área V, 4-5 conos en línea en el área VI, y una banda ancha de numeroso conos pequeños en las áreas VII-VIII. No obstante, N. brandti es aceptada como Alitta brandti [World Register of Marine Species (Worms, 2013)], mientras que N. acuminata permanece en el género. Un análisis con otras especies cercanas y/o sinónimas a N. acuminata, como N. caudata, N. operta Simpson, 1856, N. arenaceodentata Moore, 1903 y N. arenaceodonta Moore, 1903, es considerado en Santos (2007).
Por último, de acuerdo con Londoño-Mesa et al. (2002), estos organismos fueron encontrados asociados a las raíces del mangle rojo en aguas limpias, con mucha influencia de agua marina, y pocas descargas de agua dulce, en el PNNOPML. En el mismo estudio, se analizaron las muestras de raíces del mangle rojo en bosques de manglar de dos bahías en isla San Andrés, las cuales poseen contaminación por hidrocarburos y por descargas antrópicas, y no se encontraron ejemplares de esta especie. Por lo tanto, se concluye que N. acuminata podría ser una especie bioindicadora de aguas limpias, oxigenadas y sin contaminación. Londoño-Mesa et al. (2002) presentan las condiciones fisicoquímicas encontradas en el estudio para cada una de las estaciones.
Localidad tipo y distribución. Neanthes acuminata fue descrita originalmente para Nápoles (mar Mediterráneo); sin embargo, según Taylor (1984), es cosmopolita en mares templados y subtropicales. Para el Gran Caribe, Salazar-Vallejo (1996) menciona que ha sido identificada en Florida, Golfo de México, Caribe mexicano y colombiano y Cuba. Santos (2007) la identifica en el noreste de Brasil. De León-González (2009) menciona que la especie se presenta tanto en el Pacífico como Caribe mexicanos. Para Colombia, Laverde-Castillo y Rodríguez-Gómez (1987) la identifican para la bahía de Cartagena e isla Barú (islas del Rosario), por lo tanto, este registro expande la distribución en Colombia hacia el archipiélago de San Andrés y Providencia.
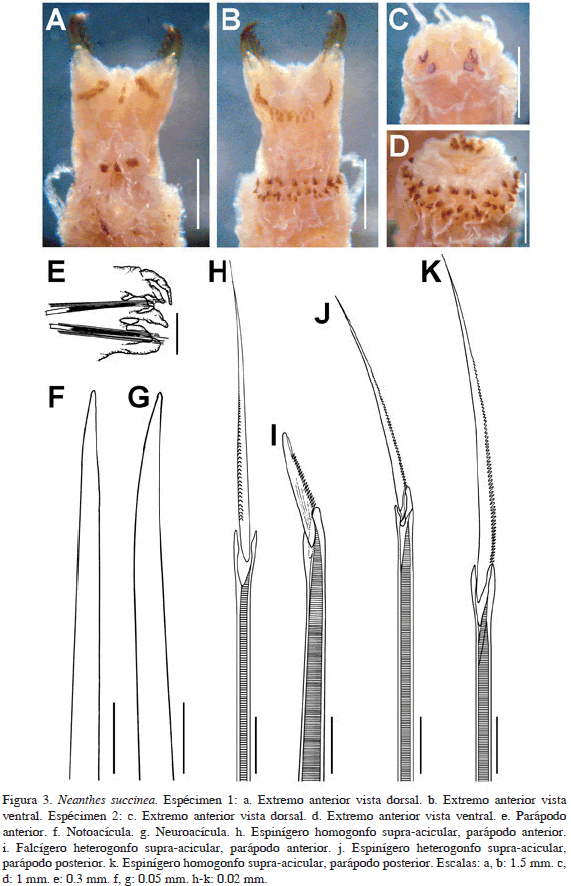
Neanthes succinea (Frey y Leuckart, 1847)
Figuras 3a-k
Nereis succinea Frey y Leuckart, 1847:154.
Nereis glandulosa Ehlers, 1908:74, pl.8 Figuras 1-6.
Neanthes succinea, Hartman, 1945:17, Figuras 1, 2; 1951:45. Rioja, 1946: 205, pl. 1, Figuras 1, 2. Imajima, 1972: 108, Figura 32a-k. Laverde-Castillo y Rodríguez-Gómez, 1987: 101. Salazar-Vallejo, 1996: 21. Dueñas, 1999: 12. Londoño-Mesa et al., 2002: 229. De León-González, 2009: 340, Figura 8B-C.
Nereis (Neanthes) succinea, Pettibone, 1963: 165, Figuras 44a-e, 45a-d. Day, 1973:41. Gardiner, 1976: 149, Figuras 15a-d.
Alitta succinea, Bakken y Wilson, 2005: 516-517; Glasby et al. 2009: 6; Quirós-Rodríguez et al., 2013: 91.
Material examinado. CEMUA-POLY-NERE-0399 (50), bahía Hooker, isla San Andrés, Caribe colombiano, Estación BHKJ1 (12°34'7.76"N 81°42'22.24"W), Julio/1998.
Descripción. Organismo incompleto (Figuras 3a-d), color café oscuro dorso-anteriormente, degradando a beige en setígeros posteriores; beige ventralmente. Con 30 mm de largo, 2 mm de ancho, 26 setígeros. Prostomio más largo que ancho, con un par de antenas cirriformes casi tan largas como los palpos. Dos pares de ojos en arreglo trapezoidal invertido, los anteriores más alejados uno del otro, negros, difusos y amorfos. Palpos subglobosos, de una y media vez el largo del prostomio; palpostilo no evidente. Peristomio tan ancho como el setígero 1, con cuatro pares de cirros tentaculares, el dorsal posterior más largo, alcanzando el setígero 6. Faringe evertida con paragnatos en ambos anillos faríngeos. Área I: 3 conos en línea longitudinal; área II: 18 conos en diagonal; área III: 23 conos agrupados cuadrangularmente; área IV: 25 conos en media luna; área V: 2 conos en línea vertical; área VI: 5-6 conos agrupados circularmente; áreas VII-VIII: 68 conos grandes y pequeños, dispuestos en 2-3 líneas transversales. Mandíbulas ámbar, con siete a nueve dientes. Parápodos birrámeos deteriorados con lóbulos, lígulas y cirros (Figura 3e). Acículas noto (Figura 3f) y neuropodiales (Figura 3g) puntiagudas. Notópodos y neurópodos anteriores con dos lóbulos semiglobosos y lígula media, cirros cirriformes, el dorsal más grande que el ventral, insertos basalmente. Parápodos posteriores del fragmento similares a los anteriores. Notópodos con espinígeros homogonfos espinulados (Figura 3h) supra-aciculares en parápodos anteriores y posteriores; neurópodos con falcígeros heterogonfos espinulados con lámina larga (Figura 3i), que supera la longitud de la base de la misma, supra e infra-aciculares en parápodos anteriores y posteriores; espinígeros heterogonfos espinulados en parápodos posteriores (Figura 3j) y espinígeros homogonfos espinulados en parápodos anteriores y posteriores (Figura 3k). Pigidio ausente.
Variaciones. Los organismos varían en tamaño, 7-15 mm de largo, 0.8-2 mm de ancho y 22-26 setígeros. Un organismo posee una elongación tan larga como la faringe en la región media de la faringe, en dirección distal, entre las mandíbulas. Otro espécimen posee dos paragnatos arreglados horizontalmente en el área V.
Observaciones. Una comparación con las demás especies registradas en el presente documento, se presentó arriba en las observaciones de N. acuminata. Neanthes succinea fue inicialmente descrita en el género Nereis, por lo que es común encontrarla como Nereis (Neanthes) succinea (Pettibone, 1963; Day, 1973). No obstante, recientemente fue considerada dentro del género Alitta (Bakken y Wilson, 2005; Bakken et al., 2009; Glasby et al., 2009; Quirós-Rodríguez et al., 2013); sin embargo, esta investigación considera el género Neanthes ya que fue resucitado por Sato (2013), quién refuta la transferencia de N. succinea al género Alitta, basado en que la especie sí posee notoacículas en los setígeros 1 y 2, contrario a la afirmación de Bakken y Wilson (2005), quienes consideran este carácter como ausente. Por lo tanto, aún hay una falta de claridad sistemática acerca de cuál es el género al que pertenece la especie. Por otro lado, de acuerdo con Uebelacker y Johnson (1984), N. succinea es similar a Nereis lamellosa, diferenciándose sólo por la ausencia de falcígeros notopodiales en parápodos posteriores, el cual es un carácter estable en el género Nereis. No obstante, debido a esto, cuando se tienen especímenes incompletos, a menudo es difícil definir a qué género pertenecen.
Neanthes succinea es diferente a N. brandti (Siberia), una de las especies similares morfológicamente del Caribe, debido a que presenta dos paragnatos en línea en el área V, seis conos en distribución circular en el área VI y dos a tres líneas irregulares de conos grandes y pequeños en las áreas VII-VIII, mientras que N. brandti presenta una mancha difusa de numerables paragnatos pequeños en el área V, 4-5 conos en línea en el área VI y una banda ancha de numerosos conos pequeños en las áreas VII-VIII (de León-González, 2009). Adicionalmente, tanto N. succinea como N. brandti son aceptados perteneciendo al género Alitta (Worms, 2013); no obstante, esto es aún propuesto y se necesita mayor discusión y análisis por los expertos. Por lo tanto, en este documento, se sigue teniendo en cuenta la especie como Neanthes.
Neanthes succinea tiene una distribución en estuarios y ambientes cerca de la costa, siendo ampliamente registrada en comunidades bentónicas (Pardo y Dauer, 2003). De acuerdo con Londoño-Mesa et al. (2002), estos organismos fueron encontrados asociados a las raíces sumergidas del mangle rojo en aguas con relativa influencia de agua marina, altas descargas antrópicas y un gran impacto por hidrocarburos en bahía Hooker. En el mismo estudio se analizaron las muestras de raíces del mangle rojo de bahía Honda, la cual está cerca (Figura 1), pero con condiciones intermedias en cuanto a influencia y descargas. En dicha bahía, esta especie igualmente fue encontrada, pero los especímenes no fueron tenidos en cuenta para este estudio, debido al mal estado de conservación en que se encontraron. Por lo tanto, en concordancia con Pardo y Dauer (2003), esta especie es euritópica, resistiendo y tolerando condiciones extremas, que otras especies no tolerarían. Se concluye que N. succinea podría ser una especie bioindicadora de aguas perturbadas, posiblemente con niveles cambiantes de oxígeno y de hidrocarburos, así como con descargas antrópicas variables. Londoño-Mesa et al. (2002) presentan las condiciones fisicoquímicas encontradas en el estudio para cada una de las estaciones.
Localidad tipo y distribución. Neanthes succinea fue descrita para el Mar del Norte. No obstante, se considera que tiene una amplia distribución en aguas templadas y tropicales (Uebelacker y Johnson, 1984). En el Gran Caribe, Salazar- Vallejo (1996) menciona que la especie ha sido registrada en la costa este de Estados Unidos, Florida, Golfo de México, Caribe mexicano, Panamá, Colombia, Venezuela e isla Trinidad. En Colombia, Dueñas (1999) y Báez y Ardila (2003) hicieron una recopilación de los registros hechos en el Caribe y mencionan que N. succinea ha sido registrada principalmente al norte del litoral continental, en el Parque Nacional Natural Tayrona, en la Ciénaga Grande de Santa Marta, en la bahía de Cartagena, en la bahía Cispatá y en Puerto Rey. Estudios recientes han encontrado la especie en el golfo de Urabá (Arteaga-Flórez, 2010) y al sur del litoral colombiano, en isla Fuerte (Molina-Acevedo, 2012). En el área insular oceánica del Caribe colombiano, sólo ha sido registrada por Londoño-Mesa et al. (2002) con el material usado en el presente documento.
Neanthes sp.
Figuras 4a-i
Nereis (Neanthes) succinea non Frey y Leuckart, Londoño-Mesa et al., 2002: 229.
Material examinado. CEMUA-POLY-NERE-0400 (4), Bahía Honda, isla San Andrés, Caribe colombiano, Estación BHNJ2 (12°34'7.76"N 81°42'22.24"W), julio/1998.
Descripción. Organismo incompleto, color café dorsal y ventralmente (Figuras 4a-d). Con 19 mm de largo, 1.2 mm de ancho y 56 setígeros. Prostomio más largo que ancho sin hendidura distal, con un par de antenas cirriformes, de la mitad del largo de los palpos. Dos pares de ojos negros en arreglo trapezoidal invertido, los anteriores más alejados uno del otro y en media luna, los posteriores redondos. Palpos subcónicos con palpostilo cilíndrico. Peristomio del ancho del primer setígero, con cuatro pares de cirros tentaculares, el dorsal posterior de mayor tamaño, alcanzando el setígero 5. Faringe evertida con paragnatos en ambos anillos faríngeos: Área I: 3 conos en línea; área II: 17-19 conos en diagonal; área III: 30 conos agrupados cuadrangularmente; área IV: 18 conos en tres líneas transversales; área V: 5 conos en organización de dado; área VI: 6-9 conos agrupados circularmente; áreas VII-VIII: dos a tres líneas de muchos conos. Mandíbulas ámbar con siete a nueve dientes. Parápodos birrámeos, deteriorados en el espécimen, con lóbulos, lígulas y cirros poco distinguibles. Acículas negras noto y neuropodiales (Figura 4e). Notópodos de parápodos anteriores con tres lóbulos, el superior sub-cónico con cirro dorsal inserto basalmente, y los demás digitiformes; lígula media; neurópodos de parápodos anteriores con dos lóbulos, el inferior subcónico, con cirro ventral inserto basalmente. Notópodo de parápodos posteriores con dos lóbulos, el superior expandido y con el cirro inserto subdistalmente; neurópodo de parápodos posteriores con dos lóbulos digitiformes, el inferior de mayor tamaño con cirro inserto basalmente. Notópodos anteriores con espinígeros homogonfos supraciculares espinulados en el margen interno (Figura 4f); neurópodos anteriores con espinígeros homogonfos espinulados supra e infra-aciculares y falcígeros heterogonfos supra e infraaciculares de lámina mediana. Notópodos medios con espinígeros homogonfos notopodiales y espinígeros homogonfos neuropodiales supraciculares y heterogonfos infraciculares (Figura 4g), falcígeros heterogonfos neuropodiales de lámina larga, superando la longitud de la base de la misma (Figura 4h). Notópodos posteriores con espinígeros homogonfos; neurópodos posteriores con espinígeros homo y sesquigonfos (Figura 4i) y falcígeros heterogonfos de lámina larga supraciculares, e infraciculaes. Pigidio ausente.
Variaciones. Organismos de 12-17 mm de largo, 0.6-1.1 mm de ancho y 34-70 setígeros. El individuo más pequeño posee palpos sub-globosos. Los demás caracteres no variaron.
Observaciones. Londoño-Mesa et al. (2002) identificaron inicialmente este material como Neanthes succinea, asociados a las raíces sumergidas de R. mangle en la zona intermareal. No obstante, una revisión taxonómica más exhaustiva del material, usando literatura actualizada, ayudó a identificar este material sólo como Neanthes sp., debido a que no se encuentra en óptimas condiciones, pero conserva las características de la faringe, las cuales poseen un alto valor taxonómico. Este material es muy similar a aquel identificado como N. succinea, aunque difiere en el número y arreglo de paragnatos en la farínge ya que N. succinea posee en el área IV 25 conos en arreglo de media luna y en el área V dos conos en línea vertical, mientras que Neanthes sp. tiene en el área IV 18 conos arreglados en tres líneas transversales y en el área V cinco conos en organización de dado (dos anteriores, dos posteriores y uno central). Adicionalmente, Neanthes sp., presenta espinígeros heterogonfos en parápodos medios, mientras que N. succinea carece de los mismos. Es importante aclarar que al correr la clave taxonómica de de León-González (2009) no hay concordancia con los caracteres mostrados allí debido a que Neanthes sp. posee parápodos con lígula dorsal y media, falcígeros de lámina larga, pero al seguir la clave los organismos con esos caracteres debían tener en el área I un paragnato o carecer de ellos, mientras que Neanthes sp., tiene tres paragnatos. Realizando la comparación con Neanthes mexicana Fauchald, 1972, la especie más cercana al correr la clave taxonómica mencionada, Neanthes sp. tiene varias diferencias marcadas con dicha especie, principalmente en el arreglo y número de paragnatos en la farínge: N. mexicana tiene un paragnato cónico en el área I, el área V no tiene paragnatos, el área VI posee un paragnato cónico y las áreas VII-VIII poseen cinco paragnatos en una línea; mientras que Neanthes sp. posee tres paragnatos cónicos en el área I, cinco paragnatos en el área V, seis a nueve paragnatos en arreglo circular en el área VI y las áreas VII-VIII dos a tres líneas de conos. Una comparación con las demás especies registradas en el presente documento es encontrada en las observaciones de N. acuminata.
Distribución. Bahía Honda, noreste de sla San Andrés, Caribe colombiano insular oceánico.
Platynereis Kinberg, 1866
Platynereis mucronata de León-González, Solís-Weiss y Valadez-Rocha, 2001
Figuras 5a-e
Platynereis mucronata de León-González, Solís-Weiss y Valadez-Rocha, 2001: 391-394, Figuras 2A-H.
Tylorrhynchus bahamensis, Londoño-Mesa et al., 2002: 229.
Material examinado. CEMUA-POLY-NERE-0401 (1), PNNOPL, Caribe colombiano, Estación MBJ (13°21'46.43"N 81°21 '16.71"W), julio/1998.
Descripción. Organismo incompleto, color beige. Con 10 mm de largo, 0.9 mm de ancho y 20 setígeros. Prostomio más largo que ancho, con un par de cicatrices antenales. Ojos negros en arreglo trapezoidal, los anteriores más alejados uno del otro. Palpos tan largos como el ancho del prostomio; palpostilo no evidente. Peristomio cercanamente tan ancho como el setígero 1, con cuatro cicatrices de cirros peristomiales. Faringe evertida con pectinas en ambos anillos faríngeos. Áreas I y II: sin paragnatos o pectinas; área III: tres líneas de pectinas; área IV: tres líneas diagonales de pectinas; área VI: una línea transversal de pectinas; áreas VII-VIII: tres líneas transversles de pectinas. Mandíbulas cafés con ocho dientes. Parápodos birrámeos deteriorados, con lóbulos, lígulas y cirros poco distinguibles (Figura 5a). Acículas negras (Figura 5b); parápodos anteriores con tres lóbulos cilíndricos de igual tamaño, el ventral tan ancho como el doble de los superiores. Cirros cirriformes, insertos basalmente. Parápodos posteriores con lóbulos indiferenciados. Notópodos anteriores y posteriores con espinígeros homogonfos espinulados supra (Figura 5c) y sub-aciculares (Figura 5d); neurópodos anteriores y posteriores con falcígeros de lámina mediana (Figura 5e), tan larga como la base de la misma, y espinígeros heterogonfos espinulados. Pigidio ausente.
Observaciones. Londoño-Mesa et al. (2002) identificaron inicialmente este material como Tylorrhynchus bahamensis, asociados a raíces sumergidas de R. mangle. Platynereis mucronata es similar a P. hutchigsae de León-González, Solís-Weiss y Valadez-Rocha, 2001. Se diferencian en que P. hutchingsae no presenta pectinas en las áreas I, III, IV y V de la faringe, mientras que P. mucronata presenta pectinas en las áreas III y IV; adicionalmente, P. mucronata presenta falcígeros heterogonfos neuropodiales con terminación en gancho, ausentes en P. hutchingsae (de León- González et al., 2001).
De acuerdo con las descripciones originales, P. hutchingsae y P. mucronata presentan falcígeros homogonfos notopodiales, por lo que al seguir la clave taxonómica de de León-González (2009), es fácil confundir dichas especies; además, el material revisado en esta investigación carecía de falcígeros homogonfos notopodiales, aunque al leer la descripción original de ambas especies, todos los caracteres concordaban con P. mucronata, por lo cual se puede inferir que dichos falcígeros pudieron haberse perdido o dañado junto con algunas carnosidades de los parápodos. Platynereis mucronata también se diferencia de P. dumerilii (Audouin y Milne-Edwards, 1933) en que esta última presenta falcígeros homogonfos notopodiales redondeados distalmente y la faringe posee seis pectinas en el área III, nueve pectinas en arreglo creciente en el área IV y cinco grupos de pectinas dobles en las áreas VII-VIII.
Por último, esta especie no había sido identificada en Colombia, debido a que es muy reciente, y todos los registros de neréididos para el país son anteriores al año 2001. Posiblemente, una revisión exhaustiva del material comentado por Dueñas (1999) y Báez y Ardila (2003) resulte en el hallazgo de esta especie, erróneamente identificada bajo otro nombre, tal como ocurrió con el material identificado en el presente documento.
De acuerdo con Londoño-Mesa et al. (2002), este individuo fue identificado como T. bahamensis, una especie perteneciente a la subfamilia Gymnonereidinae. No obstante, esa subfamilia se caracteriza por poseer algunos parápodos con cirros neuropodiales dobles, lo cual no se presentan en el material identificado como P. mucronata. De acuerdo con la descripción original, T. bahamensis posee falcígeros notopodiales homogonfos sin serración pero con dos dientes prominentes al final de la lámina, mientras que P. mucronata posee falcígeros homogonfos notopodiales en parápodos anteriores sin serración, pero con un diente apical dirigido hacia abajo. Igualmente, ambas especies difieren en el tipo y disposición de los elementos en las áreas de los anillos faríngeos. Tylorrhynchus bahamensis presenta un paragnato en el área VI, y una serie de siete paragnatos de diferentes tamaños en las áreas VII y VIII, mientras que P. mucronata tiene pectinas en las áreas III, IV, VI, VII y VIII. Adicionalmente, T. bahamensis tiene una distribución en el litoral continental colombiano, pues ha sido registrada por Laverde-Castillo y Rodríguez-Gómez (1987) y Dueñas (1999) para bahía de Cartagena, mientras que P. mucronata tiene una distribución insular colombiana, presentándose en el archipiélago de San Andrés y Providencia, según la presente investigación, y en isla Fuerte, Bolívar, según Molina-Acevedo (2012), y continental recientemente encontrada por Arteaga-Flórez (2010), en el Caribe chocoano y antioqueño del golfo de Urabá.
Localidad tipo y distribución. Platynereis mucronata fue descrita para el sur del golfo de México. De acuerdo con de León-González (2009), la especie se distribuye también hacia el Caribe mexicano. También en el Caribe colombiano en el golfo de Urabá (Arteaga-Flórez, 2010) e isla Fuerte (Molina-Acevedo, 2012). Este registro expande la distribución de la especie hacia el Caribe colombiano insular oceánico, en isla Providencia.
AGRADECIMIENTOS
Al Instituto de Investigaciones Marinas y Costeras (Invemar), por proveer fondos para el desarrollo de la presente investigación, a través del convenio de cooperación académica y científica 019-12 del Programa de Biodiversidad y Ecosistemas Marinos (BEM), la cual hace parte del trabajo de investigación de maestría "Análisis taxonómico y biogeográfico de los neréididos (Annelida, Polychaeta, Nereididae) del Caribe colombiano". Adriana Santos-Martínez permitió realizar la investigación con las muestras de poliquetos en el desarrollo del proyecto "Evaluación preliminar de la biodiversidad marina asociada a los manglares del Parque McBean Lagoon en Providencia, y bahías Honda y Hooker en San Andrés, Caribe colombiano", Instituto de Estudios Caribeños, Universidad Nacional de Colombia. Edgar Andrés Estrada Urrea ayudó con la elaboración del mapa. Finalmente, se agradece a los evaluadores anónimos, cuyos aportes fueron importantes para mejorar este documento.
BIBLIOGRAFÍA
1 Arteaga-Flórez, C. 2010. Poliquetos (Annelida: Polychaeta) asociados a raíces de mangle rojo, Rhizophora mangle, en el golfo de Urabá, Caribe colombiano. Tesis Biol., Universidad de Antioquia, Medellín. 111 p. [ Links ]
2 Báez, D.P. y N.E. Ardilla. 2003. Poliquetos (Annelida: Polychaeta) del mar Caribe colombiano. Biota Colomb., 4(1): 89-109. [ Links ]
3 Bakken, T. y R. Wilson. 2005. Phylogeny of nereidids (Polychaeta, Nereididae) with paragnaths. Zool. Scripta, 34: 507-547. [ Links ]
4 Bakken, T., C.J. Glasby y R.S. Wilson. 2009. A review of paragnath morphology in Nereididae (Polychaeta). Zoosymposia, 2: 305-316. [ Links ]
5 Cañete, J.I., G.L. Leighton y E.H. Soto. 2000. Proposición de un índice de vigilancia ambiental basado en la variabilidad temporal de la abundancia de dos especies de poliquetos bentónicos de bahía Quintero, Chile. Rev. Biol. Mar. Ocean., 35: 185-194. [ Links ]
6 Day, J.H. 1973. New Polychaeta from Beaufort with a key to all species recorded from North Carolina. NOAA Tech. Rep. NMFS Circ., 375, 140 p. [ Links ]
7 De León-González, J.A. 1999. Nereididae (Annelida: Polychaeta) de México. Informe final SNIB-CONABIO proyecto No. H011, Universidad Autónoma de Nuevo León, Monterrey. 289 p. [ Links ]
8 De León-González, J.A. 2009. Nereididae Lamarck, 1818. Tomo II. 325-354. En: De Léon-González, J.A., J.R. Bastida-Zavala, L.F. Carrera-Parra, M.E. García-Garza, A. Peña-Rivera, S.I. Salazar-Vallejo y V. Solís-Weiss. Poliquetos (Annelida: Polychaeta) de México y América Tropical. Tomos I, II y III. Universidad Autónoma de Nuevo León, Monterrey. 737 p. [ Links ]
9 De León-González, J.A., V. Solís-Weiss y V. Valadez Rocha. 2001. Two new species of Platynereis (Polychaeta: Nereididae) from eastern Mexican shores. Proc. Biol. Soc. Wash., 114(2): 389-395. [ Links ]
10 Dueñas, P.R. 1999. Algunos poliquetos (Annelida) del Caribe colombiano. Milenio, Rev. Fac. Cien. Bas. Univ. Córdoba, 1: 9-18. [ Links ]
11 Ehlers, E. 1868. Die Borstenwürmer nach systematischen und anatomischen Untersuchungen dargestellt. Wilhelm Engelmann, Leipzig, Alemania. 748 p. [ Links ]
12 Ehlers, E. 1908. Die bodensässigen Anneliden aus den Sammlungen der deutschen Tiefsee-Expedition. Wiss. Ergebn. deutsch. Tlefsee-Exped. Valdivia, 1898-99, 16(1): 1-168. [ Links ]
13 Frey, H. y R.S. Leuckart. 1847. Beitrage zur Kenntnis wirbelloser Thiere mit besonderer Berucksichtigung der Fauna des norddeutschen Meeres. Friedrich Vieweg, Braunschweig, Alemania. 170 p. [ Links ]
14 Gardiner, S.L. 1976. Errant polychaete annelids from North Carolina. J. Elisha Mitchell Sci. Soc., 91: 77-220. [ Links ]
15 Glasby, C.J. y K. Fauchald. 2000. Key to the families of Polychaeta. 53-61. En: Beesley, P. L., G. J. B. Ross y C. J. Glasby (Eds.). Polychaetes and allies: The Southern synthesis. Fauna of Australia, 4A. Polychaeta, Myzostomida, Pogonophora, Echiura, Sipuncula. CSIRO Publishing, Melbourne. 465 p. [ Links ]
16 Glasby, C.J., T. Timm, A.I. Muir y J. Gil. 2009. Catalogue of non-marine Polychaeta (Annelida) of the World. Zootaxa, 2070: 1-52. [ Links ]
17 Gómez-López, D.I., C. Segura-Quintero, P.C. Sierra-Correa y J. Garay-Tinoco (Eds.). 2012. Atlas de la Reserva de Biósfera Seaflower. Archipiélago de San Andrés, Providencia y Santa Catalina. Serie de Publicaciones Especiales No. 28, Instituto de Investigaciones Marinas y Costeras; Corporación para el Desarrollo Sostenible del Archipiélago de San Andrés, Providencia y Santa Catalina, Santa Marta. 180 p. [ Links ]
18 Hartman, O. 1945. The marine annelids of North Carolina. Bull. Duke Univ. Mar. Sta., 2, 54 p. [ Links ]
19 Imajima, M. 1972. Review of the annelid worms of the family Nereidae of Japan, with description of five new species or subspecies. Bull. Nat. Sci. Mus. Tokyo, 15: 37-153. [ Links ]
20 Laverde-Castillo, J.J. y H. Rodríguez-Gómez. 1987. Lista de los poliquetos registrados para el Caribe colombiano, incluyendo comentarios sobre su zoogeografía. An. Inst. Inv. Mar. Punta Betín, 17: 95-112. [ Links ]
21 Liñero-Arana, I. y O. Díaz-Díaz. 2011. Poliquetos bénticos de Venezuela: Aspectos morfológicos de los poliquetos bénticos y diagnosis y datos biológicos de las familias presentes en la costa venezolana. Editorial Universitaria. 147 p. [ Links ]
22 Londoño-Mesa, M.H., J. Polanía e I. Vélez. 2002. Polychaetes of the mangrove-fouling community at the Colombian Archipelago of San Andrés and Old Providence, Western Caribbean. Wet. Ecol. Man., 10: 227-232. [ Links ]
23 Molina-Acevedo, I.C. 2012. Poliquetos (Polychaeta: Annelida) de isla Fuerte, Caribe colombiano. Tesis Biol., Universidad de Antioquia, Medellín. 187 p. [ Links ]
24 Pardo, E.V. y D.M. Dauer. 2003. Particle size selection in individuals from epifaunal versus infaunal populations of the nereidid polychaete Neanthes succinea (Polychaeta: Nereididae). Hidrobiología, 496: 355-360. [ Links ]
25 Pettibone, M.H. 1963. Marine polychaete worms of the New England Region. 1. Aphroditidae through Trochochaetidae. Bull. U.S. Nat. Mus., 227, 356 p. [ Links ]
26 Quirós-Rodríguez, J., P. Dueñas-Ramírez y N.H. Campos. 2013. Poliquetos (Annelida: Polychaeta) asociados a algas rojas intermareales de Córdoba, Caribe Colombiano. Rev. Biol. Mar. Ocean., 48(1): 87-98. [ Links ]
27 Renaud, J.C. 1956. A report on some polychaetous annelids from the Miami-Bimini area. Am. Mus. Novit., 1812: 1-40. [ Links ]
28 Rioja, E. 1918. Datos para el conocimiento de la fauna de anélidos poliquetos del Cantábrico. Trab. Mus. Nal. Cienc. Nat., Ser. Zool. 29, 111 p. [ Links ]
29 Rioja, E. 1946. Estudios Anelidológicos XV. Neréidos de agua salobre de los esteros del litoral del golfo de México. An. Inst. Biol. Univ. Nal. México, 17: 205-214. [ Links ]
30 Rouse, G.W. y K. Fauchald. 1997. Cladistic and polychaetes. Zool. Scripta, 26(2): 139-204. [ Links ]
31 Rouse, G.W. y F. Pleijel. 2001. Polychaetes. Oxford University Press, Oxford. 354 p. [ Links ]
32 Salazar-Vallejo, S.I. 1996. Lista de especies y bibliografía de poliquetos (Polychaeta) del Gran Caribe. An. Inst. Biol. Univ. Nal. Aut. Mex., Ser. Zool., 67(1): 11-50. [ Links ]
33 Salazar-Vallejo, S.I. y M.S. Jiménez-Cueto. 1997. Neréididos (Polychaeta) del Caribe mexicano con una clave para las especies del Gran Caribe. Rev. Biol. Trop., 44(3)/45(1): 361-377. [ Links ]
34 Santos, C.S.G. 2007. Nereididae from Rocas Atoll (North-East, Brazil). Arch. Mus. Nac. Rio Jan., 65(3): 369-380. [ Links ]
35 Santos-Martínez, A., J. Polanía y J. Medina. 1998. Evaluación preliminar de la biodiversidad marina asociada a los manglares del Parque McBean Lagoon en Providencia y Bahías Honda y Hooker en San Andrés, Caribe colombiano. Informe de investigación, Instituto de Estudios Caribeños, Universidad Nacional de Colombia, San Andrés. 16 p. [ Links ]
36 Sato, M. 2013. Resurrection of the genus Nectoneanthes Imajima, 1972 (Nereididae: Polychaeta), with redescription of Nectoneanthes oxypoda (Marenzeller, 1879) and description of a new species, comparing them to Neanthes succinea (Leuckart, 1847). J. Nat. Hist., 47(1-2), 50 p. [ Links ]
37 Taylor, J. 1984. Nereidae Johnston. 1845. Chapter 31. 31-1 a 31-42. En: Uebelacker, J.M y P.G. Johnson (Eds.). Taxonomic guide to the polychaetes of the northern Gulf of Mexico. Final report to the Mineral Management Service, contract 14-152-29091. 7 Vols, Barry A. Vittor and Associates, Inc., Mobile, EE.UU. 1499 p. [ Links ]
38 Uebelacker, J.M. y M.L. Johnson (Eds.). 1984. Taxonomic guide to the polychaetes of the northern Gulf of Mexico. Final Report to the Minerals Management Service, contract 14-12-001-29091. 7 Vols. Barry A. Vittor and Associates. Inc., Mobile, EE.UU. 1499 p. [ Links ]
39 Weinberg, J.R., V.R. Starezak, C. Mueller, G.G. Pesch y S.M. Lindsay. 1990. Divergence between populations of a monogamous polychaete with male parental care: premating isolation and chromosome variation. Mar. Biol., 107: 205-213. [ Links ]
40 Worms. 2013. World register of marine species. Editorial Board. http://www.marinespecies.org at VLIZ. 09/11/2013. [ Links ]
FECHA DE RECEPCIÓN: 13/12/2013 FECHA DE ACEPTACIÓN: 22/04/2015