INTRODUCCIÓN
En el zooplancton, las series de tiempo a largo término (>10 años) aportan información para la comprensión del ecosistema pelágico y permite comparaciones para evaluar cambios y determinar posibles causas de las variaciones temporales (Richardson, 2008; Church et al., 2013). Para describir las diferentes configuraciones de poblaciones, comunidades o el ecosistema y por lo tanto sus variaciones se utilizan las palabras "cambios de régimen" que son indicados por las modificaciones en composición y abundancia del zooplancton (Möllman et al., 2015), en consecuencia el cambio de régimen ecológico es la variación en la estructura comunitaria y/o en especies que se mantienen algún tiempo (Sheffer y Carpenter, 2003).
En el pélagos de la zona fótica es fundamental la importancia trófica del plancton (Roemmich y McGowan, 1995; Beaugrand, 2015), que además responde rápido a los cambios ambientales, en especial el zooplancton, que se considera indicador de efectos climáticos (Hays et al, 2005), lo cual se explica porque en las aguas superficiales la temperatura afecta la fisiología del plancton, su crecimiento, la talla y el tiempo intergeneracional (Peters, 1983; Mauchline, 1998); además la turbulencia del viento altera el comportamiento individual, el metabolismo y las relaciones tróficas (Mackenzie y Legget, 1991; Margalef, 1997; Alcaraz, 1997), en consecuencia el clima impacta todo el ecosistema.
La abundancia de grupos del plancton, su diversidad y ensamble de especies informan del estado del ecosistema pelágico (Beaugrand, 2005) mejor que las variables físicas (Perry et al., 2004). Los cambios ambientales causan modificaciones en el zooplancton (Mackas et al., 2001; Beaugrand y Reid, 2003) e indican cambio de régimen (De Young et al., 2008; Scheffer, 2009; Mölmann y Diekmann, 2012; Möllman et al., 2015) lo que se presenta en todo el mundo (Hare y Mantua, 2000; Oguz et al, 2003; Peterson y Schwing, 2003; Alheit y Niquen, 2004; Cury y Shannon, 2004; Alheit et al, 2005; Weijerman et al, 2005; Kasai y Ono, 2007). La modificación del ecosistema no siempre es acusada, sino que puede ser leve y/o persistente, con variación en la retroalimentación y cambios notables en los servicios (Rocha et al., 2015), como puede ser el colapso de las pesquerías (Worm et al, 2006; Jiao, 2009).
La sardina Sardinella aurita está incluida en los peces denominados "pequeños pelágicos" de notable importancia trófica porque son el alimento de peces predadores, aves y mamíferos (Cury et al, 2000; Pikitch et al, 2014). Abundan en los ecosistemas de surgencia en donde consumen el plancton (Nikolioudakis et al., 2015). Son especies omnívoras que cambian de alimentación particulada a filtradora (James, 1987; Van der Lingen et al, 2006; Garrido et al., 2007), tienen ciclo de vida corto y sus poblaciones presentan acusadas fluctuaciones temporales como respuesta rápida a modificaciones en las condiciones ambientales (Alheit et al., 2009; Deyle et al., 2013).
El recurso pesquero más importante en Venezuela es la sardina S. aurita, explotada por 90 años. Su pesquería comenzó en 1927 (Guzmán et al., 2003) y en 1934 su procesamiento (enlatado) en isla Margarita (Gómez et al., 2008, 2014; Gómez, 2018). En 2003-2004 la captura nacional fluctuó alrededor de 200000 toneladas, en 2005 disminuyó apreciablemente comenzando una crisis sardinera con duración aproximada de 10 años porque en 2016 las capturas tuvieron relativa recuperación alcanzando 100000 toneladas (Insopesca inf. pers.). Se pesca en el nororiente del país (estados Sucre y Nueva Esparta), en este último, a comienzos de siglo, las capturas fueron 100000 toneladas y disminuyeron 50% en 2005 y 92% en 2006 (Gómez, 2006; Gómez et al, 2008) continuaron declinando los años subsiguientes (Gómez, 2015) hasta el 2016 cuando se pescaron más de 42000 toneladas (Aprosardine., com. pers). La crisis sardinera se atribuye a los pescadores por la sobrepesca (González et al., 2007; Rueda, 2012; Mendoza, 2015), pero desde su inicio citan causas ecológicas (Gómez, 2006, 2007; Gómez et al, 2008) y disminuyó la fertilidad regional (Taylor et al., 2012; Gómez y Barceló, 2014; Gómez et al., 2014, 2012) afectando la población sardinera, como ha ocurrido en otras áreas marinas con recursos de peces pequeños pelágicos.
El este de isla Margarita, es una importante área de captura del principal recurso pesquero venezolano, pero desde 2005 la pesca decayó marcadamente, iniciándose una crisis sardinera. En consideración que este recurso se alimenta de plancton, se consideró de importancia estudiar la densidad y la composición del mesozooplancton a largo término (15 años), lo cual permitirá una mejor comprensión de la ecología regional.
ÁREA ESTUDIO
La región nororiental de Venezuela (Figura 1) incluye los estados Sucre y Nueva Esparta, éste último formado por las islas Margarita, Coche y Cubagua. Es la región marina más productiva del mar Caribe (Gómez, 1996, 2001; Rueda, 2012) principalmente durante los primeros meses del año por la surgencia de aguas subtropicales, siendo objeto de numerosas investigaciones oceanográficas (Gómez y Barceló, 2014). La isla Margarita se localiza en el centro de la surgencia regional (Gómez, 1996), está rodeada por aguas con excepcional productividad que originan una considerable riqueza pesquera (Margalef, 1965; Gómez, 2001).
MATERIALES Y METODOS
Desde mediados de 2002 a diciembre de 2016 quincenalmente se visitaron dos estaciones (Figura1) localizadas a cinco millas de la costa oriental de Margarita (11° 03' 19" N - 63° 45' 53" W y 10° 52' 13" N - 63° 50 29" W), en ambas la profundidad alcanza los 30 m. Los muestreos se hicieron entre 5:30 y 10 pm utilizando red con diámetro de 1,7 m y longitud de 3,5 m (abertura de malla de 400 micras) arrastrada horizontalmente a profundidad de 10-15 m durante 20 minutos. Se estimó que en cada arrastre se filtró un volumen aproximado de 650 m3 de agua (según distancia recorrida por la embarcación); los primeros años se utilizó un contador de flujo que verificó relativa constancia en el volumen por tiempo de arrastre y por marcas de campo precisas, por lo cual todos fueron ajustados a igual volumen nominal. Esta situación es frecuente en series de tiempo de larga duración como la conocida WEC (occidente del canal ingles) aguas afuera de Plymouth, iniciada a comienzos del siglo XX (Blackett et al., 2014). Las muestras se conservan (formol 5%) en el Museo Marino de Margarita. Con fraccionador de plancton Folsom la muestra se subdividió en dos partes, una para estimar la composición y densidad de los principales grupos del zooplancton mediante contaje al microscopio estereoscópico (Zeiss M7) observando al menos el 10% de la submuestra de volumen conocido y extraída con pipeta Stempel, según pautas generales (Boltovskoy, 1981). Con la otra mitad de muestra se determinó la abundancia total (densidad, volumen sedimentado y peso seco) del zooplancton que constituye trabajo en proceso. Los resultados fueron comparados mediante análisis de varianza multifactorial y con la prueba de rangos múltiples se determinó homogeneidad de grupos de años. Se utilizó el programa estadístico Statgraphics®, se aplicó el cociente del cuadrado de la variación sobre promedio total como prueba de normalidad, en un caso se hizo transformación logarítmica (log n+1). Se excluyeron los anfípodos por su escasa aparición en los muestreos.
RESULTADOS
Los muestreos fueron realizados durante 15 años (2002-2016), se analizaron 655 muestras de mesozooplancton. El análisis de varianza multifactorial simple y con datos transformados indicó diferencia estadística significante entre los años de estudio (p < 0,01), pero no entre las estaciones, por lo cual se analizaron en conjunto. En 21 grupos del zooplancton se cuantifico la densidad (ind/m3) y la representación porcentual en la composición general, así como el promedio anual y error estándar. En la Tabla 1 se muestra el promedio y Anova entre los años.
Tabla 1 Densidad anual (ind /m3) y representación porcentual (%) de grupos del zooplancton nocturno durante 15 años de muestreo en el sureste de Isla Margarita (Venezuela) y Anova (valor F y p) entre años de estudio. (p <0,01 * significante). Al final densidad del zooplancton total.

Abundancia de principales grupos
Copépodos: la densidad promedio anual varió entre 4,53 y 56,27 ind/m3 (total 26,47 ± 2,54); en años 2002-2004 y 2014-2016 se encontraron menores promedios anuales (4,53 a 10,29 ind/m3) pero más elevados (18,80 a 56,27 ind/m3) en el período 2006 a 2013 (Tabla 1); esta tendencia interanual es general en la mayoría de grupos estudiados y se muestra en la Figura 2A. Además, la prueba de rangos múltiples verifica que los años 2002, 2003, 2004, 2013, 2014, 2015 y 2016 forman un grupo con los menores promedios; 2005 y 2012 fueron años de quiebre de la tendencia, y otro grupo formado por años 2006, 2007, 2008, 2009, 2010 y 2011 con promedios mayores. Con relación a la representación en el zooplancton, el promedio anual varió entre 13,73 y 34,48 % (total 22,71 ± 0,80); en 2002-2004 y 2014-2016 se calcularon menores promedios (hasta 23,90%) mientras que entre 2006 y 2013 fueron más elevados (hasta 34,48%).
Cladóceros Penilia: la densidad promedio anual fluctuó entre 1,23 y 57,47 ind/m3 (total 20,92±3,48); en años 2002-2005 y 2014-2016 se encontraron menores promedios (hasta 18,06 ind/m3) y mayores (hasta 57,47) entre 2006 y 2013 (Tabla 1), la tendencia se observa en Figura 2B. La prueba de rangos múltiples verifica que 2003, 2005, 2014, 2015 y 2016 forman un grupo con menores promedios y otro grupo 2002, 2004, 2006, 2007, 2008, 2009, 2010, 2011, 2012 y 2013 con valores mayores. La representación anual en el zooplancton osciló entre 6,12 y 17,66 % (total 12,56 ± 1,02).

Figura 2 Abundancia anual (ind/m3) de mesozooplancton al este de Isla Margarita, Venezuela (2002-2016). Se observa promedio (punto) e intervalos de confianza (95%).
Cladóceros Podon: la densidad promedio anual osciló entre 1,03 y 11,50 ind/m3 (total 6,74 ± 0,77); en 2002-2004 y 2014-2016 se calcularon menores promedios (hasta 5,92 ind/m3) y más elevados (hasta 11,50) entre 2006 y 2013 (Tabla 1), la tendencia se observa en Figura 2C. La prueba de rangos múltiples indica que 2002, 2003, 2016, 2004 y 2005 constituyen grupo con menores promedios y otro grupo por 2014, 2006, 2008, 2010, 2009, 2011, 2012 y 2013 con valores mayores. La representación anual en el zooplancton varió entre 1,70 y 13,35% (total 7,60 ± 0,60).
Sergestidos Lucifer faxoni: la densidad promedio anual varió entre 3,71 y 28,69 ind/m3 (total 14,92 ± 1,04). En 2002-2004 y 2014-2016 se calcularon menores promedios (hasta 12,48 ind/m3) y mayores (hasta 28,19) del 2006 al 2012 (Tabla 1), la tendencia se observa en Figura 2D. La prueba de rangos múltiples determina grupo formado por 2016, 2015, 2014, 2013, 2005, 2004, 2003 y 2002 con menores promedios, y otro grupo 2006, 2007, 2008, 2009, 2010, 2011 y 2012, con valores mayores. La representación anual en el zooplancton fluctuó entre 6,32 y 23,20% (total 14,52 ± 0,65).
Chaetognatos Sagitta: la densidad promedio anual fluctuó entre 0,48 y 7,90 ind/m3 (total 3,31 ± 0,29); en 2002-2004 y 2014-2016 se calcularon menores promedios (hasta 1,12 ind/m3) y más elevados (hasta 7,90) entre 2005 y 2013 (Tabla 1), tendencia que se muestra en Figura 2E. La prueba de rangos múltiples indica que 2002, 2003, 2004, 2014, 2015 y 2016, forma grupo con menores promedios; 2005 y 2013 son años de quiebre, y otro grupo formado por el período 2006 a 2012. La representación anual en el zooplancton varió entre 0,75 y 4,38 % (total 2,51 ± 0,14).
Zoeas de brachiura: la densidad promedio anual osciló entre 0,89 y 7,76 ind/m3 (total 3,59±0,37); entre 20022005 y 2014-2016 se determinaron menores promedios (hasta 1,68 ind/m3) y mayores (hasta 7,76) entre 2006 y 2013 (Tabla 1), tendencia observada en Figura 2F. La prueba de rangos múltiples indica que 2003, 2004, 2005, 2014, 2015 y 2016, forman grupo con menores promedios (hasta 1,68 ind/m3) y otro grupo 2006, 2007, 2008, 2009, 2010, 2011, 2012 y 2013 con promedios mayores (hasta 7,76), en la Figura 2F se muestra la tendencia. La representación anual en el zooplancton varió entre 0,01 y 4,25% (promedio 3,25 ± 0,16).
Mysis de peneidos: la densidad promedio anual varió entre 0,40 y 7,79 ind/m3 (total 3,00 ± 0,23); en 2002-2004 y 2014-2016 se calcularon menores promedios (hasta 1,13 ind/m3) y más altos (hasta 7,79) entre 2005 y 2013 (Tabla 1), la tendencia se observa en Figura 2G. La prueba de rangos múltiples determinó un grupo formado por 2004, 2002, 2003, 2016, 2015 y 2014 con menores promedios; 2005 y 2013 son de quiebre de tendencia y otro grupo el período 2006 a 2012. La representación anual en zooplancton varió entre 0,94 y 4,32% (total 2,75 ± 0,20).
Moluscos (larvas): el promedio anual fluctuó entre 0,11 y 2,36 ind/m3 (total 1,07 ± 0,20); en 2002-2004 y 2014-2016 los promedios fueron menores (hasta 0,27 ind/m3) y mayores (hasta 2,36) entre 2005 y 2013 (Tabla 1) tendencia que se observa en Figura 2H, coherente con prueba de rangos múltiples (transformada log n+1) porque los años 2016, 2002, 2015, 2004, 2014, 2003 y 2004 forman un grupo con promedios menores y otro grupo 2006, 2013, 2012, 2009, 2011, 2008 y 2010. La representación anual en el zooplancton varió entre 0,16 y 1,73% (total 0,84 ± 0,10).
Pterópodos: el promedio anual osciló entre 0,09 y 1,53 ind/m3 (total 0,68 ± 0,20); en años 2003 a 2005 y 2014 a 2016 se calcularon menores promedios (hasta 0,65 ind/ m3) y más altos (hasta 1,53) entre 2006 y 2013 (Tabla 1). En la Figura 2I se muestra la tendencia indicada y acorde con prueba de rangos múltiples que forma un grupo constituido por los años 2003, 2004, 2005, 2014, 2015 y 2016 con menores promedios y otro grupo formado por el periodo 2006 a 2013. La representación anual en el zooplancton varió entre 0,07 y 1,21% (total 0,59 ± 0,10).
Cirripedios: las larvas tuvieron promedio anual entre 0,83 y 24,83 ind/m3 (total 7,83 ± 1,68); en 2004-2005 y 2014-2015 las densidades fueron menores (hasta 1,63 ind/ m3) y mayores (hasta 16,26) entre 2006 y 2013 (Tabla 1), la variación anual se muestra en Figura 2J. La representación anual del zooplancton osciló entre 2,45 y 12,84% (total 5,07 ± 0,62).
Huevos de sardina: el promedio anual varió entre 3,04 y 21,75 huevos/m3 (total 9,39 ± 0,63); en 2004-2005 los promedios fueron menores (hasta 6,25 huevos/m3), aumentan (hasta 12,30) en el período 2006 a 2009 y entre 2010-2016 fluctuaron entre 5,95 y 11,07 huevos/m3 (Tabla 1). En la Figura 3A se observa la variación anual, debe notarse que no tiene la tendencia encontrada en los otros grupos ya mencionados y la prueba de rangos múltiples no indica claramente la formación de grupos de años. La representación anual en el zooplancton fluctuó entre 5,05 y 32,63% (total 15,84 ± 0,79) la cual se muestra en la Figura 3B; los mayores valores se encontraron en 2002, 2003, 2014, 2015 y 2016 y menores durante periodo 2005 a 2012; los años 2004 y 2013 pueden considerarse quiebre de tendencia. La prueba de rangos múltiples verificó lo anterior, en el sentido que el período 2005 a 2013 forma un grupo con menores valores, mientras que otro grupo lo constituyen 2003-2004 y 2014-2016.
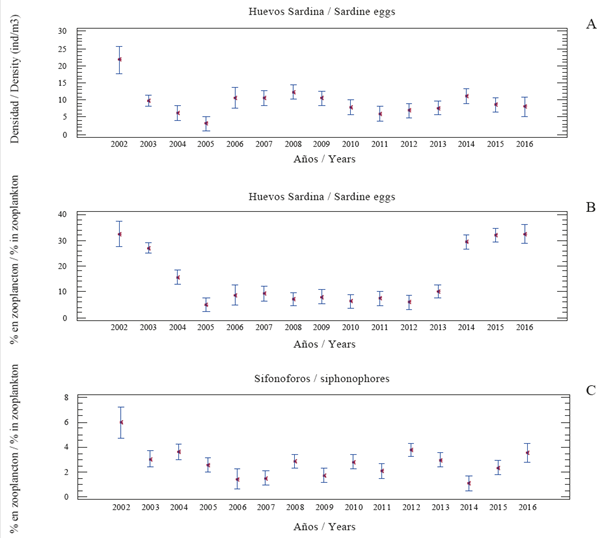
Figura 3 Abundancia anual (ind/m3) de los huevos de sardina (A) y su representación en el zooplancton (B) al este de Isla Margarita, Venezuela (2002-2016). También se muestra la representación (%) de sifonóforos (C). Se observa promedio (punto) e intervalos de confianza (95%).
Zooplancton gelatinoso: lo constituyen las medusas, los sifonóforos, los ctenóforos, urocordados y tunicados pelágicos o cordados invertebrados que incluye a las salpas, doliólidos y pyrosomas (Condon et al., 2012).
Salpas: la densidad anual promedio varió entre 0,44 y 11,76 ind/m3 (total 5,31 ± 0,69); de 2002 a 2005 y 2014 a 2016 se calcularon menores promedios (hasta 1,90 ind/m3) y mayores (hasta 11,76) entre 2006 y 2013 (Tabla 1), la tendencia se muestra en Figura 4A. La prueba de rangos indica grupo formado por 2016, 2015, 2014, 2013, 2005. 2004, 2003 y 2002 con menores promedios y otro grupo por 2012, 2011, 2010, 2009, 2008, 2007 y 2006, con valores mayores. En la representación anual del zooplancton osciló entre 1,43 y 6,42% (3,99 ± 0,29 %).

Figura 4 Abundancia anual (ind/m3) del plancton gelatinoso al este de Isla Margarita, Venezuela (2002-2016). Se observa promedio (punto) e intervalos de confianza (95%).
Apendicularias Oikopleura: el promedio anual fluctuó entre 0,56 y 5.01 ind/m3 (total 2,13 ± 0,18); en años 2002 a 2004 y 2014 a 2016 se calcularon menores promedios (hasta 1,63 ind/m3) y más elevados (hasta 5.01) entre 2006 y 2013 (Tabla 1), la tendencia se muestra en Fig. 4B coherente con prueba de rangos múltiples formando 2003, 2004, 2002, 2015, 2016, 2005 y 2014 un grupo con menores promedios y otro grupo 2006, 2007, 2009, 2010, 20011, 2012, 2013 y 2008 con los mayores. La representación anual en el zooplancton varió entre 1,21 y 4,48 % (total 2,69 ± 0,17).
Medusas: el promedio anual osciló entre 0,07 y 5,09 ind/m3 (total 1,70 ± 0,26); en 2002-2004 y 2014-2016 se calcularon menores promedios (hasta 1,30 ind/m3) y más elevados (hasta 5,09) entre 2005 y 2013 (Tabla 1), tendencia que se observa en Figura 4C conforme con prueba de rangos múltiples formando un grupo 2016, 2015, 2014, 2004, 2003 y 2002 con menores promedios y otro grupo por el periodo 2005 a 2013 con valores mayores. La representación promedio anual en el zooplancton varió entre 0,20 y 3,06% (total 1,28 ± 0,13).
Sifonóforos: el promedio anual varió entre 0,60 y 6,17 ind/m3 (total 2,73 ± 0,24); en 2002-2005 y 2014-2016 se calcularon menores promedios (hasta 5,00 ind/m3) y más elevados (hasta 6,17) entre 2006 y 2013 (Tabla 1), tendencia que se observa en Figura 4D acorde con la prueba de rangos múltiples, porque 2016, 2015, 2014, 2003, 2004 y 2005 forman grupo con menores promedios y otro grupo 2007, 2011, 2013, 2009, 20010, 2012, 2002 y 2008 con valores mayores. En la representación anual del zooplancton el promedio osciló entre 1,10 y 5,95% (total 2,75 ± 0,17).
En otros taxones contabilizados (isópodos, ostrácodos, foraminíferos, equinodermos y poliquetos) no se presenta claramente la tendencia general observada en los 13 grupos antes mencionados y tuvieron muy bajos valores de densidad y representación en el zooplancton (Tabla 1).
DISCUSIÓN
Se consideró apropiado mencionar la densidad total del mesozooplancton; el promedio anual varió entre 30,96 y 223,27 ind/m3 (total 113,73 ± 7,18 ind/m3); debe notarse que en años 2002-2004 y 2014-2016 se encontraron menores promedios (30,96 a 72,90 ind/m3) mientras que fueron más elevados (83,81 a 223,2) en periodo 2006 a 2013 (Tabla 1). En la Figura 5 se muestra la variación anual y la prueba de rangos múltiples indica que 2002, 2003, 2004, 2014, 2015, y 2016 forman un grupo homogéneo; 2005 y 2013 son años de quiebre y el periodo 2006 a 2012 otro grupo con promedios homogéneos, lo que también ocurre en 13 grupos del zooplancton a saber: copépodos, cladóceros (Penilia y Podon), sergestidos Lucifer, zoeas de brachiura, chaetognatos Sagitta, larvas de moluscos, cirripedios, mysis de peneidos, pterópodos y en el plancton gelatinoso (salpas, apendicularias Oikopleura, medusas, sifonóforos).

Figura 5 Abundancia de zooplancton (mg/m3) y captura de sardina (toneladas) en isla Margarita, Venezuela.
En el oriente de Venezuela, los primeros trabajos realizados sobre el zooplancton mencionan la notable abundancia de los copépodos que constituyen hasta el 64,7% (Legaré,1961b), sin embargo en el este de Margarita tienen menor representación y en este trabajo constituyeron 22,71% ratificando estudios previos en los cuales varió entre 22,66% y 33,12% (Gómez y Hernández, 2008; Gómez, 2006); igual situación se presenta con el segundo grupo en importancia, los cladóceros, que representaron el 20,2% pero en el golfo de Cariaco constituyen hasta 35,93% (Legaré, 1961a). Se verifica entonces que en Margarita difiere la composición porcentual de los grupos numéricamente más importantes del zooplancton regional, y se ha planteado que su causa es el consumo que hacen especies como la sardina (Gómez, 2006), en especial durante sus primeros estadios cuando son selectivas y luego cuando se alimenta por filtración (Gómez, 2015). El tercero y cuarto grupo en importancia, fueron el sergéstido Lucifer faxoni y los chaetognatos Sagitta, ambos tienen representación y densidad cercanos a trabajos previos (Hernández y Gómez, 2014; Gómez y Hernández, 2008). En áreas próximas, las Sagitta ocupan el tercer lugar en el zooplancton (Urosa, 1978). Otros grupos cuya representación y abundancia se indican en el presente trabajo (Tabla 1) constituyen menos del 10% del mesozooplancton, pero debe mencionarse que las zoea de brachiura y estados larvales de cirripedios fueron muy abundantes en algunas recolectas, como también citan otros estudios (Zoppi, 1961; Legaré, 1961b; Urosa, 1980; Hernández y Gómez, 2014). De esta manera, en el este de Margarita la composición y abundancia del mesozoplancton tiene diferencias en relación a previos trabajos de menor alcance temporal y citan, que con la excepción de los copépodos, los otros grupos constituyen menos del 10% del zooplancton (Cervigón y Marcano, 1965).
Debe notarse que el dinoflagelado Noctiluca scintillans durante los años 2002 a 2005 tuvo elevada densidad y representación (hasta 37,76 ind/m3 y 12,31%) pero fué muy poco abundante durante el periodo 2006 a 2016 (Tabla 1); esta especie fagotrófica ingiere desde bacterias hasta larvas de peces (Nakamura, 1998) y abunda después de las proliferaciones de diatomeas (De la Cruz et al., 2003; Kiorboe, 1998; Tiselius y Kiorboe, 1998). Por lo cual, su poca abundancia en los años de la crisis sardinera venezolana, puede relacionarse con surgencias débiles en intensidad, a diferencia de décadas previas (1960's) cuando Noctiluca fue muy abundante y característica en el área de surgencia (Margalef, 1965).
El este de Margarita, es la más importante área de desove de la sardina S. aurita, sus huevos fueron contabilizados porque están presentes durante todo el año (Gómez, 2015) y dominan ampliamente, en comparación con los de otras especies o familias que son poco frecuentes y escasos. Los huevos de sardina fueron más abundantes en los años 2002-2004 y 2014-2016 y tuvieron menor densidad durante el periodo 2005 a 2013. La tendencia se observa más claramente en su representación porcentual que fue alta en 2002 y 2003 pero muy inferior durante la crisis sardinera (años 2005 a 2013). En consecuencia, su abundancia y representación no tienen la tendencia observada en los mencionados 13 grupos del mesozooplancton.
También es de notar que desde 2014 aumentó notablemente la representación de los huevos de sardina y en años posteriores ocurrió una relativa recuperación de las capturas de sardina (Figura 5). Lo mencionado es interesante porque los valores altos en la abundancia de huevos conllevan al aumento de las capturas de sardina en el siguiente año, confirmando que la mejor manera de calificar la abundancia de huevos de sardina es por su representación en el plancton, lo que fue planteado previamente (Gómez 2015, 2018) para tener idea del reclutamiento potencial del recurso sardinero y/o estimación indirecta de su abundancia el año siguiente. Los huevos de sardina y los sifonóforos tienen similar tendencia en su representación (%) en el zooplancton (Figuras 3B, 3C), la explicación puede ser de tipo trófico porque los sifonóforos son altamente depredadores de huevos y larvas de pequeños pelágicos (Purcell, 1981; Purcell et al., 2007) así como los quetognatos y eufáusidos (Re, 1987; Krautz et al., 2007; Eloire et al.,2010) que junto con ctenóforos, sifonóforos y medusas forman el zooplancton carnívoro (Hirst et al., 2007).
A partir del 2005, en los muestreos diurnos y nocturnos es mayor la abundancia de zooplancton y fue menor la captura de sardina (Gómez y Hernández, 2008; Hernández y Gómez, 2014), quizás es posible que el zooplancton tuviera menor depredación, a diferencia de los años 2003-2004, cuando la densidad fue menor por el consumo de la sardina que fue muy abundante en el área (Gómez y Hernández, 2008). Entonces, es posible considerar que en el periodo 2005 a 2013 ocurrió un posible cambio de régimen, por la mayor abundancia del zooplancton total y que se verifica también en 13 grupos del mesozooplancton.
El cambio de régimen modifica la estructura trófica del ecosistema, la composición y abundancia de comunidades, pero también causa la variación poblacional de especies ícticas explotadas como respuesta a cambios oceánicos (Polovina 2005) presentándose variaciones en el zooplancton (Blanco et al., 2006; Mackas et al., 2001; Landry et al., 2001). En el Atlántico occidental los cambios de régimen conllevan al aumento en la densidad del zooplancton (Sameoto, 2001) en especial de los copépodos (Kane, 2007) y la sustitución de especies (Pershing et al., 2005); en el mar del Norte, series de tiempo largas (1970 a 2008) indican cambios aproximadamente cada 10 años que afectaron la comunidad planctónica (Alvarez-Fernández et al., 2012), estas fluctuaciones son ocasionadas por la variabilidad ambiental (Rykaczewsky y Checkley, 2008).
El presente estudio también indica que el posible cambio de régimen ocurrió durante alrededor de 10 años, e investigaciones ecológicas previas verificaron modificaciones ambientales marcadas (mayor temperatura, disminución de nutrientes, de la producción primaria y la biomasa del fitoplancton) que afectó la fertilidad acuática (Gómez, 2015, 2016; Gómez y Barceló, 2014; Gómez et al, 2012, 2014, 2016). Lo cual es consecuencia de surgencias poco intensas por el debilitamiento de los vientos Alisios (Pinckney et al., 2015; Taylor et al., 2012) durante los años de la crisis sardinera venezolana. Es conocido que en áreas con surgencia fuerte y relativamente permanente, el fitoplancton es la dieta dominante de las sardinas, pero cuando la surgencia es débil, predomina el zooplancton (Blaxter y Hunter, 1982) y es característico que las poblaciones de peces explotados tengan fluctuaciones de biomasa por la variabilidad ambiental (Rykaczewsky y Checkley, 2008). Además, en California, estudios verifican que las fluctuaciones de la sardina ocurren desde 2000 años antes de comenzar la pesca comercial (Baumgartner et al, 1992).
Durante los años de la fluctuación sardinera venezolana, la mayor abundancia del zooplancton (Figura 5) puede deberse a escasez de peces filtradores como la sardina. Pero también es posible, que la producción planctónica fuera diferente a la de años previos (2003 y 2004) cuando se determinaron temperaturas mínimas de 21.6 °C en superficie (Gómez, 2006) que indican el ascenso de aguas subtropicales y surgencia intensa, como es conocido (Okuda, 1978,1981) y aceptado (Astor et al., 2004, 2003; Gómez, 2006; Gómez et al, 2012, 2008). Las surgencias intensas favorecen al fitoplancton de mayor tamaño, el cual sería el apropiado para la sardina, especialmente para los jóvenes reclutas que cambian su alimentación de selectiva a filtradora (Gómez 2015, 2018). Durante la crisis sardinera, la surgencia fue débil en intensidad, favoreciendo al fitoplancton de talla pequeña, que puede ser inapropiado como alimento para los reclutas y adultos de sardina y en consecuencia casi colapsaron. Además, durante el periodo 2005-2013 fue baja la representación de huevos de sardina en el zooplancton (Tabla 1 y Fig. 3B).
Estudios en el oriente de Venezuela (Estación Cariaco) verifican cambios en la composición del fitoplancton regional, predominando las diatomeas pequeñas (Astor et al, 2013) y se redujo más de cinco veces la abundancia de diatomeas grandes en el microplancton (talla >20 um), lo cual sugiere una reorganización del fitoplancton y es respuesta directa a la disminución en intensidad de la surgencia (Pinckney et al, 2015). Por lo cual, es posible que la abundancia de diatomeas pequeñas tuvieron importancia en la crisis de la sardina, porque quizás el fitoplancton predominante, por su tamaño, no fuera adecuado para la alimentación de juveniles y adultos. Pero fue mayor la densidad del zooplancton, verificando un posible cambio de régimen ecológico.
En surgencias del océano Pacifico, la talla media de las células del fitoplancton cambia con el fenómeno El Niño encontrando menores tallas durante estos eventos (Polovina y Woodworth, 2013). En California, el tamaño del zooplancton tiene relación con la intensidad de la surgencia, demostrando como un mecanismo físico actúa sobre los peces y en escala interanual y/o decadal relaciona cambios ambientales con la producción de sardina (Rykaczewsky y Checkley, 2008). Las células pequeñas tienen ventaja competitiva cuando los nutrientes son escasos (Margalef, 1978; Falkowski y Oliver, 2007) mientras que el exceso de nutrientes favorece al fitoplancton con talla más grande (Moloney y Field, 1991). Así, la variabilidad temporal del plancton pequeño o grande afecta las poblaciones de peces planctófagos (Brosset et al, 2016), como puede ser el caso de la sardina en Venezuela.
Puede considerarse que en el nororiente de Venezuela, desde mediados de 2005 las aguas fueron poco fértiles por la debilidad de los Alisios entre 2006 y 2010, propiciando la disminución de la surgencia y el aumento de la zona fótica (Pinckney et al., 2015). Asimismo, fue importante la acusada disminución de las lluvias durante el 2005, lo que conllevó a una baja descarga del rio Orinoco, la contracción espacial de su pluma y la reducción de su impacto regional; también en 2005 se obtuvieron las más bajas estimaciones (satelitales) de producción primaria en el Caribe oriental (López et al., 2013), coincidentes con la sequía más intensa de los últimos 100 años en la región Amazónica, (temperaturas del aire de 3 a 5 °C más altas de lo normal). Las causas de la excepcional sequía, no se relacionaron con El Niño, fue impulsada por el Atlántico Norte tropical, anormalmente cálido que redujo la intensidad de los alisios del noreste (Marengo et al., 2008). En 2010 la sequía fue más severa que en 2005 (Lewis et al, 2011).
En consecuencia, es posible que los eventos climáticos críticos de 2005 y 2010 también tuvieran marcada influencia en el área de surgencia de Venezuela. Asimismo, en 2007 y 2008 en isla Margarita no fueron perceptibles las aguas del rio Orinoco (Gómez, 2016) y hasta 2012-2013 la fertilidad marina se mantuvo baja en comparación con 2003-2004 (Gómez et al, 2016). En el lapso 2005 a 2014 la variación de las condiciones ambientales causó un cambio de régimen que afectó la abundancia de sardina durante alrededor de 10 años.
CONCLUSIONES
Durante 15 años se determinó la abundancia de 21 grupos del mesozooplancton, en 13 grupos: copépodos, cladóceros (Penilia y Podon), sergestidos Lucifer, zoeas de brachiura, chaetognatos Sagitta, larvas de moluscos, cirripedios, mysis de peneidos, pterópodos y en el plancton gelatinoso (salpas, apendicularias Oikopleura, medusas, sifonóforos) se encontraron mayores valores de densidad y de representación en el periodo 2005 a 2013 mientras que fueron menores en 2002-2004 y 2014-2016.
La variación temporal en la abundancia del mesozooplancton y su composición, sugieren que entre 2005 y 2014 ocurrió un cambio de régimen en el este de la isla Margarita, que afectó al recurso sardinero venezolano.
Los huevos de sardina fueron abundantes en años 2002-2004 y 2014-2016 pero tuvieron menor densidad entre 2005 y 2013. Esta tendencia es más notable en la composición (%) del zooplancton siendo poco representados durante la crisis sardinera (2005 a 2013).











 text in
text in