Introducción
Tinamidae es una familia de aves exclusiva del neotrópico (Hilty y Brown, 1986), con 45 especies reconocidas (Almeida et al., 2022) que se caracterizan por sus hábitos terrestre-caminadoras, de cola y alas cortas, cuerpo redondeado, cuello delgado, cabeza pequeña y coloración críptica; sus huevos por lo general son coloridos y con apariencia de porcelana (Hilty y Brown, 1986); realiza desplazamientos sigilosos, pero son distinguibles por sus vocalizaciones (Brennan, 2004). Presentan diferentes sistemas de apareamiento: poliandria, poliginia, poliginandria y monogamia (Handford y Mares, 1985; Clutton-Brock, 1991), además, el cuidado parental es exclusivo del macho (incuba los huevos y cuida sus polluelos) (Handford y Mares, 1985).
Una de estas especies es el Tinamú negro (Tinamus osgoodi), se encuentra sobre la estribación oriental de la cordillera de los Andes, en Bolivia, Perú, Ecuador y Colombia (Pitman et al., 2002; Negret y Laverde, 2015). Habita en el bosque húmedo del piedemonte, con mezcla de elementos andinos y amazónicos, sotobosque con palmeras y epífitas del bosque primario (Negret et al., 2015). Globalmente, se categoriza como vulnerable (Unión Internacional para la Conservación de la Naturaleza [UICN], 2022) y en peligro (EN) categoría nacional (Renjifo et al., 2014).
Se reconocen dos subespecies, la raza nominal Tinamus osgoodi osgoodi, que se distribuye en Perú y Bolivia (Negret y Laverde, 2015) y fue descrita por Conover (1949) tras la recolección de tres ejemplares en Cuzco-Perú. Posteriormente, Emmet Reid Blake describe la población de Ecuador y Colombia, T. o. hershkovitzi con base en tres individuos recolectados en Huila-Colombia, según la descripción, no presentan dimorfismo sexual (Blake, 1953).
Por muchos años, se consideró esta especie como un ave enigmática debido a su rareza y dificultad para investigarla, no obstante, hay información sobre aspectos reproductivos en Perú para T. o. osgoodi (Traylor, 1952; Collar et al., 1992; Gomes et al., 2014; Cabot et al., 2017) y en Colombia, hay aportes realizados en los departamentos del Cauca (Santa Rosa) y Caquetá (Belén de los Andaquies), estas investigaciones contribuyeron substancialmente al conocimiento de esta población (Negret y Laverde, 2015; Negret et al., 2015; Díaz, 2019). Su presencia en Colombia se reconoce sobre la vertiente oriental de la cordillera oriental, entre los departamentos del Caquetá, Cauca, Putumayo y en la cabecera del Alto río Magdalena, en el departamento del Huila, abarcando una distribución potencial de 20125,5 km2 (Díaz, 2019) y un gradiente altitudinal entre los 800 y 2100 m (Hilty y Brown, 1986; Negret et al., 2015).
Con el antecedente de que es una especie con una distribución aleatoria, críptica, y que poco se conoce sobre su ecología-biología, en esta investigación abordamos la implementación de una metodología no complementaria entre sí, para determinar aspectos reproductivos, vocalizaciones y plumaje con el propósito de fortalecer el conocimiento de su historia natural y aportar información relevante para reconsiderar su tratamiento taxonómico, conservación y manejo en la región de la baja Bota Caucana.
Materiales y métodos
Área de estudio
El piedemonte andino amazónico colombiano comprende la región donde confluyen la cordillera de los Andes con la planicie amazónica y da lugar a la divisoria de aguas de la cuenca amazónica (Hernández-Manrique y Naranjo, 2007). Este estudio se desarrolló en la Serranía de los Churumbelos, aledaño al PNN Serranía de los Churumbelos Auka-Wasi, en la Reserva La Cristalina, corregimiento de Miraflor, municipio de Piamonte, departamento del Cauca (Figura 1).
Los muestreos comprendieron un gradiente altitudinal desde los 500 hasta 1600 m, la cobertura estuvo dominada por bosque denso alto de tierra firme del ecosistema subandino húmedo (Instituto de Hidrología, Meteorología y Estudios Ambientales [Ideam] et al., 2017; Instituto Amazónico de Investigaciones Científicas [Sinchi], 2018), precipitación anual entre los 4000 y 5000 mm, humedad relativa del 85 al 90% y temperatura de 12 a 26 °C (Ideam, 2021). El régimen de precipitación es monomodal, cuyo pico de mayor lluvia se presenta entre abril y junio, y de menores lluvias entre diciembre y febrero (Guzmán et al., 2014). Finalmente, hay notables cambios de las coberturas vegetales por la deforestación, extracción de madera, ganadería y cultivos ilícitos, adicionalmente se evidencia presión por cacería (Ospina, 2009; Sinchi, 2020).
Recolección de datos
Existen diferentes técnicas de muestreo que permiten responder las preguntas de investigación en ornitología, ejemplo de ello son los censos, conteo de puntos, círculos, captura con redes de niebla, marcaje (Ralph et al., 1996; Villareal et al., 2004), no obstante, con base en nuestra experiencia de campo, las dificultades del terreno en cuanto a su accesibilidad y topografía, aunado a la dificultad de la especie para ser documentada, conjugamos una serie de metodologías que se ajustan a lo recomendado por Brennan (2004) para consolidar un conjunto de datos que nos permitió exponer los resultados presentados.
Recorridos
Se realizaron recorridos ad libitum para confirmar la presencia de T. o. hershkovitzi, y de otras especies de la familia, documentar a través de imágenes y recopilar información de su historia natural y vocalizaciones; para esto, se utilizaron binoculares Nikon 10x42, cámara fotográfica (Nikon coolpix p900), grabadora de sonido de celular iphone y grabadora acústica Song Meter Sm4. Los recorridos fueron efectuados entre un gradiente de 500 a 1400 m; sin embargo, no se registraron las distancias recorridas y el tiempo invertido.
De acuerdo con la información consolidada, se infiere sobre los aspectos reproductivos y se realiza descripción de huevos y adultos en condiciones de luz natural y acorde a los colores descritos en Smithe (1975; 1981). Adicionalmente, se obtuvieron fotografías de los ejemplares depositados en el FMNH, IAvH y MHN-UC para tenerlos como referencia o comparación.
Aunado a lo anterior, se describe el plumaje en polluelos con base en la observación y fotografías (Smithe 1975; 1981); y se estima la edad de individuos (polluelo y juvenil), teniendo en cuenta las descripciones de T. tao en Solano-Ugalde et al. (2018).
Arreglos de fototrampeo
Se instalaron dos arreglos de cámaras trampa (Figura 1) siguiendo las recomendaciones propuestas por Díaz-Pulido y Payán-Garrido (2012). El primer arreglo (A1) consistió en un premuestreo de prueba (tres cámaras Bushnell Trophy cam hd, 16 MP). El segundo arreglo (A2) correspondió al muestreo de obtención de información; once cámaras Bushnell Trophy cam hd, 16 MP, y tres cámaras Reconyx hyperfire hc600. El distanciamiento entre sensores fue de 500 m en A1 y entre 5 y 500 m en A2, abarcando un transecto de 2 km lineales (Tabla 1).

Fuente: Claudia Ramírez.
Figura 1 Localización del área de estudio, arreglos de cámaras trampa y puntos de registro.
Tabla 1 Arreglos de cámaras trampa.
| Arreglo | Fecha de muestreo | N° cámaras | Gradiente altitudinal | Esfuerzo de muestreo (trampas*días) |
|---|---|---|---|---|
| A1 | 14/04/2020-01/08/2020 | 3 | 900-1400 | 304 |
| A2 | 15/11/2020-30/03/2021 | 14 | 700-1600 | 905 |
Fuente: autores.
Los puntos de instalación de las cámaras se escogieron de manera oportunista, como se implementó en Mosquera-Muñoz et al. (2014). No obstante, aquí no se usaron cebos. Para la obtención de los registros, las cámaras se configuraron así: activadas a la detección de un movimiento, tres fotografías continuas y un video de entre 15 y 20 segundos, en un intervalo de 3 y 1 segundo, respectivamente, activadas las 24 horas e instaladas a la altura de la rodilla.
Análisis de datos
Vocalizaciones
Para el análisis de las vocalizaciones, se describieron las variables utilizadas por Negret et al. (2015), para su procesamiento y análisis se utilizó Raven Lite versión 2.0.1 gratuita, utilizando la configuración preestablecida.
Fototrampeo
Se calculó el esfuerzo de muestreo con base en Dias et al. (2016) “[número de cámaras trampas*número de días (1 día=24 horas) de muestreo]”, esta operación se realizó individualmente por cada cámara y se sumó la totalidad del esfuerzo. Posteriormente, se procedió a la selección de imágenes y videos con presencia de individuos de la familia Tinamidae, información que se consolidó en Excel para ambos arreglos. Para la identificación de la especie se usó la guía de campo de Hilty y Brown (1986) y Ayerbe-Quiñones (2018), además de fotografías de la especie en la observación ad libitum. Las imágenes y videos de mala calidad o con individuos borrosos, se descartaron.
Se clasificaron los eventos de presencia como independientes de acuerdo con lo propuesto por Dias et al. (2016). Independientes: fotografías/videos consecutivos de T. o. hershkovitzi con más de 60 min. de diferencia. Adicionalmente, al encontrar varios individuos de T. o. hershkovitzi (independientemente de su edad) en un mismo momento, este se consideró como un solo evento independiente (Pérez-Irineo y Santos-Moreno, 2021).
Patrones de actividad
Teniendo en cuenta lo recomendado en Dias et al. (2016), “La tasa a la que las cámaras detectan los animales está determinada por el nivel de actividad de cada especie, por esta razón, la tasa de captura será proporcional a su nivel de actividad” (p. 886), se determinó el patrón de actividad diario con los eventos independientes (Pérez-Irineo y Santos-Moreno, 2021), posteriormente separados en intervalos de una hora, se graficó con el software Oriana 4.02 (Kovach Computing Services, 2013). Para la clasificación de hábitos (crepuscular, diurna o nocturna) se sigue lo planteado en Pérez-Irineo y Santos-Moreno (2021), con adaptación al área geográfica de muestreo, teniendo en cuenta la hora de salida y puesta del sol de acuerdo a información proporcionada por la Aerocivil (AIP, 2021).
Resultados
Recorridos ad libitum
Durante los recorridos realizados entre los años 2020 y 2022, se confirmó, mediante registros visuales y acústicos, la presencia de tres representantes de la familia tinamidae así: T. o. hershkovitzi (12 registros), T. major (1) y Crypturellus soui (1) en el área de estudio y zona cercana. Cabe resaltar, los pobladores reconocen a T. osgoodi como la “gallineta azul” por su distintiva coloración, adicionalmente, es una de las aves más apetecidas por cazadores locales. (Figura 2C).
Hallazgos aspectos reproductivos
El 26 de marzo de 2020, a las 10:00 h, en la zona denominada Plan Tinamú (01°4’47.14”N;76°28’13.12”W, 923 m), un individuo adulto huyó corriendo y vocalizando suavemente, en un radio de 3 m2 se encontró a un polluelo de aproximadamente dos semanas de nacido, permaneció inmóvil en medio de la raíz de un pequeño árbol (Figura 2A), su patrón de plumaje le permitió camuflarse entre las hojas secas y húmedas (Figura 2B).
Hacia las 14:30 h, cerca al lugar del polluelo, observamos a dos individuos adultos caminando juntos, huyeron volando al percibir nuestra presencia. Diez minutos más tarde y durante una llovizna, encontramos un individuo adulto que permaneció inmóvil en el suelo, asumimos que fue el mismo individuo visto en horas de la mañana, posiblemente, llevando a cabo actividades de cuidado parental (Figura 2C).

Fuente: Gerlando Delgado.
Figura 2 Individuos de T. o. hershkovitzi: A. Polluelo escondido en las raíces de un árbol. B. Polluelo en detalle. C, Adulto inmóvil (26 de marzo de 2020).
El 11 de abril de 2020, 9:40 h, en la misma zona (931 m), tras el vuelo abrupto de un individuo adulto, se encontró en el suelo un nido activo a casi 5 m de la quebrada La Golondrina; este, presentaba una estructura simple, más plano que concavo, con arreglo de algunas hojas secas y en medio de las raíces tabulares de un árbol vivo con abundante musgo en su base. El nido tenía algunas plumas coberteras del individuo adulto, así como cuatro huevos de color verde-amarillo (Tabla 2; Figura 3B; Figura 4). Entre la vegetación circundante al nido destacaron: Araceae, Orchidaceae, Gesneriaceae, Melastomataceae, Piperaceae, Heliconiaceae y Cyclanthaceae. El suelo estaba cubierto por material vegetal en descomposición, rocas cercanas y aquellas que sobresalen de la quebrada tenían una capa de vegetación de briofitos.
Tabla 2 Tamaño y color de los huevos de T. osgoodi en las dos poblaciones. Datos para T. o. hershkovitzi. Fuente: Autores. Para T. o. osgoodi.

Fuente: Becker (2015), Traylor (1952).
Después de tres días, al evidenciar el abandono del nido (huevos desprotegidos y fríos), tres de los cuatro huevos se recolectaron, el cuarto estaba roto y posiblemente atrajo a un individuo Nasua nasua que llegó olfateando a un metro del nido. El contenido interno de los huevos evidenció aves formadas en su totalidad, patas y pico distinguibles, cuerpo cubierto de plumones color negro y arcilla (MHN-UC-A 1345).
Finalmente, el 12 de abril de 2022 se encontraron dos huevos a más de 500 m uno del otro, en borde de camino, uno se encontraba roto y sin contenido, el segundo estaba frío, sin fracturas, ni desarrollo embrionario. Los dos hallazgos ocurrieron en la zona denominada Pico Relámpagos, a 1300 m, (1° 5′ 22.85″N 76° 28′ 8.69″W), en bosque primario con abundancia de epifitas y briófitos.
Un reporte adicional a este trabajo proviene de un hallazgo obtenido el 19 de marzo de 2016 por uno de los autores (JPL), un nido localizado entre dos raíces semitubulares, junto a un individuo adulto empollando cuatro huevos puestos sobre algunas hojas secas (ICN 111) (Figura 3A; Figura 4), el nido se encontraba dentro de un bosque maduro, con cobertura de bosque alto denso de tierra firme, con dominancia de especies de estrato subarbóreo y arbustivo y sotobosque denso. Este hallazgo ocurrió en el municipio de Santa Rosa, corregimiento de San Juan de Villalobos, Serranía de la Concepción, río Mandiyaco, 1400 m.

Fuente: autores.
Figura 3 Huevos de T. o. hershkovitzi en el nido: A, Santa Rosa, Cauca (19 de marzo 2016). B, Piamonte, Cauca (11 de abril de 2020).
Descripción del espécimen adulto
El 24 de octubre de 2021, Reserva La Cristalina (1° 04′ 52.5″N 76° 29′ 05.1″W, 1293 m), vereda Nápoles-La Florida, Piamonte (Cauca), dentro del bosque primario, árboles grandes de 20-25 m de altura, ±80% en cobertura del dosel, con abundancia de hojarasca seca en el suelo, destacaron algunas familias de plantas: Cyclanthaceae, Heliconiaceae y Araceae, los árboles carecían de vegetación epifita en sus tallos y ramas. En esta área se recolectó un individuo Tinamus osgoodi hershkovitzi, posteriormente depositado en la Colección de Ornitología del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia (ICN-43706), preparado por JPL y GD. Correspondió a una hembra adulta, osificación 100%, masa corporal de 1,452 g, envergadura 76 cm, culmen expuesto 37,44 mm, culmen total 46,59 mm, ancho de comisura 23,83 mm, longitud de ala 250 mm, longitud de tarso 74,49 mm, longitud de cola 90, 35 mm, gónadas desarrolladas, ovario desarrollado, oviducto liso, ovario 24,55 x 12,01 mm, ovocitos de mayor tamaño 4,24 x 3,81 mm. Respecto a su plumaje y características fenotípicas, encontramos que la cabeza estaba cubierta por un conjunto de plumas diminutas que llegan hasta la parte superior de la nuca y parte inferior de la garganta. El iris era café claro, base de mandíbula negro, punta gris claro, borde basal de maxila negro, el resto era gris claro. El área ocular era desnuda de color grisáceo. Las patas eran gris plata opaco, con podoteca (escamas protuberantes ásperas) en la parte dorsal del tarso, las cuales eran ocre con presencia de impurezas o tierra. Las suelas tenían color ocre, garras del dedo 1 negro, garras de dedos 2, 3 y 4 blancas con ápice negro. Cañones en coberteras internas, sin evidencia de muda en su cuerpo. En el contenido estomacal se hallaron restos de 2 semillas género Virola sp., adicionalmente, restos de exocarpos duros y gastrolitos.
Coloración
Coloración dorsal: area facial azul negro (90), coronilla, frente y auriculares azul índigo (173), la nuca desde la parte alta presenta un gris neutral negruzco (82), el resto hasta la totalidad del dorso y escapulares era gris neutro negruzco (82) con azul índigo (173) brillante en los bordes de las plumas. Las coberteras siguieron el patrón de gris neutro negruzco (82) con azul índigo (173), aquí algunas plumas de las coberteras mayores y medianas presentaron algunos puntos pequeños, casi imperceptibles con pigmentación rufa (140), adicionalmente una de estas plumas coberteras medianas era totalmente blanca (ala derecha vista dorsal, posiblemente leucismo). Las remeras primarias tenían color oliva marrón (28) y tendieron a azul índigo (173) en la mitad distal expuesta a lo largo del raquis. Secundarias y terciarias color gris neutral negruzco (82). La rabadilla siguió el mismo patrón del dorso, gris neutro negruzco (82) con azul índigo (173) en el borde. Las supracaudales presentaron entre oliva marrón (28) y oliva pardusco (29) con azul índigo (173) brillante desgastado en los bordes, en sus extremos marginales también tenían pequeños puntos rufos (140).
Ventral: la barbilla y garganta presentó un escamado gris humo (44) con gris oliva (42) en los bordes de las plumas, cuello y parte alta del pecho color gris neutro negruzco (82) que luego se tornó azul índigo (173) en la parte media y entre gris neutro pálido (86) y gris neutro claro (85) en la parte baja. Las axilas tenían color oliva (30) y los flancos color arcilla (26), el abdomen era gris humo palma (45) con gris humo (44) en los bordes. El vientre era gris neutro pálido (86) con gris humo en los bordes de las plumas, las cuales hacia la parte baja del vientre tomaron el color gris humo palma (45). El plumaje desde la cloaca hacia las infracaudales presentaron coloración rufa (140) con manchas negras irregulares.
Las alas en vista ventral eran gris neutro pálido (86) en las coberteras menores y gris neutro claro (85) en las coberteras medianas. Las remeras primarias y terciarias gris neutro pálido (86) y las secundarias gris neutro claro (85).
Descripción del plumaje de un polluelo
Un individuo pequeño en plumones (Figura 2B), el pico tenía similitud al color marrón marte (223A), más pálido en la base. Con un parche de color marrón marte (223A) con forma rectangular en dirección anterior-posterior en la corona, el cual estaba delineado por un borde delgado azul cianina (74). La frente y parte supraocular amarillo azufre (57) en forma de banda que va hasta la parte posterior de la cabeza, con un anillo ocular muy evidente azul esmaltado (70), línea post-ocular azul índigo (173) que se expande a lo ancho gradualmente, pasando por los oídos hasta la parte posterior de la cabeza. Mejillas y cuello tenían color amarillo azufré (57) con una leve línea cuerno pálido (92) sobre los costados del mentón.
Cuerpo y alas en su mayoría azul oscuro a café castaño. El color del dorso tenía una mezcla de negro azulado (90) con canela molida (239), gradualmente se transformaba en canela molida (239) hacia parte posterior o rabadilla. Dos líneas paralelas beige (124) se presentaron en los costados del dorso, las cuales marcaron el límite a una coloración castaño (32) hacia los flancos. Plumaje de los hombros azul índigo (173) y remeras color campánula (71) con leves líneas blancas en la terminación de algunas plumas.
El individuo juvenil (aprox. dos meses de edad), captado a los 21 días de julio, tenía tamaño mediano en comparación con el adulto, presentaba líneas faciales oscuras que bajaban por el cuello, el plumaje del dorso era oscuro uniforme.
Vocalizaciones
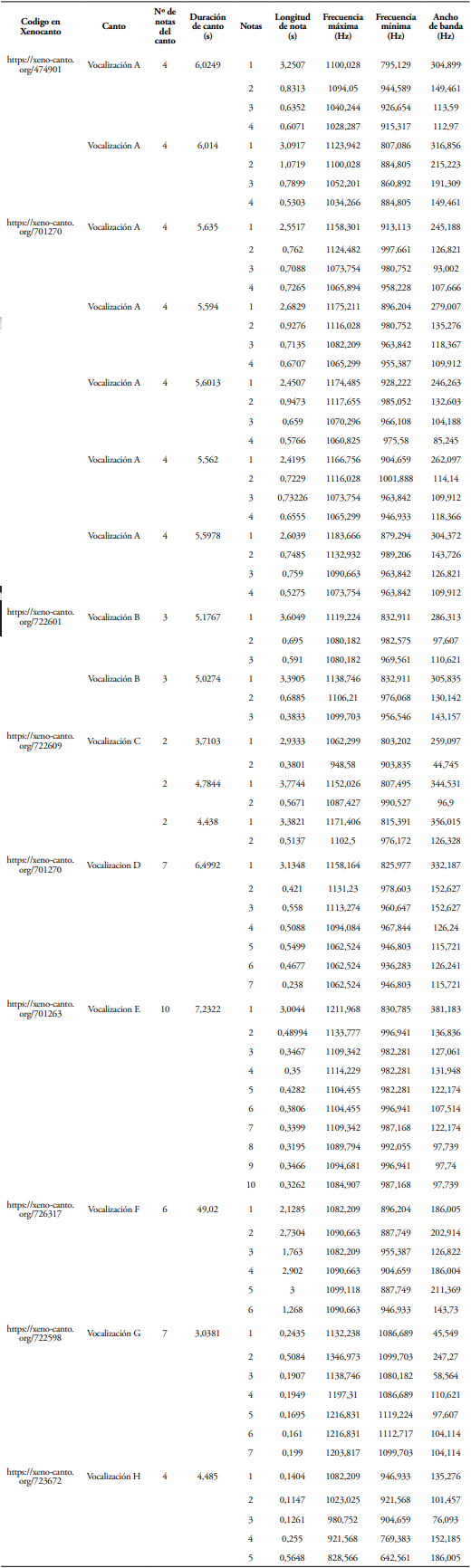
Durante los recorridos ad libitum se realizaron nueve grabaciones de audio que representaron 17 vocalizaciones agrupadas en tres patrones (Tabla 3, Figura 5). Todas se obtuvieron en el día, entre los 700 y 1300 m, no obstante, la gallineta azul también ha sido escuchada en horas de la noche (1:00 y 3:00) y registrada hasta los 600 m, de altitud, en cercanías al área de estudio (Ruta, Mirador de las Tangaras).
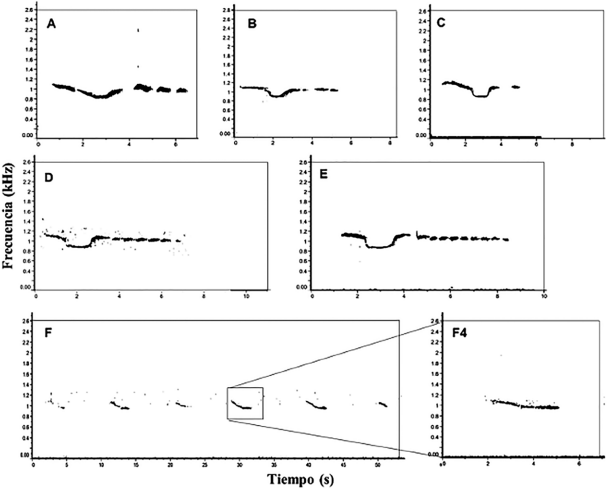
Patrón I: Nota inicial con apariencia de “V” abierta, tuvieron la mayor duración (2,41 a 3,25 s) y variación en frecuencia (795,129 a 1183,666 Hz). Le continuaron una serie de 2 a 3 notas cortas y homogéneas. Estas vocalizaciones duraron entre 5 y 6 s, con distanciamiento entre las mismas de 1 y 2,26 min. Figura (5A, 5B).
Patrón II: Nota inicial con apariencia de “U” cuadrada (Figura 5C, 5D, 5E), tuvieron la mayor duración (2,93 a 3,77 s) y variación en frecuencia, entre 803,202 y 1211,968 Hz. Le continuaron una serie de 1, 7 y 10 notas cortas y homogéneas. Estas vocalizaciones duraron entre 3,7 y 7,2 s, y solo en el patrón con dos notas se observó un distanciamiento entre vocalizaciones de 3,83 min.
Patrón III: es el más diferente y el menos usual, tuvo una duración de 49,02 s, y consistió en una serie de 6 notas descendientes muy similares/uniformes en frecuencia (887,749 a 1099,118 Hz) y tiempo (1,7 a 3 s), separadas por 6,7 s en promedio (Figura 5F, 5F4).
Fuente: autores.
Figura 5 Espectrograma de vocalizaciones de T. o. hershkovitzi captadas en el área de estudio: A y B, Patrón de Vocalización I “V”. C, D y E, Patrón de vocalización II “U”. F, Patrón de vocalización III.
Finalmente, también se captó la vocalización de un individuo adulto huyendo, este pronunció siete notas casi homogéneas en 3 s, la frecuencia alcanzada aquí fue la superior al de todas las vocalizaciones recogidas (1216,831 Hz). Así mismo, se registró en cámara trampa la vocalización de un individuo presumiblemente hembra en precópula, donde se evidenció la menor frecuencia de las vocalizaciones recogidas (642,561 Hz), 3 notas iniciales cortas y dos últimas tendieron a la forma “V” levemente marcada (Tabla 3).
Fototrampeo
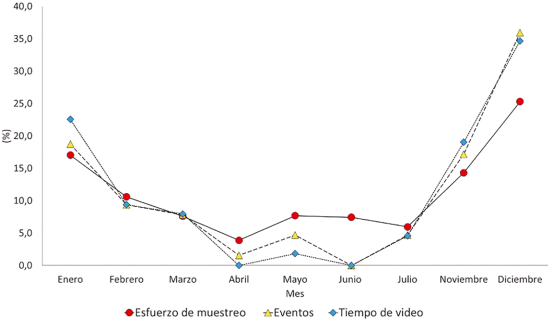
Se obtuvieron un total de 5704 archivos de fototrampeo, de estos, 52 videos y 125 fotografías que representaron 64 eventos independientes para la gallineta azul. El esfuerzo de muestreo fue de 1209 cámaras/día en los dos arreglos, con el mayor esfuerzo entre diciembre, enero y noviembre (Tabla 1; Figura 6).
En cuanto a los eventos independientes, ocurrieron en su mayoría en diciembre, enero y noviembre. A partir de febrero hasta julio la cantidad de eventos disminuyó y varió. También se registró un total de 767 s, de vídeo, siguieron un patrón similar a los eventos (Figura 6).
Eventos respecto a la elevación y esfuerzo de muestreo
La mayor cantidad de eventos se registró entre 960 y 1020 m, alcanzando el 75% de los eventos en el 40% del esfuerzo de muestreo. Le siguió 1350, m, donde el 41,4% del esfuerzo representó el 15,6% de los eventos. La elevación más baja (750 m) aportó 3,1% de los eventos y la más alta (1600 m) sin ningún evento registrado (Figura 7).
Patrón de actividad diario
Se encontró que la gallineta azul está activa durante 12 horas del día. Empieza la actividad después de las 6:00 horas y aumenta hasta las 8:00, lo que representa el primer pico de actividad en el día. Entre las siguientes tres horas (9:00, 10:00 y 11:00), la actividad es variable y disminuye hasta el punto más bajo, obtenido a las 12:00 horas. Posteriormente, entre las 13:00 y 14:00 horas, la actividad aumenta y continúa creciendo hasta alcanzar el mayor pico diario entre las 15:00 y 16:00 horas, este rango de dos horas representó el 34% de toda la actividad. Finalmente, se obtienen los últimos registros de actividad después de las 17:00 horas (Figura 8).
Descripción cortejo/precópula
Con base en las observaciones obtenidas (21 enero), se evidenció un evento de cortejo/precópula, descrito así: el individuo 1 (macho), se encontraba frente a la cámara con una posición “caminando buscando”, detrás de él estaba el individuo 2 (hembra), con el cuello totalmente erguido al frente, cola levantada y desplegada en forma de abanico. La hembra corrió manteniendo la posición hacia donde estaba el macho, este reaccionó alejándose lentamente.
Posteriormente, la hembra quedó al frente e hizo dos movimientos repetidos que consistieron en bajar el pecho y cabeza, al tiempo que alzaba la parte trasera, nuevamente levantándose y volviendo a bajar, manteniendo las alas levemente abiertas. Cuando la hembra hizo este primer movimiento de inclinarse hacia abajo emitió tres llamadas muy suaves, el macho corrió aleteando y se quedó observando a una distancia de 2 o 3 m aproximadamente. La hembra volvió a inclinarse hacia abajo y emitió nuevamente dos llamadas más suaves y prolongadas. Mientras esto ocurría, el macho espectador alzó completamente su cola y se ubicó de perfil a la hembra.
Discusión
El conjunto de los registros obtenidos ad libitum y fototrampeo recolecta información importante asociada a la historia natural de la gallineta azul, lo que conlleva a realizar las siguientes consideraciones.
En el aspecto reproductivo, en T. o. hershkovitzi, se ha inferido que el apareamiento ocurre entre febrero y mayo, posterior la incubación (Negret y Laverde, 2015), también se reportan polluelos (edad incierta) entre abril y julio (Díaz, 2019), ello coincide parcialmente con los hallazgos aquí presentados, que obtuvieron eventos de conductas asociadas a cópula similares a las descritas en T. major y T. tao (Sánchez, 2008; Solano-Ugalde et al., 2018). La evidencia sugiere que la gallineta azul inicia los primeros acercamientos para el apareamiento en diciembre y continúan en simultáneo con la incubación y eclosión entre febrero y mayo, considerando que la incubación en T. major y T. tao dura entre 16 y 18 días (Fournier et al., 2007; Solano-Ugalde et al., 2018) y crianza de polluelos desde marzo hasta agosto, teniendo en cuenta esta fase en T. tao (Fournier et al., 2007). Presumiblemente, la reproducción en T. o. hershkovitzi coincide con la época seca o de menor lluvia en el piedemonte (Guzmán et al., 2014), donde las condiciones de clima pueden ser las más aptas para la reproducción de la especie, pues se conoce que las lluvias afectan el lugar y el tiempo en la reproducción de las aves, además de su rendimiento reproductivo (Sharp et al., 2021). También, sobre este periodo acontece la fructificación de nueces género Virola, las cuales se encontraron en el buche del espécimen adulto. Virola elongata, Virola cf. flexuosa, fructifican entre agosto y abril (López y Montero, 2005), esto representa oferta de alimento en la mayor parte de la temporada reproductiva. Se conoce que en Tinamus tao los individuos encargados de la incubación pasan la mayor parte de su tiempo en el nido (Solano-Ugalde et al., 2018), lo que supone mayor consumo de alimentos para este período.
Por otro lado, no hay descripción previa de nidos para T. osgoodi; sin embargo, como en los demás tinamus, son de estructura simple (Fierro-Calderón et al., 2021) y un tanto diferentes a los descritos en T. tao y T. major, los cuales consisten en una depresión en la hojarasca acumulada o en el suelo con acomodación de hojarasca (Hilty y Brown, 1986; Solano-Ugalde et al., 2018), también se asemejan en su ubicación, a T. major, nidos localizados en la protección de árboles grandes (Hilty y Brown, 1986). Sobre estas nidadas, se ha encontrado hasta 7 y 9 huevos en T. major y T. tao respectivamente (Hilty y Brown, 1986). Para T. osgoodi solo se ha reportado una nidada de dos huevos en la población de Perú (Traylor, 1952; Becker, 2015), frente a los 4 por nidada de T. o. hershkovitzi descritos aquí. Además, el tamaño/forma y color de los huevos son notablemente diferentes en las dos poblaciones (Traylor, 1952; Becker, 2015). Particularmente, el tamaño, en T. o. hershkovitzi la diferencia promedio entre largo “menos” ancho fue 2,6 veces mayor al promedio en T. o. osgoodi. Estas variables “largo y ancho” permiten hacer diferenciación entre especies de un mismo género en tinamidae (Albarce et al., 1990). Así mismo, la coloración de los huevos en esta familia permite reconocer entre especies, se conoce que el color tiende a ser diferente en especies estrechamente relacionadas y con probabilidad de co-ocurrencia (Li y Wang, 2020), al parecer, por la “señalización de apareamiento” (Kilner, 2006); los huevos hallados fuera de nidos son un posible ejemplo de esta conducta, ayuda al reconocimiento intraespecífico y heteroespecífico, reduce el esfuerzo para encontrar pareja y evita la hibridación con especies simpátricas (Li y Wang, 2020). Lo anterior sugiere que las dos poblaciones, T. o. osgoodi, T. o. hershkovitzi son probablemente unidades taxonómicas diferentes, ello también lo sustenta el patrón de coloración de su plumaje, según Conover (1949), T. o. osgoodi, es de aspecto general negro pizarra, destacan en las coberteras superiores de la cola barras anchas marrón oscuro y vermiculaciones en coberteras superiores del ala. Ventralmente, área cloacal y flancos en su parte inferior, oscuros y ocráceo con motas y vermiculado, coberteras de la cola leonado ocráceo vermiculadas y barradas con oscuro (Conover, 1949). Mientras que en T. o. hershkovitzi el plumaje dorsal está dominado por gris neutro negruzco con azul índigo que se dispone brillante en el ápice de las plumas, y en particular, las motas, vermiculaciones y barras no hacen parte de su patrón de plumaje. Con menor detalle, estas diferencias fueron señaladas (Blake, 1953; Negret y Laverde, 2015), no obstante, la tonalidad azul ha pasado desapercibida.
Respecto a las vocalizaciones, lo hallado aquí presenta el patrón de la nota inicial “V”y “U” descrita en Negret y Laverde (2015), con variación en el número de las siguientes notas. También, una vocalización aquí tiene similitud (frecuencia y duración) con una de las vocalizaciones descritas para la población de Perú en Negret y Laverde (2015). Estos mismos autores señalan diferencias en las dos poblaciones, donde T. o. hershkovitzi presenta vocalizaciones más largas, con notas más cortas y en mayor número que T. o. osgoodi, adicionalmente, mencionan que la frecuencia máxima es mayor en T. o. hershkovitzi. No obstante, pese a las diferencias mencionadas, las vocalizaciones recolectadas en este estudio y las que ya están descritas indican mayor variación en la vocalización de T. o. hershkovitzi, y abarcan las formas descritas para las dos subespecies en Negret y Laverde (2015), por lo tanto, es necesario para fines comparativos entre ambas poblaciones realizar más análisis de vocalizaciones siempre y cuando se tenga una muestra representativa de la acústica de ambas poblaciones.
Respecto al fototrampeo, pese a que el esfuerzo de muestreo no fue uniforme durante el periodo activo de las cámaras, es probable identificar una tendencia de los eventos independientes respecto a los meses muestreados. Mayor actividad/movimiento de la gallineta azul en temporada seca y reproductiva y menor actividad/movimiento en temporada de lluvias donde hay crianza de polluelos y juveniles, en esta temporada de lluvias torrenciales se presume la pérdida de polluelos (Solano-Ugalde et al., 2018), por lo tanto, es posible que el comportamiento de cuidado parental, más la lluvia, limite el desplazamiento en adultos, ello coincide con que en ningún video se observa al tinamú caminando durante la lluvia. Por otro lado, en Díaz (2019), la mayor cantidad de registros se realizó entre mayo y julio, posterior en octubre, a través de fototrampeo y rotación de cámaras sobre tres sectores por tiempos determinados, es probable que la diferencia con los resultados aquí expuestos, sea por el desplazamiento de las cámaras a un sector donde el tinamú es menos común o abundante (ej. mayor altitud).
Los eventos independientes mostraron mayor concentración sobre el rango de 900 a 1000 m, por ende, puede indicar que las condiciones de hábitat en esta región geográfica pueden ser las más favorables para su supervivencia, esto coincide con lo encontrado en Díaz (2019), donde la ocupación disminuye a mayor elevación dentro de un rango de estudio de 1100 a 2800 m. De otra manera, Negret et al. (2015) reportan que la especie es más frecuente entre los 1400 y 1500 m, sin embargo, su metodología no tiene en cuenta un esfuerzo de muestreo uniforme en el gradiente de distribución.
Los resultados también amplían el rango de distribución altitudinal de T. o. hershkovitzi, pues no se conocían registros por debajo de ≈700 m (Negret y Laverde, 2015; Negret et al., 2015). Se asume que su desconocimiento en elevaciones bajas se debe a la pérdida y perturbación del hábitat en la mayor parte del piedemonte (Sinchi, 2020), a pesar de ello, algunas áreas de Piamonte, Cauca, aún conservan bosques en buen estado de conservación en un gradiente de 400 a 1600 m.
Las cámaras trampa también permitieron ilustrar el patrón de actividad de la gallineta azul, el 100% de actividad T. o. hershkovitzi se encuentra en el rango de salida y puesta de sol, 6 y 18 horas para el área de estudio (AIP, 2021), por ende se considera una especie totalmente diurna; sin embargo, también presenta actividad vocal en la noche, este comportamiento ya ha sido estudiado en Crypturellus undulatus y lo encuentra relacionado con la fase lunar (noches con luz), temperatura y atracción de parejas (Pérez-Granados y Schuchmann, 2021). No obstante, no hay mayor información para su análisis en T. o. hershkovitzi.
El patrón de actividad también demostró consistencia con lo hallado por Díaz (2019) un pico de actividad en la mañana y otro en la tarde, no obstante, los resultados aquí indican la mayor actividad en la tarde, y difiere totalmente con los resultados encontrados en Negret et al. (2015), registran un solo pico con la mayor actividad entre las 11 y 13 horas. Es probable que esta diferencia sea producto del menor esfuerzo de muestreo realizado, tres cámaras y 22 eventos, de los cuales no se define la independencia de los eventos.
Las amenazas para la gallineta azul persisten en la región, además de la cacería se pudo observar el avance de la frontera ganadera y agrícola, especialmente para cultivos ilícitos (Sinchi, 2020). Como medida de mitigación, es muy importante la difusión del conocimiento sobre biodiversidad que ha venido desarrollando la Asociación Salvemos Selva en el municipio, así como iniciativas locales de conservación como Piamonte Biodiverso, Reserva La Cristalina, Finca Mirasol, Brisas de Pamplonita, Kataleya, entre otras. Este estudio se convierte en una herramienta tanto local como regional para promover el conocimiento y conservación de la especie. También se destaca que estos aportes ayudan a entender aspectos de su ecología y biología reproductiva, lo que puede facilitar un mayor enfoque en futuras investigaciones para la especie (Tosa et al., 2021).
Conclusiones
De acuerdo al fototrampeo, se evidencio que Tinamus osgoodi hershkovitzi se encuentra mayormente activo en horas de la tarde e inactivo sobre el medio día; en conjunto con hallazgos de recorridos ad libitum permitió inferir época reproductiva, que se extiende desde diciembre hasta mayo, con incubación y eclosión a partir de febrero y crianza hasta agosto; los dos nidos informados sugieren camadas de 4 huevos de color verde-amarillo; estos huevos son notablemente diferentes en cuanto a tamaño/forma y color de los descritos en la población de Perú, así mismo ocurrió con el patrón de coloración en adultos, su plumaje está dominado por tonos gris y azul, por ello en la localidad de investigación se le conoce como “gallineta azul”, diferente a lo descrito en Tinamus osgoodi osgoodi “Tinamu negro”.
Los registros de audio indicaron tres patrones de vocalización, uno de ellos similar a la vocalización descrita de Tinamus osgoodi osgoodi.
Adicionalmente, con la combinación de métodos en campo como el fototrampeorecorridos ad libitum (observaciones, grabaciones, detecciones visuales) y la recolección de un ejemplar adulto en la región del piedemonte andino amazónico de Colombia, consolidó una fuente de información invaluable para generar datos recientes que aportan en los diferentes aspectos de la historia natural de esta especie. Esta contribución permite inferir en el entendimiento de la ecología y biología reproductiva, así como su tratamiento taxonómico y conservación.
Finalmente, las novedades obtenidas en la descripción del ejemplar, junto con los hallazgos reproductivos (nido, huevos y polluelos) que difieren en cuanto a la forma, tamaño y color, patrón de plumaje, sugerimos que T. o. hershkovitzi y T. o. osgoodi deben ser tratadas como unidades taxonómicas diferentes, no obstante, es importante incluir estudios genéticos y nicho ecológico para validar esta hipótesis, para poder esclarecer su validez filogenética.