Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.14 no.1 Bogotá Jan./June 2012
ARTÍCULO CORTO
Estandarización de marcadores moleculares microsatélites para su uso en la industria forestal de Misiones, Argentina
Standarization of microsatellite molecular markers for Misiones (Argentina) forest industry
Verónica Graciela Teza1, María Isabel Fonseca2, Leonardo Horacio Walantus1, Paula Davalos3, Alejandro Alberto Toro4, Ariel Ernesto Cariaga-Martinez5, Laura Lidia Villalba6, Pedro Darío Zapata7.
1 Mgter. Biotecnología Vegetal. Laboratorio de Biotecnología Molecular. FCEQyN. UNaM.
2 Lic. en Genética. Laboratorio de Biotecnología Molecular. FCEQyN. UNaM.
3 Alumno en formación. Laboratorio de Biotecnología Molecular. FCEQyN. UNaM.
4 Doctor. Lic. en Genética. Laboratorio de Biotecnología Molecular. FCEQyN. UNaM.
5 Bioquímico. Laboratorio de Biotecnología Molecular. FCEQyN. UNaM.
6 Ph.D. Ingeniero Químico. Laboratorio de Biotecnología Molecular. FCEQyN. UNaM.
7Doctor. Bioquímico. Laboratorio de Biotecnología Molecular. Facultad de Ciencias Exactas Químicas y Naturales, Universidad Nacional de Misiones. Av. Mariano Moreno 1375 (3300) Posadas, Misiones. pdr_dario@yahoo.com
Recibido: octubre 11 de 2010 Aprobado: junio 19 de 2012
Resumen
Provincia de Misiones posee actualmente una actividad forestal en pujante crecimiento ubicándose entre las primeras del país. Este marco de desarrollo productivo permite predecir un ámbito de crecimiento favorecido por las nuevas condiciones del mercado internacional. Por otro lado a pesar del avance de la tecnología industrial, no se ha alcanzado el nivel de desarrollo biotecnológico óptimo que conjugue la calidad genética con características fenotípicas de excelencia en las especies maderables de mayor demanda en la Provincia basándose la selección en criterios netamente fenotípicos y en la experiencia del productor, sin contarse con métodos moleculares desarrollados en la región. Este trabajo presenta los resultados del Proyecto Federal de Innovación Productiva (PFIP Mi09) cuyo objetivo principal fue estandarizar y transferir al sector productivo un conjunto de marcadores moleculares microsatélites para ser aplicado al análisis de poblaciones y forestaciones de Araucaria angustifolia y Pinus taeda provenientes de la Provincia de Misiones (Argentina). Esto permitirá conocer el perfil genético de plantaciones y poblaciones de estas especies forestales, pudiendo aplicarse a la certificación de calidad en la producción forestal o a la selección de ejemplares de especies nativas.
Palabras clave: biotecnología, forestaciones, Araucaria angustifolia, Pinus taeda, microsatélites.
Abstract
Misiones Province currently has the first intensive forestry activity of Argentine. This framework of productive development allows predict an area of growth favored by the new conditions of the international market. On the other side despite the progress of industrial technology, has not been reached the optimal level of biotechnological development that combining quality with genomic and phenotypic characteristics of forest species. This work presents the results of Federal Project of Productive Innovation (PFIP Mi09) whose main objective was standardize and transfer to the productive sector a set of microsatellites molecular markers to be applied to the populations analysis of Araucaria angustifolia and Pinus taeda forestation from the Misiones (Argentine). This will reveal the plantations and forest genetic profile and may be applied to genetic certification of forest production quality.
Key words: technology, forestry, Araucaria angustifolia, Pinus taeda, microsatellite.
Introducción
La forestoindustria representa uno de los pilares económicos de la Provincia de Misiones (Argentina), contándose actualmente con 330.000 ha de plantaciones forestales, en su mayoría pino, araucaria y eucalipto (SAGPyA, 2001). Sin embargo, aún no se ha alcanzado el nivel de desarrollo biotecnológico que permita conjugar la calidad genética con características fenotípicas de excelencia en las especies maderables de la Provincia. En este sentido, los marcadores moleculares polimórficos informan sobre la variabilidad de la población en estudio pudiendo analizarse su posible asociación con rasgos fenotípicos deseables que favorezcan su uso forestal. Los recursos forestales que se producen en nuestra región poseen múltiples utilidades, las cuales están en parte condicionadas a las características fisicoquímicas y biológicas particulares de cada especie forestal. Entre éstas podemos incluir las características de la madera (como color, dureza, contenido relativo de los componentes de la pared celular), la tasa de crecimiento y los requerimientos de suelo y clima. Todas estas condiciones particulares dependen tanto de características genéticas propias de cada especie como de las condiciones ambientales a las que se encuentra expuesto el individuo (López, 2005). Si bien algunas de las propiedades fisicoquímicas de las especies forestales más utilizadas están bien establecidas, aún no están identificadas las características genómicas relacionadas con estas propiedades. La carga genética, solo define parte de los parámetros que influyen en las características particulares de cada especie y/o variante forestal, quedando la otra bajo la influencia ambiental. Pero sin duda el componente genético aporta una parte determinante sobre la que se puede trabajar, iniciando programas de mejoramiento que permitan seleccionar individuos y poblaciones con características distintivas favorecidas para el desarrollo forestal elite. (Vargas Hernández et al., 2005) El uso de este recurso forestal está condicionado al establecimiento y mantenimiento de bancos de germoplasma que permitan conservar la biodiversidad de las especies más promisorias, siendo aconsejable el uso de marcadores como banco genético para su caracterización y vigilancia (Jain and Minocha, 2000).
La zona noreste del país destaca por su capacidad forestal. La provincia de Misiones y el norte de la provincia de Corrientes poseen excelentes capacidades geográficas para esta actividad siendo muy alto su rendimiento. Esto trajo aparejado la radicación de empresas que sustentaban su crecimiento en la reforestación con especies coníferas de rápido crecimiento y buenas cualidades industriales, como Pinus taeda y Araucaria angustifolia (nativa), entre otras. El sector como tal se encuentra en un período de franco crecimiento, lo que significa tanto la expansión territorial, como el aumento del número de empresas participantes, y el incremento del valor del producto generado. (Mac Donagh et al., 2009) La expansión de esta actividad está amparada por la política de incentivos a la forestación y a la forestoindustria, mediante la Ley 25.080 de Inversiones para Bosques Cultivados y la estabilidad fiscal de 30 y hasta 50 años para los proyectos forestoindustriales y beneficios impositivos de la jurisdicción nacional, provincial y municipal, ha garantizado la inversión y el crecimiento del sector. Esto promueve priorizar la relación del sector forestal, en constante crecimiento y expansión, con instituciones de I+D que favorezcan la incorporación de nuevas tecnologías en busca de mayores rendimientos sin ir en detrimento de la riqueza y biodiversidad de la región.
Los marcadores moleculares son secuencias genómicas que pueden ser seguidos a través de la progenie de una especie. Algunos de ellos pueden ser ubicados referenciando posiciones definidas dentro del genoma y son los más útiles para certificación y caracterización de especies, así como para la selección y monitoreo de los programas de mejoramiento genético (Ferreira y Grattapaglia, 1998). Para pino y otras coníferas actualmente se desarrolla el Proyecto Genoma de Coníferas a cargo de un consorcio internacional y provee de datos de gran relevancia a todo el mundo de manera libre y gratuita, siendo necesario el desarrollo de programas de transferencia tecnológica que permitan la inserción de esta tecnología en la región. Este trabajo presenta los resultados del Proyecto Federal de Innovación Productiva (PFIP Mi09) cuyo objetivo principal fue estandarizar un conjunto de marcadores moleculares microsatélites para ser aplicado al análisis de poblaciones y forestaciones de Araucaria angustifolia y Pinus taeda provenientes de la Provincia de Misiones (Argentina). Esto permitirá relacionar el perfil genético con determinadas características fenotípicas, pudiendo aplicarse a la certificación de calidad en la producción forestal o a la selección de ejemplares de especies nativas.
Materiales y métodos
Material vegetal
Se utilizaron hojas jóvenes y saludables recogidas y conservadas en bolsas de nylon herméticas en freezer a -20°C hasta el momento de su procesamiento.
Para Pinus taeda se muestrearon individuos provenientes de forestaciones ubicadas en los departamentos de Eldorado y Capital de la Provincia de Misiones, Argentina.
Para Araucaria angustifolia se muestrearon individuos provenientes de la reserva forestal Parque Provincial de la Araucaria, localizada en el Departamento de San Pedro, y de la Reserva Forestal de Cruce Caballero Provincia de Misiones, República Argentina.
Extracción de DNA
Aproximadamente 600 mg de hojas fueron molidas en nitrógeno líquido junto con la adición de 0,01 g de polivinilpirrolidona. Al macerado se le adicionó tampón de extracción (2% CTAB p/v; Tris HCl 100 mM pH 8,0; EDTA 50 mM; NaCl 500 mM; 1% Β-mercaptoetanol; proteinasa K 0,1 mg/ml) previamente calentado a 65°C. La digestión prosiguió a 65°C por 1 h, homogeneizando regularmente la mezcla.
Las muestras fueron centrifugadas y al sobrenadante fue recuperado se le realizó una extracción con igual volumen de cloroformo: alcohol isoamílico (24:1). Las proteínas fueron eliminadas por precipitación con acetato de potasio 3 M. El DNA se recuperó por precipitación con etanol 100%, fue lavado con etanol 70%, resuspendido en agua libre de RNasas-DNasas y nuevamente precipitado con etanol 100% y acetato de sodio 3 M. El DNA recuperado, nuevamente fue lavado con etanol 70%, secado y resuspendido en agua libre de RNasas-DNasas y almacenado a -20ºC hasta ser utilizado.
Purificación del DNA
La purificación del DNA fue realizada para disminuir al mínimo la presencia de posibles interferentes que dificulten la amplificación del mismo por PCR. El DNA obtenido fue purificado mediante resinas de sílice comerciales (Fermentas, K1533®).
La cantidad y calidad del DNA obtenido fueron analizadas mediante absorbancia UV y electroforesis en 1% de agarosa. La pureza se valoró mediante la realción DO260/DO280.
Amplificación de STR para Pinus taeda
Fueron utilizados cebadores de la base de datos de secuencias GenBank, teniendo en consideración las secuencias disponibles para regiones microsatélites descriptos por Echt et al., 1997, y Elsik et al., 2000, para Pinus taeda. Los números de acceso de las secuencias fueron: BV683040, BV683146, BV683043, BV683044, BV683047, BV683052, BV683053, AF143959, AF143975 (tabla 1).
La reacción se llevó a cabo con 10 pmoles de cada cebador, 200 µM de cada dNTP, 2 mM de MgCl2, 0,5 U de Taq DNA polimerasa y 20 ng de DNA. Reacciones sin DNA fueron usadas como control negativo. El ciclado utilizado fue de tipo Touch Down: 94°C por 2 min, seguidos de 35 ciclos de 94°C por 15 s, Th por 15 s y 72°C por 15 s, con una extensión final a 72°C por 3 min. Durante los 20 primeros ciclos la temperatura de hibridación decreció 2ºC cada 2 ciclos, iniciando con 60°C y posteriormente 15 ciclos con una temperatura de hibridación de 50ºC.
Amplificación de STR para Araucaria angustifolia
Fueron utilizados cebadores de la base de datos de secuencias GenBank, teniendo en consideración las secuencias disponibles para regiones microsatélites descriptos por Salgueiro et al., 2005, para A. angustifolia. Los números de acceso de las secuencias fueron: AJ749964, AJ749965, AJ749966, AJ749967, AJ749968, AJ749969 (tabla 2).
La reacción se llevó a cabo con 10 pmoles de cada cebador, 200 µM de cada dNTP, 3 mM de MgCl2 y 0,5 U de Taq DNA polimerasa. Reacciones sin DNA fueron usadas como control negativo. El ciclado utilizado fue: 94°C por 4 min, seguidos de 35 ciclos de 94°C por 20 s, 20 s a la temperatura de hibridación de cada STR y 72°C por 20 s, con una extensión final a 72°C por 4 min.
Análisis de productos de PCR mediante geles desnaturalizantes de poliacrilamida
Para verificar los resultados de la amplificación las muestras fueron separadas en geles desnaturalizantes de poliacrilamida al 12% en buffer TBE 0,5X. Las muestras fueron desnaturalizadas por tratamiento con formamida a 94°C por 2 min y luego enfriadas bruscamente a 4°C. Posteriormente, sembradas y separadas por electroforesis vertical a 120 V por 45 min y a 170 V durante 90 minutos para los geles al 6% y 12% respectivamente, utilizando el sistema MiniProtean 3D de Biorad. Seguido a la electroforesis, los geles fueron fijados en una solución 10% de etanol y 0,75% de ácido acético, y teñidos con 2 g/L de nitrato de plata. El perfil electroforético fue registrado mediante Scanner HP Deskjet F300 All-in-One series.
Resultados
Estandarización de marcadores microsatélites para Pinus taeda
La extracción de DNA para Pinus taeda mostró un rendimiento de 0,25 mg/mg de hojas frescas, asociado a valores de pureza cercanos a los 1,7 (proporción DO260/DO280). El análisis cualitativo en agarosa demostró una banda de DNA bien definida sin indicios de degradación. (figura 1)
Una vez verificada la calidad del DNA, se ajustaron los parámetros correspondientes a la amplificación de las regiones microsatélites seleccionadas. En todos los casos se aplicó un protocolo de ciclado del tipo touch down ya que permitió obtener bandas con el tamaño esperado para los amplicones de cada marcador. (figura 2)
Estandarización de marcadores microsatélites para Araucaria angustifolia
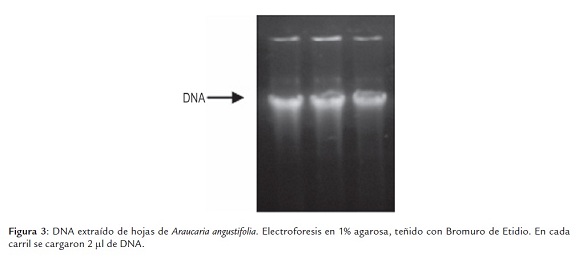
La extracción de DNA para A. agustifolia mostró un rendimiento de 1,67 µg/mg de hojas frescas, asociado a valores de pureza cercanos a los 1,7 (proporción DO260/DO280). El análisis cualitativo en agarosa demostró una banda de DNA bien definida sin indicios de degradación. (figura 3)
Una vez verificada la calidad del DNA, se realizaron los ensayos para estandarizar la amplificación de las regiones microsatélites seleccionadas. Al aplicarlo al estudio de individuos de una forestación local los marcadores Ag20, Ag45, Ag94 y Ag56 fueron los únicos que amplificaron mostrando un perfil variable entre las muestras (figura 4). En todos los casos la PCR mostraron bandas con el tamaño esperado para los amplicones de cada marcador.
Discusión
El coaislamiento de polisacáridos, fenoles, terpenos y compuestos secundarios es el principal problema encontrado en el aislamiento y purificación de DNA vegetal, pudiendo dañar el DNA e inhibir la acción de la enzima Taq polimerasa (Moralinari et al., 2001). En este sentido, las hojas de las coníferas contienen ácidos, resinas y polifenoles, los cuales son poderosos agentes oxidantes presentes en muchas especies de plantas, pueden reducir la producción y pureza del DNA extraído por unión covalente al mismo haciéndolo inútil para la mayoría de las aplicaciones subsiguientes (Katterman and Shattuck, 1983; Peterson et al., 1997). Una manera de minimizar los efectos causados por estos compuestos es con el agregado de agentes antioxidantes como el polivinilpirrilidona (PVP) (Maliyakal, 1992) y el metabisulfito de sodio que tienen por función unirse a los polifenoles provocando su precipitación obteniéndose así DNA de mejor calidad. De modo general, el protocolo de extracción de DNA más utilizado para las diferentes especies es el CTAB (bromuro de cetiltrimetilamonio) (Doyle y Doyle, 1990). Las diferencias básicas testadas en este trabajo estuvieron en la composición del tampón de extracción integrado por: un agente tampón para estabilizar el pH alrededor de 8,0; una sal para disociar las proteínas del DNA; un detergente para solubilizar las membranas y auxiliar en la inactivación de algunas enzimas, y un inhibidor de DNasa para proteger el DNA (Bered, 1998); y en los métodos de purificación en donde se ensayaron métodos: por extracción con solventes, y por extracción con solventes mas precipitación salina. La degradación del DNA se evitó realizando todos los pasos a temperatura ambiente. En el segundo lavado con cloroformo: alcohol isoamílico se realizó una incubación por 30 minutos que ayudó al retiro de pigmentos, luego se realizó una nueva purificación con acetato de potasio para eliminar restos de proteínas que todavía quedaran en suspensión. Después de la precipitación se efectuó una reprecipitación con etanol y acetato de sodio con lo cual no se formaron dos fases que si se formaba cuando utilizábamos isopropanol lo que lleva a suponer que la formación de una fase más densa estaría provocada por pigmentos miscibles en agua y solventes muy polares. Para evitar posibles interferencias en las etapas de amplificación ulteriores se purificaron las muestras. La sumatoria de estos pasos permitió la obtención de un DNA más puro e íntegro que pudo ser amplificado.
Los cebadores utilizados para la amplificación de microsatélites fueron seleccionadas secuencias polimorficas de la base de datos GenBank teniendo en cuenta los datos genómicos disponibles para regiones microsatélites previamente descriptos para Pinus taeda (Echt et al., 1997; Elsik et al., 2000). Los número de acceso de las secuencias utilizadas fueron: BV683040, BV683146, BV683043, BV683044, BV683047, BV683052, BV683053, AF143959, AF143975. La amplificación con los distintos cebadores produjeron bandas con el tamaño esperado. Los cebadores que produjeron una única banda del tamaño esperado fueron: RIPPTs 1 de 263 pb, RIPPTs 11 de 171 pb, RIPPTs 31 de 261pb, RIPPTs 79 de 139 pb, PtTX2037 237 aproximadamente, por lo que se trataría de un individuo homocigoto para estos microsatélites. Los cebadores que dieron como producto de la amplificación dos bandas del tamaño esperado fueron: RIPPTs 32 una de 183 y otra de 188 pb, RIPPTs 65 de 142 y de 139 pb, PtTX3037 de 124 y 126 pb aproximadamente, por lo que se trataría de un individuo heterocigoto, es decir con dos alelos para cada uno de estos locus de los microsatélites correspondientes. Nuestros resultados sugieren que éste método podría ser eficiente en estudios poblacionales de Pinus taeda mediante el análisis de STRs.
Por otro lado, para Araucaria angustifolia se seleccionaron los cebadores que presentaron el mayor grado de heterocigocidad y numero de alelos en un población de Brasil con la cual fueron descriptos (Salguiero et al., 2005).
Los cebadores seleccionados fueron analizados mediante programas bioinformáticas con el fin de predecir el comportamiento del proceso de amplificación y verificar el tamaño de los productos esperados. En el análisis se permitió vislumbrar la posible aparición de bandas producidas por el apareamiento de cebadores en el extremo 3' fenómeno denominado "primer-dímeros", mientras que por otro lado la autocomplementariedad medida por el parámetro "ANY" predijo el consumo de cebadores por autohibridación. De acuerdo al análisis bioinformático las temperaturas de hibridación de todos los cebadores eran distintas por lo que se planificaron ensayos de estandarización individuales.
Los parámetros de amplificación establecidos por investigaciones previas de otros grupos (Salguiero et al., 2005) fueron adecuados para iniciar la amplificación en las condiciones de trabajo de nuestro laboratorio con las muestras obtenidas por los métodos de extracción descriptos. Sin embargo, fueron necesarios ajustes principalmente en la Tm para tratar de encontrar un punto común que favorezca la amplificación simultánea de todos los STR. Esto no arrojo resultados favorables debiendo probablemente debido a las características del conjunto de cebadores usados que durante el análisis bioinformático predijo la aparición de dímeros y el consumo de cebadores que disminuye el rendimiento de las amplificaciones. Por esta razón para cada tipo de cebador debe trabajarse individualmente, o se deben establecer modificaciones que permitan su hibridación conjunta.
De todas las secuencias seleccionadas y analizadas, AG20, AG 23, AG 45, AG56, AG62, AG94, (AJ749964, AJ749965, AJ749966, AJ749967, AJ749968, AJ749969) únicamente las AG20, AG45, AG56 y AG94 fueron útiles y representativas a la hora de aplicar la plantilla de microsatélites al estudio poblacional. Incluso, algunas secuencias como AG20 deben ser testeadas con otras poblaciones por su alta tasa de homocigocidad. Esto expone la relevancia de continuar en el futuro con la búsqueda de otras regiones microsatélites para esta especie.
Conclusiones
Se optimizaron técnicas de extracción de DNA genómico para Pinus taeda y A. angustifolia obteniéndose DNA amplificable.
Para Pinus taeda, la utilización de los cebadores RIPPT-1, RIPPT-11, RIPPT-31, RIPPT-32, RIPPT-65, RIPPT-79, PtTX3037 y PtTX2037 con DNA extraído de acículas permitieron la obtención de bandas que corresponden a los tamaños esperados, pudiendo ser utilizado para estudios poblacionales de esta especie.
Para A. angustifolia, la utilización de los cebadores AG56, AG94, AG45 y AG20 con DNA extraído de hojas frescas permitieron la obtención de bandas que corresponden a los tamaños esperados, pudiendo ser utilizado para estudios poblacionales de esta especie.
Agradecimientos
Este trabajo fue financiado a través un subsidio a Proyectos Federales de Innovación Productiva (PFIP) otorgado por el Consejo Federal de Ciencia y Tecnología (CoFeCyT).
Referencias bibliográficas
1 Bered F. 1998. Extração de DNA, considerações e prática. MILACH, S. (Ed.) Marcadores moleculares em plantas. Brasil, Rio Grande do Soul: Porto Alegre, p141. [ Links ]
2 Doyle, J. J. and J. L. Doyle. 1990. Isolation of plant DNA from fresh tissue. Focus 12 (1): 13-15. [ Links ]
3 Echt C.S., May-Marquardt P. 1997. Survey of microsatellite DNA in pine. Genome. 40(1):9-17. [ Links ]
4 Elsik C.G., Minihan V.T., Hall S.E., Scarpa A.M., Williams C.G. 2000. Low-copy microsatellite markers for Pinus taeda L. Genome. 43(3):550-555. [ Links ]
5 Ferreira M.E., Grattapaglia D. 1998. Introducción al Uso de Marcadores Moleculares en análisis genéticos. Brasilia, D.F: Embrapa-Cenargen. [ Links ]
6 Jain S.M., Minocha S.C. 2000. Molecular biology of woody plants, volume 1. Dordrecht, The Netherlands. p520 [ Links ]
7 Katterman F.R.H, Shattuck V.I. 1983. An effective method of DNA isolation from the mature leaves of Gossypium species that contain large amounts of phenolic terpenoids and tannins. Preparative Biochemistry and Biotechnology. 13: 347-359. [ Links ]
8 López J.A. 2005. Mejoramiento genético de la calidad de la madera. I Jornada Sobre Potencialidad Foresto-Industrial del Eucalipto. Santiago del Estero, Argentina. [ Links ]
9 Mac Donagh P.; Berger S.; Zaderenko C.; Ziegler A. 2009. Aglomerado productivo forestal Misiones y Corrientes Norte (PI-TEC 007-06): La problemática energética y las respuestas del sector. XIII Congreso forestal mundial Buenos Aires, Argentina. [ Links ]
10 Maliyakal E.J. 1992. An efficient method for isolation of RNA and DNA from plants containing polyphenolics. Nucleic Acids Research. 20:2381. [ Links ]
11 Salgueiro F., Caron H., De Souza M., Kremer A. 2005. Characterization of nuclear microsatellite loci in South American Araucariaceae species. Molecular Ecology Notes 5(2): 256-258. [ Links ]
12 Secretaria de Agricultura, Ganadería, Pesca y Alimentación (SAGPyA). 2001. Argentina, oportunidades de inversion para bosques cultivados. Region Mesopotomica. SAGPyA. Buenos Aires, Argentina. [ Links ]
13 Vargas Hernández J., Borja De La Rosa A.B., Sánchez E.I., López Upton J. 2005. Parámetros genéticos del crecimiento y densidad de madera en edades juveniles de Eucalyptus urophylla S. T. Blake. Agrociencia 39 (4): 469-479. [ Links ]