Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.14 no.2 Bogotá jul./Dec. 2012
ARTÍCULO DE INVESTIGACIÓN
Efecto de dos citoquininas, ácido ascórbico y sacarosa en la obtención de plantas in vitro de Sorghum bicolor para la formación de callos
Effect of two cytokinin, ascorbic acid and sucrose to obtain in vitro shoots of sorghum for calli formation
Silvio de Jesús Martínez Medina1,2 , Rafael Gómez Kosky1 , Laisyn Posada Pérez1 , Raúl. Barbón Rodríguez1 , Maira Acosta Suárez1 , Maritza Reyes Vega1 , Martha Pérez Benitez1 , Damaris Torres Rodíguez1 , Mileidys Pons Corona1 , Mariana La O Cardenas1 , Annerys Aguilera Chávez3 , Miguel Tejeda González3 .
1 Instituto de Biotecnología de las Plantas. Universidad Central "Marta Abreu" de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara. Villa Clara. Cuba CP 54 830. e-mail: silvio@ibp.co.cu
2 Sede Universitaria Municipal Camajuaní. Joaquín Páneca 62. Camajuaní. Villa Clara. Cuba. e- mail: silviod@uclv.edu.cu
3 Biofábrica, MINAGRI, Cienfuegos. Carretera a Palmira km 1.5, Cienfuegos, Cuba
Recibido: febrero 21 de 2012 Aprobado: noviembre 29 de 2012
Resumen
El trabajo se realizó con el objetivo de obtener brotes in vitro vía organogénesis directa en sorgo variedad CIAP 2E-95, para la formación de callos con estructuras embriogénicas. Se tomaron semillas maduras de plantas que crecían en condiciones controladas, las que se desinfectaron y fueron colocadas a germinación en un medio de cultivo con las sales MS, mioinositol 100 mg L-1, sacarosa 3%, pH 5,7, Fitagel 2,5 g L-1. Para la multiplicación de los brotes, se estudiaron diferentes concentraciones de 6 Bencilaminopurina (6-BAP) y kinetina. El empleo en el medio de cultivo de multiplicación con las sales MS y 6- BAP 0,22 mg L-1, incrementó el número de brotes por explante y se observó la presencia de oxidación fenólica. La oxidación fenólica se contrarrestó con la adición al medio de cultivo de 50 mg L-1 de ácido ascórbico y se incrementó significativamente el número de brotes, altura y número de hojas. En la obtención de brotes in vitro de calidad para la formación de callos, estos fueron engrosados con las sales MS, sin reguladores de crecimiento, ácido ascórbico 50 mg L-1, Fitagel 2,5 g L-1, pH 5,7 y 40 g L-1 de sacarosa. La formación de callos con estructuras embriogénicas a partir del cilindro central de las hojas enrolladas del segmento más próximo a la base de los brotes engrosados se alcanzó a los 45 días de cultivo. Los segmentos del cilindro central de las hojas enrolladas constituyen una fuente segura y promisoria de explantes para la formación de callos embriogénicos.
Palabras clave: 6 BAP, brote in vitro, callos con estrucutras embriogénicos, kinetina.
Abstract
The current work aimed to obtain in vitro shoots by direct organogenesis from sorghum variety CIAP 2E-95, for the formation of calluses with embryogenic structures. Mature seeds were collected from plants grown under controlled conditions, which were disinfected and were placed in a germination medium with MS salts, myo-inositol 100 mg L-1, 3% sucrose, pH 5.7, phytagel 2.5 g L-1. Different concentrations of 6-benzylaminopurine (6-BAP) and kinetin were studied for shoot multiplication. Using 6 - BAP 0.22 mg L-1 in the multiplication culture medium increased the number of shoots per explant, showing phenolic oxidation. Adding 50 mg L-1 of ascorbic acid to the culture medium resisted phenolic oxidation and the number of sprouts (5.0), height and number of leaves increased significantly. Quality in vitro buds for callus formation were obtained stimulating the thickening by using MS salts, without growth regulators, ascorbic acid 50 mg L-1, phytagel 2.5 g L-1 and pH 5.7 and 40 g L-1 of sucrose. The largest diameter of shoots, height, number of leaves and roots of in vitro plants, was achieved after 21 days of cultured in MS salts with 40 g L-1 sucrose. Calluses formation with embryogenic structures from the central cylinder of curled leaves of the nearest segment to the base of thickened shoots was achieved after 45 days of culture. Segments from the central cylinder of the curled leaves are a safe source for the formation of embryogenic calli.
Key words: 6-BAP, in vitro shoots, callus with embryogenic structures, kinetin.
Introducción
El sorgo (Sorghum bicolor (L.) Mohen) es una planta fisiológicamente de metabolismo C-4, que se adapta bien a un entorno agroecológico cálido y seco, en el cual es difícil de cultivar otros cereales (Antonopoulou et al., 2008; Liu et al., 2009). Esta especie es una poacea oriunda de las regiones tropicales y subtropicales de África (Sudhakar et al., 2009). Se emplea en la alimentación animal, nutrición humana, producción de fibra y de alcohol biocombustible (Rooney et al., 2007). Su cultivo se ha generalizado, ocupando el sexto lugar entre los cereales, después del trigo, arroz, maíz, soya y cebada (Zhao et al., 2010).
La producción de sorgo en Cuba esta limitada por un grupo de factores, estos son: el ataque por aves, enfermedades y plagas, el alto contenido de taninos que afecta la calidad y cantidad de proteína en el grano, así como su composición en aminoácidos; por ello es necesario el desarrollo de programas de mejoramiento genético (Pérez et al., 2010). La variedad de sorgo rojo CIAP 2-E-95 es tolerante al estrés hídrico y de altos rendimientos 9,9 t.ha-1), es la más generalizada en el país, sin embargo posee alto contenido de taninos que limita la calidad y contenido de sus proteínas.
El empleo de los métodos tradicionales de mejora genética están limitados por varios factores, entre ellos: los largos periodos de selección mediante marcadores morfológicos, la complejidad del carácter a mejorar y la influencia del medio ambiente.
La transformación genética es un método poderoso, esencial en la actualidad para el mejoramiento genético. Es requisito indispensable para usar este método, contar con un eficiente protocolo de regeneración de plantas.
La embriogénesis constituye una vía de regeneración de plantas, con la cual se ha trabajado en este cultivo (Zhong et al., 1998). Esta vía de regeneración, constituye un método simple, rápido para producir un gran número de plántulas (Baskaran et al., 2005). En sorgo para la regeneración de plantas a partir de callos han sido usado varios tipos de explantes como son: inflorescencia inmaduras (Jogeswar et al., 2007); yemas apicales (Maheswari et al., 2006); embriones inmaduros (Gupta et al., 2006), embriones maduros (Zhao et al., 2008, 2010). Sin embargo con ninguna de estas fuentes de explantes para la formación de callos, se ha logrado una alta frecuencia de inducción y regeneración de plantas. El sorgo por su sensibilidad al fotoperiodo, no permite que algunos de estos tipos de explantes estén a disposición durante todo el año. El uso de embriones cigóticos inmaduros está limitado por problemas relacionados con su aislamiento y desinfección.
Aunque existen protocolos de regeneración de plantas vía embriogénesis somática como herramienta para el mejoramiento genético, estos están limitados por varios factores fisiológicos y bioquímicos que disminuyen su eficiencia en la regeneración de plantas. Estos factores están relacionados fundamentalmente con los bajos coeficientes de multiplicación, la influencia del genotipo en la producción de brotes y aparición de compuestos fenólicos, que la convierten en la especie más recalcitrante en relación con el resto de los cereales (Gupta et al., 2006; Maheshwari et al., 2006).
Dada la problemática anterior este trabajo tuvo como objetivo determinar el efecto del 6-BAP, kinetina, ácido ascórbico y sacarosa en la obtención de brotes in vitro de sorgo var. CIAP- E-95 vía organogénesis, para utilizar los segmentos centrales de las hojas enrolladas como explantes iniciales para la formación de callos con estructuras embriogénicas.
Materiales y métodos
Se utilizó como material de partida semillas maduras de sorgo variedad CIAP 2E-95 (sorgo rojo) obtenidas en la Universidad Central "Marta Abreu" de Las Villas, Santa Clara, Cuba. Las plantas donantes del material de partida crecían en condiciones controladas (casas de cultivo), cuyas pániculas desde su emisión fueron cubiertas con auxilio de bolsas de papel encerado. Las semillas fueron germinadas in vitro según la metodología propuesta por Baskaran y Jayabalan (2005).
El material vegetal durante todo el trabajo, fue incubado en cámaras de cultivo con luz solar con una intensidad de fotones fotosintéticos de 35-40 μmol.m-2s-1, temperatura 26± 2 oC y humedad relativa 80%, con subcultivos cada 21 días.
Fue utilizado un diseño experimental completamente aleatorizado y se emplearon 10 replicas en cada experimento, con cuatro muestras en cada uno de ellas. Los datos fueron procesados estadísticamente, mediante el paquete estadístico SPSS versión 13. En el análisis estadístico se empleó la prueba Kruskal Wallis. Para la comparación de las medias se utilizó la prueba no paramétrica Mann Whitney (p<0,05).
Efecto del 6-bencilaminopurina y la kinetina en la multiplicación de brotes
Para determinar el efecto del 6 BAP y la kinetina en la fase de multiplicación, se emplearon brotes formados a partir de semillas maduras germinadas in vitro, a los que se le realizó un corte transversal a 0,5 cm de altura (a partir de la base). Estos brotes fueron transferidos a medio de cultivo de multiplicación con las sales MS, tiamina 1 mg L-1, mioinositol 100 mg L-1, sacarosa 3%, Fitagel 2,5 g L-1. Se evaluaron cinco concentraciones de 6-BAP (0,04; 0,1; 0,15; 0,22; 0,5mg L-1), cuatro de kinetina (0,05; 0.5; 0,10; 0,21 mg L-1) y tratamiento control sin citoquininas. El pH fue ajustado a 5,7 con una solución de NaOH (0,1 N) y HCl (0,1 N) previo a la esterilización.
Al final de cada subcultivo se evaluaron las siguientes variables: número de brotes por explante, altura de los brotes (cm), hojas por brote, brotes fuera de tipo y brotes muertos. Desde el punto de vista cualitativo se evaluó visualmente la presencia de pigmentos de color oscuro el medio de cultivo.
Efecto del ácido ascórbico en la multiplicación de brotes
Este experimento tuvo como objetivo determinar el efecto del ácido ascórbico en la reducción de la oxidación fenólica durante la fase de multiplicación de brotes. Los brotes con tamaño uniforme fueron subcultivados en medio de cultivo compuesto por las sales MS, la concentración de 6-BAP que produjo el mayor número de brotes por explante, determinada en el primer experimento y diferentes concentraciones de ácido ascórbico (20; 50; 80 mg L-1). Las variables evaluadas fueron definidas en el experimento anterior.
Efecto de la sacarosa en la obtención in vitro de brotes de calidad para la formación de callos
El presente experimento se realizó con el objetivo obtener brotes in vitro de calidad para la formación de callos. Se utilizaron brotes in vitro de sorgo de 1,0 cm de altura y 0,2 cm de diámetro del tallo, con cuatro subcultivos en medio de cultivo de multiplicación. Estos brotes fueron transferidos para su engrosamiento a un medio de cultivo con las sales MS, tiamina 1 mg L-1, mioinositol 100 mg L-1, ácido ascórbico 50 mg L-1, Fitagel 2,5 g L-1 a pH 5,7 y se evaluaron tres concentraciones de sacarosa (20; 40; 60 g L-1).
A los 21 días de cultivo fueron evaluadas las siguientes variables: altura de los brotes (cm), diámetro de los brotes (mm), número de raíces y hojas por brote.
Formación de callos a partir segmentos del cilindro central de las hojas enrolladas de brotes in vitro
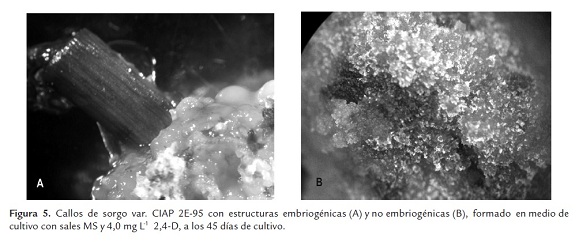
En la formación de callos se utilizaron brotes in vitro previamente engrosados. Se realizó un corte transversal al segmento nodal del brote in vitro más próximo a la base y se tomó el cilindro central de las hojas enrolladas de 0,5 cm de largo (Figura 1A). Los segmentos fueron introducidos de forma horizontal en un medio de cultivo en estado semisólido con las sales MS, 2,4-D 4 mg L-1, sacarosa 3%, Fitagel 2,5 g L-1 a pH 5,7 (Figura 1B). Se realizó una caracterización morfológica de los callos formados a los 45 días de cultivo. Las condiciones de cultivo fueron oscuridad y temperatura de 26± 2 ºC.
Resultados y Discusión
Efecto del 6-bencilaminopurina y la Kinetina en multiplicación de brotes
En la fase de multiplicación, el 6-BAP influyó en el número de brotes por explante. Se observaron diferencias significativas a los 21 días de transferidos los explantes a medio de cultivo con 0,22 mg L-1 de 6-BAP (tratamiento V), con incremento en el número de brotes por explante (4,06) en la variedad en estudio. La longitud del brote y número de hojas, varió en todas las concentraciones de 6-BAP y kinetina usadas durante la fase de multiplicación de los brotes (Tabla 1).
El 6-BAP, ha sido utilizado con éxito para estimular la proliferación de brotes axilares en muchos protocolos de cultivo de tejidos de otros cereales (Medina et al., 2004). Según, Syamala y Devi (2003), al incrementar las concentraciones de 6-BAP en el medio de cultivo de multiplicación de sorgo, se estimula la formación de brotes axilares.
En este trabajo, el aumento de concentraciones de 6-BAP a 0,22 mg L-1 en el medio de cultivo, reveló un incremento significativo del número de brotes por explante, número de hojas y longitud de los brotes, además no se observó la formación de yemas múltiples durante la fase de multiplicación. Sin embargo, existen referencias en la literatura sobre formación de yemas múltiples en sorgo, en medios de cultivo con altas concentraciones de 6-BAP (2,0 mg L-1) combinada con 2,4-D (Kishore et al., 2006).
El incremento de la concentración de kinetina, disminuyó el número de brotes por explante en comparación con el 6-BAP. Se observó una tendencia a la formación de yemas múltiples en la base de los explantes, en medio de cultivo con kinetina (0,10 y 0,21 mg L-1). Estos resultados coinciden con los de Baskaran y Jayabalan (2005) en relación al efecto de la kinetina en el incremento de la formación de yemas múltiples. Estos autores observaron un aumento del número de brotes con el incremento de las concentraciones de kinetina, lo cual no se corresponde con los resultados alcanzados en este trabajo En este sentido la literatura científica describe que la eficiencia en la regeneración de plantas depende del genotipo de Sorghum bicolor. Ahmad et al (2002) se refirieron a la influencia del genotipo en la frecuencia de regeneración plantas. La respuesta dependiente del genotipo fue observada por Mishra y Khurana (2003) al comparar 296 genotipos de Sorghum bicolor.
Baskaran et al. (2005) lograron en sorgo el mayor número de brotes por explante, cuando incrementaron las concentraciones de 6-BAP hasta 0,22 mg L-1. Además con esta concentración de 6 BAP, en combinación de ácido indolacético (AIA) y 45 g L-1 de sacarosa en el medio de cultivo lograron incrementar la longitud del brote. En los resultados del presente trabajo, el tratamiento con 0,22 mg L-1de 6-BAP es el único en que logran los mayores valores en los tres aspectos evaluados (número de brotes por explante, altura de los brotes y número de hojas por brotes. Aunque no se empleó AIA, estos parámetros estuvieron dentro de los límites aceptables para esta fase, donde el objetivo fundamental fue incrementar el número de brotes por explante.
En ninguno de los tratamientos evaluados existió mortalidad de los explantes y plantas fuera de tipo durante los 21 días de cultivo. Se observó la exudación de pigmentos de color oscuro al medio de cultivo y explantes necrosados.
Efecto del ácido ascórbico en la multiplicación de brotes
En todos los tratamientos del experimento anterior se observaron pigmentos de color oscuro con apariencia de oxidación fenólica en la base de los explantes y en el medio de cultivo. Los altos niveles de oxidación fenólica parecen ser generalizados en muchas especies de monocotiledóneas. También, Baskaran y Jayabalan (2005) observaron en la multiplicación de brotes de sorgo la producción de pigmentos de color marrón oscuro. Se plantea, en diferentes protocolos de regeneración que el principal problema en sorgo es la formación de compuestos fenólicos que afectan la regeneración de plantas (Sudhakar et al., 2007). La alta producción de compuestos fenólicos hacen que el sorgo sea considerada, la planta monocotiledónea más recalcitrante al cultivo de tejidos, regeneración de plantas y transformación genética (Gupta et al., 2006; Masherawari et al., 2006).
Se incrementó significativamente el número de brotes al utilizar 50 mg L-1 de ácido ascórbico con respecto a las demás concentraciones evaluadas incluyendo el control con las sales MS, 0.22 mg L-1 de 6-BAP y sin ácido ascórbico (Tabla 2).
Se conoce que la oxidación u oscurecimiento de tejidos cultivados in vitro, es la oxidación, por radicales libres, de diferentes componentes celulares, así como, la oxidación de compuestos fenólicos catalizado por la enzima polifenol oxidasa (PPo) para producir quinonas, las cuales son especies químicas muy reactivas y propensas a reaccionar, generando daño e incluso la muerte celular (Bray et al. 2000).La adición de antioxidantes al medio de cultivo ha sido eficaz en la prevención de la oxidación con un aumento en la eficiencia de regeneración de brotes sanos (Farooq et al., 2002). Baskaran y Jayabalan (2005) evitaron la aparición de la oxidación fenólica con la incorporación al medio de cultivo de acido ascórbico (30 mg L-1) y agua de coco (5%) que aumentó la concentración de ácido ascórbico al medio de cultivo, logrando una alta frecuencia de regeneración en los genotipos de sorgo K8 y K5.
Según Zhao et al. (2010) lograron eliminar la oxidación fenólica en los genotipos de sorgo dulce "Yuantian No.1" y "M81E", con la adición al medio de cultivo de 10 mg L-1 de ácido ascórbico. Sin embargo, en este trabajo fue necesario el empleo de 50 mg L-1 de dicho antioxidante. Según Martín et al. (1998) la variedad CIAP 2E-95 empleada, posee alto contenido de taninos, lo cual pudo haber influido en estos resultados.
El empleo de esta concentración de ácido ascórbico permitió eliminar los pigmentos de color oscuro en los explantes y en el medio de cultivo. Además del incremento significativo en el número de brotes por explante, se manifestó un comportamiento similar en el número de hojas y altura de los brotes. Esto puedo estar dado por la eliminación de las sustancias oxidantes y una mayor disponibilidad de los nutrientes presentes en el medio de cultivo. Además, este agente reductor está implicado en los procesos de división y el alargamiento celular (de Pinto et al., 1999). Se conoce el efecto de las hormonas endógenas presente en los tejidos vegetales en los procesos de división y alargamiento celular. Según Vasar (2004) los agentes antioxidantes tienen efectos beneficiosos en la protección antioxidante de las hormonas endógenas presentes en los explantes, responsables de los procesos celulares antes mencionados.
Los altos niveles de oxidación fenólica generalizada en muchas especies de monocotiledóneas y fundamentalmente en sorgo (Figura 2 A), parecen ser los responsables de la reducción del número de brotes por explante, altura de la planta y número de hojas. En este sentido, la incorporación al medio de cultivo de ácido ascórbico disminuyó la oxidación de los explantes (Azofeifa, 2009). Este antioxidante es un agente reductor que puede reducir y de tal modo neutralizar reacciones del oxígeno, como el peróxido de hidrógeno (Coulter et al., 2006). La adición al medio de cultivo de 50 mg L-1 de ácido ascórbico, logró eliminar el pardeamiento en la base del explante producto de la oxidación fenólica (Figura 2 B). El ácido ascórbico reduce el estrés oxidativo que sufren las células del explante cultivado in vitro. Este fenómeno se produce por el desbalance entre las reacciones pro-oxidación y los mecanismos antioxidantes para detoxificar (antioxidantes enzimáticos y no enzimáticos), generalmente causado por una generación incrementada de radicales libres (Turrens 2003). La reacciones pro-oxidación a nivel celular son capaces de oxidar irrestrictamente varios componentes celulares y pueden conllevar a una destrucción oxidativa de la célula. Existen moléculas, especialmente el OH- son altamente destructoras de lípidos, polisacáridos, proteínas y ácidos nucleicos, pudiendo ocasionar el colapso celular (Mittler et al. 2004). No se observaron explantes muertos, ni plantas fuera de tipo durante los 21 días de cultivo con la incorporación de ácido ascórbico al medio de cultivo.
Efecto de la sacarosa en la obtención in vitro de brotes de calidad para la formación de callos
El mayor grosor de las plantas in vitro (4,2 mm) se alcanzó al utilizar el medio de cultivo compuesto por las sales MS y 40 g L-1 de sacarosa. Este tratamiento mostró diferencias significativas respecto al resto de los tratamientos. Además, produjo un incremento significativo en la altura de los brotes, número de hojas y formación de raíces por planta (Figura 3).
No existen referencias en la literatura científica sobre tratamientos para incrementar el diámetro de las plantas in vitro previo a la formación de callos en este cultivo. Sin embargo, ha resultado indispensable para lograr este objetivo de introducir las plantas en un medio de cultivo que incremente el vigor, para que los fragmentos de plantas utilizados como explantes formen callos y en un mayor volumen. Según, Freire (1998) en caña de azúcar (Saccharum sp. híbrido var. Cuba 87-51), el incremento del vigor y grosor de los brotes in vitro en medio de cultivo compuesto por las sales MS y sacarosa 30 g L-1, fue indispensable para la formación de callos.
El incremento del valor nutricional promueve el crecimiento celular y pudiera ser la causa de formar plantas con mayor diámetro del tallo, altura, número de hojas y que emitan raíces con 40 g L-1 de sacarosa en ausencia de auxinas en el medio de cultivo (Figura 4).
En muchas especies de plantas concentraciones de sacarosa entre 4,5 y 6,0 % aumentan el crecimiento de plantas cultivadas in vitro y estimulan el enraizamiento (Lassocinski, 1985). Las altas concentraciones de sacarosa en el medio de cultivo constituyen un suplemento energético de la célula y aumentan el potencial osmótico en el medio de cultivo. Según George et al. (2008) el potencial osmótico del medio de cultivo influye en el crecimiento de los cultivos y se podría esperar que sea la concentración óptima de sacarosa la que promueve este efecto, la cual puede variar de un medio de cultivo a otro. Además refiere que el alto potencial osmótico disminuye el contenido de agua en la célula e incrementan en esta las concentraciones de nutrientes asimilables por la planta.
Formación de callos a partir del cilindro de la vaina de las hojas
La formación de callos a partir de los segmentos de los brotes de plantas in vitro se obtuvo a los 45 días de cultivo. Se observó la formación del callo en la zona de los segmentos más próxima a la base del brote, donde se realizaron los cortes y cubría la totalidad del tejido de la sección de la base (Figura 5 A).
Se formaron dos tipos de callos, unos compactos con superficies lisa, friables, brillantes, de color amarillo claro (Figura 5 A) y otros blandos de coloración oscura y amarillo crema (Figura 5 B).
Callos similares a los descritos anteriormente fueron observados por Girijashankar et al. (2007) quienes lograron a partir de ápices formar callos con estructuras embriogénica de color amarillo y compactos, así como la formación de callos de naturaleza no embriogénica suaves, de color blanco-cremoso y nodular. Zhao et al. (2010) describen en las variedades Yuantian No 1 M81E la formación de callos no embriogénicos de apariencia acuosa y color oscuro que exudaban pigmentos de color oscuro al medio de cultivo que se asemejan a los formados en la variedad CIAP 2E-95 en este estudio.
No existen referencias en la literatura científica del uso de segmentos del cilindro central las hojas enrolladas para la formación de callos con estructuras embriogénicas en sorgo. No obstante en el cultivo de la caña de azúcar variedad C 87-51, Freire (1998) informó la forman callos a partir de segmentos de brotes de plantas in vitro de más de 2,4 mm de grosor.
Los callos derivados de inflorescencias y embriones inmaduros son considerados la mejor fuente de explantes para el cultivo in vitro en sorgo, sin embargo estas estás disponibles en un corto período de tiempo del año debido al fotoperíodo de los diferentes genotipos. Los callos provenientes de estos tipos de explantes se ve limitados por el bajo potencial de regeneración, así por problemas asociados con el aislamiento y desinfección ( Kishore et al. 2006). Los brotes in vitro al obtenerse de semillas maduras, pueden reproducirse en cualquier época del año, por lo que lo segmentos del cilindro central de las hojas enrolladas constituyen una fuente contante y promisoria de explantes para la formación de callos embriogénicos.
Conclusiones
Fue posible incrementar el número de brotes in vitro por explante con el empleo de 0,22 mg L-1 de 6- BAP en el medio de cultivo.
Se logró eliminar la presencia de pigmentos de color oscuro con la adición de 50 mg L-1 de ácido ascórbico en el medio de cultivo para la multiplicación y engrosamiento de los brotes in vitro.
Se logró aumentar el grosor de los brotes in vitro para la formación de callos con estructuras embriogénicas, al incrementar la concentración de sacarosa a 40 g L-1 en el medio de cultivo.
Referencias bibliográficas
1 Ahmad, A., Zhong, H., Wang, W., Sticklen, M. B. 2002. Shoot apical: in vitro regeneration and morphogenesis in wheat (Triticum aestivum L.). In vitro Cell Developmental Biology-Plant 38 (2): 163-167. [ Links ]
2 Antonopoulou, G., Gavala, H., Skiadas, I., Angelopoulos, K., Lyberatos, G. 2008. Biofuels generation from sweet sorghum: Fermentative hydrogen production and anaerobic digestion of the remaining biomass. Bioresour. Technology. 99 (1): 110-119. [ Links ]
3 Azofeifa, A. 2009. Problemas de oxidación y oscurecimiento de explantes in vitro. Agronomía Isoamericana. 20 (1): 153-175. [ Links ]
4 Baskaran, P., Jayabalan, N. 2005. A simple approach to improve plant regeneration from callus culture of Sorghum bicolor for crop improvement. Journal of Agricultural Biotechnology. 1(1): 179-192. [ Links ]
5 Bray, E., Bailey-Serres, J., Weretilnyk, E. 2000. Responses to abiotic stresses. En: Buchanan,B; Gruissem, W; Jones, R. (eds.) Biochemistry and Molecular Biology of Plants. (Ed.) American Society of Plant Physiologists. Maryland, USA, p. 1158-1203. [ Links ]
6 Coulter, I., Hardy, M., Morton, S., Hilton, L., Tu, W., Valentine, D., Shekelle, P. 2006. Antioxidants vitamin C and vitamin E for the prevention and treatment of cancer. Journal of general internal medicine: official journal of the Society for Research and Education in Primary Care Internal Medicine. 21 (7): 735-44. [ Links ]
7 de Pinto, M., Francis, D., De Gara L., 1999. The redox state of the ascorbate-dehydroascorbate pair as a specific sensor of cell division in tobacco BY-2 cells. Protoplasma 209 (1-2): 90-97. [ Links ]
8 Farooq S., Farooq, T., Rao, T. 2002. Micropropagation of Annona squamosa L. using nodal explants. Pakistan Journal of Biological Science. 5 (1): 43-46. [ Links ]
9 Freire, M. 1998. Embriogénesis somática en caña de azúcar (Saccharum sp. híbrido var. C 87 - 51. Tesis para optar por el grado Científico de Master en Biotecnología Vegetal. 61 p. Universidad Central "Marta Abreu" de Las Villas. [ Links ]
10 George, F., Hall, M., De Klerk, G. 2008. Plant Propagation by Tissue Culture 3rd Edition. Vol.1:131-139. [ Links ]
11 Girijashankar, V., Sharma, K.K., Balakrishna, P., Seetharama, N. 2007. Direct somatic embryogenesis and organogenesis pathway of plant regeneration can seldom occur simultaneously within the same explant of sorghum. Journal of SAT Agricultural Research, 3 (1): 1-3 [ Links ]
12 Gupta S., Khanna V., Singh, R., Garg, G. 2006. Strategies for overcoming genotypic limitations of in vitro regeneration and determination of genetic components of variability of plant regeneration traits in sorghum. Plant Cell Tiss Organ Culture. 86 (3): 379-388. [ Links ]
13 Jogeswar, G., Ranadheer, D., Anjaiah, V., KaviKishor, P.B. 2007. High frequency somaticembryogenesis and regeneration in different genotypes of Sorghum bicolor (L.) Moench from immature inflorescence explants. In vitro Cell Developmental Biology-Plant. 43 (2): 159-166. [ Links ]
14 Kishore, K., Visarad, K., Aravinda, Y., Pashupatinath, E., Rao, S., Seetharama, N. 2006. in vitro culture methods in sorghum with shoot as the explant. Plant Cell Reports. 25 (3): 174-182. [ Links ]
15 Lassocinski, W. 1985. Chlorophyll-deficient cacti in tissue cultures. Acta. Horticulturae 167: 287-293. [ Links ]
16 Liu, G.S., Zhou, Q.Y., Song, S.Q., Jing, H.C., Gu, W.B., Li, X.F., Su, M., Srinivasan, R. 2009. Research advances into germplasm resources and molecular biology of the energy crop sweet sorghum. China Bull Boatany. 44 (3): 253-261. [ Links ]
17 Maheswari, M., Lakshmi, N.J., Yadav, S.K., Varalaxmi, Y., Lakshmi, A.V., Vanaja, M., Venkateswarlu, B. 2006. Efficient plant regeneration from shoot apices of sorghum. Biology Plant. 50 (4): 741-744. [ Links ]
18 Martín, D.; Saucedo, O.; Mena, O.; Valdés, L.; Clara, R. 1998. CIAP-2E-95, variedad de sorgo de grano rojo con adaptación tropical, apta para la alimentación animal. CENTRO AGRÍCOLA. 2 (25): 75. [ Links ]
19 Medina, R., Faloci, M., Marassi, M.A., Mroginski, L.A. 2004. Genetic stability in rice micropropagation. Biocell. 28 (1): 13-20. [ Links ]
20 Mishra, A.; Khurana, P. 2003. Genotype dependent somatic embryogenesis and regeneration from leaf base cultures of Sorghum bicolor. Journal of Plant Biochemistry and Biotechnology. 12 (1): 53-56. [ Links ]
21 Mittler, R., Vanderauwera, S., gollery, M., Breusegem, F. 2004. Reactive oxygen gene network of plants. Trends in Plant Science 9 (10): 490-498. [ Links ]
22 Murashige, T., Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum. 15 (3): 473-497. [ Links ]
23 Pérez, A., Saucedo, O., Iglesias, J., Wencomo, H., Reyes, F., Oquendo, G., Millán., I. 2010. Caracterización y potencialidades del grano de sorgo (Sorghum bicolor (L.) Moench). Pastos y Forrajes. 33 (1): 1-17. [ Links ]
24 Rooney, W.L., Blumenthal, J., Bean, B., Mollet, J.E. 2007. Designing sorghum as a dedicated bioenergy feedstock. Biofuels, Bioproducts and Biorefining. 1 (2): 147-157. [ Links ]
25 Syamala, D., Devi, P. 2003. Efficient regeneration of sorghum (Sorghum bicolor (L.) Moench), from shoot-tip explant. Indian Journal of Experimental Biology. 41 (12): 1482-1486. [ Links ]
26 Sudhakar, N., Sarada, M., Ramana, T. 2008. Plant tissue culture studies in Sorghum bicolor, immature embryo explants as the source material. International Journal of Plant Production. 2 (1): 1-14. [ Links ]
27 Sudhakar, N., Sarada, M., Ramana, T. 2009. Mature embryos as source material for efficient regeneration response in sorghum (Sorghum bicolor L. Moench). Sjemenartvo. 26 (3-4): 93-104. [ Links ]
28 Turrens, J. 2003. Mitochondrial formation of reactive oxygen species. Journal of Physiology 552 (2): 335-344. [ Links ]
29 Vasar, V. 2004. Aplicat ion of antioxidants in rooting of Prunus Avium L. Microshoots. Acta Universitatis Latvieensis. Biology. 676: 251-256. [ Links ]
30 Zhao, L., Liu, S., Song, S. 2008. Efficient induction of callus and plant regeneration from seeds and mature embryos of sweet sorghum. Chinese Bull Botany. 25: 465-468. [ Links ]
31 Zhao, L., Liu, S., Song, S. 2010. Optimization of callus induction and plant regeneration from germinating seeds of sweet sorghum (Sorghum bicolor Moench). African Journal of Biotechnology. 9 (16): 2367-2374. [ Links ]
32 Zhong, H., Wang, W., Sticklen, M. 1998. in vitro morphogenesis of Sorghum bicolor (L.) Moench: efficient plant regeneration from shoot apices. Journal of Plant Physiology. 153 (5-6): 719-726. [ Links ]