INTRODUCCIÓN
El cultivo de batata o camote (Ipomoea batatas L.), es uno de los alimentos más importantes en los países en desarrollo debido a su alto valor nutritivo, es importante resaltar su uso para el consumo humano y animal, así como materia prima para la agroindustria (Scott et al.,1992). A nivel mundial la batata se siembra 114 países y está catalogada dentro de los cinco esenciales cultivos en más de 50 países. Asia es la región de mayor producción (Cuellar et al., 2015), con un área sembrada de 8.623 millones hectáreas, con una producción anual estimada 105 millones de toneladas siendo China el principal productor con 70 millones por hectáreas (FAO, 2016).
En América latina, el cultivo de batata se destina al consumo de los países que la producen, en su mayoría con problemas de desnutrición y pobreza. Presenta grandes posibilidades para aumentar el área sembrada debido a que constituye una alternativa en la rotación de cultivos y la implementación de modelos de agricultura sostenible. Con el aumento de la población mundial se hace necesario abastecer la demanda de alimentos, una opción sustentable a esta problemática podría estar enfocada en incluir en la dieta un producto de alto valor energético como lo es la batata (Tique et al., 2009).
En Colombia, la batata es un cultivo de amplia diversidad genética, sin embargo, se encuentra relegado a la producción en huertas caseras en algunas regiones del país (Flórez et al., 2016). Colombia registró una producción de 291,8 toneladas en 2012, donde se resalta la participación del departamento de Sucre con el 53% de la producción nacional, seguido por Córdoba (17.13%) y Magdalena (12.88%).
Para lograr una mayor productividad en el cultivo de batata, se requiere el uso de fertilizantes de síntesis química, se estima que los cultivos absorben entre un 20 a 40% del fertilizante aplicado, el resto se pierde por diversos mecanismos, generando cuantiosas pérdidas económicas y contaminación ambiental, como la eutrofización de cuerpos de agua, lluvia ácida, destrucción de la capa de ozono, impacto variable en la composición y funciones de la microbiota del suelo e incremento del efecto de invernadero (Grageda et al., 201 2; Savci, 2012).
Teniendo en cuenta estas amenazas, una de las alternativas amigables al ambiente para mitigar el uso de fertilizantes de síntesis química es la aplicación de inoculantes bacterianos a base de Rizobacterias Promotoras De Crecimiento Vegetal (PGPRs, por su siglas en inglés), que son bacterias con propiedades bioestimulantes, encargadas de promover desarrollo vegetal, producción de hormonas y enzimas, entre otras, las cuales constituyen una de las prácticas promisorias e innovadoras para el sector agrícola. Estas interacciones planta-microbio en la rizósfera son factores determinantes en la salud de las plantas, la productividad y la fertilidad del suelo (Stone et al., 2000; Bent, 2006; Brundrett, 2009; Iyer y Rajkumar, 2017).
Los inoculantes bacterianos pueden contribuir a aumentar la eficiencia agronómica mejorando la absorción de nutrientes, como sucede cuando se inocula con microorganismos fijadores de nitrógeno atmosférico y a la vez se puede aumentar la disponibilidad de nutrientes poco móviles del suelo, como es el caso de bacterias solubilizadoras de fósforo (Singh et al., 2016). Existen numerosos géneros bacterianos que muestran potencialidad como inoculantes entre los más aceptados se encuentran Azospirillum, Pseudomonas, Azotobacter, Bacillus, entre otros (Farzana & Radizah, 2005; Khan & Doty, 2009; Yasmin et al., 2010; Sánchez et al., 2019). El éxito de un bioestimulante microbiano en el campo agrícola, está influenciado no solo por la capacidad del microorganismo para sobrevivir sino también por los efectos interactivos con los microbios nativos del suelo (Dawwam et al., 2013). El objetivo de esta investigación fue evaluar el efecto de Azotobacter vinelandii y Pseudomonas denitrificans con diferentes niveles fertilización química nitrogenada en el cultivo de batata establecido en la microrregión del Valle del Sinú.
MATERIALES Y MÉTODOS
La presente investigación se desarrolló en la Corporación Colombiana de Investigación agropecuaria-AGROSAVIA, en el Centro de Investigación Turipaná de Cereté (Córdoba - Colombia), durante el primer semestre 2016, sus coordenadas geográficas corresponden a los 8° 31' 16'' de latitud norte y 75° 58' 11' de longitud oeste.
Material vegetal
Se utilizó como material vegetal plántulas de batata cultivar Criolla de la Pozona del banco de germoplasma de Agrosavia, las cuales fueron proporcionadas por el Laboratorio de Producción Vegetal del Centro de Investigación Turipaná y obtenidas in vitro con el protocolo código GA-O-22. La etapa de endurecimiento de las plántulas se realizó en bandejas de 24 alveolos, empleando un sustrato integrado por la mezcla de 85% de aluvión, 10% de arena y 5% ceniza de cascarilla de arroz; las plántulas fueron establecidas en invernadero durante 40 días y los riegos fueron realizados por aspersión cada 15 a 20 minutos a una temperatura de 27°C a 31°C, con una humedad relativa la primera semana ≥ 90%, la segunda semana ≥ 80% y la tercera y cuarta semana ≥ 70%.
Cepas Bacterianas
Como inoculantes microbianos se usaron las cepas bacterianas Pseudomonas denitrificans IBVS2 y Azotobacter vinelandii IBVS13, que hacen parte de la colección de trabajo del Laboratorio de Microbiología Agrícola del Centro de Investigación Turipaná. Las características de estas cepas y su actividad PGPRs fueron descritas por Pérez y Sánchez (2017).
Preparación de inóculos
Las cepas seleccionadas fueron activadas en placas Petri con agar Luria Bertani (LB) - (Bertani, 1951), mediante el método de estriado. Las cepas ya activadas se sembraron en caldo LB en un volumen correspondiente al 10% del volumen final requerido y se dejaron en un agitador orbital a 150 rpm durante 24 horas alcanzando una concentración de 1x108 ufc/mL.
Establecimiento del experimento en campo
Las plantas in vitro previamente endurecidas fueron establecidas en campo (Figura 1a y 1b) bajo un diseño completamente aleatorizado con ocho tratamientos y tres repeticiones. Los tratamientos evaluados fueron los siguientes: T1: T. absoluto (Sin inoculación, sin fertilización), T2: T. químico (sin inoculación, 100%FM), T3: IBVS2 + 50%, T4: IBVS2 + 75%FM, T5: IBVS13 + 50% FM, T6: IBVS13 + 75%FM, T7: IBVS2 +IBVS13 + 50%FM T8: IBVS2+IBVS13+75%FM. El tamaño de parcela o unidad experimental constaba de cinco surcos de 7,2 m de largo y una distancia de 1 m entre surco con una densidad de siembra 0,4 m, para un total de 2,160 plantas.

Figura 1 Cultivo de batata establecido en Centro de Investigación Turipaná en la microrregión del Valle del Sinú. a. Follaje del cultivo 60 días. b. Follaje de la batata a los 210 días.
El suelo empleado para el establecimiento del cultivo presentó 1.55% MO; (mg.kg-1) 11,70 P; 0,72 K; 7,25 Mg; 12,89 cmol.Kg-1 Ca y pH: 6,94. Las dosis de la fertilización química fueron calculadas teniendo en cuenta los requerimientos del cultivo y los resultados del análisis de suelo. Los nutrientes requeridos por la planta KCL y DAP fueron aplicados al momento de la siembra y las diferentes dosis de FM se aplicaron en dos fracciones. La primera fracción correspondiente al 30% se aplicó 20 días después de la siembra (DDS), y una segunda fracción del 70% a los 40 DDS. La inoculación de las plantas con las cepas bacterianas se realizó con la FM. Las plantas fueron inoculadas directamente en el suelo al pie de la planta con 10 mL de la suspensión bacteriana correspondiente a cada bacteria con una concentración celular de 1x108 UFC.mL-1 en medio LB® (Bertani, 1951).
La cosecha se realizó a los 210 días de establecido el experimento (Figura 2), se midieron datos de rendimiento, producción de materia seca radicular y de la parte aérea, composición bromatológica de raíz reservante proteína bruta % (AOAC 960.52) y fibra cruda % (MTC 5122).
Análisis estadísticos
El análisis estadístico se realizó empleando el paquete estadístico SAS v 9.2 (2016). Se llevó a cabo un análisis de varianza y pruebas de comparación múltiple de Tukey al 5% de confianza.
RESULTADOS Y DISCUSIÓN
En la Figura 3a, se observan los resultados obtenidos para la variable rendimiento de raíces frescas. El tratamiento T6 presentó diferencias estadísticamente significativas (p< 0,05) con T2 y respecto a T1 aunque no presentó diferencias significativas se obtuvo un mayor valor medio de rendimiento (Figura 1a).
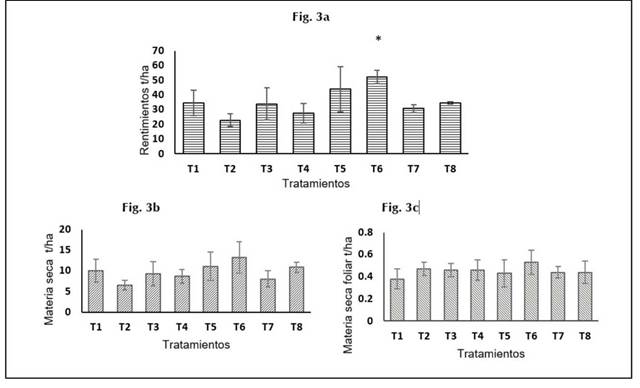
Figura 3 Efectos de inoculación de bacterias eficientes y fertilización nitrogenada en el cultivo de batata en el Valle del Sinú. Fig.3a. Rendimientos de tubérculos batatas Fig.3b. Materia seca de tubérculos. Fig.3c. Materia seca foliar). Los tratamientos evaluados: T1: T. absoluto (Sin inoculación, sin fertilización), T2: T. químico (sin inoculación, 100%FN), T3: IBVS2 + 50%, T4: IBVS2 + 75%FN, T5: IBVS13 + 50%FN, T6: IBVS13 + 75%FN, T7: IBVS2 +IBVS13 + 50%FN T8: IBVS2+IBVS13+75% FN . (*) para designar las diferencias significativas (p≤0,05).
El Tratamiento T6 que incluye la inoculación de la bacteria Azotobacter vinelandii IBVS13 + 75%FM favoreció el llenado de raíces expresado en un mayor contenido de materia seca (Figura 3b); estos resultados pueden explicarse considerando que Azotobacter vinelandii al ser una bacteria de vida libre pueden comportase como asociativa, coloniza las raíces y mejora el desarrollo de la planta a través de la producción de reguladores de crecimiento, estimulando el desarrollo radicular, permitiendo una mejor absorción de agua y nutrientes del suelo (Cassán et al ., 2011), razón por la cual, la FM puede favorecer su establecimiento bajo condiciones de campo. Estos resultados sugieren que la inoculación de bacterias en el cultivo de batata genera una respuesta en el rendimiento de este tubérculo. Mookaraju et al. (2011), reporta que el crecimiento vegetativo, el número de tubérculos y el rendimiento puede mejorarse con el uso de PGPRs y han demostrado ser beneficiosas para el desarrollo productivo de cultivo batatas (Dashti-Gibson et al., 1997; Hayat et al., 2010). Por tanto, las PGPRs se utilizan en la actualidad como inoculantes microbianos, los cuales reducen la fertilización química y aumentan la productividad de los cultivos (Henagamage, 2016). Además, se ha informado que el Ácido Indol Acético (AIA) exógeno producido por PGPRs aumentan el crecimiento y desarrollo de las plantas y estimula el alargamiento de las raíces y la formación de raíces laterales (Ahemad y Kibret, 2014).
Los valores más bajos de rendimiento (Figura 3a) y materia seca radicular (Figura 3b) se obtuvieron con T4 y T2. Respecto a estos resultados Añez y Espinoza (2006), han reportado que las aplicaciones excesivas de Mitrógeno (M), durante la estación temprana de cultivos de papa pueden dar como resultado un crecimiento excesivo del follaje, retrasar la iniciación y el llenado eficiente de los tubérculos. Por su parte Yasmin et al. (2007), indicaron que plantas de batata de la variedad Sepang Oren inoculadas con las rizobacterias Klebsiella sp., Erwinia sp., Azospirillum brasilense y Bacillus sphaericus con una dosis de fertilizante de 100 kg M/ha redujo de forma significativa el rendimiento de los tubérculos en 1,5 t/ha, en comparación con las plantas tratadas con una dosis de 33,0 kg M/ha.
Respecto a los resultados de la materia seca radicular no hubo efectos significativos de la inoculación de las rizo-bacterias (p≤ 0,05) (Figura 3b). Los valores obtenidos con el T6 generaron un incremento de 6.65 t/ha con respecto al testigo químico y 3,18 t/ha en relación con el testigo absoluto. Estos resultados son similares a los reportados por Dawwan et al. (2013), reportaron que la bacteria Achromobacter xylosoxidans, en experimentos llevados a cabo en invernadero incrementaron los parámetros de crecimiento, mejoró el desarrollo y aumentó significativamente en 0,025 g/planta la materia seca de raíces de almacenamiento de plantas de batata. En el mismo sentido, varios estudios han informado que las PGPRs pueden usar diferentes mecanismos de forma simultánea, empleando la fijación biológica de Mitrógeno atmosférico (N2), la producción fitohormonas como auxinas, citoquininas y giberelinas para mejorar la estimulación del crecimiento de las plantas (Van Loon, 2007; Bhattacharyya y Jha, 2012). Patten y Glick, 1996 informa que las AIA exógeno actúan como molécula de señalización que puede conducir a iniciación temprano de tubérculos en papa. Burr et al. (1978), informaron un aumento significativo en crecimiento y rendimiento tubérculos de las plantas de papa después de inocular sus semillas con P seudomonas putida y P. fluorescens a nivel de invernadero.
Los resultados de la variable materia seca foliar indican que no hubo diferencias estadísticamente significativas (p≤0,05) entre los tratamientos (Figura 3c), no obstante, con T6 se obtuvo el mayor valor medio de materia seca. Grada et al. (2017), describen que Azotobacter vinelandii presenta los mejores resultados, afectando positivamente la masa seca de las plantas maíz, lo cual se supone un incremento significativo del nitrógeno en las plantas. Oswald et al. (2010), describieron que las PGPRs en papa atribuyeron los aumentos de los rendimientos de tubérculos en plantas tratadas con PGPRs a inducción de tubérculos tempranos rápido desarrollo del área foliar y mayor fotosíntesis.
El nitrógeno fijado deriva de las actividades de ciertas bacterias que absorben el nitrógeno atmosférico y lo convierten en amonio; estas bacteria fijadoras de nitrógeno (BFM) se asocian con las raíces de las plantas y estas plantas suple energía a la bacteria, mientras que la bacteria suple a la planta nitrógeno fijado (Peoples et al., 1995; Iyer y Rajkumar, 2017); los mecanismos más importantes de fijación del nitrógeno en los sistemas agrícolas son las asociaciones simbióticas, así mismo, los procesos biológicos que contribuyen al 65% de la producción total anual del nitrógeno fijado (Mewton et al., 2002).
La Figura 4, hace referencia al análisis bromatológico que se realizó a las raíces tuberosas, aunque no se presentaron diferencias significativas (p≤0,05) en estas variables; el contenido de proteína bruta fue mayor en los tratamientos inoculados con microorganismos T4 (17,26%), T5 (5,34%) y T6 (13,93%) respecto a los testigos. En las plantas, los aminoácidos son el principal componente para la síntesis de proteínas (Lam et al., 1996) y, por lo tanto, juegan un papel importante en la nutrición humana. Las proteínas en los alimentos son sustancias nitrogenadas importantes ya que son necesarias para el crecimiento y la reparación de los tejidos corporales de los seres vivos (Latham, 2002). Mosheen et al. (2016), reportan que, la inoculación de bacterianas en condiciones de campo, mostraron mejoras significativas con incrementos de 55 a 250 % en contenidos de proteína bruta en las semillas de alazor (Carthamus tinctorius) por Azotobacter vinelandii suplementado con una cuarta dosis nitrógeno y fósforo. Por su parte, Abdel- Maby et al. (2018), informan que en plantas de batata cultivar Abbes la aplicación de bioestimulantes a base de bacterias y actinomicetos (2 mL/L) incrementaron de forma significativa el rendimiento de las plantas, materia seca de raíz de tubérculo (%), proteína cruda (%), carbohidratos totales (%), almidón (%), azúcares totales (%), contenido de betacaroteno y vitamina C de la raíz del tubérculo en comparación con las plantas no tratadas que dieron los menores valores durante las dos estaciones evaluadas.

Figura 4 Análisis Bromatológicos de raíces tuberosas inoculados con bacterias eficientes en el cultivo de batata.
En relación con la fibra cruda se presentaron incrementos con respecto al testigo absoluto en los tratamientos inoculados con las bacterias, presentado la mayor media T3 (31,75 %), T5 (25,91 %), T7 (22,62 %) y T4 (6,56 %).
La fibra cruda es importante en los alimentos porque es la base de una buena movilidad intestinal al aumentar el volumen y ablandar los residuos intestinales de un ser vivo (Gonzalvo et al., 2001).
CONCLUSIONES
El uso de plántulas in vitro de batata inoculadas con Azotobacter vinelandii y una dosis de fertilización nitrogenada del 75%, generó un alto rendimiento en el cultivo de batata (Ipomoea batatas) alcanzando un rendimiento de 52,36 t/ha y una reducción del 25% en las cantidades de fertilizante nitrogenado.
Los resultados de esta investigación sugieren que la incorporación de inoculantes microbianos al cultivo de batata favorece la acumulación de materia seca radicular y foliar, adicionalmente mejora la composición nutricional de las raíces tuberosas en cuanto a proteína bruta y fibra cruda, por tanto, los inoculantes microbianos pueden ser considerados como beneficiosas y con capacidad de mejorar la tuberización, el crecimiento y la nutrición en el cultivo de batata.















