INTRODUCCIÓN
El propósito de hacer ensilaje es producir un forraje estable, con una alta conservación de la materia seca, energía y nutrientes digeribles después de la cosecha (Kung Jr. et al. 2018). En los sistemas de ganadería tropical, la inestabilidad aeróbica de los silos conlleva a pérdidas en el alimento, por lo tanto, se debe preparar en volúmenes apropiados, para administrarse en un corto lapso, después de la apertura.
Una vez abiertos los silos, la exposición aeróbica induce el desarrollo de poblaciones microbianas aerobias, iniciando la oxidación de los productos de fermentación presentes en el sustrato, causando un deterioro en la calidad, por la producción de sustancias o microorganismos tóxicos (Danner et al. 2003; Santos da Silva et al. 2014). Así, el ensilaje se torna aeróbicamente inestables, si en el periodo post apertura es invadido por microorganismos deletéreos, tales como mohos y levaduras (Borreani et al. 2018). Si estos microorganismos encuentran un ambiente favorable podrían ocasionar cambios en la coloración y la textura, como pérdidas de materia seca (DM) y nutrientes. El incremento de la actividad microbiana induce el aumento de la temperatura, así la estabilidad aeróbica se puede medir, evaluando este parámetro. El sustrato ensilado es aeróbicamente estable, si después de la exposición aeróbica mantiene una temperatura interna no superior a los 3 °C de diferencia respecto a la temperatura ambiente (Espinoza et al. 2017; Heinritz et al. 2012). El incremento de la temperatura constituye un indicador de la actividad de microrganismos aerobios, como mohos y las levaduras, proceso que puede ocasionar pérdidas de MS, si el incremento del consumo de nutrientes es considerable (Borreani et al. 2018).
El daño aeróbico de los ensilajes constituye un problema para la conservación de nutrientes, principalmente, por la fermentación alcohólica causada por levaduras y mohos, que asimilan el lactato (Pahlow et al. 2003). Frente a esto, los mecanismos para inducir la resistencia al deterioro aeróbico varían, entre ellos, los lactobacillus heterofermentativos, que tienen una acción positiva, dado que producen ácido acético y propanodiol, además, decrece el número de levaduras y se incrementa el ácido acético en el ensilaje (Kung Jr. et al. 2018); esto contribuye a prolongar la resistencia aeróbica.
La inoculación con bacterias ácido-lácticas (BAL) heterofermentativas, como Lactobacillus brevis o Lactobacillus buchneri, aumenta la estabilidad (Danner et al. 2003); sin embargo, otras estrategias se podrían considerar para mitigar el deterioro, entre ellas, el ensilado de mezclas de plantas fuentes de energía y fibra con especies, que tienen la capacidad de producir altas concentraciones de ácido láctico en procesos de fermentación aeróbica, es decir, plantas con alta capacidad de mantener un pH bajo, cuando el silo es expuesto al aire (Mendieta-Araica et al. 2009).
Esta investigación parte de la hipótesis de que la sustitución de PP con TD en diferentes proporciones en el sustrato fermentado, aumenta la resistencia aeróbica. Por lo tanto, este experimento tiene como objetivo cuantificar el efecto de diferentes niveles de sustitución de la mezcla T. diversifolia/P. purpureum, enriquecidos con aditivos de lactobacillus sobre la estabilidad del ensilaje, en el periodo de exposición aeróbica.
MATERIALES Y MÉTODOS
Los análisis, se realizaron en el Laboratorio de Calidad de Forrajes del Centro Internacional de Agricultura tropical - CIAT, en el Municipio de Palmira, Colombia, 3°30'09"N; 76°21'18"W.
Preparación de los microsilos. El forraje utilizado para la producción de ensilaje fue recolectado en el Centro Experimental de la Universidad Nacional de Colombia - sede Palmira (CEUNP), en el Departamento del Valle del Cauca; área localizada a una altitud de 1.000 m s.n.m.; 2°06’N y 65°03’W; presenta una precipitación anual media de 1.000 mm y temperatura media de 24 °C. Esta zona ha sido clasificada como tropical bosque seco (Holdridge, 2000). El forraje de Pennisetum purpureum y Tithonia diversifolia, se cosecharon en estado de prefloración. El forraje, se secó previamente durante 24 horas; luego, se picó para reducir la partícula tamaño a 2 cm, en un molino de tres palas, 7.5 HP, 1.400 rpm y 4.5 Amperios, marca Gaitán. Una vez que el forraje fue picado por separado para cada especie, se hizo una mezcla manual.
Los ensilajes, se almacenaron durante 90 días. Se mezclaron en cuatro niveles de sustitución de materia fresca, configurando cuatro proporciones de TD/PP, así: 100/0; 67/33; 33/67; 0/100. Cada proporción, se enriqueció con dos aditivos, para evaluar el efecto de inóculo: T735; SIL-ALL®4x4 y un control (sin inóculo). El inoculo T735 es una bacteria aislada de T. diversifolia, correspondiente a Lactobacilus paracasei, obtenido a partir de hojas maceradas, siguiendo el protocolo explicado por Holguín et al. (2018), desarrollado en el Laboratorio de Diagnóstico Veterinario de la Universidad del Tolima. La concentración del inóculo utilizado fue de 30 x 107 UFC mL-1, y SIL-ALL®4x4, que es una mezcla comercial de bacterias del ácido láctico Streptococcus faecium (CNCM I-3236), Lactobacillus plantarum (CNCM I-3235), Pediococcus acidilactici (CNCM I-3237) y Lactobacillus salivarius (CNCM I-3238).
A los 90 días, se hizo un análisis bromatológico de los microsilos (Tabla 1). Se determinó fibra detergente neutra (FDN); fibra detergente ácida (FDA), según el método descrito por Van Soest & Wine (1967); proteína cruda (PC), según el método de Kjeldahl (Nielsen, 1994) y Materia seca (MS) y cenizas, por medio del método de residuo mineral fijo, descritos por la AOAC (1990), verificándose la calidad bromatológica de los sustratos, donde los valores de PC, MS, FDA y FDN son consistentes con las mezclas y el proceso adecuado de fermentación láctica.
Tabla 1 Composición química de los ensilajes a los 90 días de fermentación.

Proporciones: 1: 100/0; 2: 67/33; 3: 33/67; 4: 0/100; MS: materia seca; PC: proteína cruda; FDN: fibra detergente neutro; FDN: fibra detergente ácido.
Estabilidad aeróbica. La prueba de estabilidad aeróbica, se realizó siguiendo los protocolos descritos por Honig (1990). Los tratamientos, se ensilaron en bolsas de polietileno, con una capacidad de 1 kg y se sellaron al vacío por triplicado. Luego, se liofilizaron y se almacenaron a una temperatura de, aproximadamente, 25 °C, durante 90 d.
Para la evaluación en el PEA, los microensilajes fueron monitoreados durante siete días después de la apertura. Se hicieron mediciones de temperatura, el pH y la MS; para ello, los microsilos se abrieron y se introdujeron en recipientes de poliestireno de 60 mm de espesor; cada recipiente estaba equipado con termómetros digitales mínimos interiores y exteriores simples (IN-OUT THERMO, infactory, precisión de 0,5 y 0,1 °C, respectivamente), para monitorear la temperatura del ambiente y de los sustratos de forma simultánea. Una desinfección con alcohol del sensor fue realizada después de cada medida. La temperatura, se monitoreo en tres ocasiones durante el día, a las 8, 12 y 16 horas, durante todo el PEA de siete días consecutivos. El pH y la MS fueron medidos al momento de la apertura y a los siete días. La determinación del pH, se hizo con un equipo marca Mettler-Toledo, modelo SG8, serie: B 337764747. La MS, se determinó mediante una estufa PresitionTM, a 63 °C, durante 72 h.
Diseño experimental y análisis estadístico. Se usó un diseño experimental factorial (Tabla 2); el primer factor fue el nivel de inclusión en la mezcla TD/PP y el segundo, el inoculante (ecuación 1).
Donde:
Y = es la variable objetivo
μ es el promedio general
I = inoculante
TD/PP = proporción de T. diversifolia/ P. purpureum en el ensilaje
ε = error experimental aleatorio
Se realizó una comparación estadística entre el día en que se abrió el silo y a los siete días después de abierto. Se usó medidas repetidas, siguiendo la subrutina "Estimación de modelos lineales generales y mixtos", asumiendo variaciones heterogéneas, mediante el software estadístico Infostat (Di Rienzo et al. 2008). Las diferencias estadísticas, se detectaron mediante comparaciones de medias de Tukey (p <0,05).
RESULTADOS Y DISCUSIÓN
Las características químicas de los ensilajes a los 90 días mostraron una tendencia lógica en función de las proporciones TD/PP. La MS, se redujo a medida que se aumenta el nivel de inclusión de PP, siendo más bajos los valores en los ensilajes que contienen PP al 100 % (p <0,05); no se presentó efecto del inoculo (p valor 0,2181). Los valores de PC fueron más altos en los ensilajes que contienen TD al 100 %; cabe señalar que, en este nivel de inclusión, la adición de inóculo no presentó ningún efecto favorable. A medida que se incrementa el nivel de inclusión de PP la proporción de FDN y FDA se incrementa, dada la composición química de las plantas C4 de poseer una pared celular mucho más gruesa respecto a las asteráceas. Con base en estas características del ensilaje, se hicieron los análisis de resistencia aeróbica a los 7 días de abiertos los microsilos.
Variación de la temperatura. No se presentaron diferencias significativas (p >0,05) en el efecto de los inóculos ni en la interacción tratamiento-inóculo, por lo cual, se realiza el análisis de factores individuales. La figura 1 muestra que la temperatura del sustrato disminuye durante las primeras 24 horas y luego aumenta después del tercer día de exposición aeróbica (PEA), en las cuatro proporciones de TD/PP. La diferencia con respecto a la temperatura ambiente, alcanzado en los siete días posteriores a la apertura del silo en las cuatro proporciones, es evidente, principalmente, el aumento térmico de la proporción 4. En esta mezcla, se dio un aumento importante en la temperatura registrada en los primeros dos días de exposición aeróbica, posiblemente, debido a la baja capacidad búfer de la gramínea, que no amortiguó el rápido incremento del pH y como consecuencia una proliferación de microrganismos patógenos, que incrementan la respiración y, por tanto, el aumento de calor (Borreani et al. 2018).

Figura 1 Temperatura ambiente y del ensilaje en el periodo de exposición aeróbica de la mezcla Tithonia diversifolia/Pennisetum purpureum. a. 1: 100/0; b. 2: 67/33; c. 3: 33/67; d. 4: 0/100.
En términos generales, la temperatura del sustrato alcanza una expresión máxima entre los días 4 y 5 del PEA y luego decae, estabilizándose alrededor de 27 °C. El pico de alta temperatura alcanzado en la proporción 4 es sobresaliente, después de dos días del PEA, lo que sugiere una mayor intensidad en la actividad microbiana en este tratamiento; posiblemente, esto esté relacionado con un aumento del pH, lo que hace que el ambiente sea más propicio para la actividad de los organismos aeróbicos.
La separación de las medias, en cada uno de estos días, indica que existen diferencias significativas entre las proporciones (p <0,05), con un aumento evidente en la 4 (Figura 2).

Figura 2 Variación térmica en el período de exposición aeróbica de los ensilajes de la mezcla Tithonia diversifolia/Pennisetum purpureum.
Pese a que las proporciones con mayor proporción de T. diversifolia (1 y 2) son las que en el proceso de fermentación tienen mayor dificultad de bajar el pH, presentando los valores más altos al momento de apertura, fueron las que presentaron una mayor estabilidad aeróbica. La menor diferencia de temperatura respecto al ambiente está relacionada con la menor actividad microbiana, dada la capacidad buffer de T. diversifolia, que inhibe el incremento de pH, una vez se abre el silo, manteniendo un ambiente ácido más estable y, por tanto, restringiendo la proliferación de microorganismos no deseables.
El efecto tampón de las materias primas está relacionado directamente con el contenido de proteína. En general, las fuentes de proteína tienen una alta capacidad tampón, dado que su reacción selectiva con otra sustancia puede aumentar la unión de protones (Otthuis et al. 1994). Esto se explica, porque las moléculas nitrogenadas (aminoácidos y proteínas) presentes en los tejidos son electrolitos anfóteros, por lo cual, pueden ceder o captar protones y, dependiendo del pH, se pueden desempeñar al mismo como ácido o como base. En un medio muy básico se cargan negativamente, mientras que, en el fuertemente ácido, lo hacen positivamente. En ese orden, los componentes intracelulares de origen proteico, con sus substancias ionizables a diferentes valores de pH, aportan de manera el intercambio de H+ con iones unidos a proteínas, mantenimiento el pH; éstos, normalmente, se mueven desde el exterior de las células, contribuyendo a mantener la neutralidad en el medio.
En cuanto a la temperatura del ensilaje con respecto al ambiente, los datos muestran una estabilidad a la exposición aeróbica, evidenciado en que el mayor incremento térmico, entre 3 y 5 °C con respecto a la temperatura ambiente, se mantiene por un periodo menor a tres días consecutivos. Mendieta-Araica et al. (2009) sugieren que, cuando la temperatura del ensilaje sobrepasa estos umbrales por encima de la temperatura ambiente y se mantiene durante más del periodo indicado, el sustrato se considera como aeróbicamente inestable y el deterioro es esperado. Esto puede ser explicado con la proliferación de levaduras que actúan sobre el lactato y oxidan los ácidos láctico y acético y carbohidratos solubles en agua, produciendo CO2 y agua, con el incremento de calor (Navas & Morales, 2016).
pH y materia seca en el periodo de exposición aeróbica. Los resultados de la MS y el pH determinado en la apertura y después de la prueba de estabilidad aeróbica a los 7 días, se muestran en la tabla 3.
Tabla 3 Variación de la MS en el período de exposición aeróbica de los ensilajes de Penisetum purpureum en mezcla con Tithonia diversifolia.

Letras iguales no son significativamente diferentes (p >0,05).
Respecto a los valores de MS, tanto en la apertura del ensilaje a los 90 días como después del PEA, se registraron diferencias significativas en la prueba de medias (p <0,05), entre los niveles de sustitución, con una tendencia a aumentar la MS en los tratamientos, con una mayor proporción de TD. A su vez, los cambios en la MS después del período de exposición aeróbica (PEA), en comparación con la apertura a los 90 días, no fue significativo. Estos resultados, se constituyen en atípicos; Honig & Woolford (1980) informan sobre pérdidas de MS y nutrientes que pueden oscilar entre 1,5 y 4,5 % diariamente, después de la exposición a condiciones aeróbicas, incluso, Borreani et al. 2018 y Bernardes et al. (2012), mencionan que las pérdidas se pueden incrementar hasta el 20 % del total de MS almacenada de ensilajes agrícolas, tanto en clima templado como en climas cálidos.
Por el contrario, el estudio de Gerlacha et al. (2014) presenta resultados con una ligera concentración del material sólido después de la exposición a condiciones aeróbicas, cambiando del 29 al 29,8 %, en un PEA, de 7 días. Los valores de la MS medidos son más bajos que los reportados por otros autores en ensilajes de pastos y otras especies, como asteráceas y fabáceas; por ejemplo, Ávila et al. (2009) y Jones et al. (2004) informaron un 41,8 y 28,8 % de MS, respectivamente, en ensilajes de sorgo; esto demuestra que las condiciones del ambiente de ensilaje, expresadas en temperatura y pH, pueden ser determinantes en la conservación de nutrientes en el proceso de ensilaje; así un medio ácido y bajas temperaturas, significa eficiente fermentación, limitará la proliferación de microorganismos indeseables y reducirá las proteólisis y consumo de materia seca, mientras que un ambiente inadecuado, se reflejará en pérdida de nutrientes y, por tanto, de materia seca (Borreani et al. 2018).
Ensilajes con bajo contenido de MS presenta fermentación indeseable, además, que los efluentes pueden causar focos de contaminación; así, cuando presenta valores menores a 30 %, se inducen fermentaciones prolongadas, debido a su mayor capacidad búfer; sin embargo, en el presente estudio, los tratamientos registraron porcentajes de MS menores a esta cifra sin pérdidas, ni deterioro de sus propiedades.
Cabe advertir que, cuando ocurren procesos respiratorios dentro de un silo, la humedad puede aumentar, produciéndose los lixiviados y disminuir la MS, a través del tiempo de fermentación, constituyendo en uno de los indicadores de deterioro aeróbico, ya que puede oxidar el lactato y el acetato produciendo CO2 y agua (Oude et al. 1999).
Con relación al pH, al momento de la apertura de los microsilos (Tabla 4), se registran diferencias entre las cuatro proporciones (p <0,0001) y entre los aditivos de BAL (p <0,0001), pero no hubo diferencias en la interacción (p= 0,0802). En todas las proporciones, los ensilajes inoculados con la cepa T-735 fueron los que presentaron el pH más bajo, seguidos de los sustratos enriquecidos con SIL-ALL®4x4; el ensilaje sin inóculo registró el pH promedio más alto (p <0,05). Martens et al. (2014) demostraron que el uso de carbohidratos en combinación con cepas de bacterias ácidas podría mejorar la fermentación de forrajes tropicales; así, la combinación de lactobacillus y la sacarosa, generalmente, incrementan la tasa de reducción del pH, en la mayoría de las gramíneas (Hoedtke & Zeyner, 2011).
Tabla 4 Variación del pH en el período de exposición aeróbica de los ensilajes de la mezcla Tithonia diversifolia / Pennisetum purpureum enriquecida con o sin inóculo de lactobacillus (T-735 y Sil-all ©4x4).
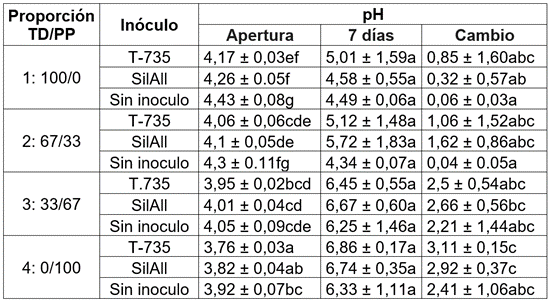
Letras iguales no son significativamente diferentes (p >0,05).
El análisis de diferencia de medias para la variable de pH indica significancia entre las proporciones al momento de la apertura del silo; igualmente, en los valores de cambio de pH en el PEA, al día siete. La prueba de Tukey (p <0,05) indica diferencias estadísticas entre proporciones, pero no hubo efecto de inóculo (p=0,0986) ni en la interacción (p=0,8602).
En el PEA, los datos confirman que el pH aumenta a medida que se incrementa la proporción de PP en la mezcla. Ensilajes con alta proporción de PP, como en general sucede con altos contenidos de gramíneas en el sustrato ensilable, tienen una baja capacidad búfer, que resulta en rápido incremento de la acidez en el PEA.
En el momento de la apertura de los silos es evidente que la mayor proporción de la gramínea (PP) en la mezcla, probablemente, restringe la capacidad búfer de T. diversifolia, lo que explica los valores de pH más bajos en las mezclas, con un mayor porcentaje de inclusión de P. purpureum (Proporciones 3 y 4) y, por el contrario, los ensilajes con mayor proporción de TD, presentaron los valores más altos de pH (1 y 2); sin embargo, después de la prueba de estabilidad aeróbica, a los siete días, el pH obtenido, mostró diferencias respecto a los valores al momento de la apertura, con una variación significativa (p <0,05), especialmente, en la proporción 4. Solo para la proporción 1, no se presentó diferencia (p=0,1366), lo cual, indica una mayor estabilidad en el sustrato de TD, al 100 %.
Así, el papel de la TD es evidente como amortiguadora del cambio de pH, ya que su alta capacidad búfer tiene un efecto estabilizador en el del medio ácido, una vez que se abre el silo. Autores, como Holguín et al. (2018) y Kung Jr. et al. (2018) han demostrado que la capacidad buffer es alta para alimentos ricos en proteínas, mientras que es baja para alimentos energéticos y las gramíneas.
Por otra parte, la relación carbohidratos solubles en agua/capacidad buffer (CSA/BC) de TD, indica su baja idoneidad para el ensilado en comparación con PP, o su alta proporción en la mezcla, que tiene una mejor relación CSA/BC; Heinritz et al. (2012) afirman que, entre mayor sea esta relación, mayor será la ensilabilidad y, por tanto, la estabilidad del ambiente ácido. Este hallazgo ayuda a explicar por qué los valores de pH son más bajos en mezclas con un mayor porcentaje de PP, pues la CB más baja de las gramíneas hace que el ambiente ácido se torne más bajo y en menos tiempo.
Se resalta, como puntos relevantes de este estudio, que la variación de la temperatura en el PEA no superó los 3 °C durante más de tres días, lo que confirma la estabilidad aeróbica del ensilaje.
El efecto de TD en la estabilidad aeróbica del ensilaje es positivo, dada su capacidad búfer al evitar un incremento de pH, una vez que se abre el silo. Por lo tanto, la mayor estabilidad aeróbica se produce en los ensilajes, con una mayor proporción de TD (proporciones 1 y 2), que en aquellos con una mayor proporción de PP (3 y 4). De acuerdo con los resultados, la mejor proporción es 1:100/0; sin embargo, desde el punto de vista zootécnico, sería más recomendable usar un ensilaje de una mezcla de una fuente de proteína y una fuente energética fibrosa, para así mantener una relación proteína/energía adecuada y evitar problemas metabólicos.

















