Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.10 no.4 Bogotá Oct./Dec. 2006
REVISIÓN DE TEMA
Infecciones micóticas oportunistas en pacientes con VIH/SIDA Fungal opportunistic infections in HIV/AIDS patients
ÁNGEL GONZÁLEZ 1,2 ÁNGELA M ARÍA TOBÓN 1,3
1Grupo de Micología Médica y Experimental, Corporación para Investigaciones Biológicas (CIB);
2 Escuela de Bacteriología y Laboratorio Clínico, Universidad de Antioquia; Medellín, Colombia
3 Hospital La María, Medellín, Colombia.
Fecha de recepción: 08/11/2006; fecha de aceptación; 17/11/2006
Resumen
Hace 25 años se describieron los primeros casos de la infección por el virus de la inmunodeficiencia humana (VIH) y el desarrollo del síndrome de inmunodeficiencia adquirida (sida). Las primeras manifestaciones que fueron consideradas como marcadoras de sida eran la aparición de infecciones oportunistas producidas por microorganismos, generalmente, considerados no patógenos para el humano. Dentro de este grupo de infecciones oportunistas se encontraban los hongos, principalmente, Pneumocystis jirovecii (antes P. carinii), Candida albicans, Cryptococcus neoformans e Histoplasma capsulatum. Actualmente, a pesar de la introducción de la terapia antirretroviral altamente efectiva (highly active anti-retroviral therapy, HAART) y al desarrollo de nuevos procedimientos y técnicas diagnósticas, continúan las altas tasas de morbilidad y mortalidad en los países con recursos limitados, debido al acceso limitado que tienen los pacientes a estos avances. En esta revisión nos enfocamos en la descripción de algunos aspectos clínicos y en el desarrollo de avances diagnósticos para las principales infecciones micóticas oportunistas en pacientes con VIH/sida.
Palabras clave: VIH, sida, infecciones oportunistas, infecciones micóticas
Abstract
Twenty-five years ago the first cases of infection by the human immunodeficiency virus (HIV) and the development of the acquired immunodeficiency syndrome (AIDS) were described. The first manifestations that were considered as markers of the latter process were the opportunistic infections produced generally by microorganism considered non-pathogens for humans. Among such opportunistic infections the fungi were prominent. Pneumocystis jirovecii (earlier P. carinii), Candida albicans, Cryptococcus neoformans and Histoplasma capsulatum were often found. Nowadays and despite of the introduction of highly active antiretroviral therapy (HAART) and the development of new proceedings and diagnostic techniques, HIV infection continues to exhibit high morbidity and mortality rates in countries with low economic resources due to the patients limited access to such advances. This review focuses on clinical aspects and new diagnostic advances concerning opportunistic fungal infections in patients that live with the HIV-AIDS.
Key words: HIV, AIDS, opportunistic infections, fungal infections.
INTRODUCCIÓN
A pesar de los avances en el diagnóstico y el tratamiento, el estado epidemiológico de la infección por el virus de la inmunodeficiencia humana (VIH) y el desarrollo del síndrome de inmunodeficiencia adquirida (sida), el control de la infección es difícil en muchos de los países del tercer mundo (1).
El impacto del VIH/sida es diferente en los países desarrollados y aquéllos con escasos recursos, incluida Colombia. Algunas de las razones son el acceso limitado a los servicios de salud, la poca infraestructura para un diagnóstico rápido y oportuno, y el alto costo de la terapia antirretroviral altamente efectiva; debido a ello, la morbimortalidad de esta infección continúa en aumento (2).
En personas infectadas con el VIH, la permanente replicación viral produce una disminución de la inmunidad mediada por células, lo cual da origen a diversas manifestaciones por la presencia de infecciones oportunistas y permite el paso al estadio más avanzado de la enfermedad, el sida.
Antes de la introducción de la terapia antirretroviral altamente efectiva, los pacientes con diagnóstico de infección oportunista presentaban una mortalidad temprana (6 a 24 meses). En los años 90 fue claro que la terapia antirretroviral y la profilaxis contra algunos oportunistas, como Pneumocystis jirovecii y el complejo Mycobacterium avium, prolongaron el tiempo del paso a sida, disminuyeron la incidencia de infecciones oportunistas y mejoraron la supervivencia de estos pacientes (3). Sin embargo, la baja disponibilidad de estos fármacos en los países en desarrollo permite que las infecciones oportunistas continúen presentes. Entre las más frecuentes producidas por hongos encontramos: la neumonía por P. jirovecii, la candidiasis oroesofágica, la criptococosis extrapulmonar y la histoplasmosis.
La probabilidad de que un paciente infectado con el VIH desarrolle una infección oportunista depende de tres factores:
1. el estado de inmunocompromiso, representado por el recuento de células CD4;
2. la xposición al patógeno potencial, y
3. la relativa virulencia del patógeno potencial en relación con el estado inmune del paciente.
El uso de la terapia antirretroviral combinada y la introducción de inhibidores de proteasas en 1995 y 1996, han conducido, en los Estados Unidos, a un drástico cambio en la historia natural de la infección por VIH tratada, con una disminución en la mortalidad de 29,4 muertes por 100 personas/año en 1995, a 8,8 en 1997.
Esta disminución en la mortalidad estuvo acompañada por una importante disminución en la incidencia de infecciones oportunistas (4).
Por ello, se hace necesario administrar la terapia antirretroviral oportunamente y diagnosticar en forma temprana las infecciones oportunistas, con el fin de iniciar las terapias específicas que ayuden a disminuir la morbimortalidad de los pacientes con VIH.
NEUMONÍA POR PNEUMOCYSTIS JIROVECII
La neumonía por P. jirovecci es causada por el hongo P. jirovecii (antes P. carinii). Es la infección pulmonar oportunista más frecuente en pacientes con sida, con una mortalidad que varía entre 10% y 30% (5, 6).
En países con amplia utilización de la terapia antirretroviral altamente efectiva, su incidencia ha declinado desde el inicio de los años 90, pero permanece como la infección oportunista centinela en pacientes que desconocen su estado de infección por VIH, aquéllos infectados pero que no reciben cuidado y en quienes ha fracasado la terapia antiviral.
Como enfermedad marcadora del paso a sida, en Estados Unidos ha descendido del 50% en 1988, al 39% en 1996, por el uso de la terapia antirretroviral altamente efectiva y de la profilaxis primaria (5-9). Sin embargo, a pesar de la disminución en su incidencia, la mortalidad hospitalaria continúa siendo alta, debido a que ahora se presenta en pacientes gravemente inmunocomprometidos y con factores de riesgo adicionales que determinan un peor pronóstico, como son: edad avanzada, infección concomitante con Citomegalovirus, CD4 inferior a 50 células/mm 3 y ausencia de profilaxis con trimetoprim sulfametosaxol (10, 11).
Frecuentemente, el desarrollo de esta micosis se asocia con un conteo de linfocitos CD4+ inferior a 200 células/mm 3 y se acompaña de fiebre, disnea y tos no productiva. En forma característica, las radiografías de tórax muestran infiltrados intersticiales bilaterales difusos (figura 1), pero pueden ser normales en el 10% (12, 13).
En varios estudios se han identificado algunos factores que reflejan la gravedad de la enfermedad y predicen un pobre resultado clínico con la terapia, como son: disminución de la oxigenación alveolar, con gradiente alvéolo-arterial de O2 inferior a 30 mm Hg, compromiso pulmonar extenso bilateral, presencia de otra enfermedad pulmonar intercurrente, incremento de los niveles séricos de la enzima lactatodeshidrogenasa (LDH), elevación de neutrófilos en el lavado broncoalveolar (LBA) y enfermedad recurrente más que primaria (14-19).
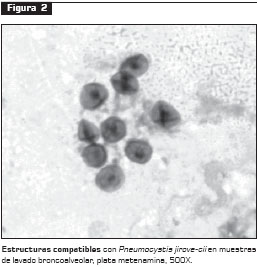
Debido a que P. jirovecii no se puede cultivar, el diagnóstico por el laboratorio se basa en la observación directa del microorganismo en muestras respiratorias, obtenidas por esputo inducido o por lavado broncoalveolar, utilizando coloraciones especiales como Giemsa, azul de toluidina o plata metenamina (figura 2), o mediante técnicas de fluorescencia, como calcoflúor blanco y anticuerpos monoclonales o policlonales específicos que mejoran la sensibilidad (20, 21). La sensibilidad de estas técnicas varía entre 35% y 92%, según la muestra clínica utilizada (22).
La detección de niveles de anticuerpos no es concluyente y no tiene la capacidad de diferenciar entre infección reciente y pasada (23). Recientemente, Daly et al. (24) estudiaron tres fragmentos glucoproteicos de P. jirovecii y, utilizando la técnica de ELISA, encontraron que pacientes VIH positivos con neumonía por P. jirovecci presentaban títulos de anticuerpos significativamente más elevados que los individuos sanos.
El diagnóstico molecular de neumonía por P. jirovecci se basa en la amplificación de secuencias de ADN utilizando la reacción en cadena de la polimerasa (PCR). Entre los genes blanco utilizados se encuentran: la subunidad grande y la subunidad pequeña del ARN mitocondrial, regiones ITS (del inglés, internal transcribed spacer) y la enzima timidilato sintasa, entre otros. La sensibilidad de la PCR varía entre 30% y 100%, de acuerdo con la técnica, la muestra y el gen analizado (21, 22). Una de las principales desventajas de esta técnica es la incapacidad de diferenciar entre una neumonía por P. jirovecci activa y una colonización.
Actualmente, la prueba de PCR se realiza en la Corporación para Investigaciones Biológicas (CIB), Medellín, Colombia. En estudios realizados por el Grupo de Micología Médica y Experimental de la CIB, se ha observado una sensibilidad y una especificidad de 86% y 98%, respectivamente (datos sin publicarse).
P. jirovecii no es sensible a los medicamentos antifúngicos comúnmente utilizados; sin embargo, es sensible a antibióticos convencionales. El tratamiento de elección es trimetoprim sulfametosaxol, el cual actúa inhibiendo la síntesis del ácido fólico. Otros medicamentos efectivos contra Pneumocystis son trimetrexato, pentamidina, clindamicina, primaquina, dapsona y atavacuona. Debe realizarse profilaxis primaria con trimetoprim sulfametosaxol en todos los pacientes con infección por VIH con un recuento de células CD4 inferior a 200/mm 3; y profilaxis secundaria, luego de la enfermedad, hasta que los linfocitos CD4 superen las 200 células (25).
CANDIDIASIS
El término candidiasis comprende una amplia vari edad de cuadros clínicos que tienen en común ser ocasionados por levaduras del género Candida. Se trata de la micosis oportunista de mayor importancia en el hospedero con compromiso del sistema inmune, especialmente en individuos positivos para VIH, en los cuales se presenta hasta en 90% durante el curso de la enfermedad (26, 27).
De las muchas especies que se agrupan en el género Candida, C. albicans es el agente etiológico de mayor frecuencia; sin embargo, especies diferentes, como C. krusei, C. parapsilopsis, C. tropicalis, C. glabrata, C. keffir y C. guillermondi entre otras, son ahora reconocidas como patógenos importantes en pacientes inmunocomprometidos (28) .
La candidiasis mucocutánea es probablemente una de las manifestaciones más comunes en los pacientes VIH positivos con recuentos de CD4 inferiores a 300 células/mm3; la candidiasis esofágica es una de las entidades definitorias de sida y una de las infecciones oportunistas más ampliamente reportadas en la literatura (2). Se presenta como placas blanquecinas que se pueden remover con el bajalenguas y se localizan, principalmente, en el dorso de la lengua, el paladar blando, las amígdalas y la mucosa oral. También pueden encontrarse placas eritematosas sin el característico exudado. Puede extenderse a hipofaringe y comprometer el esófago, ocasionando disfagia importante la cual empeora el estado de malnutrición. Pueden presentarse, además, queilitis angular, gingivitis y glositis. Se han reportado manifestaciones menos frecuentes, como lesiones cutáneas generalizadas no ulcerativas, candidiasis diseminada y lesiones perineales, en las cuales C. albicans es el agente causal más frecuente (2, 29). Además, C. dubliniensis es otra de las especies importantes implicada en la candidiasis esofágica (30).
A pesar de que la introducción de la terapia antirretroviral altamente efectiva ha tenido un importante impacto en la disminución de la incidencia de la candidiasis esofágica, muchos de los pacientes que reciben la terapia antirretroviral continúan siendo colonizados por Candida spp ., pero no desarrollan la candidiasis clínicamente (31).
Los métodos de identificación para las levaduras de interés clínico se basan en el estudio de las características morfológicas macroscópicas y microscópicas obtenidas en el cultivo, junto con los patrones bioquímicos o genéticos (32).
Candida spp. puede observarse al microscopio como células ovaladas o redondeadas (3 a 7 µm de diámetro), Gram positivas y con un metabolismo principalmente aerobio. Esta levadura es capaz de producir gemación y formar pseudohifas, hifas verdaderas o ambas; además, posee una reproducción asexual por blastoconidias (26, 33). La especie C. albic ans produce tubos germinativos y éste es uno de los principales parámetros para su diferenciación (figura 3). En agar Sabouraud crecen formando colonias blancas, blandas, cremosas y lisas (26).
El tratamiento usualmente se realiza con fluconazol (200 mg al día) y no requiere profilaxis secundaria.
La identificación de la especie es muy importante para la terapia, debido a que la infección puede ser ocasionada por algunas especies con resistencia intrínseca al fluconazol, como C. glabrata y C. krusei. (34). Además, dado el amplio uso de antimicóticos, se vienen presentado con mayor frecuencia infecciones causadas por hongos resistentes a éstos. La historia de terapia antimicótica previa de larga duración y recuentos bajos de CD4 se han reconocido como factores de riesgo para candidiasis resistente a fluconazol (35).
CRIPTOCOCOSIS
Cryptococcus neoformans es el agente causal de la criptococosis, la segunda infección micótica oportunista en pacientes con sida (36). Existen dos variedades: C. neoformans var. neoformans que, a su vez, se dividen en los serotipos A, D y AD, los cuales causan la enfermedad en pacientes con alteración del sistema inmune, especialmente en individuos con infección por VIH. La otra variedad es el C. neoformans var. gatti que, a su vez, se divide en los serotipos B y C, que causan enfermedad en hospederos con sistema inmune competente (36, 37). Franzot et al. (38) han propuesto la reclasificación del serotipo A en una nueva especie: grubii. La identificación de la variedad o el serotipo de los aislamientos de Cryptococcus es importante para la instauración de la terapia. La mayoría de los aislamientos en pacientes VIH positivos son serotipo A (serovariedad grubii) (2).
En 1992, durante el pico de la epidemia del sida en los Estados Unidos, se presentaban cinco casos de criptococosis por 100.000 personas/año. Actualmente, con el amplio uso de terapia antirretroviral altamente efectiva, se presenta un caso por 100.000 personas/año. Infortunadamente, esta situación no se da en países en desarrollo, especialmente en África, donde la prevalencia de criptococosis alcanza a 15% a 45% de la población con VIH. De esta forma, la criptococosis representa en la actualidad una infección que identifica la desventaja de un paciente al no ser diagnosticado y no recibir terapia oportuna para la infección por VIH, es decir, identifica el grupo de pacientes con VIH que tienen menos acceso a la atención médica (39).
La meningoencefalitis o meningitis crónica es la forma más común de presentación clínica de esta micosis; cerca de 70% a 90% de los pacientes con sida y criptococosis del sistema nervioso central presentan cefalea, fiebre, trastornos visuales, alteración del estado de conciencia y, en algunos casos, pérdida de la memoria (2 a 4 semanas antes del diagnóstico) (37). La cefalea es la segunda causa de dolor en pacientes con sida y la criptococosis del sistema nervioso central es responsable del 40% de este síntoma (37).
El factor de predicción más importante de muerte temprana es el estado mental del paciente al momento del diagnóstico; sin embargo, se pueden asociar otros factores, entre los que se encuentran: títulos de antígenos polisacáridos de la cápsula (AgPC) en líquido cefalorraquídeo superiores a 1.024, recuento de células en líquido cefalorraquídeo inferior a 20/mm3 y edad inferior a 35 años. El compromiso de otro órgano diferente al sistema nervioso central, la presencia de hipernatremia y un alto número de células fúngicas en el tejido, también son parámetros asociados a un pobre pronóstico (40).
En la diseminación del hongo puede comprometerse también el pulmón, lo que se manifiesta con fiebre, tos, dolor torácico y, en las radiografías de tórax, con la presencia de infiltrado intersticial bilateral y lesiones nodulares más frecuentemente.
En 15% de los casos puede evidenciarse compromiso de la piel, por la presencia de pápulas umbilicadas diseminadas, similares al molusco contagioso, las cuales pueden ulcerarse.
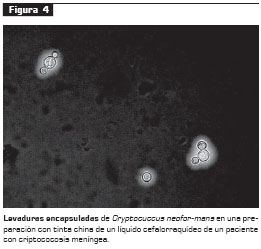
El diagnóstico de la criptococosis se establece por el aislamiento del microorganismo en el cultivo, la histopatología o la detección del AgPC en fluidos corporales. Generalmente, el hongo crece en agar sangre o agar chocolate en los primeros 3 a 5 días de cultivo (41). El cultivo y aislamiento del hongo se considera la prueba de oro; sin embargo, la demostración directa de levaduras encapsuladas en preparaciones utilizando tinta china en el líquido cefalorraquídeo es suficiente para iniciar una terapia antifúngica específica (figura 4) (2). El examen directo con tinta china presenta una sensibilidad de 96,3% en los casos de sida (42).
No obstante, la mejor opción para el diagnóstico de la micosis en términos de alta sensibilidad y rápida obtención de resultados, es la detección del AgPC mediante la prueba de aglutinación con partículas de látex en líquido cefalorraquídeo, suero u orina (37).
La anfotericina B (1 a 2 g como dosis total), con o sin 5-fluocitocina, constituye la droga de elección para el inicio de la terapia, seguida por el fluconazol (200 mg al día) como terapia de mantenimiento crónica en pacientes con sida (37). El itraconazol, a dosis de 200 mg al día, es útil como terapia de mantenimiento para prevenir las recaídas, en pacientes con infección por Cryptococcus resistente al fluconazol (43). El voriconazol y el posaconazol representan nuevos azoles con eficacia contra Cryptococcus.
Antes del uso de la terapia antirretroviral altamente efectiva, la profilaxis con fluconazol en los pacientes con meningitis por Cryptococcus era de por vida (36). Actualmente, gracias a la terapia antirretroviral, la discontinuación de la terapia antifúngica se sugiere en los pacientes que recobran parcialmente la función inmune con un recuento de células CD4 superior a 100/mm3 y carga viral indetectable por un periodo superior a tres meses consecutivos (36). Se recomiendan el seguimiento y el control en este grupo de pacientes, debido a que las recaídas son altas, aún después del éxito con la terapia inicial (2).
HISTOPLASMOSIS
Es una micosis sistémica causada por el hongo dimórfico térmico Histoplasma capsulatum. La infección se adquiere por la inhalación de las partículas infectantes (conidias), las cuales, una vez llegan al pulmón que se considera el órgano blanco, son fagocitadas por los macrófagos alveolares, donde se transforman en su forma de levadura y desarrollan la enfermedad (44, 45). La presentación clínica de esta micosis depende del número de conidias inhaladas y del estado inmune del hospedero, y van desde una infección pulmonar localizada autolimitada (asintomática) hasta una forma diseminada aguda fatal, la cual es particularmente peligrosa en individuos inmunosuprimidos, especialmente, aquéllos con sida (44, 45).
H. capsulatum presenta una amplia distribución mundial con áreas endémicas reconocidas en el este de los Estados Unidos y algunas regiones de Suramérica. El reservorio ambiental para H. capsulatum es el suelo contaminado con heces de aves y murciélagos (45).
La epidemia del sida ha presentado un efecto significativo en la epidemiología de la histoplasmosis en las áreas de alta endemicidad. Sin embargo, la incidencia de la enfermedad en estos individuos ha disminuido notablemente con terapia antirretroviral altamente efectiva. Así, la mayoría de los casos de histoplasmosis en pacientes con sida se presentan en aquéllos que no reciben la terapia antirretroviral y, en muchos de los casos, la histoplasmosis define el sida (45).
La enfermedad puede presentarse como consecuencia de una infección aguda o por reactivación de una infección previa.
Las manifestaciones clínicas son variadas y dependen de la forma clínica de la enfermedad. En los pacientes con sida, se presenta la forma diseminada de la infección, con un curso clínico agudo generalmente fatal y, más frecuentemente, un curso indolente con grave compromiso del estado general.
Entre las manifestaciones clínicas más frecuentes están fiebre, pérdida de peso, anorexia, diarrea o vómito, hepatoesplenomegalia, adenopatías y lesiones en piel de tipo úlcero-costrosas, acompañadas en ocasiones por síntomas respiratorios, como tos, expectoración y disnea (1, 45). Es frecuente encontrar pancitopenia o bicitopenia como consecuencia del compromiso medular por el hongo y alteración de las enzimas hepáticas.
El diagnóstico de la histoplasmosis incluye diversas pruebas de laboratorio, tales como: a) cultivo y aislamiento del hongo; b) coloraciones especiales de tejidos o fluidos corporales; c) pruebas serológicas para la identificación de anticuerpos o antígenos; y d) amplificación de ADN de muestras de tejido o de cultivos (46, 47).
La utilidad de cada una de estas pruebas de laboratorio varía con la forma clínica y la gravedad de la infección (tabla 1)
El cultivo se considera la prueba de oro, pero presenta ciertas limitaciones, a saber: i) los cultivos pueden ser negativos en las formas leves de la infección y, generalmente, son positivos en las formas diseminadas o pulmonares crónicas; sin embargo, en estas formas pueden ser negativos en un 20% y 50%, respectivamente (48-51); ii) el crecimiento de H. capsulatum en cultivo es lento y requiere entre 4 y 6 semanas, lo cual retarda el diagnóstico; iii) generalmente, se requieren procedimientos invasores para obtener muestras para el cultivo, y iv) el aislamiento del hongo en cultivo en su forma miceliar debe ser verificado para asegurar su identificación (47). La confirmación del hongo en cultivo requiere la conversión de la fase de moho a la fase levadura a 37°C y, en algunos casos, se necesita la demostración de precipitinas por la prueba de exoantígenos o la utilización de sondas de ADN (47).
Las pruebas serológicas para la detección de anticuerpos proporcionan las bases para el diagnóstico en pacientes con infección moderada y estado inmune conservado. Sin embargo, los anticuerpos requieren, por lo menos, un mes para aparecer después de la exposición inicial, lo cual reduce su utilidad en pacientes con histoplasmosis pulmonar aguda. Además, con frecuencia, la detección de anticuerpos es negativa en pacientes con enfermedad diseminada, debido a la inmunosupresión, especialmente en pacientes con sida, quienes presentan una disminución en la producción de anticuerpos (47). Las pruebas comúnmente utilizadas para la detección de anticuerpos son la fijación del complemento y la inmunodifusión en gel agar. La prueba de fijación del complemento se considera positiva con títulos superiores o iguales a 1:32; sin embargo, en pacientes con sida, títulos de anticuerpos 1:8 deben tenerse en cuenta en el diagnóstico (46). Con la prueba de inmunodifusión se detectan bandas de precipitina denominadas H y M. La banda H indica una infección activa y la banda M indica exposición previa al hongo (47).
Las coloraciones especiales más utilizadas para detectar la presencia del hongo en muestras de tejido o fluidos corporales son: plata metenamina, Wright, ácido peryódico de Schiff y Giemsa, entre otras (figura 5).
La detección de antígenos se realiza en muestras de fluidos corporales como orina (antigenuria), suero (antigenemia) y líquido cafalorraquídeo utilizando técnicas como la ELISA y el radioinmunoensayo. Los antígenos son detectables hasta en 90% de los pacientes con histoplasmosis diseminada, 40% en enfermedad cavitaria y 20% en histoplasmosis pulmonar aguda. Sin embargo, es importante tener en cuenta que se pueden presentar resultados falsos positivos por reactividad cruzada con otros hongos dimórficos como Blastomyces dermatitidis, Paracoccidioides brasiliensis y Penicillium marneffei; además, no se encuentran disponibles en nuestro medio (46, 47).
El diagnóstico molecular se basa en la detección de ADN de H. capsulatum a partir de cultivos utilizando sondas comerciales. Además, las técnicas de PCR para la detección del hongo en muestras clínicas son otra posibilidad para el diagnóstico; éstas aún no están disponibles en los laboratorios de rutina. Algunos de los genes blanco utilizados son: los antígenos H y M, una proteína específica de 100 kd, regiones ITS y la subunidad 18S del ARN ribosómico (47, 52-54).
En Colombia, las pruebas disponibles para el diagnóstico de histoplasmosis incluyen el cultivo, las coloraciones especiales y las pruebas serológicas como la inmunodifusión y la fijación del complemento. Además, la prueba de PCR anidada para el diagnóstico de esta micosis se realiza en el Laboratorio de Micología Médica y Experimental de la CIB, Medellín, Colombia. Estudios realizados en nuestro laboratorio indican una sensibilidad y una especificidad del 100% (datos sin publicarse).
Los pacientes infectados con el VIH y con histoplasmosis diseminada requieren un tratamiento de inducción para revertir los síntomas clínicos de la enfermedad y disminuir o suprimir la carga fúngica, seguido por una terapia de mantenimiento para prevenir las recaídas (55, 56). En pacientes con enfermedad micótica grave, la anfotericina B constituye la droga de elección para el tratamiento inicial. Se presenta una respuesta clínica después de dos semanas de tratamiento en 88% de los pacientes que reciben anfotericina B liposomal Versus 64% de los pacientes que reciben deoxicolato de anfotericina B (57).
En pacientes con enfermedad moderada y en aquéllos con enfermedad grave luego de mejoría clínica con anfotericina B, el tratamiento con itraconazol (400 mg al día) por 12 semanas es efectivo e induce remisión de la enfermedad en 85% de los casos, basados en la resolución de los signos y síntomas de la micosis, así como también en la negatividad de los cultivos (49). Luego de 12 semanas, el paciente debe continuar con terapia de mantenimiento con itraconazol, 200 mg al día de por vida, para evitar recaídas.
CONCLUSIONES
Uno de los factores de riesgo más importantes asociado al desarrollo de infecciones micóticas oportunistas en pacientes infectados con el VIH, es un recuento de células CD4+ inferior o igual a 200 células/mm 3. La introducción de la terapia antirretroviral altamente efectiva ha llevado a una importante disminución en la morbimortalidad, como también en la incidencia de infecciones oportunistas en estos pacientes (31, 58, 59). Sin embargo, a pesar de los avances en el tratamiento de la infección por el VIH, el diagnóstico y el desarrollo terapéutico, las infecciones oportunistas permanecen como una importante causa de morbimortalidad en aquellos individuos que tienen un acceso limitado a los servicios de salud, a la terapia antirretroviral altamente efectiva o a los fármacos quimioprofilácticos (2).
Por otro lado, un diagnóstico efectivo depende de un alto índice de sospecha clínica, acompañado de una buena práctica de laboratorio. La ausencia de signos y síntomas sugestivos de una infección en particular en estos pacientes, a menudo hace difícil realizar un diagnóstico certero, principalmente en los estadios tempranos de la infección, lo cual interfiere con el adecuado manejo de los pacientes infectados (2). Así, un diagnóstico erróneo tiene importantes implicaciones en términos de costos, efectos adversos a drogas, morbilidad y mortalidad.
Por otro lado, el diagnóstico de las infecciones oportunistas en pacientes de países con escasos recursos está ampliamente basado en los métodos convencionales, tales como la demostración directa del microorganismo, la histopatología y el cultivo, lo cual conlleva a una demora innecesaria en el diagnóstico. Muchos factores infieren en el proceso diagnóstico, como son el estadio o la forma clínica de la enfermedad, la recolección apropiada de la muestra clínica, el procesamiento y las técnicas utilizadas en el laboratorio. Es por esto que, en algunos casos, para el diagnóstico definitivo de una infección oportunista, el aislamiento repetido del microorganismo del mismo sitio, o el mismo microorganismo de múltiples sitios (según la presentación clínica de la enfermedad), es esencial para diferenciar entre un estado de colonización y una enfermedad activa (2).
Finalmente, el cumplimiento de los protocolos clínicos estandarizados para evidenciar algunas de las infecciones oportunistas, tales como: " probado o documentado", " posible" y " probable", son necesarios para el diagnóstico de algunos agentes infecciosos inusuales (2).
HACIA EL FUTURO
Las técnicas biomoleculares para el diagnóstico de las infecciones oportunistas, como en el caso de la neumonía por P. jirovecii, a través de la utilización de muestras tomadas por procedimientos no invasores, son vistas como herramientas promisorias para la detección temprana de este microorganismo, especialmente en aquellos pacientes que no se encuentran en condiciones para practicarles procedimientos invasores.
El avance en las técnicas moleculares de diagnóstico ha permitido mejorar la detección temprana de algunas infecciones oportunistas; tal es el caso de la PCR en tiempo real, una técnica rápida, altamente sensible y específica como la PCR convencional, que además, cuantifica el número de copias de ARN de un microorganismo lo cual permite la diferenciación entre una colonización (estado de portador) y una infección activa (enfermedad) en la mayoría de los casos.
Además, estas herramientas moleculares permitirán establecer la presencia de mutaciones en genes que confieren resistencia a ciertos antifúngicos; de igual manera, se hará necesario implementar las pruebas de susceptibilidad antifúngica como procesos rutinarios de laboratorio, debido al aumento en la resistencia de algunos microorganismos oportunistas a los antifúngicos más comúnmente utilizados, principalmente, en el caso de Candida spp. y C. neoformans.
Correpondencia: Ángel González, Corporación para Investigaciones Biológicas (CIB); Carrera 72A Nº 78 B 141, Medellín, Colombia. Teléfono: 441 08 55; Fax: 441 55 14 agonzalezm@cib.org.co
Correpondencia: Ángel González, Corporación para Investigaciones Biológicas (CIB); Carrera 72A Nº 78 B 141, Medellín, Colombia. Teléfono: 441 08 55; Fax: 441 55 14
REFERENCIAS
1. Marques SA, Robles AM, Tortorano AM, Tuculet MA, Negroni R, Mendes RP. Mycoses associated with AIDS in the Third World. Med Mycol. 2000;38:S269-79. [ Links ]
2. Banerjee U. Progress in diagnosis of opportunistic infections in HIV/ AIDS. Indian J Med Res. 2005;121:395-406. [ Links ]
3. Graham NM, Zeger SL, Park LP, Vermund SH, Dtels R, Rinaldo CR, Phair JP. The effects on survival of early treatment of human immunodeficiency virus infection. N Eng J Med. 1992;326:1037-42. [ Links ]
4. Palella FJ, Delaney KM, Moorman AC, Loveless MO, Fuhrer J, Satten GA et al. Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection. N Eng J Med. 1998;338:853-60. [ Links ]
5. McLeod DT, Neill P, Robertson VJ, Latif AS, Emmanuel JC, Els JE, Gwanzura LK et al. Pulmonary diseases in patients infected with the human immunodeficiency virus in Zimbabwe, Central Africa. Trans R Soc Trop Med Hyg. 1989;83:694-7. [ Links ]
6. Levine SJ. Pulmonary complications of HIV. Clin Chest Med. 1996;17:665-95. [ Links ]
7. Pitchenik AE, Ganjei P, Torres A, Evans DA, Rubin E, Baier H. Sputum examination for the diagnosis of pneumonia in the acquired immunodeficiency syndrome. Am Rev Respir Dis. 1986;133:226-9. [ Links ]
8. Colford JM Jr, Segal M, Tabnak F, Chen M, Sun R, Tager I. Temporal trends and factors associated with survival after Pneumocystis carinii pneumonia in California, 1983-1992. Am J Epidemiol. 1997;146:115-27. [ Links ]
9. Nyamande K, Lalloo UG, York D, Naidoo M, Irusen EM, Chetty R. Low sensitivity of a nested polymerase chain reaction in oropharyngeal washings for the diagnosis of pneumocystis pneumonia in HIV-infected patients. Chest. 2005;128:167-71. [ Links ]
10. Jacobson MA, Franch M. Altered natural history of AIDS-related opportunistic infections in the era of potent combination antiretroviral therapy. AIDS. 1998;12:S157-63. [ Links ]
11. Benfield TL, Helweg-Larsen J, Bang D, Junge J, Lundgren JD. Prognostic markers of short-term mortality in AIDS-associated Pneumocystis carinii pneumonia. Chest. 2001;119:844-51. [ Links ]
12. Kovacs JA, Gill VJ, Meshnick S, Masur H. New insights into transmission, diagnosis, and drug treatment of Pneumocystis carinii pneumonia. JAMA. 2001;286:2450-60. [ Links ]
13. Opravil M, Marincek B, Fuchs WA, Weber R, Speich R, Battegay M et al. Shortcomings of chest radiography in detecting Pneumocystis carinii pneumonia. J Acquir Immune Defic Syndr. 1994;7:39-45. [ Links ]
14. Fernández P, Torres A, Miro JM, Vieigas C, Mallolas J, Zamora L et al. Prognostic factors influencing the outcome in Pneumocystis carinii pneumonia in patients with AIDS. Thorax. 1995;50:668-71. [ Links ]
15. Azoulay E, Parrot A, Flahault A, Cesari D, Lecomte I, Roux P et al. AIDS-related Pneumocystis carinii pneumonia in the era of adjunctive steroids: implication of BAL neutrophilia. Am J Respir Crit Care Med. 1999;160:493-9. [ Links ]
16. Kales CP, Murren JR, Torres RA, Crocco JA. Early predictors of inhospital mortality for Pneumocystis carinii pneumonia in the acquired immunodeficiency syndrome. Arch Intern Med. 1987;147:1413-7. [ Links ]
17. Bennett CL, Weinstein RA, Shapiro MF, Kessler HA, Dickinson GM, Peterson B et al. A rapid preadmission method for predicting inpatient course of disease for patients with HIV-related Pneumocystis carinii pneumonia. Am J Respir Crit Care Med. 1994;150:1503-7. [ Links ]
18. Zaman MK, White DA. Serum lactate dehydrogenase levels and Pneumocystis carinii pneumonia. Diagnostic and prognostic significance. Am Rev Respir Dis. 1988;137:796-800. [ Links ]
19. Garay SM, Greene J. Prognostic indicators in the initial presentation of Pneumocystis carinii pneumonia. Chest. 1989;95:769-72. [ Links ]
20. Dei-Cas E, Fleurisse L, Aliouat EM, Bahon-Le Capon J, Cailliez JC, Creusy C. Morphological and ultraestructural methods for Pneumocystis. FEMS Immunol Med Microbiol. 1998;22:185-9. [ Links ]
21. Agostoni F, Atzori C, Angeli E, Mainini A, Micheli V, Cargnel A. Pneumocystis carinii diagnosis: an update. Int J Antimicrob Agents. 2000;16:549-57. [ Links ]
22. Flori P, Bellete B, Durand F, Raberin H, Cazorla C, Hafid J et al. Comparison between real-time PCR, conventional PCR and different staining techniques for diagnosing Pneumocystis jirovecii pneumonia from bronchoalveolar lavage specimens. J Med Microbiol. 2004; 53:603-7. [ Links ]
23. Leigh TR, Millett MJ, Jameson B, Collins JV. Serum titres of Pneumocystis carinii antibody in health care workers caring for patients with AIDS. Thorax. 1993;48:619-21. [ Links ]
24. Daly KR, Koch J, Levin L, Walzer PD. Enzyme-linked immunosorbent assay and serologic responses to Pneumocystis jiroveci. Emerg Infect Dis. 2004;10:848-54. [ Links ]
25. Barry SM, Johnson MA. Pneumocystis carinii pneumonia: a review of current issues in diagnosis and management. HIV Med. 2001;2: 123-32. [ Links ]
26. Macola, S. Candida. En: Llop A, Valdés-Dapeno M, Zuazo JL (editores). Microbiología y parasitología médicas; La Habana: Editorial Ciencias Médicas; 2001. p.501-7. [ Links ]
27. McDonald LC, Lauderdale TL, Lo HJ, Tsai JJ, Hung CC. Colonization of HIV-infected outpatients in Taiwan with methicillin-resistant and methicillin-susceptible Staphylococcus aureus. Int J STD AIDS. 2003;14:473-7. [ Links ]
28. Fisher-Hoch SP, Hutwagner L. Opportunistic candidiasis: an epidemic of the 1980s. Clin Infect Dis. 1995;21:897-904. [ Links ]
29. De Repentigny L, Lewandowski D, Jolicoeur P. Immunopathogenesis of oropharyngeal candidiasis in human immunodeficiency virus infection. Clin Microbiol Rev. 2004;17:729-59. [ Links ]
30. Gutiérrez J, Morales P, González MA, Quindos G. Candida dubliniensis, a new fungal pathogen. J Basic Microbiol. 2002;42: 207-27. [ Links ]
31. Yang YL, Lo HJ, Hung CC, Li Y. Effect of prolonged HAART on oral colonization with Candida and candidiasis. BMC Infect Dis. 2006; 20: 6-8. [ Links ]
32. Linares M, Solís F. Identificación de levaduras. Rev Iberoam Micol. 2001; 11-21. [ Links ]
33. Vásquez JA, Sobel JD. Candidiasis. En: Dismukes WE, Pappas PG, Sobel JD (editoes). Clinical Mycology. New York: Oxford University Press, Inc.; 2003. p.143-87. [ Links ]
34. Lattif AA, Banerjee U, Prasad R, Biswas A, Wig N, Sharma N et al. Susceptibility pattern and molecular type of species-specific Candida in oropharyngeal lesions of Indian human immunodeficiency viruspositive patients. J Clin Microbiol. 2004;42:1260-2. [ Links ]
35. Maenza JR, Keruly JC, Moore RD, Chaisson RE, Merz WG, Gallant GE. Risk factors for FCZ-resistant candidiasis in human immunodeficiency virus-infected patients. J Infect Dis. 1996; 173:219-25. [ Links ]
36. Subramanian S, Mathai D. Clinical manifestations and management of cryptococcal infection. J Postgrad Med. 2005;51:S21-6. [ Links ]
37. Pappalardo MC, Melhem MS. Cryptococcosis: a review of the Brazilian experience for the disease. Rev Inst Med Trop Sao Paulo. 2003;45:299-305. [ Links ]
38. Franzot SP, Salkin IF, Casadevall A. Cryptococcus neoformans var. grubii: separate varietal status for Cryptococcus neoformans serotype A isolates. J Clin Microbiol. 1999;37:838-40. [ Links ]
39. Mirza S, Phelan M, Rimland D, Graviss E, Hamill R, Brandt ME et al. The changing epidemiology of Cryptococosis: an update from population based active surveillance in 2 large metropolitan areas, 1992-2000. Clin Infect Dis. 2002;36:789-94. [ Links ]
40. Saag MS, Graybill RJ, Larsen RA, Pappas PG, Perfect JR, Powderly WG et al. Practice guidelines for the management of cryptococcal disease. Infectious Diseases Society of America. Clin Infect Dis. 2000;30:710-8. [ Links ]
41. Perfect JR, Durack DT, Gallis HA. Cryptococcemia. Medicine (Baltimore). 1983;62:98-109. [ Links ]
42. Rozenbaum R, Goncalves AJ. Clinical epidemiological study of 171 cases of cryptococcosis. Clin Infect Dis. 1994;18:369-80. [ Links ]
43. Viviani MA. Opportunistic fungal infections in patients with acquired immune deficiency syndrome. Chemotherapy. 1992;38:S35-42. [ Links ]
44. Wheat J. Endemic mycosis in AIDS: a clinical review. Clin Microbiol Rev. 1995;8:146-59. [ Links ]
45. Deepe Jr. GS. Histoplasma capsulatum. En: Mandell, GL, Bennett JE, Dolin R (editors). Principles and practice of infectious diseases. Philladelphia, USA: Elsevier Churchill Livingstone; 2005. p.3012-26. [ Links ]
46. Hamilton AJ. Serodiagnosis of histoplasmosis, paracoccidioidomycosis and penicilliosis marneffei; current status and future trends. Med Mycol. 1998;36:351-64. [ Links ]
47. Wheat LJ. Current diagnosis of histoplasmosis. Trends Microbiol. 2003;11:488-94. [ Links ]
48. Sathapatayavongs B, Batteiger BE, Wheat J, Slama TG, Wass JL. Clinical and laboratory features of disseminated histoplasmosis during two large urban outbreaks. Medicine (Baltimore). 1983;62:263-70. [ Links ]
49. Wheat J, Hafner R, Korzun AH, Limjoco MT, Spencer P, Larsen RA et al. Itraconazole treatment of disseminated histoplasmosis in patients with the acquired immunodeficiency syndrome. AIDS Clinical Trial Group. Am J Med. 1995;98:336-42. [ Links ]
50. Wheat J, MaWhinney S, Hafner R, McKinsey D, Chen D, National Institute of Allergy and Infectious Diseases Acquired Immunodeficiency Syndrome Clinical Trials Group and Mycoses Study Group. Treatment of histoplasmosis with Fluconazole in patients with acquired immunodeficiency syndrome. Am J Med. 1997;103:223-32. [ Links ]
51. Wheat LJ, Wass J, Norton J, Kohler RB, French ML. Cavitary histoplasmosis occurring during two large urban outbreaks. Analysis of clinical, epidemiologic, roentgenographic, and laboratory features. Medicine (Baltimore). 1984;63:201-9. [ Links ]
52. Bracca A, Tosello ME, Girardini JE, Amigot SL, Gomez C, Serra E. Molecular detection of Histoplasma capsulatum var. capsulatum in human clinical samples. J Clin Microbiol. 2003;41:1753-5. [ Links ]
53. Bialek R, Feucht A, Aepinus Ch, Just-Nübling G, Robertson VJ, Knobloch J, Hohle R. Evaluation of two nested PCR assays for detection of Histoplasma capsulatum DNA in Human tissue. J Clin Microbiol. 2002;40:1644-7. [ Links ]
54. Chemaly RF, Tomford JW, Hall GS, Sholtis M, Shua JD, Procop GW. Rapid diagnosis of Histoplasma capsulatum endocarditis using the Accuprobe on an excised valve. J Clin Microbiol. 2001;39: 2640-1. [ Links ]
55. Hecht FM, Wheat J, Korzun AH, Hafner R, Skahan KJ, Larsen R et al. Itraconazole maintenance treatment for histoplasmosis in AIDS: a prospective, multicenter trial. J Acquir Immune Defic Syndr Hum Retrovirol. 1997;16:100-7. [ Links ]
56. Wheat LJ, Connolly P, Haddad N, Le Monte A, Brizendine E, Hafner R. Antigen clearance during treatment of disseminated histoplasmosis with itraconazole versus fluconazole in patients with AIDS. Antimicrob Agents Chemother. 2002;46:248-50. [ Links ]
57. Wheat LJ, Cloud G, Johnson PC, Connolly P, Goldman M, Le Monte A et al. Clearance of fungal burden during treatment of disseminated histoplasmosis with liposomal amphotericin B versus itraconazole. Antimicrob Agents Chemother. 2001;45:2354-7. [ Links ]
58. Mocroft A, Ledergerber B, Katlama C, Kirk O, Reiss P, dArminio Monforte A et al. Decline in the AIDS and death rates in the EuroSIDA study: an observational study. Lancet. 2003;5:22-9. [ Links ]
59. Kaplan JE, Hanson D, Dworkin MS, Frederick T, Bertolli J, Lindegren ML et al. Epidemiology of human immunodeficiency virus-associated oportunistic infections in the United States in the era of highly active antiretroviral therapy. Clin Infect Dis. 2000;30:S5-14. [ Links ]